Fe3+水解及其对304不锈钢点蚀行为的影响
黄世新,杜 楠,赵 晴,艾莹珺,王力强,文庆杰
(1. 南昌航空大学 轻合金加工科学与技术国防重点学科实验室,南昌 330063;2. 成都飞机(集团)有限责任公司 制造工程部,成都 610092)
Fe3+水解及其对304不锈钢点蚀行为的影响
黄世新1,杜 楠1,赵 晴1,艾莹珺1,王力强2,文庆杰2
(1. 南昌航空大学 轻合金加工科学与技术国防重点学科实验室,南昌 330063;2. 成都飞机(集团)有限责任公司 制造工程部,成都 610092)
采用动电位极化曲线、电化学阻抗谱、腐蚀形貌分析等方法研究了不同含量Fe3+溶液水解对304不锈钢点蚀行为的影响,并从动力学角度分析了蚀孔生长的过程。结果表明:随Fe3+含量的升高,水解产生的H+含量升高,使自腐蚀电流密度升高,而溶解氧去极化作用减弱,使得自腐蚀电位负移;由于氢去极化作用,电荷转移电阻逐渐减小,腐蚀速率加快;当Fe3+浓度达到3.0mol/L时,自腐蚀电流密度趋于平稳,金属离子的扩散控制了蚀孔生长,亚稳蚀孔向稳态蚀孔转变存在一个临界电流密度。
304不锈钢;水解;蚀孔;点蚀
不锈钢具有良好的耐蚀性、耐热性和力学性能,同时具有良好的加工性和可焊性,被广泛应用于家庭用品、建材、化学、食品等工业[1-4]。点蚀是不锈钢失效的主要形式之一,蚀孔常常被腐蚀产物所覆盖,由于蚀孔具有口小、孔深和隐蔽性强等特点,使点蚀成为一种危害性极大的金属腐蚀形式[5-7]。
不锈钢点蚀可分为萌生和发展两个阶段[8],点蚀萌生之后,产生大量的亚稳态蚀孔,部分亚稳态点蚀逐渐发展成稳态点蚀[9-12]。杜楠等[13]采用电子散斑干涉(ESPI)技术结合紫外分光光度法测得光斑区域腐蚀产物中Fe3+含量,得到单个稳态蚀孔的溶解速率。为了维持蚀坑的生长,相对于本体溶液而言,活性溶解蚀坑内的溶液必须含有大量的侵蚀性离子(如Cl-)和比较低的pH[14]。阳极过程中产生的金属离子发生水解导致孔内溶液持续酸化[15-16],这是蚀孔持续生长的推动力之一。本工作采用FeCl3溶液模拟蚀孔内溶液,利用电化学测试方法,研究Fe3+水解对304不锈钢点蚀行为的影响和腐蚀机理。
1 试验
试验材料为304不锈钢,主要化学成分(质量分数/%):C0.035,Si0.520,Mn1.180,P0.036,S0.026,Cr17.59,Ni8.030,Fe余。将304不锈钢线切割成直径3mm(测极化曲线)和10mm(测电化学阻抗谱)的圆片电极,用耐酸环氧树脂封装非工作面,工作面经180号至2 000号的水砂纸逐级打磨后,依次用去离子水、无水乙醇清洗,然后在空气中干燥。试验介质为1.0~3.5mol/LFeCl3溶液(FeCl3·6H2O在20 ℃和30 ℃下的饱和浓度分别为3.4mol/L和3.9mol/L[17]),溶液温度为25 ℃。
使用梅特勒-托利多S210pH计测FeCl3溶液的pH,通过式(1)计算出H+含量的实际值。
(1)
式中:cH+为H+浓度,mol/L。
电化学测试在瑞士万通公司的PGSTAT302N电化学工作站上采用标准三电极体系进行。其中,工作电极为304不锈钢电极,辅助电极为铂电极,参比电极为饱和甘汞电极(SCE),文中电位均相对于SCE参比电极。在25 ℃的FeCl3溶液中,待试样的开路电位稳定后测动电位极化曲线,扫描区间为-0.4~0.4V,扫描速率为5mV/s,结果为5次测量的平均值。电化学阻抗谱(EIS)在开路电位下测量,扫描频率为10mHz~100kHz,交流激励信号幅值为10mV,测量结果用ZsimpWin软件进行分析。采用日本浩视三维视频显微镜观察304不锈钢的腐蚀表面形貌。
2 结果与讨论
2.1Fe3+水解对蚀孔内溶液的影响
在酸性溶液中Fe3+水解平衡可以用反应式(2)~(4)来描述。
(2)
(3)
(4)
多元盐水解是分级进行的,反应式(2)~(4)分别为一级、二级、三级水解。根据热力学原理,平衡常数是温度和压力的函数,一般而言压力对平衡常数的影响很小,可以忽略,所以温度是平衡常数的重要影响因素。
从表1可知,随FeCl3含量的升高,水解产生的H+含量升高,与文献[18]结果一致。
2.2电化学分析
图1为304不锈钢在不同含量FeCl3溶液中的极化曲线,表2为极化曲线的拟合参数。由表2可见,在FeCl3溶液中随FeCl3含量的增大,304不锈钢的自腐蚀电位负移,自腐蚀电流增大。不锈钢电极可能发生的反应如下。

表1 水解产生的H+含量及FeCl3溶液pHTab. 1 H+ concentration generated by hydrolysis andpH values of FeCl3 solutions
阳极反应:
(5)
阴极反应:
(6)
(7)
FeCl3溶液会腐蚀溶氧仪的电极,引起测量结果误差,NaCl溶液与FeCl3溶液电离出的离子含量大致相同,故通过测NaCl溶液中的氧含量表征FeCl3溶液中氧含量随FeCl3含量的变化趋势。用STARTER300D溶氧仪测得0.6,1.0,3.0,6.15mol/LNaCl溶液的氧质量浓度分别为5.41,3.65,2.28,1.85mg/L。这表明溶液中Fe3+含量的
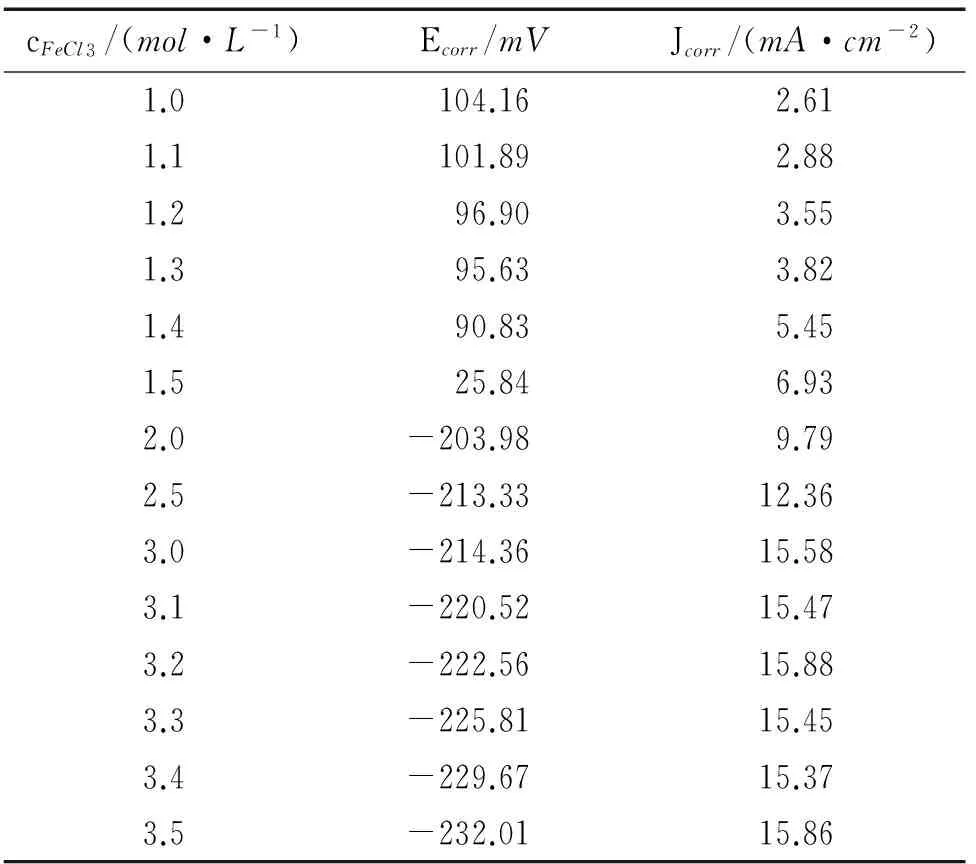
表2 304不锈钢在不同含量FeCl3溶液中的 动电位极化曲线的拟合参数Tab. 2 Fitted electrochemical parameters of 304 stainlesssteel in FeCl3 solutions with different concentrations
升高会导致溶液中氧含量的下降。而溶液中氧含量的下降会导致氧还原所占比例的下降,使304不锈钢的自腐蚀电位负移。叶超[19]的研究表明,304不锈钢在3.5%NaCl溶液中的自腐蚀电位也随氧含量的下降而负移。结合表1可知,FeCl3溶液中H+含量随着Fe3+含量的增加而升高,阴极发生的析氢反应消耗了金属阳极溶解的电子,促进了腐蚀的进行,导致自腐蚀电流密度升高。
图2为304不锈钢在不同含量FeCl3溶液中的电化学阻抗谱。从图2可见,电化学阻抗谱中发生实部收缩,出现感抗弧,这可能与腐蚀介质吸附及在电场下的电磁效应有关。
采用图3的等效电路对电化学阻抗谱进行拟合,忽略低频感抗部分,拟合结果见表2。图3中的Rs表示溶液电阻,Rct表示电荷转移电阻,Qdl表示电极表面双电层电容。由表2可见,随FeCl3含量的增大,电荷转移电阻减小。由于Fe3+的水解作用,使得溶液中产生H+,并且两者含量呈正比关系。大量H+的存在,造成钝化膜的溶解与破裂。由于氢的去极化作用,使腐蚀加速,蚀孔的生长加速,导致电荷转移电阻减小,与极化曲线分析结果一致。
2.3亚稳蚀孔转变稳态蚀孔的动力学分析
试验测得304不锈钢在3.5%(质量分数)NaCl溶液中的自腐蚀电流密度为1.27×10-5mA/cm2,比在FeCl3溶液中的最小自腐蚀电流密度小5个数量级。从图4可见,在FeCl3溶液中,随FeCl3含量增加,304不锈钢的自腐蚀电流密度先快速线性增大。这是因为随着Fe3+含量的升高,水解作用产生的H+含量也不断升高,由于氢去极化作用,氢平衡电位不断正移,极化加大使腐蚀加剧,蚀孔生长速率加快,造成自腐蚀电流密度增大。当FeCl3浓度超过3.0mol/L时,304不锈钢的自腐蚀电流密度几乎不随FeCl3含量而变化。Tian等[20]指出金属离子的扩散过程控制了亚稳蚀孔的生长。当FeCl3浓度超过3.0mol/L时,虽然H+含量仍随Fe3+含量增加而不断升高,但此时蚀孔的生长受Fe3+的扩散控制,致使腐蚀电流密度不再发生变化。
2.4腐蚀形貌分析
从图5可见,在1.0mol/L和1.5mol/L的FeCl3溶液中,304不锈钢均发生局部腐蚀,但在1.5mol/L的FeCl3溶液中蚀孔的总表面积更大,此外最大蚀孔的孔深、直径及体积也均明显大于在1.0mol/L的FeCl3溶液中的。这表明FeCl3含量的增加,发生腐蚀溶解的金属面积更大,高含量FeCl3促进了蚀孔的活性生长。当FeCl3的浓度达到2.0mol/L时,整个电极表面均发生了金属的活性溶解,腐蚀由局部腐蚀(点蚀)转变为均匀腐蚀。发生腐蚀反应时,整个电极表面可以看作一个活性溶解的蚀孔底面,同时有大量的次生孔存在于活性溶解界面上,这些次生孔是不锈钢均匀腐蚀过程中局部活化再钝化造成的。活性溶解区域高度低,形成次生孔底,而钝化区域高度高,形成孔口,但钝化再活化过程是交替发生的,因此总体形貌上表现为均匀腐蚀。当FeCl3浓度由2.0mol/L增加到3.5mol/L时,次生孔的数量减少,尺寸减小,整个腐蚀区域的表面粗糙度下降。这表明在更高含量的FeCl3溶液中,整个电极活性溶解过程中局部区域再钝化的可能性更小,相邻区域间腐蚀速率差距不大,高度差减小,均持续发生腐蚀反应,这导致次生孔的数量减少及尺寸减小。结合电化学测试结果可知,更高含量的FeCl3溶液促进了金属溶解速率增大,同时金属的再钝化能力减弱,蚀孔更容易由亚稳态向稳态转变。
3 结论
(1) 随Fe3+含量的升高,水解产生的H+含量升高,使自腐蚀电流密度升高,而溶解氧去极化作用减弱,使得自腐蚀电位负移。
(2) 由于氢去极化作用,电荷转移电阻逐渐减小,腐蚀速率加快。
(3) 当FeCl3浓度为1.0~3.0mol/L时,自腐蚀电流密度随FeCl3含量增加而不断增大,蚀孔生长速率加快;当FeCl3浓度达到3.0mol/L以上时,自腐蚀电流密度趋于平稳,此时金属离子的扩散控制了蚀孔生长。在蚀孔生长的过程中,亚稳蚀孔向稳态蚀孔转变存在一个临界电流密度。
[1]叶超,杜楠,赵晴,等. 不锈钢点蚀行为及研究方法的进展[J]. 腐蚀与防护,2014,35(3):271-276.
[2]顾帅帅,钟庆东,蒋继波,等. 304不锈钢在RCC-M1310标准下的耐蚀性[J]. 腐蚀与防护,2015,36(5):480-483.
[3]李成涛,李晓刚,程学群,等. 316L不锈钢、690合金在NaOH溶液中的电化学性能[J]. 腐蚀与防护,2011,32(4):252-255.
[4]艾莹珺,杜楠,赵晴,等. 重力对304不锈钢点蚀行为的影响[J]. 腐蚀与防护,2014,35(12):1182-1186.
[5]FURUKAWAK,YOSHIMOTON,EGASHIRAM,etal.Anodicbehaviorofstainless-steelsubstrateinorganicelectrolytesolutionscontainingdifferentlithiumsalts[J].ElectrochimicaActa,2014,140:125-131.
[6]杜楠,叶超,田文明,等. 304不锈钢点蚀行为的电化学阻抗谱研究[J]. 材料工程,2014(6):68-73.
[7]EZUBERH,EL-HOUDA,EL-SHAWESHF.Astudyonthecorrosionbehaviorofaluminumalloysinseawater[J].Materials&Design,2008,29(4):801-805.
[8]田文明. 304不锈钢在3.5%NaCl溶液中的点蚀动力学研究[D]. 南昌:南昌航空大学,2013:1-3.
[9]BURSTEINGT,CARBONERASM,DAYMONDBT.Thetemperaturedependenceofpassivitybreakdownonatitaniumalloydeterminedbycyclicnoisethermammetry[J].ElectrochimicaActa,2010,55(27):7860-7866.
[10]BURSTEINGT,LIUC.NucleationofcorrosionpitsinRinger′ssolutioncontainingbovineserum[J].CorrosionScience,2007,49(11):4296-4306.
[11]ZHANGZ,WANGZ,JIANGY,etal.Effectofpost-weldheattreatmentonmicrostructureevolutionandpittingcorrosionbehaviorofUNSS31803duplexstainlesssteelwelds[J].CorrosionScience,2012,62(9):42-50.
[12]ERNSTP,NEWMANRC.Pitgrowthstudiesinstainlesssteelfoils.II.effectoftemperature,chlorideconcentrationandsulphateaddition[J].CorrosionScience,2002,44(5):943-954.
[13]杜楠,田文明,赵晴,等. 304不锈钢在3.5%NaCl溶液中的点蚀动力学及机理[J]. 金属学报,2012,48(7):807-814.
[14]MARCUSP,MAURICEV,STREHBLOWHH.Localizedcorrosion(pitting):amodelofpassivitybreakdownincludingtheroleoftheoxidelayernanostructure[J].CorrosionScience,2008,50(9):2698-2704.
[15]MATTINSP,BURSTEINGT.Detailedresolutionofmicroscopicdepassivationeventsonstainlesssteelinchloridesolutionleadingtopitting[J].PhilosophicalMagazineLetters,1997,76(5):341-348.
[16]TIANWM,LISM,DUN,etal.Effectsofappliedpotentialonstablepittingof304stainlesssteel[J].CorrosionScience,2015,93(4):242-255.
[17]张向宇. 实用化学手册[M]. 北京:国防工业出版社,2011:673-675.
[18]马莹,何静,马荣骏. 三价铁离子在酸性水溶液中的行为[J]. 湖南有色金属,2005,21(1):36-39.
[19]叶超. 304不锈钢点蚀行为的电化学研究[D]. 南昌:南昌航空大学,2014(6):34-35.
[20]TIANWM,DUN,LISM,etal.Metastablepittingcorrosionof304stainlesssteelin3.5%NaClsolution[J].CorrosionScience,2014,85(4):372-379.
Fe3+HydrolysisandItsImpactonthePittingBehaviorof304StainlessSteel
HUANGShi-xin1,DUNan1,ZHAOQing1,AIYing-jun1,WANGLi-qiang2,WENQing-jie2
(1.NationalDefenseKeyDisciplinesLaboratoryofLightAlloyProcessingScienceandTechnology,NanchangHangkongUniversity,Nanchang330063,China;2.DepartmentofManufactureEngineering,ChengduAircraftIndustrial(Group)Co.,Ltd.,Chengdu610092,China)
EffectsofhydrolysisofsolutionswithdifferentconcentrationsofFe3+onpittingcorrosionbehaviorof304stainlesssteelwerestudiedbypotentiodynamicpolarization,electrochemicalimpedancespectroscopy(EIS)andcorrosionmorphologyanalysis.Thegrowthprocessofpitswasinvestigatedthroughdynamicsaspect.TheresultsshowthatthecontentofH+producedinhydrolysiswasincreasedwiththeincreaseofFe3+content,whichresultedintheincreaseoftheselfcorrosioncurrentdensity,andthedepolarizationeffectofdissolvedoxygendecreased,resultinginnegativeshiftoftheselfcorrosionpotential.WhenthecontentofFe3+reached3.0mol/Lormore,theselfcorrosioncurrentdensitytendedtobestableandlevel,anddiffusionofmetalionscontrolledthegrowthofpits,therewasacriticalcorrosioncurrentdensitywhenthemetastablepitschangedintostablepits.
304stainlesssteel;hydrolysis;pit;pitting
10.11973/fsyfh-201606004
2015-11-20
国家自然科学基金(51561024)
杜 楠(1956-),教授,硕士,从事电化学相关研究,0791-83863187,d_unan@sina.com
TG172
A
1005-748X(2016)06-0453-05

