高效液相色谱法测定胃舒颗粒中柚皮苷的含量
刘晓丽
(泰安市中医医院药剂科,山东 泰安 271000)
高效液相色谱法测定胃舒颗粒中柚皮苷的含量
刘晓丽*
(泰安市中医医院药剂科,山东 泰安271000)
目的:建立高效液相色谱法测定胃舒颗粒中柚皮苷含量的方法。方法:采用十八烷基硅烷键合硅胶色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈-0.1%磷酸水溶液(V∶V=18 ∶82),检测仪器为紫外检测器,检测波长为283 nm;进样量为10 μl。结果:柚皮苷质量浓度在0.123 9~1.239 4 μg范围内线性关系良好(r=0.999 9),平均回收率为99.97%,RSD为0.66%。结论:本法测定柚皮苷简便、准确、重现性好,可用于胃舒颗粒中柚皮苷的含量测定。
胃舒颗粒; 柚皮苷; 高效液相色谱法; 含量测定
胃舒颗粒是由枳壳、柴胡、醋香附等18味中药材经提取、浓缩、加工制成的颗粒制剂,具有疏肝和胃、制酸止痛、健脾护胃的功效。检索文献及《中华人民共和国药典:一部》(2015年版),枳壳具有理气宽中、行滞消胀的作用,用于胸胁气滞、胀满疼痛、食积不化、痰饮内停、脏器下垂[1]。枳壳为胃舒颗粒方中要药,药量较大,其所含成分主要为柚皮苷等黄酮类、生物碱类及挥发油类成分[2]。本研究以柚皮苷作为质控成分,采用高效液相色谱法测定胃舒颗粒中柚皮苷的含量。
1 材料
1.1仪器
岛津ATY124型电子天平、高效液相色谱仪(LC-20 AB 泵、SIL-20 A 自动进样器)(日本岛津公司);PQ3120型超声仪(上海楚定分析仪器有限公司)。
1.2药品与试剂
胃舒颗粒(泰安市中医医院医院制剂,批号:150525);柚皮苷对照品(中国药品生物制品检定所,批号:110722-201312,纯度:94.7%);乙腈(美国Sigma公司,色谱纯);水为超纯水,其他试剂均为分析纯。
2 方法与结果
2.1色谱条件与系统适用性试验
色谱柱:十八烷基硅烷键合硅胶(ODS-3)色谱柱(4.6 mm×250 mm,5 μm);检测器:紫外检测器;流动相:乙腈-0.1%磷酸水溶液(V∶V=18 ∶82);检测波长:283 nm;进样量:10 μl。在上述色谱条件下,理论板数以柚皮苷计≥3 000。
2.2溶液的制备
2.2.1供试品溶液:取本品适量,研细,精密称定2 g,置于具塞锥形瓶中,精密加入30%甲醇溶液25 ml,密塞,称定质量,超声处理(功率为250 W,频率为50 kHz)30 min,放冷,用30%甲醇溶液补足质量,摇匀,滤过,取续滤液,即得。
2.2.2对照品溶液:取柚皮苷对照品适量,精密称定16.36 mg,置于50 ml容量瓶中,加30%甲醇溶液溶解并定容至刻度,摇匀,即得柚皮苷对照品储备液;精密量取上述储备液5 ml,置于25 ml容量瓶中,加30%甲醇溶液稀释至刻度,摇匀,即得,含量为61.97 μg/ml。
2.2.3阴性对照溶液:取处方中除去枳壳的其他药味,按处方比例制成缺枳壳阴性对照样品,按照“2.2.1”项下供试品溶液的制备方法制得阴性对照溶液。
2.3 测定条件的考察
2.3.1测定波长的选择:取柚皮苷对照品溶液加30%甲醇溶液稀释后于190~400 nm光谱扫描,其最大吸收波长为283 nm,同时参考《中华人民共和国药典:一部》(2015年版)“药材”项下及文献中柚皮苷含量测定检测波长为283 nm[3],经验证样品在波长为283 nm时吸收最大,杂质最少,因此确定283 nm为检测波长。
2.3.2流动相的考察:以方中枳壳的质控成分柚皮苷为考察对象,参照《中华人民共和国药典:一部》(2015年版),以柚皮苷分离度、保留时间、对称因子、理论塔板数等进行考察。精密吸取2份“2.2.2”项下对照品溶液各10 μl,注入液相色谱仪,分别采用乙腈-0.1%磷酸水溶液(V∶V=18∶82)和乙腈-0.1%磷酸水溶液(V∶V=20∶80)洗脱[4],其他色谱条件与“2.1”项下条件相符,观察高效液相色谱图,记录峰面积,见表1。结果表明,选择乙腈-0.1%磷酸水溶液(V∶V=18∶82)为流动相的效果更好。

表1 流动相考察结果
2.3.3提取溶剂的考察:本品为原粉入药制剂,参考《中华人民共和国药典:一部》(2015年版)及文献,柚皮苷在甲醇溶液、乙醇溶液中的溶解性较好[5]。采用30%甲醇溶液、100%甲醇溶液分别作为柚皮苷对照品的提取溶剂[6],其他制备方法按照“2.2.2”项下方法制备柚皮苷甲醇溶液。精密吸取上述2种柚皮苷甲醇溶液各10 μl,注入高效液相色谱仪,采用“2.1”项下色谱条件,观察高效液相色谱图,记录峰面积。结果显示,采用30%甲醇溶液提取的样品含量为0.791 4 mg/g、峰面积为1 144 917,采用100%甲醇溶液则分别为0.776 8 mg/g、1 123 803。表明采用30%甲醇溶液作为溶剂进行样品提取,效果最佳。
2.4专属性试验
分别精密吸取同一批号样品制备的供试品溶液、对照品溶液、阴性对照溶液各10 μl,注入高效液相色谱仪进行测定[7]。结果显示,色谱图中供试品溶液与对照品溶液在相同的位置上有相应色谱峰,阴性对照溶液上无相应色谱峰,说明处方中其他药味对测定结果无干扰,见图1。

A.对照品溶液; B.供试品溶液; C.阴性对照溶液A.reference substance solution; B.test sample solution;C.negative control solution图1 高效液相色谱图Fig 1 HPLC chromatogram
2.5耐用性试验
将检测波长及色谱柱类型进行微小变动,其他参数不变,以含量为依据,考察方法耐用性。结果,不同检测波长和色谱柱条件下测定RSD分别为0.502 0%、0.098 4%,表明本方法耐用性良好,见表2~3。

表2 检测波长考察

表3 色谱柱考察
2.6线性范围考察
精密吸取“2.2.2”项下对照品储备液溶液2、5、10、15、20 ml分别用甲醇稀释至50 ml,各取10 μl注入液相色谱仪,记录峰面积。以峰面积(Y)为纵坐标,进样质量(X,μg)为横坐标进行线性回归[8],回归方程为:Y=1 820 405.91X-6 403.21,相关系数r=0.999 9,结果表明柚皮苷溶液在0.123 9~1.239 4 μg呈良好的线性关系,见图2。

图2 柚皮苷标准曲线Fig 2 Standard curve of naringin
2.7精密度考察
精密吸取“2.2.2”项下对照品溶液10 μl,注入液相色谱仪,连续进样6次,记录峰面积。结果,柚皮苷峰面积的RSD=0.048%(n=6),表明仪器精密度[9]良好。
2.8中间精密度考察
取本品,研细,精密称定样品2 g,根据“2.2.1”项下方法制备供试品溶液,按照“2.1”项下色谱条件,在同一实验室,考察不同操作人、不同时间、不同仪器的精密度,分别连续进样3次,测得峰面积,计算含量。结果表明中间精密度良好,见表4。
2.9稳定性考察
精密量取“2.2.1”项下供试品溶液10 μl,分别于3、4、5、6、7、8 h,注入液相色谱仪,记录色谱峰面积。结果,柚皮苷峰面积的RSD=0.1645%,表明供试品溶液在8 h内稳定性良好[10],满足测定需要。
2.10重复性考察
取同一批样品(批号:150601),平行取6份,按“2.2.1”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,每份平行进2针,精密吸取10 μl,注入液相色谱仪,记录峰面积。结果柚皮苷峰面积的RSD=1.38%,表明本方法重复性良好。

表4 中间精密度考察
2.11加样回收考察
经过查阅大量文献[11-15],加样回收实验如下:取本品适量,研细,平行取6份样品约1 g,精密称定,置具塞锥形瓶中,精密加入“2.2.2”项下柚皮苷对照品储备液5 ml、30%甲醇溶液20 ml,密塞,称定质量,超声处理(功率为300 W,频率为50 kHz)30 min,放冷,用30%甲醇补重,摇匀,滤过,取续滤液,即得供试品溶液。精密吸取上述6份供试品溶液及“2.2.2”项下对照品溶液各10 μl,分别注入液相色谱仪,再按“2.1”项下色谱条件进样测定,结果见表5。
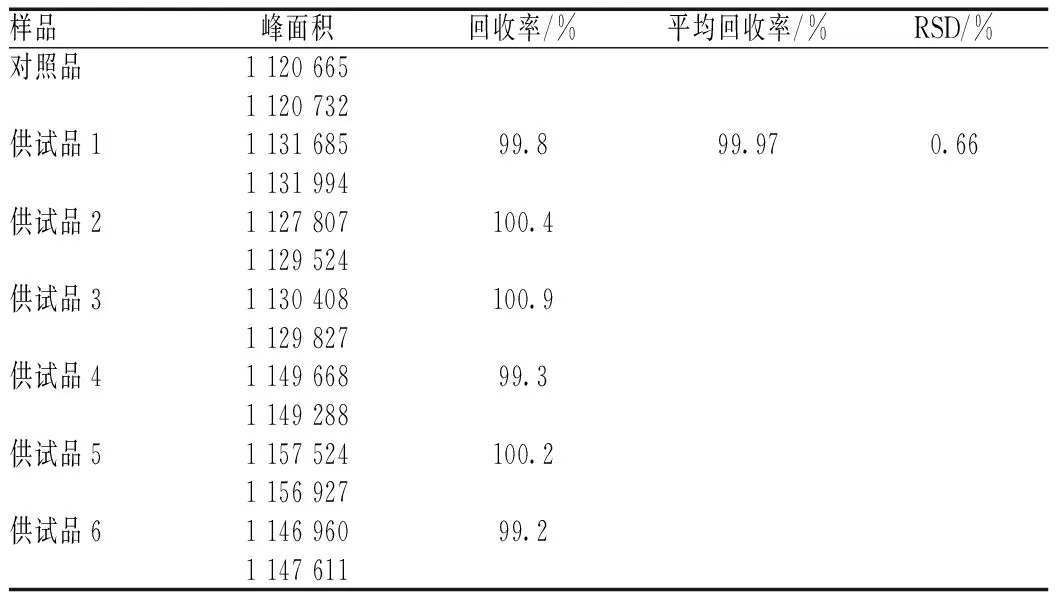
表5 加样回收率考察
2.12样品含量测定
取各批次样品适量,分别按“2.2.1”项下方法制备供试品溶液,再按“2.1”项下色谱条件分别精密吸取样品溶液10 μl注入液相色谱仪,记录色谱图,计算柚皮苷含量,见表6。
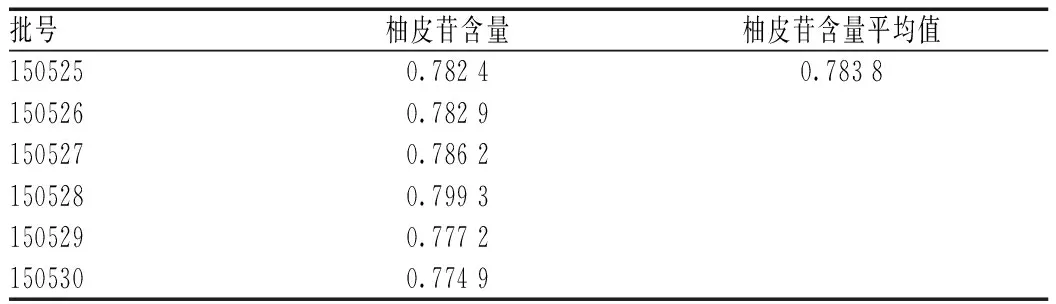
表6 样品含量测定结果(n=6,mg/g)
3 讨论
流动相考察中,采用乙腈-0.1%磷酸水溶液(V∶V=20∶80)为流动相时,色谱图出峰时间较短,且峰形较差,后有肩峰,分离度较差;采用乙腈-0.1%磷酸水溶液(V∶V=18∶82)为流动相时,色谱图的出峰时间适中,分离度较好,主峰无拖尾现象,可以满足检测需求,因此选择乙腈-0.1%磷酸水溶液(V∶V=18∶82)为流动相。
按照《中华人民共和国药典:一部》(2015年版)“药材”项下质量进行折算:处方中药材饮片质量×(1-含水量)×饮片中成分含量/处方质量×药材成分测定转移率×70%,暂定本品含量为每克含枳壳以柚皮苷(C27H32O14)计,不少于0.6 mg,经过对不同批次样品含量测定,此限度合理。
[1]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:化学工业出版社,2015:283-284.
[2]陈希华,张建康,黄检平,等.枳壳研究进展[J].今日药学,2015,25(3):229-231.
[3]张赟华,董媛,李忠琼,等.HPLC-DAD法同时测定气滞胃痛颗粒中5个成分的含量[J].药物分析杂志,2012,32(9):1661-1664.
[4]王元清,严建业,师白梅,等.不同批次枳壳中柚皮苷、新橙皮苷、总黄酮、挥发油的含量比较及质量评价[J].中国实验方剂学杂志,2012,18(7):146-150.
[5]唐琴,陈先勇,宋航.柚皮苷的溶剂热法提取及其抗氧化性、稳定性测定[J].食品科学,2011,32(12):287-291.
[6]赵明会,付凌燕,程晓英.高效液相色谱法测定生骨散中柚皮苷的含量[J].中国中医药现代远程教育,2014,12(18):157-158.
[7]李成明,刘效栓,李喜香,等.高效液相色谱法测定慢支胶囊中柚皮苷的含量[J].甘肃中医学院学报,2015,32(2):24-26.
[8]李园园,石磊.枳苓六妙口服液中活性成分研究[J].中医学报,2014,29(9):1330.
[9]金林,赵万顺,郭巧生,等.白芍饮片的化学成分测定及质量评价[J].中国中药杂志,2015,40(3):484-489.
[10]杨佳静,薛佳,周华方,等.HPLC法同时测定胃苏颗粒中柚皮苷、橙皮苷和新橙皮苷的含量[J].中国药房,2014,25(4):372-374.
[11]张艳艳,曹淑娟,陈汝红,等.HPLC法测定接骨七厘片中柚皮苷的含量[J].中国药房,2014,25(28):2676-2677.
[12]刘伟,杨艳玲,刘乃强,等.柴胡口服液HPLC指纹图谱及柴胡皂苷b2的含量测定[J].中国实验方剂学杂志,2013,19(8):134-137.
[13]陈忠新,李强,戴临风,等.真武汤颗粒剂质量标准研究[J].黑龙江医药,2015,28(1):52-55.
[14]李碧艳,李梅丽,蓝小霞.超高效液相色谱法测定肚液散中甘草酸的含量[J].海峡药学,2015,27(12):50-52.
[15]徐新,廖思佳,廖先智,等.高效液相色谱法测定阿司匹林含量[J].广州化工,2012,40(8):131-132.
Content Determination of Naringin in Weisukeli by HPLC
LIU Xiaoli
(Dept.of Pharmacy, Taian Traditional Chinese Medicine Hospital, Shandong Taian 271000, China)
To establish the HPLC method for content determination of naringin in Weishukeli. METHODS: ODS-3 C18column (4.6 mm×250 mm,5 μm)was used and the mobile phase consisted of methanol-0.1% phosphoric acid solution (V∶V=18 ∶82) with UV detector,the detection wavelength was 283 nm and the sample size was 10 μl. RESULTS: The Linear range of the naringin in concentration was 0.123 9-1.239 4 μg(r=0.999 9). The average recovery rate was 99.97%,RSDwas 0.66%. CONCLUSIONS: The method is simple, accurate, and reproducible. It can be used to determine the content of naringin in Weishukeli.
Weishukeli; Naringin; HPLC; Content determination
R927.2
A
1672-2124(2016)08-1073-03
10.14009/j.issn.1672-2124.2016.08.025
2016-01-15)
*主任药师。研究方向:中药制剂与中药质量控制。E-mail:lxllvj@163.com

