挽救生命的奇迹:DNA修复机制的发现及研究历程
宋晶晶 陈波
摘要:介绍了2015年的诺贝尔化学奖DNA修复机制的研究历程,包括其修复机理和修复途径方面的理论与实践研究以及DNA修复机制所展现的治癌新契机,给生物医学领域带来的新的发展方向,为人类的抗癌事业做出的巨大贡献。
关键词:诺贝尔化学奖;DNA修复机制;DNA修复途径;抗癌
文章编号:1005–6629(2016)7–0090–07 中图分类号:G633.8 文献标识码:B
2015年的诺贝尔化学奖授予托马斯·林达尔(瑞典)、保罗·莫德里奇(美)和阿奇兹·桑贾尔(土耳其)三位科学家,以表彰他们在DNA修复的细胞机制方面的研究。瑞典皇家科学学院在授予他们该荣誉的颁奖词中提到:三人在分子领域绘制出了细胞是如何完成DNA修复及保护其遗传信息的,他们的研究发现为活细胞功能的认知提供了基础知识,其研究成果在未来甚至可以为癌症治疗的发展提供极大的帮助。这一科学研究领域的成果有望为广大癌症患者带来福音。那么,这一科学研究是如何被一步步发现的?又为何会获得诺贝尔化学奖这一崇高荣誉?其科学意义和应用前景又会是怎样?对我们又有何启发?
1 DNA修复机制的发现
人们可能认为DNA像是布满灰尘的模板,DNA分子伴随着人类出生而出现,死亡时便消失。我们知道DNA(即脱氧核糖核酸)是由核苷酸重新排列的一类具有长键的生物高分子,它是由两条主链形成的双螺旋结构。在细胞核中,它是组成遗传基因信息的一类重要功能分子。然而DNA不仅如此,它还能够真实地作为一个细胞内部的计算机,直接培育形成,并对细胞自身修复受损部位。简言之,这是维持人类长寿的关键因子,DNA有能力改变和修复人体受损组织,如癌症和其他突变引起的损伤一样能够由DNA的自身修复功能来完成。
DNA是一种化学分子,必然在生物体内会发生各种化学反应,则发生化学反应的分子是如何修复的呢?基于此,科学家们一直对DNA的修复机制的研究充满了兴趣。
诺贝尔化学奖的得主托马斯·林达尔、保罗·莫德里奇和阿齐兹·桑贾尔各自独立地阐明了与人类相关的若干DNA修复过程。托马斯·林达尔一直从事癌症方面的研究,自然少不了对DNA修复机制的研究;保罗·莫德里奇早在杜克大学教授生物化学时,就专注于研究DNA的错配修复;而阿奇兹·桑贾尔专门从事DNA修复、细胞周期检查点和生物钟方面的研究,他花费了较长的时间研究光解和光激活的机制,直接观察到了光解酶修复胸腺嘧啶二聚体的过程(即下面即将提到的直接修复)。
“DNA到底有多稳定?”,托马斯·林达尔早在20世纪60年代末就对这个问题深感好奇。那时,科学界相信作为生命基础的DNA分子必须极度坚实,没有别的可能性。生物体要生长必然要经历演化的过程,而生物演化需要突变的存在,但每一代的突变都是有限的。如果遗传信息太过不稳定,多细胞生物就无法存在了。在美国普林斯顿大学当博士后的时候,林达尔研究RNA—一种与DNA相近的分子。研究很不顺利。在实验中,他必须加热RNA,但这个过程不可避免地会导致RNA快速降解。如果RNA在受热时都被毁灭得如此迅速,具有相似性的DNA真的能一辈子保持稳定吗?
几年后,林达尔进入瑞典斯德哥尔摩的卡罗林斯卡学院。一些实验验证了他的怀疑:DNA其实会发生缓慢但可观测的降解。据林达尔估计,基因组每天会发生数千起灾难性的潜在损伤,人类能在地球上得以延续,这些损伤显然不可能真的发生。他的结论是,肯定有分子机制负责对这些DNA缺陷进行修复。本着这个思路,托马斯·林达尔打开了通向崭新研究领域的大门。
和人的DNA一样,细菌DNA同样由核苷酸的四种碱基腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)组成[1]。托马斯·林达尔开始利用细菌DNA来寻找修复酶。DNA的化学弱点之一,它的胞嘧啶(C)很容易丢失一个氨基,这可能导致遗传信息改变。在DNA的双螺旋中,C总是与G配对,但当氨基丢失后,受损的碱基往往与A配对[2]。因此,如果允许这个缺陷继续存在,下一次DNA复制时就会发生一次突变。林达尔意识到,细胞对此必存在某种防范机制。随后,他成功发现,有一种细菌酶能去除DNA里受损的胞嘧啶。1974年,他发表了这一发现。
之后35年的成功工作就此展开,在此期间,托马斯·林达尔发现并研究了许多细胞用来修复DNA所用的工具蛋白。在20世纪80年代初,他因缘际会来到英国,在伦敦他接受了帝国癌症研究基金会(Imperial Cancer Research Fund)的一个职位。1986年,他成为了新成立的剑桥大学克莱尔学堂实验室(Clare Hall Laboratory)主任,这个实验室随后以其科学创造力而闻名遐迩。
一点一滴,林达尔拼起了“碱基切除修复(base excision repair)”是如何作用的分子图景,证实了糖基化酶(glycosylases)正是DNA修复过程中的第一步,这种酶很类似他在1974年发现的那个细菌的酶。碱基切除修复也发生在人类身上,1996年,托马斯·林达尔还在体外设法重建了人类的修复过程。
对于托马斯·林达尔而言,关键的一点是意识到了DNA不可避免地会发生变化,哪怕是当分子位于细胞的保护性环境中时也不例外。于是,他完成了“碱基切除修复”的拼图[4]。
但是,我们早已知道DNA会因环境因素如UV辐射而受到损伤。林达尔并没有发现并阐述这一受损过程是如何被修复的,而多数细胞用于修复紫外线伤害的机制“核苷酸切除修复”是被阿齐兹·桑贾尔阐明的。
桑贾尔出生于土耳其的萨武尔,活跃于美国研究界。他对于生命分子开发的痴迷是在伊斯坦布尔攻读医学学位的时候培养起来的。毕业之后,他在土耳其的乡下当了几年的外科医师,但1973年时,他决定学习生物化学。他的兴趣是被一个特别的现象所激发的:细菌暴露在致命的紫外线照射下之后,如果再用可见蓝光照射,它们突然就能死里逃生。桑贾尔对这近乎魔法的反应感到非常好奇,这是一种怎样的化学功能?
一位名叫克劳德·鲁珀特(Claud Rupert)的美国人当时在研究这一现象。于是阿齐兹·桑贾尔加入了他在达拉斯的德克萨斯州大学实验室。1976年,使用当时的粗糙工具,他成功地克隆出能修复被紫外线损伤的DNA的酶——光解酶的基因,并成功让细菌批量生产这种酶。这成为了他的博士论文,但在当时,并没有引起很多反响。他申请了三次博士后职位,却都遭到了驳回。对于光解酶的研究也被搁置了。为了继续对DNA修复进行研究,阿齐兹·桑贾尔在耶鲁大学医学院(这是业内领先地位的机构)找了个实验室技术员的工作。在这里,他的工作最终让他获得了诺贝尔化学奖。
当时,人们已经知道细菌有两套修复紫外线损伤的机制:一条系统是依赖光的作用的“光修复”,需要光解酶;另一个系统则可以在暗处发挥作用。阿齐兹·桑贾尔在耶鲁大学的新同事们从二十世纪六十年代中叶就开始研究暗修复系统,研究对象是三个对紫外线敏感的细菌突变系,这三个细菌系中分别有不同的基因发生了突变,分别被称为UVRa、UVRb与UVRc[5]。
就像此前对光修复的研究一样,桑贾尔开始探索暗修复的分子机制。只花了几年的时间,他就鉴定、分离与描述了这三个基因编码的酶。在突破性的体外实验中,他证明了这些酶可以发现紫外线伤害的位点,然后在DNA链上切开两个切口,分别发生在紫外线损害位点两侧。一段12~13个碱基对的片段,包括损伤位点,就这样被切掉了。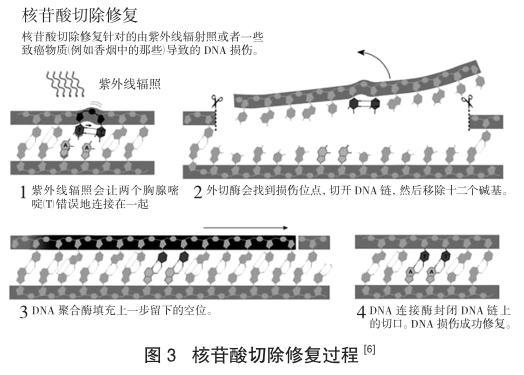
阿齐兹·桑贾尔从分子水平的细节中获取对这一途径认知的能力改变了整个研究领域。他在1983年发表了他的研究。这样的成就让他获得了北卡罗来纳大学教堂山分校的副教授职位。在那里,他又一次漂亮地完成了对核苷酸切除修复机制的下一阶段的研究工作。桑贾尔与其他研究人员——包括托马斯·林达尔——同时进行着人类中的核苷酸切除修复的研究。在人体中,紫外线损伤修复的机制远比细菌中的程序复杂,但是从化学上来说,所有有机体里的核苷酸切除修复都是类似的[7]。
然后,桑贾尔最初感兴趣的光修复又怎样了呢?最后他还是回到了光解酶,找到了它“复活”细菌的机制。另外,他还证明,人类体内相应的酶帮助我们建立了生物钟。
接下来就是保罗·莫德里奇的工作了。他也是从关于基因修复机制的模糊概念出发,从中雕琢出了美妙的分子细节。
保罗·莫德里奇在美国新墨西哥州北部的一个小城镇长大。当地多种多样的广袤风景激发了他对大自然的兴趣。但是有一天,他教生物的父亲说:“你应该研究一下DNA那套东西。”那是在1963年,詹姆斯·沃森和弗朗西斯·克里克因发现DNA结构而获得诺贝尔奖的第二年。
几年后,“DNA那套东西”真的成为了保罗·莫德里奇生活的中心。在他研究生涯的早期,在斯坦福大学做博士研究生、在哈佛大学做博士后以及在杜克大学做助理教授的时候,他检验了一系列作用于DNA的酶:DNA连接酶,DNA聚合酶和限制性内切酶。随后,当他在20世纪70年代末将注意力转移到Dam甲基化酶时候,他不小心碰到了另一件“DNA那套东西”上,占据了他科学生涯的一大部分。
Dam甲基化酶能够给DNA加上甲基基团。保罗·莫德里奇证明,这些甲基基团可以像路标一样起作用,帮助某个特定的限制性内切酶在正确的位置切断DNA链。但是,就在几年前,马修·梅塞尔森(Matthew Meselson),一位哈佛大学的分子生物学家,认为DNA甲基基团还有另一种信号作用。
利用一些分子生物学技巧,梅塞尔森改造出了一种噬菌体,它的DNA中有几个不匹配位点。譬如,A(腺嘌呤)对面可能是C(胞嘧啶),而不是它本来应该配对的T(胸腺嘧啶)。让这些噬菌体感染细菌,细菌就会修复错误的配对。没人知道细菌为什么有这个功能,但是在1976年,梅塞尔森提出,这可能是因为细菌自己本身存在的修复机制,来修复这些有时在DNA复制时出现的错误。如果推测是正确的,梅塞尔森继续推测,可能DNA上的甲基基团帮助细菌确认,纠正的时候哪个是原来的模板,哪个是后来的错误。带有错误的新DNA链还没有甲基化,可能这就是它被识别并修正的方式?
在DNA甲基化的过程中,保罗·莫德里奇和马修·梅塞尔森的道路相交了。两人合作构建了一个具有一系列DNA错配的病毒。这一次,莫德里奇的Dam甲基化酶也被用于在其中一条DNA链上添加甲基。当这些病毒感染细菌时,细菌持续地修正那些未经甲基化的、错配的DNA。莫德里奇和梅塞尔森的结论是,DNA的错配修复是一个天然的过程,在DNA复制过程中,以未甲基化为标志来识别出错的DNA链。
保罗·莫德里奇的这个发现引发了长达十年的系统性工作——克隆和测定错配修复过程中一个又一个酶。到20世纪80年代末,他已经可以体外重建这套复杂的分子修复机理,并且深入了解它的细节。这项工作在1989年发表[8]。
和托马斯·林达尔、阿齐兹·桑贾尔一样,保罗·莫德里奇也研究了人类版本的修复系统。今天我们知道,在人类基因组复制时产生的所有错误中,只有千分之一逃过了错配修复的法眼。但是,在人类错配修复中,我们仍然不能确切地知道怎么判断哪条链是原本的链。DNA甲基化在我们的基因组中有与微生物中不同的功能,所以,一定是什么别的东西在掌管究竟应该修复哪条链——这个东西是什么还有待查明。
除了碱基切除修复、核苷酸切除修复和DNA错配修复这三种,还有其他多种机制维护着我们的DNA。每天,它们修复几千起因为日照、吸烟或其他遗传毒性物质导致的DNA损伤;它们不断抵抗着DNA的自发改变。而且,每一次细胞分裂,错配修复都会纠正几千个错配。没有这些修复机制,我们的基因组将会崩溃。其中哪怕只有一个机制失灵了,遗传信息就会很快改变,致癌风险也会增加。比如,DNA错配修复如果存在缺陷,就会增加患遗传性结肠癌的风险。
事实上,在很多类癌症中,就是上述一到多个修复体系部分地或者全部地被关闭了。这使得癌细胞的DNA变得不稳定,这也是癌细胞经常突变且能够抵抗化疗的原因之一。
同时,这些生病的细胞会更加依赖还在正常工作的修复体系:没有剩下的这些修复体系,它们的DNA受到的损伤会过于严重,细胞也会死亡。研究者试图利用这种弱点来研发新的抗癌药物。通过抑制残留的修复体系,人们可以减缓或者完全阻止癌症的生长。譬如,奥拉帕尼(olaparib)就是一种可以抑制修复体系的抗癌药物。
我们人体的分子装置一直受到周围环境的攻击。活性化学物质使其腐败,高温使其折叠结构改变而变性。紫外线则会使其分解,多数情况下,它们被损坏而无法正常地发挥作用。细胞可以无情地抛弃受损的蛋白质,却承担不起抛弃DNA的代价。DNA必须维持完美的构型,因为它负载着遗传信息,指导着细胞的生命进程并遗传给下一代,为确保这一遗传信息不丢失,细胞具备了多种不同的方式保护DNA免于受损,并在其受损时修复它们[9]。
随着研究的推进,我们对修复机制和修复过程有了更为深入系统的了解。在包括人类在内的哺乳动物中,细胞内不同的DNA受损主要通过六种方式修复:①直接修复(direct repair,DR):直接修复DNA的烷基化损伤;②碱基切除修复(base excision repair,BER):主要修复内源性的氧化、烷基化和脱氨基的碱基损伤;③核苷酸的切除修复(nucleotide excision repair,NER):主要修复外源性辐射、化学物质及蛋白质形成的DNA加成物;④错配修复(mismatch repair,MMR):修复自发产生的和碱基脱氨基、碱基氧化及碱基甲基化等导致的碱基错配;⑤同源重组修复(homologous recombination repair,HR)和⑥非同源末端连接(non-homologous end-joining repair,NHEJ):均修复DNA双链断裂。故而,要想研究细胞内的DNA修复机制是如何运行的,首先就要对DNA修复的六种途径进行分析[10]。
2 DNA修复途径
细胞的DNA不断遭受内源性和外源性物质的袭击:内源性物质引起的损害包括正常代谢中产生的活性氧引起的氧化作用;来自环境的外源性损伤物质包括化学物质、致癌物质、紫外线和化学治疗药物及电离辐射等。DNA损伤的类型决定DNA修复的途径,从图5的脉络中我们可以看到于DNA修复的六种途径,以下我们主要介绍两种。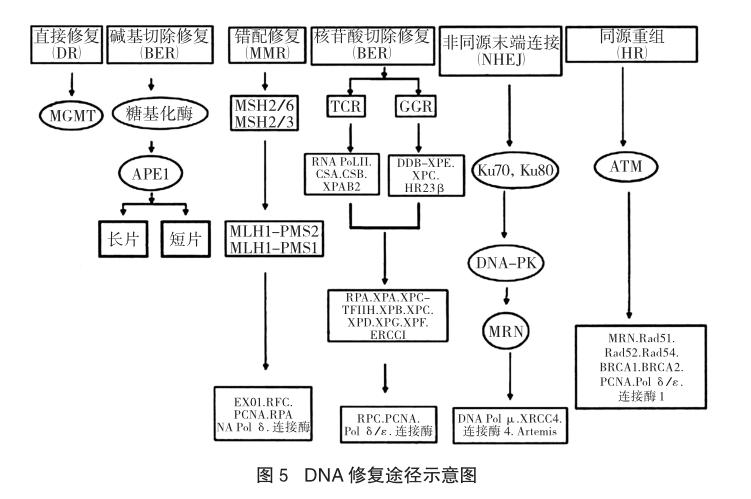
2.1 直接修复
有时称为“直接逆转”,该修复途径是针对DNA由于外源性的损伤物质(比如紫外线)而引起的损伤修复机制。通过微电子显微镜可以观察到长期受紫外线照射会使得DNA中相邻的两个嘧啶碱基通过共价键桥接起来造成损伤,这样的双嘧啶键结构与DNA自身的双螺旋结构是不匹配的,如果不将其除去就无法完成遗传因子的复制。细胞的直接修复可移除DNA分子中受损碱基的改变部位,而非切除受损碱基。所以,该途径是通过DNA光解酶催化来完成的,将双嘧啶键解分为两个正常的单体,使DNA恢复原貌,恢复为正常的双螺旋。
在可见光(300~600nm)活化之下,由光复活酶催化胸腺嘧啶二聚体分解为单体的修复机制如图6显示,这也是阿奇兹·桑贾尔研究发现的。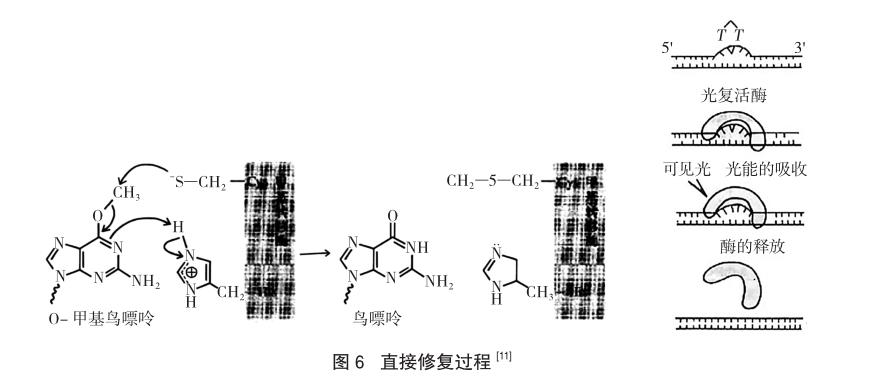
2.2 碱基切除修复(BER)
构成DNA的腺嘌呤和胞嘧啶会发生自然的脱氨基化,生成次黄嘌呤和尿嘧啶,引起损伤。因此,碱基切除修复途径主要是修复单个碱基受损的情况,包括:N-烷基化嘌呤;5-羟基胞嘧啶;尿素及其他加合物。DNA糖基化酶能识别,并将它们与糖苷键切断,切除受损的碱基,脱氧核糖上留下无碱基位点,启动修复过程。出现无碱基位点时,利用核酸内切酶将空位的磷酸键移除,形成空缺,最后通过DNA聚合酶和酶的作用完成修复过程[12]。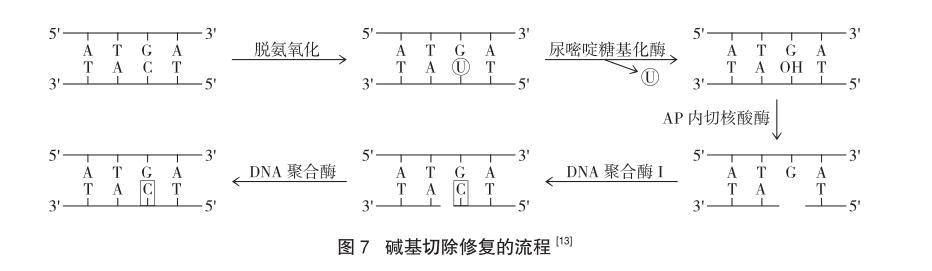
3 DNA修复机制的前景
随着研究的深入,对于DNA修复机制的应用也越来越广泛。科学家用实际的探索向世界证实了:DNA修复并非空谈。在了解了DNA修复机制的修复过程后,针对DNA修复系统进行抗肿瘤药物的研发,近几年来发展迅速。
细胞中这么多DNA,全都是从一开始受精卵里那两米长的DNA复制来的。所有化学进程都是不精确的,这几十亿次的复制之后早就应该错得没边儿了,何况细胞还在每天承受活性分子和辐射带来的损伤。但是我们大部分人都活得还挺好,基因也没有变成一堆乱码。我们体内有一群蛋白质专门负责看管DNA。它们持续不断地校对基因组,发现损伤就立刻着手修复[14]。2015年的诺贝尔化学奖表彰的就是发现这一修复机制的化学家。生命要想存活下去,遗传物质必须相对稳定。最早时候,人们觉得DNA本身就特别结实,根本就不需要修护。林达尔发现,DNA其实没有人想象的那么结实,你要把DNA单独拿出来,它很容易坏,但是在人体内却没坏,就证明它肯定是有什么特殊的机制在起作用。从他才开始意识到我们需要这么一个机制。
事实上,许多类型的癌症就要归结于这些机制的失灵,但得是部分失灵。全部机制都完好的话,新的错误就很难产生,癌症就不容易发展;但如果所有机制都坏了,细胞就承受不了错误,会很快死掉。许多癌症药物都是以破坏癌细胞残存修复机制为目标的。因此,2015年诺贝尔化学奖不但增进了我们对细胞的了解,还可能成为许多拯救生命药物的来源。
准确地说,很多种癌症发病的一个重要因素就是某些修复机制坏了,为什么会有癌症?癌症是因为正常的细胞出现了突变,或DNA出了错,它不按照本来正常规定工作去运行,修复机制完好的时候,它也不是万能的,之前说一般它的修复率可能一千个里面会漏掉一个,它也会犯错误。但是在修复机制完好的时候,癌症是比较难出现的,一旦众多修复机制有一两个坏掉了,这时候犯错误的概率大大增加,即细胞失灵突变成癌细胞的概率大大增加了。修复机制也是随机突变导致的,但是现在我们知道,它坏了可以想办法修复它,或者是就反过来让它坏得更彻底,让癌细胞彻底死掉,这是对待癌症思路之一。由此可见,能够找到适用的DNA修复机制就是找到了修复“生命密码”,癌症不再是无法战胜的。
4 意义和启发
2015年诺贝尔化学奖的三位得主分别发现了三种DNA修复机制,这些基础研究不仅加深了我们对于自身运转方式的理解,而且有助于继续研发可以拯救生命的治疗方法。如果我们回过头来总结一下,就会发现,他们的身上都具有一些相同的特质,这就是好奇心、不迷信权威和坚持到底的精神。
与其同时代的研究人员都认为DNA如此稳定、如此强大,完全不需要任何修复。但托马斯·林达尔在做关于RNA的分子实验时,由于发现它特别不稳定,很容易分解,却能联想到它的近亲DNA是否也会具有相似的性质?秉持着这份有依据的好奇心,他开始了一次次的实验,终于检测到DNA也不像普遍认为的那样强大。而阿齐兹·桑贾尔的研究实际上也是从一个失败开始的,但他一旦决定了DNA的研究方向,就会对实验中的错误和失败展开锲而不舍的追问和探究,并最终取得了丰硕的研究成果,也获得了世人的肯定和激赏。
我们现在也已知,RNA和DNA的修复机制是多种多样的,这也是科学家们在前人研究的基础上不断摸索前行,开拓新领域的结果。或许,诺贝尔奖获得者,不论其研究领域属于哪个方向,他们的科研经历和共通的品质特性,或多或少,都会对我们的学习有所启迪!
参考文献:
[1][3][12] 柴国林,朱卫国. DNA的损伤与修复[J].中华肿瘤杂志,2005,(10):577~580.
[2][5] P. Somnath, B. Nilanjana, C. Aditi, et al. Arsenicinduced Promoter Hypomethylation and Over-expression of ERCC2 Reduces DNA Repair Capacity in Humans by Nondisjunction of the ERCC2-Cdk7 Complex [J]. Metallomics,2014,(4):864~873.
[4] T. Lindahl, R. D. Wood. Quality Control by DNA repair [J]. Science,1999,(286):1897~1905.
[6][10][14] N. Shrivastav, D. Li, and J. M. Essigmann. Chemical Biology of Mutagenesis and DNA Repair: Cellular Responses to DNA Alkylation [J]. Carcinogenesis,2009,(31):59~70.
[7] Dragony Fu, Jennifer A, Calvo, Leona D, Samson. Balancing Repair and Tolerance of DNA Damage Caused by Alkylating Agents [J]. Nature Reviews Cancer, 2012,(12):104~120.
[8] A. Sancar, L. A. Lindsey-Boltz, K. Unsal-Kacmaz, S. Linn. Molecular Mechanisms of Mammalian DNA Repair the DNA Damage Checkpoints [J]. Annual Review of Biochemistry,2004,(73):39~85.
[9][美]古德赛尔著.王新国译. 生命与死亡——《图解生命》[M].中国青年出版社,2013:121~129.
[11] A. Sancar. Structure and Function of DNA Photolyase and Cryptochrome Blue-light Photoreceptors [J]. Chemical Reviews,2003,(103):2203~2237.
[13] P. Modrich, R. Lahue. Mismatch Repair in Replication Fidelity, Genetic Recombination and Cancer Biology[J]. Annual Review of Biochemistry,1996,(65):101~133.

