关于Caco-2细胞构建肠粘膜屏障模型的相关研究*
吴茂军 侯龙龙
(泰山医学院附属医院,山东 泰安 271000)
关于Caco-2细胞构建肠粘膜屏障模型的相关研究*
吴茂军侯龙龙
(泰山医学院附属医院,山东 泰安271000)
目的通过用Caco-2细胞的体外培养,建立肠粘膜屏障的模型。方法通过对Caco-2细胞在体外transwell小室中连续培养21 d,并对培养的细胞进行形态学观察、跨膜电阻测定、inulin-FITC通透率测定,评估肠屏障模型是否构建成功。结果通过体外连续培养Caco-2细胞形成了致密单层,可见细胞层单层排列,相互融合,边界清晰,细胞间紧密连接清晰可以见,21 d TER值为496.32±6.02(Ω·cm2),inulin-FITC的通透率<0.5%。结论通过细胞形态学观察,跨膜电阻测定及inulin-FITC的通透率显示Caco-2细胞体外构建肠屏障模型成功,此模型对于相关疾病的研究具有一定意义。
Caco-2细胞;肠粘膜屏障;模型
无论是外科手术或内科疾病,只要有肠道缺氧、缺血发生,即可能有肠黏膜屏障功能障碍,容易发生肠道细菌易位,可进一步引发全身炎症反应综合征(SIRS) 、脓毒症( sepsis) 以及多器官功能障碍综合征(MODS)[1-2]。 新生儿坏死性小肠结肠炎(NEC)发生的起始原因就是肠黏膜损伤。新生儿尤其早产儿肠黏膜上皮细胞发育不完善,易受缺氧、配方奶喂养和细菌感染等因素影响,导致新生儿肠粘膜损伤,发生NEC[3]。人结肠腺癌细胞(the human colon adenocarcinoma cell lines,Caco-2细胞)可以在体外培养条件自发的不需诱导分化形成成熟的单层肠上皮细胞,被广泛用作肠道屏障模型进行体外毒理学研究。在传统的细胞培养条件下,将Caco-2细胞接种于多孔可渗透碳酸聚酯膜上增殖融合并自发分化为成熟肠上皮细胞,具有肠腔侧 (Apical Side,AP端、绒毛面)和肠壁侧(BasoLateral Side,BL端,基底面) ,形成刷状缘,在单层肠上皮细胞形成过程中刷状缘可以分化出碱性磷酸酶。但由于细胞来源和培养条件的不同,细胞特性有所改变。Caco-2在不同的实验室及不同的培养条件下如动物血清的使用类型、补充添加到培养基中的成分、细胞克隆的来源及代数等会有差异性,因此在建立稳定的肠屏障的模型的过程中需要对细胞的生物学行为、跨上皮电阻、菊粉-FITC通透率等参数进行评估,肠粘膜屏障构建成功对于肠屏障功能障碍引起的疾病的研究奠定基础。
1 材料与方法
1.1实验材料
1.1.1试剂及仪器DMEM高糖培养基(Gibco公司)、谷氨酰胺(Gibco公司)、非必须氨基酸(Gibco公司)、胎牛血清(Gibco公司)、0.25%-EDTA胰蛋白酶消化液(Gibco公司)、菊粉-FITC(Sigma公司)、Millicell-ERS跨上皮电阻仪(WPI公司)、Transwell-24孔system(pore size 0.4 μm,0.33 cm2)(Corning公司)。
1.1.2 实验细胞Caco-2细胞株 22代(由中国科学院上海细胞库提供)。实验在温州医科大学小儿外科重点实验室完成。
1.2 实验方法
1.2.1 Caco-2细胞的培养Caco-2细胞(中国科学院上海细胞库),置于37 ℃,5%CO2培养条件下,用配制好含10%胎牛血清的DMEM培养液,培养在25 cm2培养瓶中,隔1~2 d换新鲜培养液一次,一般约4~5 d细胞生长融合后传代,也可按照实验需要消化细胞传代培养。
1.2.2 Caco-2细胞肠屏障模型的建立将含10%胎牛血清的DMEM培养基加入transwell-24孔小室,置于细胞培养 箱内平衡过夜备用,取对数生长期的Caco-2细胞,接种于transwell-24小室内AP侧加入200 μl细胞悬液,BL侧下腔加800 μl培养液,接种后1周内每48 h换液,1周以后每24 h换液。显微镜下观察细胞生长状况。

图1 Caco-2在Transwell中单层屏障模型图
1.2.3 Caco-2细胞肠屏障跨上皮电阻(TER)测定将Caco-2细胞在transwell-24孔小室内连续培养至21 d,应用跨膜电阻仪自接种时开始,隔日测定Caco-2细胞TER值。测量时应用PBS把无菌电极浸泡过夜,并且最好控制在37 ℃下进行,选取Transwell小室三个不同方向的点,检测该点的TER,每点重复测3次,取平均值即为该样品的TER值,结果以Ω·cm2表示。根据公式TER值=(R1-R0)×A(Ω·cm2),式中R1(Ω)代表各组接种Caco-2细胞小室的TER值,R0(Ω)代表空白对照组(未接种细胞小室的TER值),A(cm2)为小室底面膜面积。
1.2.4 inulin-FITC通透率测定Caco-2细胞接种在Transwell小室上腔,放入CO2培养箱,连续培养。培养期间,显微镜下观察细胞生长状况,当细胞完全融合后开始检测。将小室中的培养基吸弃,用不含Ca2+、Mg2+的PBS润洗3次,在小室AP侧加 100 ul inulin-FITC(1 g/L),放入培养箱中孵育1 h。避光操作。1 h后于小室下腔同一平面3个不同的位置取100 μl培养基。使用多功能酶标仪于激发波长(Excitation Wavelength,Ex)为485 nm、发射波长(Emission Wavelength,Em)为520 nm处测定FITC荧光强度值。通过测量inulin-FITC通过单层Caco-2细胞肠屏障的速率,观察单层肠屏障模型的通透性的变化,具体参照Basuroy等[4]的方法。肠屏障模型的通透率等于每小时每平方厘米通过AP侧的荧光强度占总荧光强度的百分比。
1.3 统计学分析所有计量资料均以均数+标准差(MEANSD)表示,数据采用SPSS17.0统计软件进行分析。对所有数据进行正态性检验,对两样本采用独立样本t检验方法比较均数,多组间比较前先检查其方差齐性,方差齐,采用单因素方差分析(oneway-ANOVA)进行组间比较,若方差不齐则需做Welch校正。处理组与对照组间多重比较,方差齐时用Dunnett法分析;方差不齐时则用Durmett T3法。以P≤0.05作为检验标准。
2 结 果
2.1 Caco-2细胞光学显微镜下形态学观察
Caco-2细胞经消化、传代、培养,利用倒置相差显微镜观察Caco-2细胞的生长状况。镜下观察可见细胞贴壁生长,随培养时间的延长细胞和细胞之间会出现融合,大约5~6 d可达到80%以上融合。倒置显微镜下可见细胞生长良好,细胞边界明显,细胞生长第5 d时(图2,Day 5),细胞相互接触融合成片,可见细胞和细胞间紧密连接出现。如图2(Day 14)所示Caco-2细胞形成了致密单层,可见细胞层单层排列,相互融合,边界清晰,细胞间紧密连接清晰可以见,提示Caco-2细胞单层肠上皮屏障形成。




图2 显微镜下Caco-2细胞肠屏障形成过程中细胞形态观察
注:随Caco-2细胞培养时间延长,细胞接种后的5 d内细胞增殖明显,第9 d时出现细胞部分融合,培养延长至14 d时X200镜下观察细胞形成致密单层。
2.2 Caco-2细胞肠屏障形成过程中跨上皮电阻测定 Caco-2细胞接种在Transwell-24小室系统,自接种日开始用EVOM2细胞跨膜电阻仪测TER值,测TER的方法参照文献[5-6]所述,TER的值是用测得电阻值乘单层膜的面积所计算出,单位Ω·cm2。由于Traswell小室的聚酯膜本身有一定电阻,因此计算时需要去除聚酯膜电阻值(大约30 Ω·cm2)。取培养在Transwell小室的细胞,取3组细胞,每组细胞同一平面不同位置测电阻3次后取均值。从图3中可以看出,随Caco-2细胞培养时间延长,TER值在前5 dTER增长缓慢,提示细胞还未融合;其后因细胞融合,细胞间紧密连接形成,TER值增长较快,至21 d TER值为496.32±6.02(Ω·cm2),提示Caco-2细胞肠屏障模型建立。
2.3 Caco-2细胞inulin-FITC通透率的测定Caco-2细胞接种在Transwell小室中,置于37 ℃,5% CO2,相对湿度90%的培养箱中连续培养21 d后,加入inulin-FITC后放入培养箱中孵育1 h,然后在小室BL侧3个不同吸取100 μl的培养基,用多功能酶标仪检测荧光强度,并计算inulin-FITC的通透率。从表2中可以看出,Caco-2细胞在Transwell中连续孵育21 d后,inulin-FITC的通透率<0.5%,提示Caco-2细胞彼此融合,形成紧密连接,提示肠屏障模型构建成功。

表 1 Caco-2细胞培养时间与跨上皮电阻的关系
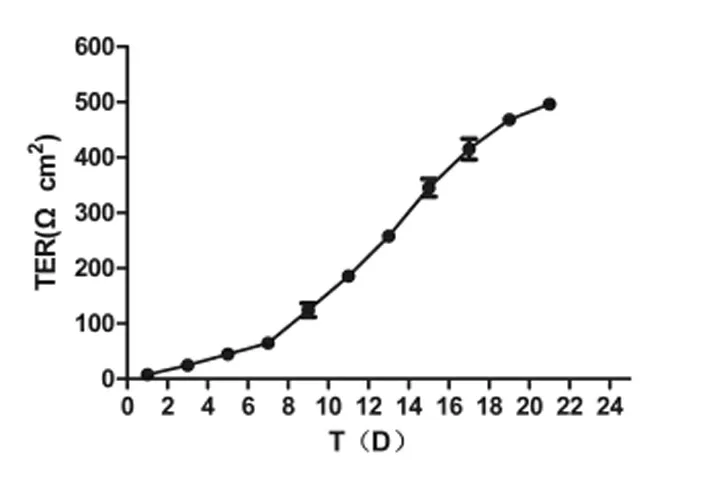
图3 Caco-2细胞培养时间与跨上皮电阻的关系

组别荧光强度123(x±s)Permeability(%/h/cm2)AP侧7.4799.2368.2767.9619.7568.5767.5358.9898.1367.658±0.2649.327±0.3928.330±0.2250.2750.3340.298Total901.772935.682923.02920.158±17.135
3 讨 论
在过去的20多年中人类小肠Caco-2细胞系作为肠屏障模型被广泛应用。最初的细胞系来源于人类结肠腺癌细胞,在体外培养的条件下可以自发的分化形成单层的细胞,表达一些常成熟的上皮细胞的形态和功能特征。研究发现体外的培养条件的不同可以影响这些特征的表达,部分是由于最初的母细胞系的异质性,导致一些细胞亚群增生明显。此外,几个克隆细胞系已经从母系细胞中分离出来,表现出更均匀的差异分化特征,而不是经常表达母系细胞的所有特征。最初的关于Caco-2细胞的研究表明,在不同的条件下,表达一些小肠上皮细胞的形态学和生物化学特性[7]。这些细胞呈单层生长,表现为外圆极化状态,微绒毛在AP侧,相邻细胞之间存在TJs(tight junctions,TJs)大小形态和微绒毛顶端一方面,相邻细胞之间的紧密连接,可以在AP侧表达小肠水解酶酶活性(如麦芽糖酶、乳糖酶、氨基肽酶N、dipeptidylpeptidase IV等)。除此之外,Caco-2细胞还可以表达相同或者类似的正常小肠上皮中的代谢酶等,包括刷状缘特异性表达的碱性磷酸酶、谷氨酰胺转肽酶、细胞色素P450同工酶等。
随着近年来Caco-2细胞在在营养、药理学和毒理学等研究领域的应用越来越广泛,在培养相同的条件下,不同克隆来源的Caco-2细胞系在不同的试验室也很难进行结果的比较[8]。因此,在进行Caco-2细胞肠屏障试验时需要对建立的模型进行验证,建模成功的标准主要进行单层Caco-2细胞完整性的评价。常用的评价指标:(1)光学显微镜和电镜检查单层细胞屏障的表面和细胞间结构;(2)测定单层细胞屏障的跨上皮电阻(TER);(3)细胞间转运标准物的通透量,常用的有PEG4000、3H-甘露醇、菊粉等[9,10]。
本实验中采用的Caco-2细胞是购于上海中科院细胞库,来源于ATCC的Caco-2细胞系,22代。实验中所用的细胞代数约25~45代之间,尽量不用超过60代的细胞,以免细胞生物学特性改变。从实验结果中可以看出,Caco-2细胞在连续培养7天内主要是以细胞增殖为主,在后续逐渐出现细胞相互融合,完成功能性屏障特性表达。从图2中的倒置显微镜下的细胞形态学观察发现,细胞在第5 d左右开始出现细胞融合,至第14 d时可以看到细胞融合成致密的单层,可以看到细胞间紧密连接存在,提示Caco-2细胞肠屏障的形态学模型形成。
通过对接种在Transwell小室中的Caco-2细胞连续培养过程中TER值的测定,如表1和图3结果显示,Caco-2细胞肠屏障形成过程大致需要21 d,与文献中描述一致。TER值在前7 d内呈缓慢增长趋势,在第7 d时出现迅速增加,在2周后增长趋势逐渐平缓,在第21 d左右时趋于稳定。该结果值与Caco-2细胞培养过程中形态学变化相吻合。在连续培养21 d后,单层Caco-2细胞的菊粉通透率<0.5%(见表2),也提示Caco-2细胞单层肠屏障模型建立成功。
研究发现,Caco-2细胞在连续培养21 d左右能够形成致密的单层,TER值为496.32±6.02(Ω·cm2),inulin-FITC通透率<0.5%,生物学形态上和小肠单层肠上皮细胞相似。在本实验室中连续培养Caco-2细胞建立的模型符合单层肠上皮细胞屏障模型,可以作为评估影响肠屏障模型的体外实验模型。
本实验成功构建了体外的Caco-2细胞单层肠屏障模型,经检测符合肠屏障体外实验模型,可以应用此模型研究肠屏障功能破坏引起的疾病如炎症性肠道疾病、食物过敏和乳糜,为后续的研究提供基础支持。
[1]Zhang JB,Du XG,Zhang H,et al. Breakdown of the gut barrier in patients with multiple organ dysfunction syndrome is attenuated by continuous blood purification: effects on tight junction structural proteins [J].Int J Artif Organs,2010,33: 5-14.3.
[2]Catalioto RM,Maggi CA,Giuliani S. Intestinal epithelial barrier dysfunction in disease and possible therapeutical interventions[J].Curr Med Chem,2011,18: 398-426.
[3]Turcios-Ruiz RM,Axelrod P,et al. Outbreak of Necrotizing Enterocolitis Caused by Norovirus in a Neonatal Intensive Care Unit[J]. J Pediatr, 2008,153(3):339-344.
[4]Basuroy S, Sheth P, Rao RK,et al.Expression of kinase-inactive c-Src delays oxidative stress-induced disassembly and accelerates calcium-mediated reassembly of tight junctions in the Caco-2 cell monolayer. J Biol Chem 2003,278:11916-11924.
[5]Suzuki T, Seth A, Rao R. Role of phospholipase Cgamma-induced activation of protein kinase Cepsilon (PKCepsilon) and PKCbetaI in epidermal growth factor-mediated protection of tight junctions from acetaldehyde in Caco-2 cell monolayers[J]. J Biol Chem, 2008, 283:3574-3583.
[6]Suzuki T, Elias BC, Rao R,et al. PKC eta regulates occludin phosphorylation and epithelial tight junction integrity[J]. Proc Natl Acad Sci U S A, 2009,106:61-66.
[7]Pinto M,Robine-Leon S,Appay M-D,et al. Enterocyte-like differentiation and polarization of the human colon carcinoma cell line Caco-2 in culture[J].Biol Cell,1983,47:323-30.
[8]Artursson P,Palm K,Luthman K.Caco-2 monolayers in experimental and theoretical predictions of drug transport[J].Adv Drug Deliv Rev,2001,46:27-43.
[9]Berry R J, Li Z. Folic acid alone prevents neural tube defects: evidence from the China study[J]. Epidemiology, 2002, 13(1): 114-116.
[10]James S J, Pogribny I P, Pogribna M, et al. Mechanisms of DNA damage, DNA hypomethylation, and tumor progression in the folate/methyl-deficient rat model of hepatocarcinogenesis[J]. The Journal of nutrition, 2003, 133(11): 3740S-3747S.
Related research of building intestinal barrier modal with Caco-2 Cells
WU Mao-jun HOU Long-long
(Affiliated Hospital of Taishan Medical University,Taian 271000,China)
Objective: To develop and evaluate an in vitro model of the intestinal epithelial barrier with Caco-2 cells grown in a trans-well system.Methods: we checked the intestinal barrier by measuring the transepithelial electrical resistance (TER) and inulin permeability in a Caco-2 cell monolayer model.Results: We cultured Caco-2 cells in transwell, measuring the TER increased gradually along with the extension of incubation time .Until 21days,TER was was 496.32±6.02 (Ω·cm2) and the permeability of inulin-FITC was less than 5%.Conclusion: Observed the cell morphology and measuring the transepithelial electrical resistance (TER) and inulin permeability,we cultured the model of intestinal barrier. Thus it is significant for the research of related diseases.
Caco-2 Cells; intestinal barrier; modal
吴茂军(1968—)男,山东莱芜人,副主任医师,硕士,主要从事小儿外科疾病的诊断及治疗
R726
A
1004-7115(2016)04-0361-04
10.3969/j.issn.1004-7115.2016.04.001
2016-01-21

