圆叶决明对镉胁迫的生理响应
何梨香,黄运湘,黄楚瑜,刘利杉,龙 祥,罗 琳(湖南农业大学资源环境学院,湖南长沙410128)
圆叶决明对镉胁迫的生理响应
何梨香,黄运湘*,黄楚瑜,刘利杉,龙祥,罗琳
(湖南农业大学资源环境学院,湖南长沙410128)
圆叶决明是我国20世纪80年代从澳大利亚引进的豆科牧草,适合亚热带地区广泛种植。为探明圆叶决明的耐镉性,本文采用添加外源有效态镉的土壤盆栽试验方法,研究不同浓度(0,1,2,4,8 mg/kg)镉胁迫对圆叶决明CIP86134生长发育及其生理响应机制。结果表明,镉胁迫抑制圆叶决明的生长发育,降低其生物产量,且随镉浓度的升高,抑制作用加强。当镉处理浓度为4 mg/kg时,地下部、地上部生物产量与对照比显著下降,分别为对照的59.69%和63.77%。镉胁迫抑制圆叶决明叶绿素a、叶绿素b和类胡萝卜素的合成,镉浓度升高,叶绿素含量逐渐降低,处理之间达显著差异水平。镉处理浓度为1~2 mg/kg时,SOD、POD、CAT 3类保护酶协调一致,圆叶决明生长正常,地下部、地上部生物产量与对照比差异不显著;镉浓度升高至4 mg/kg,SOD酶活性降低,MDA含量升高,POD和CAT酶被诱导激活,缓解了镉胁迫对圆叶决明的伤害,生物产量虽显著下降,但未中毒死亡;镉浓度升高至8 mg/kg时,MDA含量显著增加,细胞保护酶系统失调,圆叶决明至收获时全部干枯死亡。圆叶决明吸收的镉主要积累在地下部,迁移系数仅为0.152~0.234。在供试土壤添加外源有效态镉的条件下,圆叶决明能忍耐2 mg/kg以下的镉胁迫,可作为南方红壤地区矿山镉污染土壤的生态修复植物类型。
圆叶决明;镉胁迫;生理响应;保护酶活性;Cd积累与分布
http://cyxb.lzu.edu.cn
何梨香,黄运湘,黄楚瑜,刘利杉,龙祥,罗琳.圆叶决明对镉胁迫的生理响应.草业学报,2016,25(2):198-204.
HE Li-Xiang,HUANG Yun-Xiang,HUANG Chu-Yu,LIU Li-Shan,LONG Xiang,LUO Lin.Physiological response of Chamaecrista rotundifolia to cadmium exposure.Acta Prataculturae Sinica,2016,25(2):198-204.
圆叶决明(Chamaecrista rotundifolia)是20世纪80年代从澳大利亚国际农业研究中心引进的一种豆科牧草[1],具有生物产量高、固氮能力强、养分丰富、抗逆性强等优点,在我国广东、福建、湖南等地成功引种并广泛种植[2-3]。有关圆叶决明对丘岗红壤的培肥改良、果园套种的生态效应等已有大量的研究报道[4-6]。对干旱、高温、土壤酸化等逆境胁迫下的生理生化反应也有少量研究[7-8],钟珍梅等[12]还发现,圆叶决明2228有较强的耐镉性,在80 mg/kg镉胁迫下仍能生长,但耐镉机理有待进一步深入系统探讨。随着矿山污染土壤修复工作的全面开展和生态环境建设的大力推进,矿山污染土壤的生态修复模式及修复植物的筛选应用成为当前主要的研究课题。有关修复草种的耐镉性研究也取得了重要进展,刘俊祥等[9]研究表明,结缕草(Zoysia japonica)具有一定的镉耐性,可用作镉污染土壤的修复植物,白车轴草(Trifolium repens)和紫花苜蓿(Medicago sativa)可用于修复镉浓度25 mg/kg以下的污染土壤[10-11]。本文在前人研究的基础上,通过添加外源有效态镉的土壤盆栽试验方法,探明圆叶决明CIP86134对镉胁迫的生理反应及镉的富集特征和分布规律,以期为红壤地区矿山镉污染土壤的生态修复和农田镉污染土壤的修复治理提供修复材料。
1 材料与方法
1.1供试材料
1.1.1供试土壤湖南农业大学校区内由第四纪红土母质发育的耕型第四纪红土红壤。采集0~20 cm耕层混合土壤。土壤理化性质如下:p H值4.68,有机质9.61 g/kg,全氮0.64 g/kg,碱解氮50.9 mg/kg,全钾7.70 g/kg,全磷0.34 g/kg,有效磷12.2 mg/kg,速效钾164.7 mg/kg,缓效钾413.2 mg/kg,全镉0.167 mg/kg。
1.1.2供试品种福建省农科院农业生态研究所提供的圆叶决明CIP86134,是目前推广应用最广泛的品种之一。
1.2土壤盆栽试验设计与取样分析
土壤盆栽试验布置于湖南农业大学校内实习基地资源环境学院网室中。供试土壤取回后经风干、锤碎、过5 mm筛、混匀。按照每kg土加入N 0.1 g,P2O50.15 g,K2O 0.1 g计算施肥量,以尿素、磷酸二氢钾、氯化钾为肥源,与土壤充分拌匀后装入塑料桶(高22 cm,内径22.5 cm)中,每桶装土5 kg。试验共设5个处理:Cd2+添加浓度分别为0(对照),1,2,4和8 mg/kg,每处理重复6次。以Cd Cl2·2.5H2O为镉源,溶于水后喷洒在土壤中,与土壤拌匀后陈化15 d,于2014年3月21日每盆播种30粒种子,植株长出第2片叶时,选取长势一致的12株幼苗继续培养,并测量株高等生长动态指标。幼苗期(2014年7月8日),取3个重复的植株进行叶绿素、SOD、POD、CAT酶活性和MDA含量等生理指标的测定,每盆取样部位一致,均剪取自顶端2~4片完全叶。2014年7月20日,分盆收割其余的3个重复,测定地上部和地下部生物产量。植株取回后先用自来水洗净根系泥土,再用蒸馏水清洗植株叶片和根系,用吸水纸吸干表面水分后置于90℃烘箱中杀青30 min,60℃下烘至恒重,烘干样品用粉碎机粉碎后用于植株Cd含量测定。
1.3分析方法
土壤基本理化性质采用常规分析方法[13];土壤全量Cd采用国家标准方法(GB/T 17141-1997)测定;叶绿素含量采用丙酮∶乙醇∶水混合液(4.5∶4.5∶1.0)提取,分光光度法测定;MDA含量采用硫代巴比妥酸法测定;SOD酶活性采用NBT法,POD酶活性采用愈创木酚比色法,CAT酶活性采用紫外分光光度法测定[14-15]。
植株Cd含量采用HNO3-HCl O4湿灰化,电感耦合等离子体发射光谱仪(Perkinelmer公司生产iptima 8300)测定。
1.4数据处理
采用SPSS 17.0软件进行方差分析,采用Duncan新复极差法进行差异显著性检验。
2 结果与分析
2.1镉胁迫对圆叶决明生物量的影响
图1为不同浓度镉胁迫下圆叶决明地上部和地下部生物量(以干重计)。与对照比,低浓度镉(1~2 mg/kg)胁迫对圆叶决明地上部和地下部生物量的影响不显著,随着镉浓度的升高,圆叶决明生物量显著下降,当镉处理浓度为4和8 mg/kg时,圆叶决明地上部生物量分别为对照的59.69%和8.39%,地下部生物量为对照的63.77%和1.39%。从生物量说明圆叶决明对镉胁迫有一定的忍耐性,在供试土壤条件下,能忍耐2 mg/kg以下的镉胁迫。
2.2镉胁迫对圆叶决明叶绿素含量的影响
叶绿素是植物进行光合作用的物质基础,环境胁迫可导致叶绿素被破坏与降解,叶绿素含量的多少是衡量叶片衰老程度的重要指标[16-17]。镉胁迫对圆叶决明叶绿素含量的影响见表1。与对照相比,不同浓度镉处理显著降低圆叶决明叶绿素a、叶绿素b和类胡萝卜素含量,降幅分别达35.84%~86.95%、49.04%~87.88%和44.50%~82.57%。表明低浓度镉胁迫即抑制圆叶决明叶绿素的合成,镉处理浓度升高,抑制作用加强。其原因,一方面可能是镉的存在影响了叶绿素的合成,另一方面可能是镉的存在使植物体内原有的叶绿素遭到破坏。叶绿素a/b值总体大于对照,说明镉胁迫对叶绿素b合成的抑制作用较叶绿素a更严重。
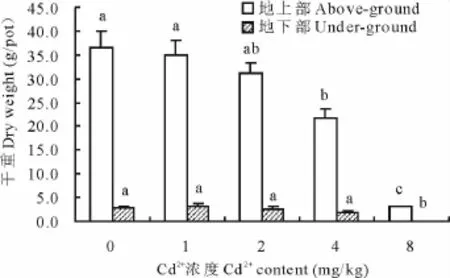
图1 镉胁迫对圆叶决明生物量的影响Fig.1 Effects of cadmium stress on biomass of C.rotundufolia
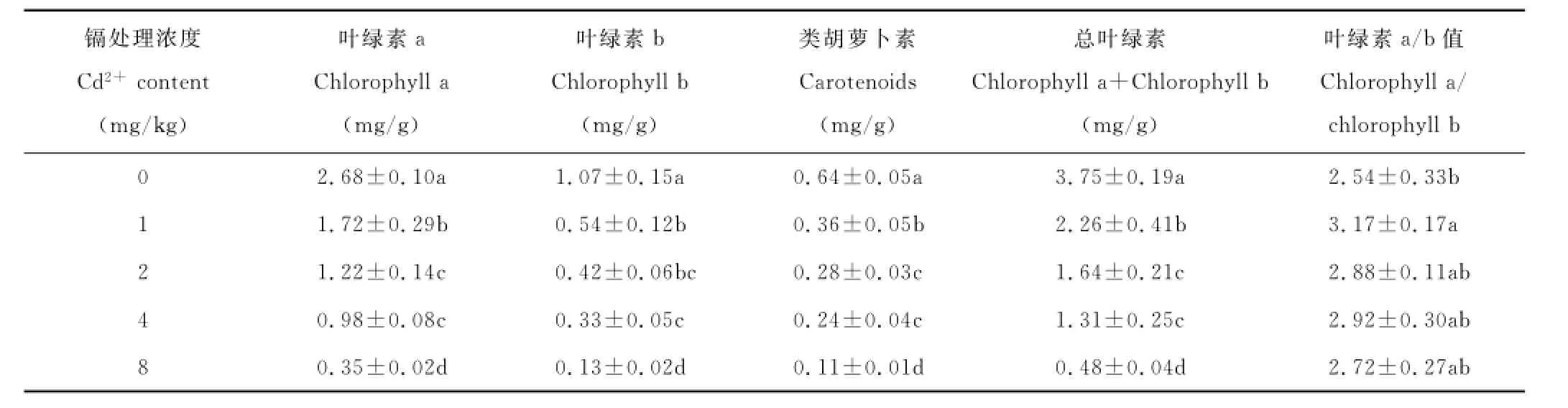
表1 镉胁迫对圆叶决明叶绿素含量的影响Table1 Effects of cadmium stress on chlorophyll content of C.rotundufolia
2.3镉胁迫对圆叶决明细胞保护酶活性和丙二醛(MDA)含量的影响
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是植物适应多种逆境胁迫的重要酶类,统称为植物体内的保护酶系统[18]。SOD歧化超氧阴离子自由基[O2·-]成H2O2,过氧化氢酶(CAT)和过氧化物酶(POD)清除H2O2,3种酶协调一致能将植物体内的[O2·-]和H2O2转化成H2O和O2,并能减少具有毒性的、高活性的氧化剂羟自由基(·OH)的形成[19-20]。故植物细胞存在着自由基的产生和消除这两个过程,当SOD、POD、CAT三者协调一致时,植物体内自由基维持一个较低水平,从而抵抗逆境胁迫的伤害。由图2a可知,供试土壤加镉处理,圆叶决明叶片SOD酶活性显著低于对照,镉浓度升高,SOD酶活性逐渐降低,处理间差异不显著。POD和CAT酶活性在镉处理浓度为1 mg/kg时均稍低于对照,镉浓度升高,POD酶活性急剧升高(图2b),CAT酶活性则缓慢升高(图2c)。当镉处理浓度为4 mg/kg时,POD酶的活性较对照提高了192.5%,CAT酶活性仅提高4.93%;镉浓度升至8 mg/kg,CAT酶的活性开始降低。从3大类细胞保护酶对镉胁迫的响应来看,POD酶在镉胁迫下被诱导激活的程度最高,为镉胁迫敏感酶类,SOD和CAT酶对镉胁迫的敏感度相对较低。
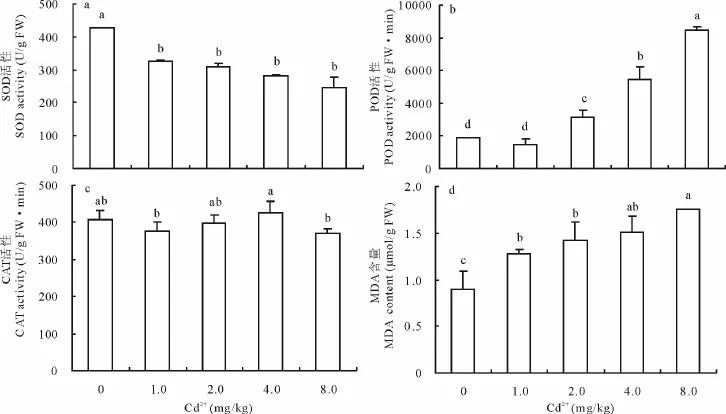
图2 镉胁迫对圆叶决明叶片SOD、POD、CAT活性和MDA含量的影响Fig.2 Effects of cadmium stress on activities of SOD、POD、CAT and the content of MDA in C.rotundufolia leaf
丙二醛(MDA)是细胞膜脂过氧化作用的产物,能与蛋白质、核酸、氨基酸等物质交联,形成不溶性化合物(脂褐素)沉积,从而干扰细胞正常的生命活动,影响植物的生长发育,其含量是反映细胞膜脂过氧化作用强弱的一个重要指标[21]。从图2d可知,供试土壤添加不同浓度镉,圆叶决明叶片MDA含量随镉浓度的升高而增加,均显著高于对照,镉浓度为1~8 mg/kg,圆叶决明叶片MDA含量为对照的1.43~1.97倍。因镉胁迫降低了SOD酶活性,圆叶决明体内自由基的清除能力下降,细胞膜脂质过氧化作用增强,MDA含量升高。
综上分析表明,当镉处理浓度为1~2 mg/kg时,虽然MDA含量开始升高,但由于SOD、POD和CAT酶系统的保护作用,圆叶决明受镉胁迫的影响较小,生物产量与对照比差异不显著。当镉处理浓度升高至4 mg/kg时,SOD酶活性进一步降低,MDA含量继续升高,圆叶决明受镉胁迫的影响程度增大,植物体内POD和CAT酶被诱导激活,减轻或缓解了镉胁迫的伤害,虽然生物产量有所降低,但不至于中毒死亡。镉浓度升高至8 mg/kg,细胞保护酶系统失调,膜脂过氧化作用增强,导致细胞衰老,收获时圆叶决明全部中毒死亡。
2.4圆叶决明对镉的吸收和迁移系数
从表2可知,圆叶决明对镉的吸收积累量均随镉处理浓度的升高而增加,处理之间达极显著差异水平。当镉处理浓度为1 mg/kg时,圆叶决明地下部和地上部镉含量分别为对照的4.6和2.4倍,镉累积量分别为对照的4.0和2.4倍。地下部镉含量远高于地上部,当镉处理浓度为1~4 mg/kg时,圆叶决明地下部镉含量是地上部的4.27~6.58倍。由于地上部生物量高于地下部,故镉的积累量是地上部高于地下部,地上部是地下部的2.20~2.65倍。
迁移系数(translocation factor,即植物地上部某种元素含量/植物根部该种元素含量,也称位移系数)通常用来表征某种重金属元素或化合物从植物根部到植物地上部的转移能力,是衡量超积累植物的指标之一。对某种重金属或化合物迁移系数越大的植物,越有利于用作植物的提取修复,一般认为迁移系数大于1的元素或化合物,其迁移能力强。从表2可知,圆叶决明在不同浓度镉处理下,迁移系数在0.152~0.234之间,表明圆叶决明CIP86134对镉的迁移能力较差,为非超积累植物。
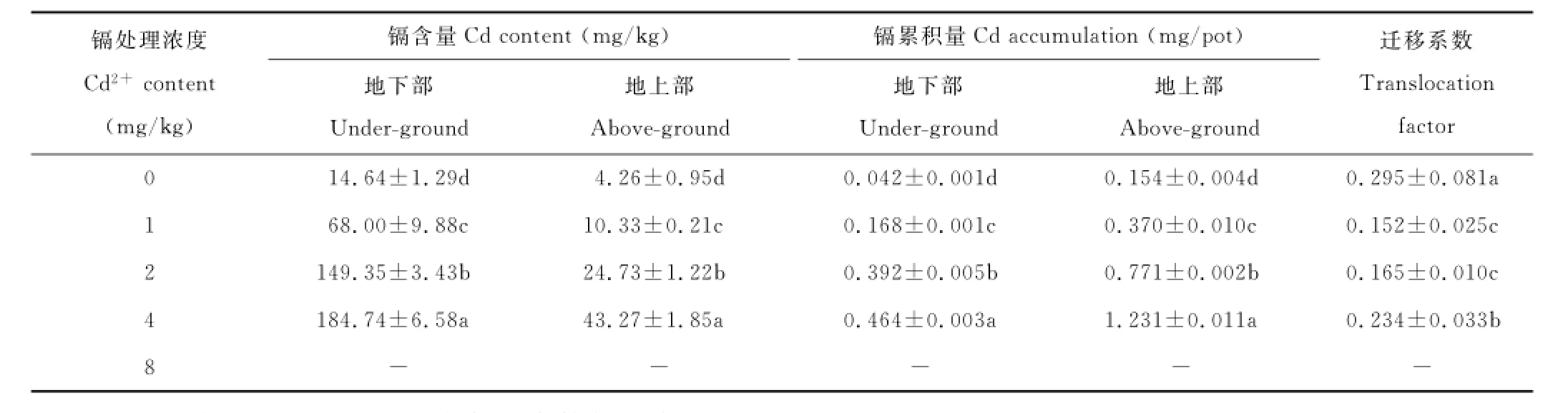
表2 不同浓度镉处理圆叶决明地上部、地下部镉的吸收累积量及迁移系数Table2 Contents,accumulation and translocation factor of Cd in the under-ground and above-ground of C.rotundufolia under different Cd concentrations
3 结论与讨论
镉为植物非必需营养元素,在植物体内过量积累会对植物造成毒害[22-24]。通常表现为植物生长迟缓、根系生长受阻、养分代谢失调及其他的生理紊乱,最终表现为产量下降,严重时甚至导致植物死亡等,不同植物对镉胁迫的响应机理不同[25-26]。本研究表明,在供试土壤条件下,圆叶决明CIP86134能忍耐2 mg/kg以下的镉胁迫,镉浓度升高,植株生长发育受阻,表现为叶片变小、失绿,根系短小,地上部和地下部干物质量降低等,当镉处理浓度为8 mg/kg时,圆叶决明至收获时全部干枯死亡。
当植物受到镉胁迫时,体内会做出一系列的生理反应,如自由基的积累和细胞膜脂的过氧化作用等,但也会通过多种途径对镉进行解毒,如抗氧化酶活性的升高、可溶性蛋白质含量的增加,镉结合蛋白的形成等[19-20]。本研究表明,供试土壤添加低浓度镉(1~2 mg/kg),SOD、POD、CAT细胞保护酶系统协调一致,圆叶决明生长发育未受显著影响,生物产量与对照比差异不显著;镉浓度升高至4 mg/kg时,虽然SOD酶活性进一步降低,MDA含量升高,由于POD和CAT酶被诱导激活,缓解了圆叶决明对镉胁迫的毒害作用,生物产量虽显著降低,但不至于中毒死亡;镉处理浓度升至8 mg/kg时,圆叶决明种子能正常萌发,幼苗期仍能缓慢生长,随着镉胁迫时间的延长,毒害作用加强,通过诱导氧化酶系统已难以抵抗镉胁迫的伤害,圆叶决明中毒死亡。
根系是植物与土壤环境接触的重要界面,更易对土壤环境做出反应。在镉胁迫条件下,圆叶决明通过根系吸收的镉主要积累在地下部,向地上部迁移的数量较少,迁移系数仅0.152~0.234,由于根系对镉的阻碍作用,阻止其向地上部转移,这也是圆叶决明抵抗低浓度镉胁迫毒害的机理之一。
本研究表明,圆叶决明CIP86134虽不是镉的耐性植物,但由于其生物量大,地面覆盖度高,生育期长,耐旱性强等特点,对南方红壤区矿山镉污染土壤的生态修复来说,是一种较理想的草被植物类型。
References:
[1]Zhan J,Luo X H,Su X Z,et al.Effect of planting density on productivity and photosynthetic characteristics of Chamaercrista roundifolia.Acta Prataculturae Sinica,2011,20(5):66-71.
[2]Zuo S P,Wang H M,Ma Y Q,et al.Response to cutting treatment of interspecific relationship of leguminous forages in semiarid regions.Acta Prataculturae Sinica,2009,18(5):150-159.
[3]Wen B Q,Jiang F Y,Fang J M,et al.Effect of chilling stress on carbon and nitrogen metabolism of leguminous Cassia rotundifolia seedings.Acta Prataculturae Sinica,2006,15(6):64-69.
[4]Ying Z Y,Huang Y B,Wen B Q,et al.Planting and study the Chamaecrista rotundifolia effects on the soil and water conservation and soil improvement in red soil hilly region.Youth Work Committee of China Grass Society Academic Papers[C]. Haikou:Chinese Grassland Society,2007.
[5]Luo X H,Liu M X,Luo S H,et al.Effects of intercropping Chamaecrista rotundifolia in tea plantation on weed diversity. Chinese Journal of Tropical Crops,2013,34(12):2503-2507.
[6]Li J Y,Shi M Z,Fu J W,et al.Effect of interplanting Chamaecrista rotundifolia on arthropod community in mango orchard. Journal of Fruit Science,2014,31(6):1128-1133.
[7]Weng B Q,Huang D F,Xiong D Z,et al.Effects of selenium on Chamaecrista rotundifolia growth,nutrient absorption and nitrogen-fixing ability.Chinese Journal of Applied Ecology,2004,24(12):2810-2817.
[8]Ren L H,Weng B Q,Yu H,et al.Effects of drought stress on the seed germ ination of Chamaecrista rotundifolia.Subtropical Agriculture Research,2010,6(4):232-235.
[9]Liu J X,Sun Z Y,Ju G S,et al.Physiological response of Zoysia japonica to Cd2+.Acta Ecologica Sinica,2011,32(20):6149-6156.
[10]Liu S L,Yang R J,Ma M D,et al.Effects of cadmium stress on growth,cadmium content and nutrient distribution in Trifolium repens L.plants.Journal of Nuclear Agricultural Sciences,2015,29(3):595-604.
[11]Sun N X,Song G L.Physiological response of Medicago sativa to cadmium stress and accumulation property.Pratacultural Science,2015,32(4):581-585.
[12]Zhong Z M,Huang Q L,Wang Y X,et al.Response to cadmium stress and cadmium uptake of Chamaecrista rotundifolia. Journal of Agro-Environment Science,2010,29(12):2287-2292.
[13]Bao S D.Soil Analysis[M].Beijing:China Agriculture Press,2000.
[14]Gao J F.Plant Physiology Experiment Instruction[M].Beijing:Higher Education Press,2006.
[15]Zhou Q.Plant Physiology Experiment Instruction[M].Beijing:China Agriculture Press,2000.
[16]Guo Z,Wang T,Ao Y S.Physiological rsponses of Solanum nigrum L.seedlings to cadmium stress.Journal of Agro-Environment Science,2009,28(4):755-760.
[17]Stroeva N,Berova M,Zlatev Z.Physiological response of maize to arsenic contamination.Biologia Plantarum,2004,47(3):449-452.
[18]Huang Y X.Toxic Effects of Cadmium on Glycine Max Plants and Differences of Cadmium Tolerance of Various Glycine Max Varieties[D].Changsha:Hunan Agricultural University,2006.
[19]Gajewska E,Sklodowska M,Slaba M,et al.Effect of nickel on antioxidative enzyme activities,proline and chlorophyll contents in wheat shoots.Biologia Plantarum,2006,50(1):653-659.
[20]Strobrawa K,Lorene Pluciska G.Thresholds of heavy metal toxicity in cutting of Europe black poplar(Populusnigra L.)determined according to antioxidant status of line roots and morphometrical disorders.Science of the Total Environment,2008,390(1):86-96.
[21]Wen Y,Mu L Q.Effects of soil Pb,Cd stress on the growth,Physiological and accumulating characteristics of four ornamental trees.Journal of Soil and Water Conservation,2013,27(5):234-238.
[22]Guo Z,Yuan H Y,Ao Y S.Effects of Cd stress on phytosynthsis and concentrations of nutrient elements of Solanum nigrum L.Ecology and Environmental Sciences,2009,18(3):824-829.
[23]Shen X T,Xing Y,Lu D,et al.Research progress in poisoning cadmium pollution to tobacco an its control measures.Acta Agriculture Jiangxi,2014,26(9):58-60.
[24]Wang M,Zhao M Q,La G X.Research progress on cadmium contamination an its control measures.Journal of Agriculture Science and Technology,2011,13(2):93-98.
[25]Li Z J,Ma G R,Xu J M,et al.Physiological and biological mechanism of plant for adapting the stress by cadmium.Chinese Journal of Soil Science,2004,35(2):234-238.
[26]Zhu Z Y,Hao Y F,Wu J Z,et al.Effects of Cd2+stress on the seeding growth,Cd2+,Zn2+and Mn2+uptake of different wheat cultivars.Journal of Soil and Water Conservation,2011,25(2):209-213.
[1]詹杰,罗旭辉,苏小珍,等.不同留株密度对圆叶决明生产性能及光合特性的影响.草业学报,2011,20(5):66-67.
[2]左胜鹏,王会梅.刈割扰动下半干旱区豆科牧草种间关系的反应.草业学报,2009,18(5):150-159.
[3]翁伯琦,江福英,方金梅,等.低温胁迫对豆科牧草圆叶决明苗期植株C、N代谢的影响.草业学报,2006,15(6):64-69.
[4]应朝阳,黄毅斌,温伯奇,等.红壤丘陵区种植圆叶决明的水土保持与土壤改良的效果研究.中国草学会青年工作委员会学术研讨论文集[C].海口:中国草学会,2007.
[5]罗旭辉,刘明香,罗石海,等.茶园套种圆叶决明对杂草物种多样性的影响.热带作物学报,2013,34(12):2503-2507.
[6]李建宇,史梦竹,傅建炜,等.套种圆叶决明对芒果园节肢动物群落的影响.果树学报,2014,31(6):1128-1133.
[7]翁伯琦,黄东风,熊德中,等.施用硒肥对圆叶决明生长、酶活性及其叶肉细胞超显微结构的影响.生态学报,2004,24(12):2810-2817.
[8]任丽花,翁伯琦,余华,等.干旱胁迫对圆叶决明种子萌发的影响.亚热带农业研究,2010,6(4):232-235.
[9]刘俊祥,张振元,巨关升,等.结缕草对重金属镉的生理响应.生态学报,2011,31(20):6149-6156.
[10]刘柿良,杨荣孑,马明东,等.镉胁迫对白车轴草生长、镉含量及养分分配的影响.核农学报,2015,29(3):0595-0604.
[11]孙宁晓,宋桂龙.紫花苜蓿对镉胁迫的生理响应及累积特性.草业科学,2015,32(4):581-585.
[12]钟珍梅,黄勤楼,王义祥,等.圆叶决明对重金属镉胁迫的响应及镉吸收效果研究.农业环境科学学报,2010,29(12):2287-2292.
[13]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
[14]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[15]皱琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[16]郭智,王涛,奥岩松.镉对龙葵幼苗生长和生理指标的影响.农业环境科学学报,2009,28(4):755-760.
[18]黄运湘.镉对大豆的毒害效应及不同大豆品种耐镉差异性研究[D].长沙:湖南农业大学,2006.
[21]王瑀,穆立蔷.土壤铅、镉胁迫对4种绿化植物生长、生理及积累特性的影响.水土保持学报,2013,27(5):234-238.
[22]郭智,原海燕,奥岩松.镉胁迫对龙葵幼苗光合特性和营养元素吸收的影响.生态环境学报,2009,18(3):824-829.
[23]沈雪婷,邢燕,卢迪,等.镉污染对烟草的毒害及调控措施研究进展.江西农业学报,2014,26(9):57-60.
[24]王淼,赵明钦,腊贵晓.烟草中重金属镉污染及调控措施研究进展.中农业科技导报,2011,13(2):93-98.
[25]李兆军,马国瑞,徐建明,等.植物适应重金属Cd胁迫的生理及分子生物学机理.土壤通报,2004,35(2):234-238.
[26]朱志勇,郝玉芬,吴金芝,等.镉胁迫对不同小麦品种幼苗生长及Cd2+、Zn2+、Mn2+吸收和累积的影响.水土保持学报,2011,25(2):209-213.
Physiological response of Chamaecrista rotundifolia to cadmium exposure
HE Li-Xiang,HUANG Yun-Xiang*,H UANG Chu-Yu,LIU Li-Shan,LONG Xiang,LUO Lin
College of Resource and Environment,Hunan Agricultural University,Changsha 410128,China
Chamaecrista rotundifolia,introduced from Australia in the 1980s is a leguminous forage widely cultivated in subtropical regions.The effects of cadmium(Cd)exposure on the growth and physiological characteristic of C.rotundifolia were studied at different Cd concentrations(0,1,2,4,8 mg Cd/kg dry soil)using a pot experiment.When C.rotundifolia was exposed to a Cd concentration of 1-2 mg Cd/kg soil,the protective enzymes superoxide dismutase(SOD),peroxidase(POD),and catalase(CAT)were all produced and C. rotundifolia growth was normal.There was no significant decrease in underground or aboveground biomass,compared with the controls.When C.rotundifolia was exposed to 4 mg Cd/kg soil,SOD activity was reduced,while the content of the oxidative stress marker malondialdehyde(MDA)increased.However,the enzymes POD and CAT were activated.Therefore,there was some alleviation of Cd stress.Although no tissue death was observed,at the Cd concentration of 4.0 mg/kg,the values for underground and above ground biomass were reduced by 59.69%and 63.77%,respectively,compared with the control.When C.rotundifolia was ex-posed to 8 mg Cd/kg soil,the MDA content increased significantly,the cell protective enzyme system was imbalanced,and all plants were dead when harvested.The synthesis of chlorophyll a,chlorophyll b and carotenoids was inhibited by Cd exposure,and the inhibitory effect increased with increasing Cd concentration.The Cd accumulated mainly in the underground organs of C.rotundifolia,and the translocation factor was only 0.152-0.234.In this experiment were available Cd was added to soil,C.rotundifolia tolerated Cd concentrations below 2.0 mg/kg.C.rotundifolia has potential as a remediation plant to restore soil contaminated with Cd by mining operations in China's south red soil region.
Chamaecrista rotundifolia;cadmium stress;physiological response;protective enzyme activities;Cd accumulation and distribution
10.11686/cyxb2015158
2015-03-26;改回日期:2015-06-12
国家科技支撑计划项目“矿区重金属污染土壤生态修复技术及示范”(2012BAC09B04)资助。
何梨香(1990-),女,湖南邵阳人,在读硕士。E-mail:284800748@qq.com
Corresponding author.E-mail:yxhuang63@163.com

