复合微生物肥料对羊草草原土壤理化性质及酶活性的影响
权国玲,谢开云,仝宗永,李向林*,万里强,毕舒贻,万修福(.中国农业科学院北京畜牧兽医研究所,北京0093;2.兰州大学草地农业科技学院,草地农业生态系统国家重点实验室,甘肃兰州730020)
复合微生物肥料对羊草草原土壤理化性质及酶活性的影响
权国玲1,2,谢开云1,仝宗永1,李向林1,2*,万里强1,毕舒贻1,万修福1
(1.中国农业科学院北京畜牧兽医研究所,北京100193;2.兰州大学草地农业科技学院,草地农业生态系统国家重点实验室,甘肃兰州730020)
为了使微生物肥料达到更好的效果,便出现了集无机化学肥料、有机肥料以及微生物肥料综合效果的新型肥料-复合微生物肥料。本文选择腐殖酸、糖蜜发酵、海藻酸等3种复合微生物肥料,设置对照、3种复合微生物肥料单施及混合施入5种处理,分别用CK、F、T、H、A表示,研究其在改善羊草草原土壤肥力中的作用。结果显示:1)表层土壤全磷在T和A处理较CK降低显著;土壤有机质在F处理变化不显著外,在其余3种处理均较CK增加显著,且A处理较F和T处理增加显著;其余土壤理化性质在各处理均无显著变化。2)土壤酶活性却对复合微生物肥料有显著性的变化:0~10 cm土层中,与对照相比,过氧化氢酶活性除在F处理变化不显著外,其余处理均显著降低;磷酸酶活性除在H处理变化不显著外,其余处理均显著增加;脲酶活性在F和T处理降低显著;而蔗糖酶活性在各处理均变化不显著。10~20 cm土层中,与对照相比,过氧化氢酶活性在F处理显著增加,而其他3个处理均显著降低;蔗糖酶活性除在A处理变化不明显外,其余3个处理均降低显著;脲酶活性只在F处理显著降低;磷酸酶活性在各处理均无显著性变化。3)表土层的过氧化氢酶活性与土壤p H呈显著正相关,脲酶与全氮呈显著负相关,磷酸酶与全磷呈显著负相关,下层土壤的蔗糖酶活性与有机质呈显著正相关,与土壤含水量呈显著负相关,且土壤酶活性随土壤剖面深度增加而降低。总的来看,微生物肥料在天然草地中的施用还需进行改良实验。
羊草草原;复合微生物肥料;土壤肥力;土壤酶
http://cyxb.lzu.edu.cn
权国玲,谢开云,仝宗永,李向林,万里强,毕舒贻,万修福.复合微生物肥料对羊草草原土壤理化性质及酶活性的影响.草业学报,2016,25(2):27-36.
QUAN Guo-Ling,XIE Kai-Yun,TONG Zong-Yong,LI Xiang-Lin,WAN Li-Qiang,BI Shu-Yi,WAN Xiu-Fu.The effect of compound bio-fertilizers on soil physical and chemical properties and soil enzyme activity in Leymus chinensis steppe.Acta Prataculturae Sinica,2016,25(2):27-36.
近年来,随着现代农业技术的发展与应用,化肥使用量及使用规模逐年增加,但平均利用率不到30%[1],而且还造成土壤品质下降、生态环境恶化、土地富营养化、重金属污染[1-3],生态平衡破坏,经济效益降低[4]等问题。微生物肥料的开发和应用满足了人们对生态农业和绿色食品生产发展的要求,其不仅可以改善土壤品质,提供安全食品,保证人畜健康、改善生态环境[4-7],而且可以刺激作物生长,提高产量,减轻病害[8],促进农业可持续发展[9-11]。故该类研究得到国内外研究学者的高度重视,并在农业生产中得到广泛应用,至今还没有文献报道其在改善天然草地土壤中的作用。
有研究表明,微生物肥料在农业生产中的增产效果一般在5%~20%[12],且可提高温室草莓(Fragaria ananassa)单株产量最高达0.52 kg/株[4],并有效增加温室豇豆(Vigna unguiculata)地上生物量[13]。但也有研究证明,虽然单一施用微生物肥料可改善棉田土壤生态环境,提高土壤肥力,增加土壤速效磷、碱解氮和速效钾含量,但微生物肥料与有机肥混施效果更好[14]。早期也有学者认为应在加施有机肥或化肥的同时施微生物肥料[8]。如此,便出现了复合微生物肥料。
复合微生物肥料是采用高新合成技术将有益微生物、有机物质及无机营养元素复合而成的一种可以体现无机化学肥料、有机肥料以及微生物肥料的综合效果新型肥料[15]。有大量研究证明,施用复合微生物肥可显著提高棉花(Gossypium hirsutum)产量及经济效益[16],并使水稻(Oryza sativa)产量与当地的平均施肥水平相比提高50.1 kg,增幅8.4%[17],也可使蔬菜增产9.2%~39.6%,降低蔬菜发病率5.6%~9.5%[15]。
鉴于这个背景,在内蒙古半干旱羊草(Leymus chinensis)草原中施入不同的混合微生物肥料,测定施入后土壤酶活性及土壤理化性质含量的变化,旨在研究施入不同混合微生物肥料对羊草草原土壤品质的改善情况,为未来微生物肥料在天然草地土壤中的拓展研究工作开辟道路。
1 材料与方法
1.1研究区域概况
试验区位于河北省张家口市北部坝上高原塞北管理区(原沽源牧场),国家草地生态系统野外观测站(塞北),地处内蒙古锡林郭勒草原南缘,河北省沽源县北部,E 115°39′51″,N 41°45′52″。海拔1400 m,年均温1.4℃,年均降水量297 mm(主要集中在7-9月),年蒸发量1785 mm,土壤以栗钙土、草甸土为主,p H值7.0~8.5,土壤有机质含量2.5%左右。地带性植被主要有:羊草为建群种,占有绝对优势,同时伴有糙隐子草(Cleistogenes squarrosa)、扁蓿豆(Lelissitus ruthenicus)、克氏针茅(Stipa krylovii)、华北岩黄茂(Hed ysarum gmelinii)等优良牧草,还有菊叶委陵菜(Potentilla tanacetifolia)、南牡篙(Rtemisia frigida)、蕊瓣唐松草(Thalictrum petaloideum)、柴胡(Bupleurum chinensis)、防风(Saposhnikovia divaricata)、二裂委陵菜(Potentilla bifurca)、山韭(Allium senescens)、细叶韭(Allium tenuissimum)、阿尔泰狗娃花(Heteropap pus altaicus)、蒙古篙(Artemisia eriopoda)、西伯利亚寥(Polygonum glaucum)等多种杂类草。
1.2实验设计与样品采集
2014年5月初在试验区域内选择地势平坦,土壤和植被类型基本一致的地段作为样地。实验采用随机区组设计,设置对照(CK)、单施腐殖酸复合微生物肥料(F)、糖蜜发酵复合微生物肥料(T)、海藻酸复合微生物肥料(H)和3种复合微生物肥料混合施入(A)等5个处理(表1),微生物肥料的施入采用表施。每个处理重复3次,共15个实验小区,小区面积15 m2(3 m×5 m)。于2014年7月末进行土样取样。在每个样方中随机选取3个点,用直径3.5 cm的土钻分0~10 cm、10~20 cm和20~30 cm取样,去除根系和石块等杂物后带回实验室。一部分土样4℃冰箱中保存,用于土壤酶活性的测定;另一部分土样风干后用于土壤理化性质的测定。
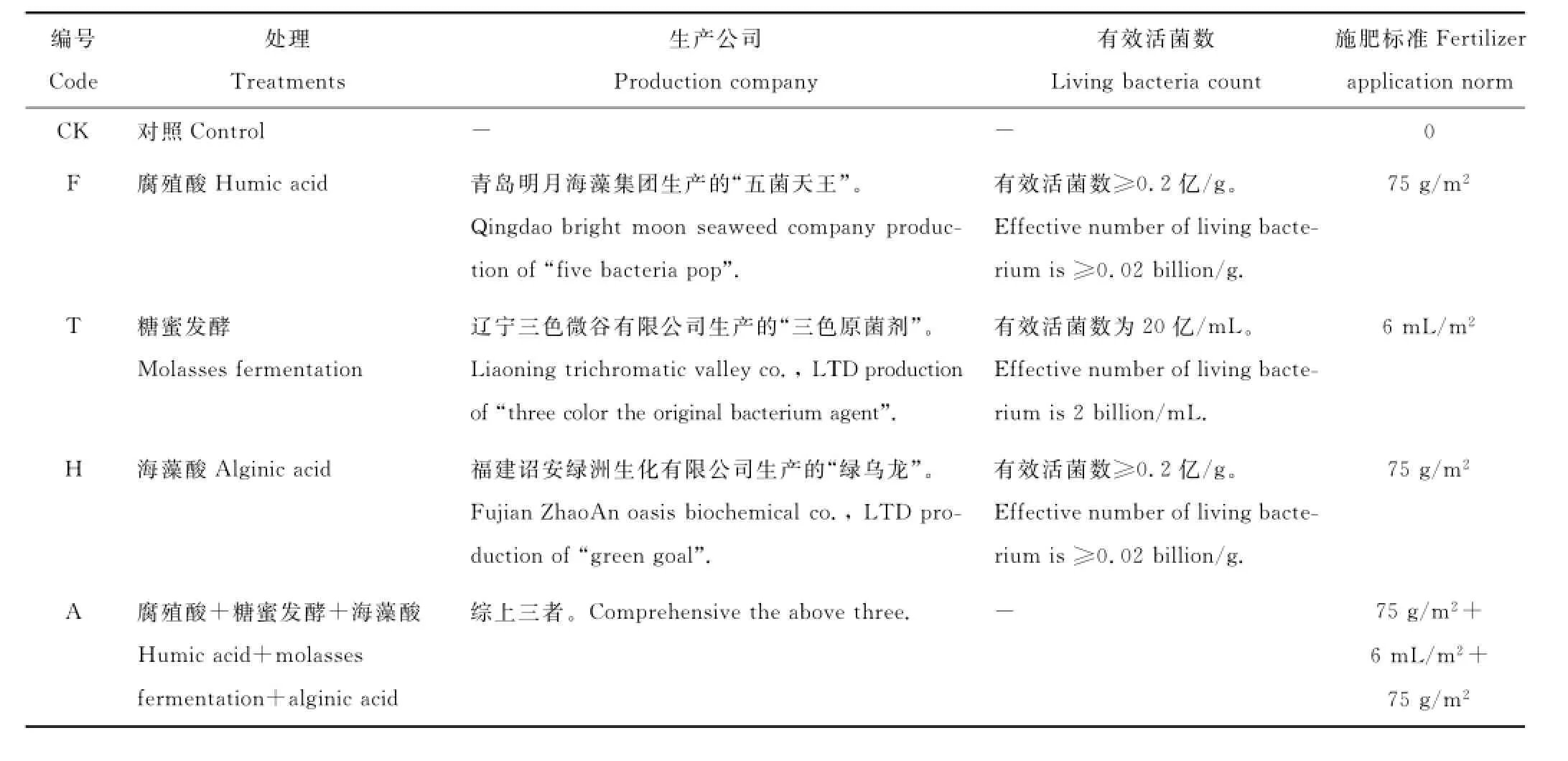
表1 实验设计Table1 The experiment design
1.3测定及分析方法
1.3.1土壤理化性质的测定土壤全氮采用凯氏定氮法(Kjeltec 1026,瑞典FOSS Tecator公司),土壤全磷采用酸溶-钼锑抗比色法,速效磷采用0.05 mol/L NaHCO3-钼锑抗比色法,土壤全钾采用氢氧化钠熔融法,土壤速效钾采用NH4OAc浸提法,土壤有机质的测定采用重铬酸钾容量法,土壤p H值以水为浸提液,用酸度计测定,土壤含水量以称重法测定[18]。
1.3.2土壤酶的测定土壤脲酶活性采用苯酚—次氯酸钠比色法,以37℃培养24 h后1 g土壤中生成的NH3-N的质量(mg)来表示;蔗糖酶活性用3,5-二硝基水杨酸比色法,以1 g土壤在37℃培养24 h内释放的葡萄糖mg数表示;磷酸酶活性采用磷酸苯二钠比色法,以24 h后1 g土壤中酚的mg数表示[19]。过氧化氢酶活性采用0.3%的H2O2比色法,用20 min内1 g土壤分解的过氧化氢的mg数表示[20]。
1.4数据分析
所有实验数据均用Microsoft Excel 2010和SAS 9.1软件进行整理和分析。采用方差分析(One-way ANOVA)比较不同处理间的差异显著性,用简单相关分析评价各因子间的相关关系,显著性水平设为P<0.05。利用Graphpad prism 6软件作图。
2 结果与分析
2.1施入微生物肥料对土壤理化性质的影响
施微生物肥料对各土层土壤理化性质的影响均不显著(表2)。0~10 cm土层中,与对照相比,全磷在单施糖蜜发酵复合微生物肥(T)和各复合肥混合施入(A)处理均降低显著(P<0.05),有机质除在单施腐殖酸复合微生物肥料(F)处理变化不显著外,其余3种处理均较对照增加显著(P<0.05),且混合施入(A)处理较单施腐殖酸复合微生物肥料(F)处理和单施糖蜜发酵复合微生物肥(T)处理增加显著(P<0.05)。10~20 cm和20~30 cm土层中,所有理化性质在各处理组间变化均不显著(P>0.05)。
表2 不同处理对土壤理化性质的影响Table2 The effects of different treats on soil physical and chemical properties

表2 不同处理对土壤理化性质的影响Table2 The effects of different treats on soil physical and chemical properties
注:同一土层同列数据不同字母表示差异显著(P<0.05)。Note:Different letters in the same column for a given soil layer meant significant difference at 0.05 level.
土层Soil layer (cm)处理Treatments p H含水量Soil water content (%)全氮Total N (g/kg)全钾Total K (g/kg)全磷Total P (g/kg)速效磷Available P (mg/kg)速效钾Available K (mg/kg)有机质Soil organic matter(%).34±0.23c F 8.37±0.13a 9.21±0.99a 0.27±0.08a 1.52±0.03a 5.43±0.40ab 3.80±0.91a 407.73±60.15a 1.44±0.09c T 8.46±0.04a 8.59±0.84a 0.25±0.07a 1.58±0.04a 4.50±0.67bc 3.50±1.09a 436.34±14.80a 2.00±0.17b H 8.37±0.05a 8.99±0.72a 0.27±0.03a 1.59±0.01a 5.22±0.44ab 3.63±1.07a 366.24±9.55a 2.25±0.25ab A 8.29±0.06a 8.51±0.67a 0.30±0.02a 1.57±0.06a 3.68±0.73c 2.57±1.41a 353.71±66.01a 2.53±0.10a 10~20 CK 8.80±0.20a 9.78±0.83a 0.22±0.09a 1.53±0.13a 4.07±1.62a 3.83±0.10a 277.81±47.98a 2 0~10 CK 8.56±0.04a 8.74±0.45a 0.24±0.02a 1.52±0.12a 5.51±0.21a 3.99±0.53a 410.76±72.89a 1 .61±0.54a F 8.70±0.25a 10.06±0.13a 0.26±0.04a 1.53±0.08a 5.12±0.89a 4.29±0.20a 202.66±48.96a 2.79±1.13a T 8.68±0.15a 9.35±0.69a 0.22±0.06a 1.44±0.10a 4.59±1.57a 4.77±0.62a 236.44±81.77a 2.47±0.39a H 8.69±0.15a 9.35±0.66a 0.25±0.07a 1.60±0.05a 4.31±0.97a 5.43±0.66a 283.88±81.16a 2.78±1.37a A 8.63±0.09a 9.55±0.52a 0.26±0.06a 1.53±0.04a 4.23±0.63a 5.51±1.27a 189.76±59.75a 2.45±0.83a 20~30 CK 9.19±0.31a 10.04±0.17a 0.18±0.13a 1.53±0.09a 3.99±1.04a 7.50±2.37a 165.47±34.43a ±0.89a 1.50±1.26a F 9.15±0.12a 9.96±0.07a 0.18±0.01a 1.54±0.08a 3.80±1.37a 6.76±1.00a 127.52±13.85a 1.71±0.50a T 9.08±0.14a 10.05±0.08a 0.24±0.07a 1.52±0.08a 3.50±0.16a 6.03±1.20a 198.49±46.81a 1.77±0.59a H 9.27±0.22a 10.02±0.03a 0.19±0.02a 1.53±0.09a 3.62±2.07a 6.74±0.73a 286.54±22.34a 1.53±0.73a A 9.00±0.24a 9.64±0.57a 0.20±0.16a 1.53±0.08a 2.58±1.12a 6.99±2.59a 143.08±13.29a 1.53
2.2施入微生物肥料对土壤酶的影响
施入不同的复合微生物肥料,表层土壤过氧化氢酶和磷酸酶活性,及下层土壤过氧化氢酶和脲酶活性的差异均极显著(P<0.001),下层土壤蔗糖酶活性的差异显著(P<0.05),而表层土壤蔗糖酶和脲酶活性及下层土壤磷酸酶活性的差异均不显著(P>0.05)(表3)。0~10 cm土层中,与对照相比,过氧化氢酶活性除在单施腐殖酸复合微生物肥料处理(F)变化不显著外,其余处理均显著降低(P<0.05);磷酸酶活性除在单施海藻酸复合微生物肥料处理(H)变化不明显外,其余处理均显著增加(P<0.05),且3种复合微生物肥料混合施入(A)增加较单施腐殖酸(F)和糖蜜发酵复合微生物(T)处理增加显著;脲酶活性在各处理均有降低趋势,且单施腐殖酸(F)和糖蜜发酵处理降低显著(P<0.05);而蔗糖酶活性对复合微生物肥料的施入响应不显著(图1,表3)。10~20 cm土层中,与对照相比,过氧化氢酶活性在单施腐殖酸复合微生物肥料处理(F)显著增加(P<0.05),而其他3个处理均显著降低(P<0.05);蔗糖酶活性除在3种复合微生物肥料混合施入处理(A)变化不明显外,其余3个处理均降低显著(P<0.05);脲酶活性除单施腐殖酸复合微生物肥料处理(F)降低显著(P<0.05)外,其余处理变化均不显著;磷酸酶活性在各处理变化均不显著(图1,表3)。
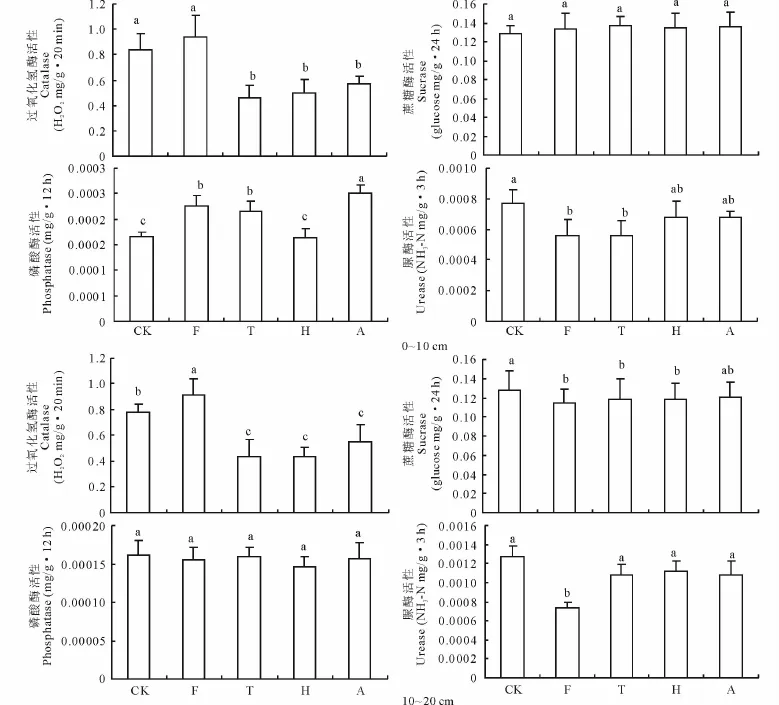
图1 不同处理土壤过氧化氢酶、蔗糖酶、磷酸酶和脲酶活性的变化Fig.1 Changes in activities of soil catalase,sucrase,phosphatase and urease under different treatments
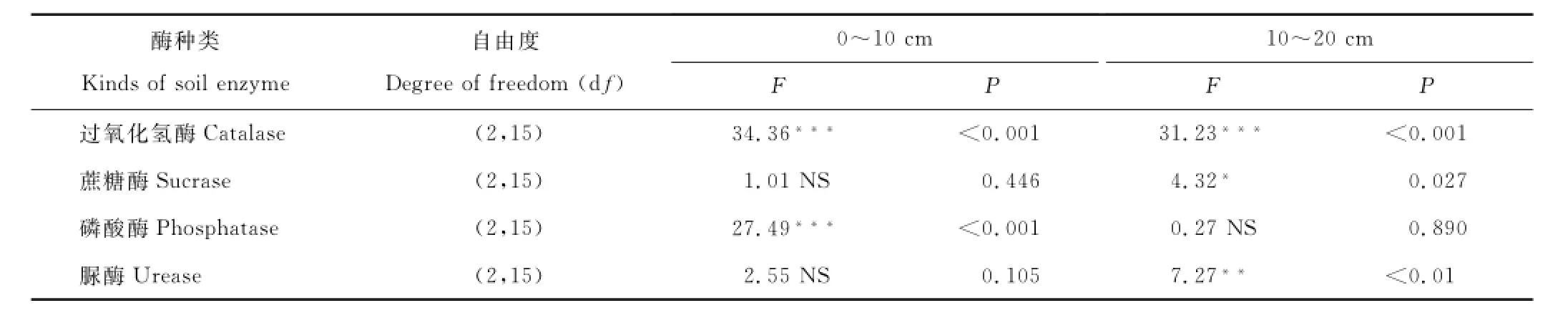
表3 不同处理对各土层土壤酶活性影响的单因素方差分析结果(One-way ANOVA)Table3 Results of one-way ANOVA on soil enzyme activities on soil layer under different treatments
2.3土壤酶与土壤理化性质的相关分析
土壤酶作为土壤的重要组成部分,与土壤理化性质之间具有较好的关联性[21]。本文中,0~10 cm土层的过氧化氢酶活性与土壤p H呈显著正相关,脲酶与全氮呈显著负相关;磷酸酶与全磷呈显著负相关。10~20 cm土层的蔗糖酶活性与有机质呈显著正相关,而与土壤含水量呈显著负相关(表4)。
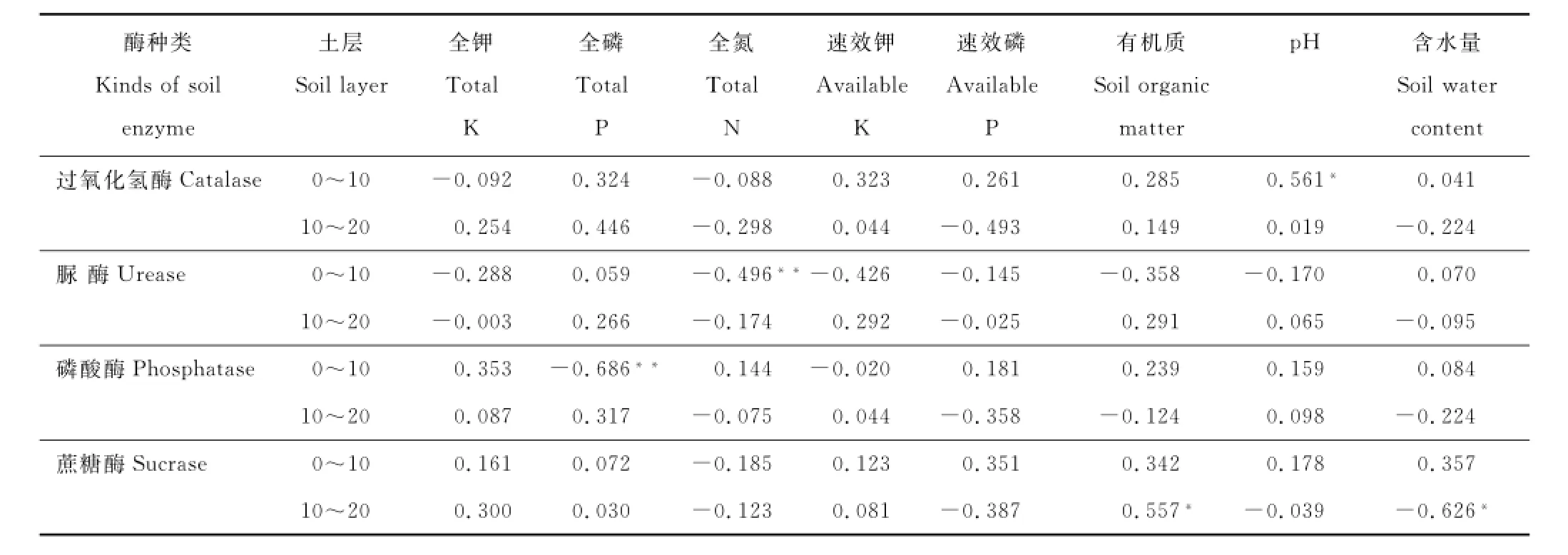
表4 土壤酶活性与土壤理化性质的相关系数Table4 Correlation coefficients between soil enzyme activities and physico-chemical properties
3 讨论
3.1施入复合微生物肥料对土壤理化性质的影响
有大量研究证明,施入微生物肥料对土壤理化性质有显著的影响,但在不同研究由于施入微生物肥料种类及试验地生境的不同,结果有很大差异。土壤p H值是土壤重要的基本性质之一,与土壤的肥力状况、微生物活动及作物生长有密切关系[22]。有研究证明,施入微生物肥料会降低土壤p H[23-24],但也有研究显示施入微生物肥料会显著提高土壤p H[25]。很多研究表明,施入微生物肥料可以促进土壤有机质的合成[24-26],提高土壤有效磷含量[25-26]。也有研究显示,施用繁殖酸复合微生物肥料导致土壤有机碳(SOC)值和C/N值均下降[27]。本文中,施入微生物肥料促进了0~10 cm土壤有机质的形成,这与前人的研究相似[24-26]。结果还显示,0~10 cm土层的全磷在单施糖蜜发酵复合微生物肥料和3种微生物复合肥料混合施入处理组显著降低,而其余土壤理化性质对复合微生物肥料的响应均不显著(表2)。原因可能是由于本实验地属于干旱半干旱农牧交错区,年均降水量只有297 mm,水资源极度匮乏[28],施入肥料后长期不降雨,土壤本身含水量又低,导致对肥料的吸收利用率不高,进而对土壤理化性质的影响不显著。土壤全磷量包括有机磷和无机磷两大类,土壤中的磷素大部分是以迟效性状态存在,因此土壤全磷含量并不能作为土壤磷素供应的指标。而本文显示的土壤全磷含量的变化反应,其具体响应机制,有待进一步研究。
3.2施入微生物肥料对土壤酶活性的影响
施入微生物肥料对土壤酶活性具有显著影响,但其响应机理并不相同(图1,表3)。过氧化氢酶在土壤中分布较为广泛,主要参与生物呼吸和有机物氧化过程中的物质代谢,其活性的大小可以表示土壤氧化过程的强度[20,29]。结果显示,10~20 cm土层的过氧化氢酶活性在施入腐殖酸复合微生物肥料后有所升高(图1),这与彭正萍等[30]的实验结果一致,而其余处理组都显著降低了各土层过氧化氢酶活性(图1)。海藻酸微生物肥料是一种新型的肥料,有大量农田研究证明,施入海藻酸肥料可以显著促进植物生长。但也有早期研究证明,海藻酸施入过多,植物的生长速度反而下降[31]。所以施入海藻酸复合微生物肥料后过氧化氢酶活性显著降低的原因是不是由于海藻酸肥料施入过多,还有待验证。而糖蜜发酵肥料对土壤酶活性影响的文章到目前为止几乎没有,所以出现本文结果的具体原因,还有待验证。脲酶是一种酰胺酶,其活性通常与土壤微生物数量、土壤有机质、全氮和速效氮等因素有关,可用来表征土壤氮素供应的强弱[19]。本文中,施入腐殖酸复合微生物肥料显著降低了各土层脲酶活性(图1),这与前人的研究相一致[30,32-34],0~10 cm土层中施入糖蜜发酵复合微生物肥料也使脲酶活性显著下降(图1),而其余处理均没有明显变化。蔗糖酶能将蔗糖水解为果糖和葡萄糖,可用来表征碳素供应的强度[29,35],而磷酸酶活性直接影响土壤有机磷的分解转化,进而影响土壤磷素的有效性[35-38]。本文中,表层土壤磷酸酶活性除在糖蜜发酵肥料中变化不明显外,在其余处理组均显著增加;而下层蔗糖酶活性除在混合施入处理组外,其余处理组均显著下降(图1)。磷酸酶活性与全磷含量有显著负相关(表4),全磷的显著降低可以解释磷酸酶活性的显著增加。在实验区,碳含量本底值相对较低,微生物肥料的施入可能导致土壤中一些可利用基质发生变化,致使碳含量下降更快,从而引起蔗糖酶活性的变化。
3.3土壤酶与土壤理化性质的关系及其在土层深度的差异
在本文中,4种酶除了与所表征的特定理化性质之间的关系显著之外,与其余土壤理化性质之间的关系均不显著(表4),这与其他实验结果有很大的不同。比如在果园土壤中的研究结果发现,脲酶活性与有机质、全氮、全钾都呈显著正相关[39],而本文中,0~10 cm的脲酶活性与全氮呈极显著负相关,这与苏洁琼等[40]在荒漠草原的实验结果相似。土壤过氧化氢酶活性与土壤肥力诸因素均密切相关,是影响土壤肥力的一个关键酶。本实验研究结果显示,土壤过氧化氢酶活性与土壤有机质、全氮、全磷、速效磷等含量都存在一定的相关性,但均未达显著水平,但0~10 cm土层的过氧化氢酶活性与p H呈显著正相关(表4)。这可能是因为过氧化氢酶参与生物呼吸、生物代谢过程,以及土壤动物、植物根系分泌及残体分解[41-42],一个适宜的p H环境对其发挥作用很重要。在本实验中,0~10 cm土层的磷酸酶活性与土壤全磷呈极显著负相关(表4),这与他人的研究类似[43]。因为磷酸酶活性影响着土壤有机磷的分解转化,而土壤有机磷又属于全磷的一部分,该结果可以得到解释。本文中,土壤酶活性随土壤剖面深度增加而降低,这与Taylor等[44]的研究结果一致。主要是因为研究区域中主要的植被类型是草本植物,植物根系主要集中在表土层,所以表土层的土壤微生物活动比表下层旺盛,故而表层土壤酶活性高于表下层。
4 结论
1)在羊草草原,只有全磷在糖蜜发酵复合微生物肥和3种复合肥混合施入处理降低显著外,其余土壤理化性质对复合微生物肥料的施入无显著响应。
2)施入复合微生物肥料对土壤酶活性有较为显著的影响,但其影响机理并不相同。总体看来,过氧化氢酶活性对复合微生物肥料的施入变化更敏感,且腐殖酸微生物肥料对土壤酶活性的影响要优于其他复合微生物肥料。
3)4种酶只与所表征的特定理化性质之间的关系表现显著。
4)土壤酶活性随土壤剖面深度增加而降低。
总的来说,不建议在干旱半干旱天然草原施入微生物肥料作为改善土壤肥力的一种措施,除非与其他措施配合处理。因为该草地水分含量本来就低,降雨量及降雨时间又没办法控制,试验地风量又大,不利于肥料的迅速吸收利用,容易造成浪费及无用功。
References:
[1]Wang J,Ma Y.The application of bio-fertilizer is an effective way to increase crop yield.Developing,2011,(10):68-71.
[2]Owamah I H,Asiagwu A K,Egboh S H O,et al.Drinking water quality at Isoko North Communities of the Niger Delta Region,Nigeria.Toxicological and Environmental Chemistry,2013,95(7):1116-1128.
[3]Zhu H J,Sun L F,Zhang Y F,et al.Conversion of spent mushroom substrate to biofertilizer using a stress-tolerant phosphate-solubilizing pichia farinose Fl7.Bioresource Technology,2012,111:410-416.
[4]Pesakovic M,Karaklajic-Stajic Z,Milenkovic S,et al.Biofertilizer affecting yield related characteristics of strawberry(Fragaria X Ananassa Duch.)and soil micro-organisms.Scientia Horticulturae,2013,150:238-243.
[5]Johansen A,Carter M S,Jensen E S,et al.Effects of digestate from anaerobically digested cattle slurry and plant materials on soil microbial community and emission of CO2and N2O.Applied Soil Ecology,2013,63:36-44.
[6]Owarnah H I,Dahunsi S O,Oranusi U S,et al.Fertilizer and sanitary quality of digestate biofertilizer from the Co-digestion of food waste and human Excreta.Waste Management,2014,34(4):747-752.
[7]Bakry M A,Soliman Y R,Moussa S A.Importance of micronutrients,organic manure and biofertilizer for improving maize yield and its components grown in desert sandy soil.Research Journal of Agriculture and Biological Sciences,2009,5(1):16-23.
[8]Wang B D,Huang S X,Su M F,et al.The influence of bio-fertilizer on soil fertility.Journal of Changjiang Vegetables,2003,11:28.
[9]Li J,Shen D L,Jiang X.Status quo and countermeasure of microbial fertilizer industry in China.Agricultural Quality& Standards,2003,3:27-29.
[10]Shen D L,Li J,Jiang X.Status quo and development of microbial fertilizer industry in China.Journal of Microbiology,2013,33(3):1-4.
[11]Han G Q,Hou H Y,Wang K,et al.The development and effect of microbial fertilizer in the modern agricultural.Rural E-conomy and Science,2014,9:14.
[12]Yang H T,Xu C,Zhao G H,et al.The application of microbial fertilizer in agriculture and forestry.Journal of Anhui Agriculture.Science,2014,42(29):10078-10080.
[13]Stamford N P,Figueiredo M V,Silva Junior S da,et al.Effect of gypsum and sulfur with acidithiobacillus on soil salinity alleviation and on cowpea biomass and nutrient status as affected by Pk rock biofertilizer.Scientia Horticulturae,2015,192:287-292.
[14]Sun Z T,Yao L T,Sun F M,et al.Effects of microbial fertilizer on the soil ecosystem and growth of cotton.Chinese Journal of Eco-Agriculture,2005,13(3):54-56.
[15]Song Z W,Yang S Y,Wang Q A,et al.An applied effect test of compound microbial fertilizer on eggplants and other vegetables.Journal of Henan Vocation-Technical Teachers College,2002,30(4):33-35.
[16]Wu M E J.Applying test summary of compound microbial fertilizer in xinjiang cotton.Xinjiang Agricultural Science and Technology,2014,(1):13-14.
[17]Yi C H,Guan S H,Guo Z H,et al.The application effect of compound microbial fertilizer on rice.China Agricultural Technology,2015,31(6):37-38.
[18]Lao J C.Soil Analysis Manual[M].Beijing:Agricultural Press,1988.
[19]Guan S Y.Soil Enzyme and Study Method[M].Beijing:Agricultural Press,1986.
[20]Yang L F,Zeng Q,Li H B,et al.Measurement of Catalase activity in soil by ultraviolet spectrophoto-metry.Chinese Journal of Soil Science,2011,42(1):207-210.
[21]Gao X F,Han G D,Zhang G,et al.Study on dynamics of soil enzyme activity and nutrient of desert steppe under different grazing intensities.Pratacultural Science,2007,24(2):10-13.
[22]Lu H,Cong J,Liu X,et al.Plant diversity patterns along altitudinal gradients in alpine meadows in the Three River Headwater Region,China.Acta Prataculturae Sinica,2015,24(7):197-204.
[23]Yan D R.Study of plantation soil humus characteristics and soil enzyme activity.Forestry Science&Technology,1997,22(5):10-12.
[24]Song Y Z.Study on Application of Microbiological Fertilizer Afforestation on Songnen Plain Saline Alkali Land[D].Haerbin:Northeast forestry University,2009.
[25]Luo Y L,Tian G,Zhang D M,et al.Effects of biological bacterial manure on soil nutrient and nitrate-N accumulation in greenhouse.Chinese Agricultural Science Bulletin,2015,13:46.
[26]Fan J Q,Chu C B,Wu S H,et al.Effects of bio-fertilizers on soil microbes and fruit quality of Peach.Acta Agriculturae Shanghai,2013,(1):51-54.
[27]Gao L.Research of humic acid compound microbial fertilizers on growth of vegetables and components of soil humus.Humic Acid,2014,3:4.
[28]Zhou Z Y,Li F R,Chen S K,et al.Dynamics of vegetation and soil carbon and nitrogen accumulation over 26 years under controlled grazing in a desert shrubland.Plant and Soil,2011,341(1-2):257-268
[29]Lin X G.Soil Microbial Research Theories and Methods[M].Beijing:Higher Education Press,2010.
[30]Peng Z P,Meng M X,Xue B M,et al.Effects of humic acid(HA)compound fertilizer on the conversionof soil nutrient and activities of soil enzyme.Journal of University of Hebei,2005,28(4):1-4.
[31]Blunden G,Wildgoose P B.The effects of aqueous seaweed extract and kinetin on potato yields.Journal of the Science of Food&Agriculture,1977,28(2):121-125.
[32]Qian H X,Sun M Q.Effect of increasing maize yields and saving nitrogen fertilizer by inoculation of azospirillum brasilense UB37.Soil and Fertilizer Sciences in China,2002,(1):34-36.
[33]Jiang J P,Sun M Q,Guo Y R,et al.Pilot study on production of urea humate and its application.Phosphate&Compound Fertilizer,2006,21(1):24-26.
[34]Lu X,Wang S G.Study on new types of urease inhibitors.Acta Pedologica Sinica,1997,34(4):461-466.
[35]Ma W W,Yao T,Jin P,et al.Characteristucs of microorganisms and enzyme activity under two plant communities in desert steppe.Journal of Desert Research,2014,34(1):176-183.
[36]Wen D R L,Li G,Zhang J N,et al.The study of soil microbial biomass and soil enzyme activity on different grassland in Hulubeier,Inner Mongolia.Acta Prataculturae Sinica,2010,19(5):94-102.
[37]Guan S Y,Shen G Q,Meng Z P,et al.Enzyme activities in main soils in China.Acta Pedologica Sinica,1984,21(4):368-381.
[38]Cao H,Yang H.The changes of soil microbial biomass and enzyme activity on vegeTablesoil under different planting time. Soil,2002,34(4):197-200.
[39]Li S L,Li Y Q.The research of relations of orchard soil enzyme activity and soil fertility.Fujian Agricultural Science and Technology,1990,1:9-10.
[40]Su J Q,Li X R,Bao J T.Effects of nitrogen addition on soil physico-chemical properties and enzyme activities in desertified steppe.Chinese Journal of Applied Ecology,2014,25(3):664-670.
[41]Bandick A K,Dick R P.Field management effects on soil enzyme activities.Soil Biology&Biochemistry,1999,31(11):1471-1479.
[42]Zimmermann S,Frey B.Soil respiration and microbial properties in an acid forest soil:Effects of Wood Ash.Soil Biology& Biochemistry,2002,34(11):1727-1737.
[43]Geng Y Q,Bai C X,Zhao G L,et al.Soil phosphatase activity and its correlation with composition of organic phosphorus. Journal of Beijing Forestry University,2008,30(2):139-143.
[44]Taylor J B,Wilson,Mills M S,et al.Comparison of microbial uumbers and enzymatic activities in surface soils and subsoils using various techniques.Soil Biology and Biochemistry,2002,34(3):387-401.
[1]王佳,马玥.微生物肥料的应用是增加农作物产量的有效途径.发展,2011,(10):68-71.
[8]王宝档,黄寿煦,苏苗富,等.微生物肥料对土壤肥力的影响.长江蔬菜,2003,11:28.
[9]李俊,沈德龙,姜昕.我国微生物肥料行业的现状与发展对策.农业质量标准,2003,3:27-29.
[10]沈德龙,李俊,姜昕.我国微生物肥料产业现状及发展方向.微生物学杂志,2013,33(3):1-4.
[11]韩广泉,侯红燕,王珂,等.微生物菌肥在现代农业中的开发与影响.农村经济与科技,2014,9:14.
[12]杨鹤同,徐超,赵桂华,等.微生物肥料在农林业上的应用.安徽农业科学,2014,42(29):10078-10080.
[14]孙中涛,姚良同,孙凤鸣,等.微生物肥料对棉田土壤生态与棉花生长的影响.中国生态农业学报,2005,13(3):54-56.
[15]宋志伟,杨首乐,王庆安,等.复合微生物肥料在茄果类蔬菜上应用效果研究.河南职业技术师范学院学报,2002,30(4):33-35.
[16]吾买尔江·阿巴拜克力.复合微生物肥料在新疆棉花上施用肥效试验总结.新疆农业科技,2014,(1):13-14.
[17]易传海,关绍华,郭智慧,等.复合微生物肥料在水稻上的应用效果.中国农技推广,2015,31(6):37-38.
[18]劳家柽.土壤农化分析手册[M].北京:农业出版社,1988.
[19]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[20]杨兰芳,曾巧,李海波,等.紫外分光光度法测定土壤过氧化氢酶活性.土壤通报,2011,42(1):207-210.
[21]高雪峰,韩国栋,张功,等.荒漠草原不同放牧强度下土壤酶活性及养分含量的动态研究.草业科学,2007,24(2):10-13.
[22]卢慧,丛静,刘晓,等.三江源区高寒草甸植物多样性的海拔分布格局.草业学报,2015,24(7):197-204.
[23]闫德仁.人工林土壤腐殖质特性和土壤酶活性的研究.林业科技,1997,22(5):10-12.
[24]宋玉珍.微生物肥料在松嫩平原盐碱地造林中的应用研究[D].哈尔滨:东北林业大学,2009.
[25]罗玉兰,田龚,张冬梅,等.微生物菌剂对连栋大棚土壤养分及硝态氮累积的影响.中国农学通报,2015,13:46.
[26]范洁群,褚长彬,吴淑杭,等.不同微生物菌肥对桃园土壤微生物活性和果实品质的影响.上海农业学报,2013,(1):51-54.
[27]高亮.腐植酸复合微生物肥料对蔬菜生长及土壤腐殖质组分的影响研究.腐植酸,2014,3:4.
[28]林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[30]彭正萍,门明新,薛宝民,等.腐殖酸复合肥对土壤养分转化和土壤酶活性的影响.河北农业大学学报,2005,28(4):1-4.
[32]钱惠祥,孙明强.腐植酸包裹型长效尿素肥效机理初步研究.土壤肥料,2002,(1):34-36.
[33]姜剑平,孙明强,郭玉荣,等.腐植酸尿素的中试工艺研究与应用.磷肥与复肥,2006,21(1):24-26.
[34]陆欣,王申贵.新型脲酶抑制剂的试验研究.土壤学报,1997,34(4):461-466.
[35]马文文,姚拓,靳鹏,等.荒漠草原2种植物群落土壤微生物及土壤酶特征.中国沙漠,2014,34(1):176-183.
[36]文都日乐,李刚,张静妮,等.呼伦贝尔不同草地类型土壤微生物量及土壤酶活性研究.草业学报,2010,19(5):94-102.
[37]关松荫,沈桂琴,孟昭鹏,等.我国主要土壤剖面酶活性状况.土壤学报,1984,21(4):368-381.
[38]曹慧,杨浩.不同种植时间菜园土壤微生物生物量和酶活性变化特征.土壤,2002,34(4):197-200.
[39]李双霖,李友钦.果园土壤酶活性与土壤肥力关系的研究.福建农业科技,1990,1:9-10.
[40]苏洁琼,李新荣,鲍婧婷.施氮对荒漠化草原土壤理化性质及酶活性的影响.应用生态学报,2014,25(3):664-670.
[43]耿玉清,白翠霞,赵广亮,等.土壤磷酸酶活性及其与有机磷组分的相关性.北京林业大学学报,2008,30(2):139-143.
The effect of compound bio-fertilizers on soil physical and chemical properties and soil enzyme activity in Leymus chinensis steppe
QUAN Guo-Ling1,2,XIE Kai-Yun1,TONG Zong-Yong1,LI Xiang-Lin1,2*,WAN Li-Qiang1,BI Shu-Yi1,WAN Xiu-Fu1
1.Institute of Animal Sciences,Chinese Academy of Agriculture Sciences,Beijing 100193,China;2.The State Key Laboratory of Grassland Agroecosystems,College of Pastoral Agriculture Science and Technology,Lanzhou University,Lanzhou 730020,China
Compound bio-fertilizers have recently been developed to improve the performance of bio-fertilizers. These compounds are a mix of inorganic chemical,organic and bio-fertilizers.In this study,we investigated the effect on Leymus chinensis steppe soil fertility of three kinds of compound bio-fertilizer:humic acid,molasses fermentation and alginic acid.We also measured the effects of a mixed application of these three compounds. Results showed that compared to the control there was a significant reduction in total phosphorus in surface soils under the molasses fermentation and three compound mix treatments.Soil organic matter increased significantly,with these increases being higher for the three compound mix than for the humic acid and molasses fermentation treatments.The other soil physical and chemical properties measured showed no significant change under each treatment.Soil enzyme activities were significantly affected.Compared with the control,hydrogen peroxide enzyme activity in the 0-10 cm soil layer was significantly reduced in all treatments except for the humic acid compound.Phosphatase activity increased significantly in all cases except for the alginic acid treatment.Urease activity was reduced significantly in the humic acid and molasses fermentation treatments.Invertase activity did not change significantly.In 10-20 cm soil layer,hydrogen peroxide enzyme activity increased significantly in the humic acid treatment while it significantly reduced under the other treatments.Invertase activity did not change with the three compound mix but reduced significantly under the remaining three treatments.Urease activity decreased only with humic acid treatment,while phosphatase activity did not significantly change in any of the treatments.Hydrogen peroxide enzyme activity and soil p H were significantly positively correlated,while urease and total nitrogen were significantly negatively correlated.Phosphatase and total phosphorus had a significant negative correlation in topsoil.Invertase activity was significantly positively correlated with organic matter,and was significantly negatively correlated with soil moisture content in the lower soils.In general,soil enzyme activity decreased with increasing depth of soil profile.
Leymus chinensis;compound;soil fertilizer;soil enzyme
10.11686/cyxb2015422
2015-09-08;改回日期:2015-10-13
公益性行业(农业)科研专项经费项目(201303060)和国家牧草产业技术体系(CARS-35)资助。
权国玲(1991-),女,青海互助人,在读硕士。E-mail:ling107209@163.com
Corresponding author.E-mail:lxl@caas.cn

