活血荣络片对大脑中动脉缺血模型大鼠脑组织微囊蛋白-1表达的影响※
周德生 刘利娟 寇志刚 陈 瑶 胡 华 钟 捷
(湖南中医药大学第一附属医院神经内科,湖南 长沙 410007)
实 验 研 究
活血荣络片对大脑中动脉缺血模型大鼠脑组织微囊蛋白-1表达的影响※
周德生刘利娟△寇志刚1陈瑶胡华钟捷
(湖南中医药大学第一附属医院神经内科,湖南长沙410007)
目的观察活血荣络片对大脑中动脉缺血(MCAO)模型大鼠脑组织中细胞膜微囊蛋白-1(Caveolin-1)表达的影响,探讨活血荣络片对脑缺血后神经功能修复的作用机制。方法将96只SD大鼠随机分为假手术组(24只)和造模组(72只),造模组采用线栓法制作MCAO模型,造模成功后再随机分为模型组、对照组及实验组,各24只。假手术组及模型组予蒸馏水2 mL灌胃,实验组予活血荣络片药液灌胃,对照组以磷酸吡哆醛丁咯地尔胶囊药液灌胃,均造模6 h后首次给药,然后每日灌胃2次,直至处死为止。每日观察大鼠的一般情况,进行神经功能缺损评分,并分别在造模1、3、5及7 d后各组随机选取6只大鼠处死取材,观察比较各组大鼠脑组织Caveolin-1的表达情况。结果造模1 d后,造模组各组大鼠神经功能缺损评分比较差异无统计学意义(P>0.05);造模3、5及7 d后对照组及实验组大鼠神经功能缺损评分与模型组比较差异有统计学意义(P<0.05),均高于模型组,且对照组与实验组组间比较差异均无统计学意义(P>0.05);模型组、对照组及实验组造模1、3、5及7 d后Caveolin-1表达水平与假手术组同期比较差异均有统计学意义(P<0.05),均高于假手术组;对照组及实验组造模1、3、5及7 d后Caveolin-1表达水平与模型组同期比较差异均有统计学意义(P<0.05),均高于模型组;实验组在造模1、3及5 d后时Caveolin-1表达水平与对照组比较差异无统计学意义(P>0.05),在造模7 d后时Caveolin-1表达水平明显高于对照组,比较差异有统计学意义(P<0.05)。结论活血荣络片可明显增加Caveolin-1在梗死周围脑组织中的表达,促进脑血管新生,从而改善脑缺血后神经功能缺损。
脑梗死;中药疗法;动物,实验;大鼠;疾病模型,动物
缺血性脑血管病是神经内科的常见病、多发病,具有病死率高、致残率高的特点。目前相关研究显示,脑缺血后神经功能的恢复及中枢神经的再生与血管新生有着密切的联系,脑血管新生是缺血区组织抗损伤及神经元修复的结构基础,而细胞膜微囊蛋白-1(Caveolin-1)可以参与调控血管内皮细胞生长因子(VEGF) 生理活性,由此推断Caveolin-1与血管新生关系密切。本实验拟采用Longa EZ等[1]改良线栓法制作大鼠大脑中动脉缺血(MCAO)模型,通过观察活血荣络片对MCAO模型大鼠梗死周围脑组织Caveolin-1表达的影响,探讨其对神经功能修复作用机制。
1 材料与方法
1.1实验动物清洁级健康雄性SD大鼠120只,体质量(250±20)g,由湖南省中医药大学实验动物中心提供,许可证号:SCXK(湘)2011-0003。所有大鼠均饲养于湖南中医药大学SPF动物实验中心,室温为24~26 ℃,湿度在55%~60%之间,自由进水及食物,定期更换垫料及清洗笼子。
1.2实验药品活血荣络片(由天麻、白芷、忍冬藤、石菖蒲、木瓜、玄参、赤芍药及桃仁按3∶2∶6∶2∶3∶3∶3∶3组成配制,由湖南中医药大学第一附属医院制剂科提供,湘药制字Z20080472)每片0.35 g,每片含生药量0.14 g,配成相当于含生药量2.8 mg/mL的药液;磷酸吡哆醛丁咯地尔胶囊(昆明积大制药股份有限公司,国药准字H20064618),配成2.1 mg/mL的药液。均放置于冰箱中备用。
1.3主要试剂及仪器
1.3.1实验试剂兔抗大鼠Caveolin-1多克隆抗体(上海翔升生物科技有限公司);即用链霉亲和素-生物素-过氧化物酶复合物(SABC)免疫组化染色试剂盒及二氨基联苯胺(DAB)显色试剂盒(武汉博士德生物工程有限公司);水合氯醛、多聚甲醛、磷酸盐缓冲液(PBS)、枸橼酸缓冲液及苏木素(长沙丽欣生物技术有限公司)。
1.3.2实验仪器JY3002型电子天平(上海精密科学仪器有限公司);HHS-2电子恒温不锈钢水浴锅(上海南阳仪器有限公司);LEICA DM LB2型双目显微镜(德国莱卡微系统国际有限公司);SZ-93自动双重纯水蒸馏器(上海亚荣生化仪器厂);DNP-9162型电热恒温培养箱(上海精宏实验设备有限公司);Motic B5 显微摄像系统(麦克奥迪实业集团有限公司)。
1.4实验方法
1.4.1模型制备120只SD大鼠在实验室里饲养1周后,随机选取其中96只,其余24只备用。将96只大鼠再随机分为假手术组(24只)和造模组(72只)。造模组参照Longa EZ等[1]腔内线栓法制作MCAO模型,术前6 h禁食不禁水,先将大鼠用10%的水合氯醛(3 mL/kg)进行腹腔麻醉,将大鼠头部及四肢仰卧位固定于台面,备皮,消毒,在颈部中央切口,沿胸锁乳突肌内缘钝性分离皮下组织及肌肉,分离出右侧颈总动脉、颈外动脉及颈内动脉,在颈总动脉远心端和近心端、颈总分叉处及颈外动脉处挂线备用,沿颈内动脉继续往头部方向分离血管,直至颈内动脉与翼腭动脉分叉处,挂线将翼腭动脉结扎,将颈总动脉近心端及颈外动脉结扎,然后用动脉夹夹住颈内动脉,轻提近心端结扎颈总动脉的线,用眼科剪斜向头部剪一小口,将已经准备好的栓线从颈总动脉分叉处沿颈内动脉插入颅内,直至遇到阻力,深度为18 mm左右(从颈总动脉分叉口算起),紧紧系牢颈总动脉远心端的细线。将栓线放置于皮肤内,防止过长大鼠自行拔出,再涂撒青霉素预防感染,缝合颈部皮肤,消毒。造模后将大鼠单独放置,保温直至苏醒,术后6 h再恢复喂食。假手术组则只切开皮肤后随即缝上。缺血模型成功的标准为:手术操作顺利,术中无大出血,参照Zausinger S等[2]方法进行神经功能缺损评分,<5分者则为造模成功。造模失败及麻醉前即死亡者剔除,再随机从备用大鼠中补充。
1.4.2分组及给药方法造模组造模成功后再随机分成模型组、实验组及对照组,每组各24只。假手术组及模型组每次予蒸馏水2 mL灌胃,实验组予活血荣络片药液(1 mL/100 g)灌胃,对照组以磷酸吡哆醛丁咯地尔胶囊药液(1 mL/100 g)灌胃。各组大鼠造模6 h后首次给药,然后每日灌胃2次,直至处死为止。
1.5观察指标及方法造模后每日观察各组大鼠的精神状态、饮食、活动及毛发色泽等一般情况,参照Zausinger S等[2]方法进行神经功能缺损评分:0分,不能自发行走;1分,自由走动状态下向病变对侧旋转;2分,抓住鼠尾,大鼠向病变对侧旋转;3分,对施向病变对侧的侧压力抵抗力下降;4分,不能伸直病变对侧前爪,甚至全身向对侧屈曲;5分,无神经功能缺损。分别于造模1、3、5及7 d后各组随机选取6只大鼠处死取材(在末次给药2 h后处死)。先用10%水合氯醛(3 mL/kg)腹腔麻醉,剪断颈动脉放血以处死大鼠,打开颅腔取出大脑,将整个大脑组织保存于4%的多聚甲醛溶液中,固定24 h 然后进行脑组织切片显微镜观察及Caveolin-1表达的免疫组织化学检测,严格按照检测试剂盒说明书步骤进行。
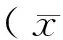
2 结 果
2.1造模组大鼠造模1、3、5及7 d后神经功能缺损评分比较见表1。

表1 造模组大鼠造模1、3、5及7 d后神经功能缺损评分比较 分,±s
与模型组比较,*P<0.05
由表1可见,造模1 d后,造模组各组大鼠神经功能缺损评分比较差异无统计学意义(P>0.05);造模3、5及7 d后对照组及实验组大鼠神经功能缺损评分与模型组比较差异有统计学意义(P<0.05),均高于模型组,且对照组与实验组组间比较差异均无统计学意义(P>0.05)。
2.2各组大鼠造模1、3、5及7 d后脑组织中Caveolin-1表达情况比较
2.2.1显微镜观察结果比较在光镜下观察(×400),假手术组各个时间点可见较少的Caveolin-1棕黄色阳性表达灶,造模组与假手术组相比各个时间点Caveolin-1表达增多,可见强弱不等的阳性表达,阳性表达大多位于胞浆。假手术组大鼠各个时间点Caveolin-1表达无明显变化;模型组大鼠Caveolin-1表达在3 d时达最高,以后逐渐下降;实验组与对照组各个时间点Caveolin-1的表达强度均较高于模型组。各组大鼠造模7 d后Caveolin-1的表达,见封3,图1。
2.2.2免疫组织化学检测结果比较见表2。
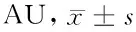

组 别n1d3d5d7d假手术组60.12±0.030.21±0.040.18±0.030.20±0.05模型组60.27±0.04*0.48±0.05*0.39±0.06*0.37±0.03*对照组60.36±0.05*△0.64±0.09*△0.49±0.01*△0.44±0.10*△实验组60.35±0.02*△0.59±0.07*△0.54±0.11*△0.59±0.06*△#
与假手术组同期比较,*P<0.05;与模型组同期比较,△P<0.05;与对照组同期比较,#P<0.05
由表2可见,模型组、对照组及实验组造模1、3、5及7 d后脑组织Caveolin-1表达水平与假手术组同期比较差异均有统计学意义(P<0.05),均高于假手术组;对照组及实验组造模1、3、5及7 d后Caveolin-1表达水平与模型组同期比较差异均有统计学意义(P<0.05),均高于模型组;实验组在造模1、3及5 d时Caveolin-1表达水平与对照组比较差异无统计学意义(P>0.05),在造模7 d时Caveolin-1表达水平明显高于对照组,比较差异有统计学意义(P<0.05)。
3 讨 论
微囊是细胞质膜向内凹陷所形成的一种特化细胞质膜囊状结构,具有胆固醇转运、信号传导、大分子物质转输等理化功能[3-5]及调节细胞生长、凋亡、血管生成等生物学功能[6]。Caveolin-1是微囊蛋白家族成员之一,在维持微囊的结构及上述的功能当中具有重要作用,是内皮细胞对大分子物质转运中的一种敏感型载体,并参与、调控VEGF生物活性的发挥,同时其还具有促进内皮细胞迁移的功能[7],而血管新生的过程包括内皮细胞增殖、迁移和分化,故Caveolin-1也参与了血管新生的过程。由于内皮型一氧化氮合酶(eNOS)、血管内皮细胞生长因子受体(VEGFR)、前列环素合成酶等与血管的生成密切相关,同时它们在血管内皮细胞的微囊含量丰富,因此Caveolin-1可能是血管生成的促进剂与抑剂共同作用的靶点[8]。现代医学也对Caveolin-1展开了一系列研究,在一氧化氮(NO)介导的血管新生中,Caveolin-1在内皮细胞分化与管腔形成及对VEGF与eNOS激活方面具有重要作用[9],Caveolin-1表达升高可促进肝细胞癌的侵袭转移,其作用机制可能是通过诱导肝细胞癌表达VEGF,促进肿瘤新生血管生成而实现[10];芹菜素可上调脑缺血再灌注后Caveolin-1的表达,对大鼠局灶性脑缺血再灌注损伤具有保护作用[11];脑缺血后可促进脑内细胞增殖和胶质活化,而Caveolin-1缺失可减弱脑缺血早期脑内细胞增殖,增强胶质活化[12];向Caveolin-1缺陷的小鼠体内注入肿瘤细胞后,与野生型小鼠相比,其血管生成显著降低[13-14],并且受到缺血损伤时,小鼠缺乏血管新生能力,梗死面积扩大,细胞凋亡增加[15-16]。综上所述,Caveolin-1能促进内皮细胞增殖及血管新生形成,所以对缺血性疾病可通过正调节因子诱导血管新生,从而在梗死区形成更多的新生血管或侧支循环,减轻缺血组织损伤,促进神经功能恢复,为临床治疗提供了新靶点。
中医学认为,缺血性中风基本病机为阴阳失调、气血逆乱所致,故我们认为对本病治疗的关键是平衡阴阳,基本原则是调理气血,并在荣气虚滞论[17]基础上研制了活血荣络片。方中忍冬藤清热解毒,通络止痛;木瓜养阴生津,舒筋活络;天麻熄风止痉,祛风通络;玄参清热生津,滋阴润燥;赤芍药凉血止血,活血散瘀止痛;桃仁活血祛瘀;石菖蒲开窍醒神,豁痰辟秽,宁神益智;白芷祛风止痛。诸药合用,具有养阴活血、祛风化痰、化瘀通络的功效。前期研究也已表明,活血荣络片可有效治疗血管性痴呆[18],明显减轻大鼠脑梗死的面积,降低基质金属蛋白酶-9(MMP-9)的表达[19-20],改善脑组织功能。
本实验即从血管新生的机制着手,以Caveolin-1为研究对象,结果显示模型组在各时间点Caveolin-1阳性细胞数较假手术组均明显增多(P<0.05),可以证明在脑缺血灶及缺血半暗带存在Caveolin-1的表达;在实验组和对照组中各时间点Caveolin-1的表达均高于模型组(P<0.05),说明在缺血性脑病发生后,大脑组织在缺血、缺氧的情况下,脑代谢降低,脑血流灌注随之减少,进而使缺血区VEGF合成减少,内皮细胞增殖减少,而通过相关干预治疗,促进Caveolin-1在缺血区的表达,启动正反馈调节机制,可使VEGF合成增多,促进梗死灶边缘区有代偿性的血管新生,使神经功能得到改善;另外,实验组造模7 d后Caveolin-1表达明显高于对照组,提示活血荣络片远期疗效可能更佳。
本实验研究结果表明,活血荣络片可明显增加MCAO模型大鼠Caveolin-1的表达,改善大鼠神经功能缺损评分,远期疗效更佳,推测其相关作用机制是通过增加Caveolin-1表达促进梗死区周围脑组织血管新生。但本实验尚未对Caveolin-1与其他血管新生因子之间的相互作用及在分子基因水平的研究,有待于将来进一步深入探讨。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2]Zausinger S,Hungerhuber E,Baethmann A,et al.Neurological impairment in rats after transient middle cerebral artery occlusion: a comparative study under various treatment paradigms[J].Brain Res,2000,863(1-2):94-105.
[3]Luo DX,Cao DL,Xiong Y,et al.A novel model of cholesterol efflux from lipid-loaded cells[J].Acta Pharmacol Sin,2010,31(10):1243-1257.
[4]郝长春,孙润广,张静.DOPC,DOPE和神经酰胺对鞘磷脂/胆固醇双层膜结构的影响[J].高等学校化学学报,2009,30(5):913-918.
[5]Frank PG.Endothelial caveolae and caveolin-1 as key regulators of atherosclerosis[J].Am J Pathol,2010,177(2):544-546.
[6]Senetta R,Stella G,Pozzi E,et al.Caveolin-1 as a promoter of tumour spreading: when, how, where and why[J].J Cell Mol Med,2013,17(3):325-336.
[7]周德生,寇志刚,陈瑶,等.Caveolin-1与血管新生相关性的研究进展[J].中国临床新医学,2013,6(3):270-272.
[8]刘辉,熊国祚.Caveolae/Caveolin-1在血管生成中的作用[J].现代卫生医药,2012,28(8):2792-2794.
[9]潘一明,姚永忠,朱章华,等.Caveolin-1在一氧化氮介导的三维纤维蛋白凝胶血管新生模型中的作用[J].中华实验外科杂志,2011,28(10):1693-1695.
[10]张志波,何庆良,石铮,等.Caveolin-1在肝细胞癌表达及与肿瘤血管生成的关系[J].中国普通外科杂志,2012,21(1):53-57.
[11]牛文泽,李雪梅,王果,等.芹菜素对局灶性脑缺血再灌注大鼠脑内Caveolin-1表达的影响[J].中草药,2010,41(10):1658-1662.
[12]刘柏炎,易健,刘富林,等.局灶性脑缺血对Caveolin-1敲除小鼠细胞增殖与神经胶质纤维酸性蛋白表达的影响[J].中华行为医学与脑科学杂志,2012,21(3):216-218.
[13]Woodman SE,Ashton AW,Schubert W,et al.Caveolin-1 knockout mice show an impaired angiogenic response to exogenous stimuli[J].Am J Pathol,2003,162(6):2059-2068.
[14]Sainz-Jaspeado M,Huertas-Martinez J,Lagares-Tena L,et al.EphA2-induced angiogenesis in ewing sarcoma cells works through bFGF production and is dependent on caveolin-1[J].PLoS One,2013,8(8):e71449.
[15]Massimino ML,Griffoni C,Spisni E,et al.Involvement of caveolae and caveolae-like domains in signalling, cell survival and angiogenesis[J].Cell Signal,2002,14(2):93-98.
[16]Jasmin JF,Malhotra S,Singh DM,et al.Caveolin-1 deficiency increases cerebral ischemic injury[J].Circ Res,2007,100(5):721-729.
[17]周德生,张雪花,谭静.荣气虚滞论[J].中医药通报,2005,4(2):22-25.
[18]彭勃,周德生,高晓峰,等.活血荣络片治疗血管性痴呆36例[J].光明中医,2012,27(11):2194-2196.
[19]Zhou D,Li M,Hu H,et al.Huoxue Rongluo Tablet reduces matrix metalloproteinase-9 expression in infarcted brain tissue[J].Neural Regen Res,2013,8(34):3216-3224.
[20]李媚.活血荣络片对大鼠急性脑梗死MMP-9蛋白表达影响的研究[D].长沙:湖南中医药大学,2013.
(本文编辑:石康)
Effects of Huoxue-rongluo tablets on the expression of Caveolin-1 in brain tissue of middle cerebral artety occlusion rats
ZHOUDesheng*,LIULijuan,KOUZhigang,etal.
*DepartmentofNeurology,FirstHospitalAffiliatedtoHunanUniversityofChineseMedicine,Hunan,Changshan410007
ObjectiveTo study the effect of Huoxue-rongluo tablets on the expression of Caveolin-1 in brain tissue of middle cerebral artery occlusion (MCAO) rats, and investigate nerve function recovery mechanism. Methods 96 SD rats were divided into sham operation group (24 cases) and modeling group (72 cases). Rats in modeling group were constructed in MCAO model by suture-occluded method. After successful modeling, rats in modeling group were randomly divided into model group, control group and experimental group, 24 rats in each group. Rats in sham operation and model group were received distilled water (2 mL) via gastrogavage. Rats in experimental group were received Huoxue-rongluo liquid, and rats in control group were received buflomedil pyridoxal phosphate liquid at 6 h after modeling, twice a day until death. The daily general condition and neurological function defect score was observed. 6 rats in each group were randomly selected, sacrificed at 1, 3, 5, 7 d after molding respectively. The expressions of Caveolin-1 in mice brain tissue were observed in all groups. Results One day after modeling, there was no statistical difference on neurological function defect score in each group of modeling group (P>0.05). The neurological function defect scores 3, 5, 7 d after modeling in control and experimental group were higher than those in model group (P<0.05), and there was no statistical difference between control and experimental group (P>0.05). The expression of Caveolin-1 1, 3, 5, 7 d after modeling in model control and experimental group was higher than that in sham operation group at same period (P<0.05). There were no statistical differences on Caveolin-1 expression in experimental and control group at 1, 3 and 5 d after modeling (P>0.05). The expression of Caveolin-1 in experimental group 7 d after modeling was obviously higher than that in control group (P<0.05). Conclusion Huoxue-rongluo tablets can significantly increased the expression of Caveolin-1 in brain tissue around infarction, can promote cerebral vascular growth then improve the neurological function.
Cerebral infarction; Traditional Chinese medicine; Animal; Experiment; Rat; Disease model; Animal
10.3969/j.issn.1002-2619.2016.01.025
△湖南中医药大学2013级博士研究生,湖南长沙410208
周德生(1965—),男,主任医师,教授,博士。研究方向:中医药防治神经系统疾病研究。
R-33;R285.5;R743.33
A
1002-2619(2016)01-0080-05
2014-02-28)
※ 项目来源:湖南省中医药管理局中医药科研计划项目(编号:201136);长沙市科学技术局基础性研究与软科学资金专项项目(编号:K1308023-31)
1河南省郑州市第三人民医院康复科,河南郑州450000

