箭舌豌豆根系抗坏血酸及相关酶对镉胁迫的响应
芮海云,张兴兴,庄 凯,沈振国,张芬琴
(1 泰州学院,江苏泰州 225300;2 南京农业大学 生命科学学院,南京210095;3 河西学院,甘肃张掖734000)
箭舌豌豆根系抗坏血酸及相关酶对镉胁迫的响应
芮海云1,2,张兴兴2,庄凯2,沈振国2,张芬琴3
(1 泰州学院,江苏泰州 225300;2 南京农业大学 生命科学学院,南京210095;3 河西学院,甘肃张掖734000)
以箭舌豌豆(ViciasativaL.)品种L3(耐镉)和ZM(镉敏感)为材料,研究了不同程度镉胁迫下箭舌豌豆幼苗根系抗坏血酸(AsA)含量、脱氢抗坏血酸还原酶(DHAR)同工酶活性、抗坏血酸过氧化物酶(APX)同工酶活性以及APX基因表达的变化。结果显示:(1)2个箭舌豌豆品种根系AsA和脱氢抗坏血酸(DHA)含量在镉胁迫下显著升高;AsA/DHA比值在镉耐性品种L3中显著升高,在敏感品种ZM中显著下降;相同镉处理浓度下,L3根系AsA含量和AsA/DHA比值显著大于ZM。(2)2个品种根系DHAR的活性电泳共显示4条同工酶条带,它们的活性均随镉处理浓度的升高而升高;其中DHAR1只在L3显示,DHAR4只在ZM显示;相同镉处理浓度下,品种L3 的DHAR的总活性大于品种ZM。(3)2个品种根系APX的活性电泳共显示11条同工酶条带,其中的APX1、2、4仅在敏感品种ZM中受镉胁迫诱导,APX 8在耐性品种L3中受到比敏感品种ZM更显著的诱导;克隆得到1个箭舌豌豆APX基因,荧光定量RT-PCR结果显示该基因的转录在L3和ZM根系均受镉处理诱导。研究表明,镉胁迫下2个箭舌豌豆品种根系AsA含量,AsA代谢相关酶DHAR和APX的活性以及APX的转录水平均显著升高;镉耐性品种L3较敏感品种ZM能更有效地促进AsA循环,维持更高的AsA水平,从而更有效地缓解镉胁迫诱导产生的氧化胁迫,这可能是L3较ZM具有更高镉耐性的重要机制之一。
箭舌豌豆;镉耐性;抗坏血酸;抗坏血酸过氧化物酶;脱氢抗坏血酸还原酶
镉是毒性最强的重金属之一,因其易被植物吸收,并进一步通过食物链危害人体健康,因此受到特别的关注。镉不具有氧化还原活性,不能引起Fenton和Haber-Weiss反应,但镉胁迫常导致植物产生和积累大量的活性氧(ROS)[1-2],ROS会诱导膜脂过氧化、产生质膜损伤,因此氧化损伤被认为是植物镉毒害的主要原因之一[3]。许多研究报道了镉处理下植物氧化胁迫的产生[4-5]。抗坏血酸(AsA)是植物体内高丰度小分子抗氧化物质,是抗氧化系统的重要组成部分,被认为是氧化还原的中心,在植物抵抗氧化胁迫中具有重要作用。AsA存在于植物细胞质、叶绿体、线粒体和质外体中,可以通过抗坏血酸过氧化物酶APX的催化作用或者本身直接与H2O2反应,将H2O2还原为H2O,降低植物细胞的H2O2积累,减轻植物的氧化胁迫伤害。AsA本身被氧化为脱氢抗坏血酸( DHA),DHA通过脱氢抗坏血酸还原酶(DHAR)还原为AsA。据报道,AsA含量升高能提高植物对各种胁迫,如盐、紫外线和冷胁迫的抵抗能力[6-7]。Burkey等[8]发现,臭氧胁迫下耐性品种菜豆叶中AsA的含量比敏感品种高,耐性品种能维持相对较高的AsA库水平。Sharma和Dubey[9]报道铝胁迫诱导水稻幼苗APX活性升高,同时其同工酶的组成也发生改变。也有报道AsA能提高植物对镉胁迫的抵抗能力,如外源添加AsA合成的前体L-半乳糖酸-1,4-内酯,硬粒小麦 (Triticumdurumcv Creso) AsA 合成增加, 镉胁迫产生的氧化胁迫得到缓解[10]。
本实验以中国西北地区广泛种植的耐寒旱、食饲兼用的作物箭舌豌豆(ViciasativaL.)为实验材料,研究2个不同镉耐性的箭舌豌豆品种在镉胁迫下根系AsA含量、APX同工酶谱和基因表达以及DHAR同工酶谱的变化,进一步探讨植物抗坏血酸代谢响应镉胁迫的机理。
1 材料和方法
1.1材料培养及处理
实验材料箭舌豌豆包括1个镉耐性品种L3和1个镉敏感品种ZM。种子经3%的H2O2消毒15 min,用去离子水彻底冲洗后,浸种16 h,转移至蛭石中20 ℃~25 ℃萌发。3 d后,挑选长势良好且一致的幼苗转移至含2.5 L Hoagland营养液的培养钵中培养,每培养钵移苗10棵。培养条件如下:昼/夜温度25 ℃/20 ℃,相对湿度60%~80% ,光照时间12 h,光照强度400 μmoL· m-2·s-1。每3 d 换1次营养液,营养液pH控制在5.5 左右。
实验一:2个箭舌豌豆品种移苗7 d后,用25 μmol·L-1镉处理(镉以CdCl2·2.5 H2O的形式加入)。每个处理3次重复,处理液每3 d换1次。分别在处理0、2、4、6、8、10、12、14 d取样用于根系生长指标测定。
实验二:0(Control)、10、25、50 μmol·L-1镉处理(处理方法同实验一),处理 7 d 后收获根部,立即用于实验,或于液氮中冷冻后,-80 ℃保存供生理指标的测定。
实验三:移苗3 d后,转移至加入25 μmol·L-1CdCl2的营养液中处理(处理方法同实验一),每个处理重复3次,处理96 h内根系取样,每个样品为4株苗的混合样,取样时间为0、12、24、48、96 h。所取样品立即于液氮中速冻,-80 ℃保存用于根系总RNA的提取。
1.2测定项目及方法
1.2.1根系生长指标分别在25 μmol·L-1镉处理0、2、4、6、8、10、12、14 d,测量幼苗主根长后,收获根部,吸去表面水分称取鲜重。
1.2.2质膜完整性质膜完整性的测定参照Schützendübel等[11]的伊文思蓝(Evans blue)吸收法。取10株新鲜植物1 cm主根根尖,于0.025%(W/V)伊文思蓝溶液中染色30 min, 去离子水冲洗15 min彻底清除浮色后,于1% SDS(W/V)50%(V/V)甲醇中研磨成匀浆,50 ℃水浴15 min后,14 000×g 离心15 min,取上清测600 nm下吸光值。
1.2.3膜脂过氧化的组织化学检测膜脂过氧化的组织化学检测参照Yamamoto等[12]的方法。将2 cm主根根尖浸入Schiff 试剂 (0.5 g碱性品红,0.5 g K2S2O5,100 mL 1 mol·L-1HCl,100 mL H2O)中染色60 min,然后用0.5% (W/V) 的K2S2O5溶液 (溶于0.05 mol·L-1的HCl) 冲洗,置于配有数码相机的体视显微镜下观察、拍照。
1.2.4AsA和DHA含量AsA含量测定参照Kampfenkel等[13]的方法。取1 g新鲜植物根系,加入预冷的5 mL 6% TCA冰浴研磨,4 ℃离心(12 000×g,20 min),上清液为待测液。总AsA含量的测定:取0.2 mL待测液(对照取0.2 mL 6% TCA),加0.2 mL 10 mmol·L-1DTT和0.4 mL 0.2 mol·L-1PBS(pH 7.4),充分混匀,42 ℃反应15 min后向其中加入0.2 mL 0.5% N-乙基马来酰亚胺 (NEM)、1 mL 10%TCA、0.8 mL 42% H3PO4、0.8 mL 4%联吡啶、0.4 mL 3% FeCl3,迅速剧烈震荡混匀,42 ℃反应40 min,测定525 nm处吸光值。还原型AsA测定时以0.2 mL H2O和0.2 mL PBS分别代替DTT和NEM,其他同上。总AsA含量减去还原型AsA含量即为氧化型AsA,即脱氢抗坏血酸(DHA)含量。AsA溶解于6% TCA,同法作标准曲线。
1.2.5DHAR和APX的活性电泳蛋白提取及不连续活性聚丙烯酰胺凝胶电泳(native PAGE)参照Laemmli[14]的方法在4 ℃下进行。分离胶和浓缩胶(不含SDS)铺进电泳槽,电泳槽各孔加入等量的蛋白质,电泳缓冲液为pH 8.3的Tris-HCl,恒定电流30 mA。电泳完毕,进行酶的活性染色。
DHAR的native PAGE采用4%的浓缩胶和10%的分离胶。DHAR的活性染色参照Aravind等[15]的方法。将电泳后的凝胶浸入含4 mmol·L-1GSH,2 mmol·L-1DHA的0.1 mol·L PBS (pH 6.2)中,于摇床上温育20 min。水洗后,于含0.1% FeCl3和0.1% K3[Fe(CN)6] 的0.1 mol·L-1HCl溶液中孵育,在浅蓝色背景上出现深蓝色的条带。蒸馏水漂洗,图像扫描。
APX的native PAGE采用4%的浓缩胶和8%的分离胶。APX的活性染色采用Rao等[16]的方法。凝胶先在含2 mmol·L-1AsA的50 mmol·L-1PBS中孵育30 min,再在含4 mmol·L-1AsA和2 mmol·L-1H2O2的50 mmol·L-1PBS(pH 7.0)中孵育20 min。缓冲液冲洗1 min后,在含28 mmol·L-1TEMED和2.45 mmol·L-1NBT的PBS(pH 7.8)中,轻轻摇动,染色10~15 min。水洗,终止反应。图像扫描。
1.2.6APX基因表达的荧光定量PCR分析于NCBI网站查寻箭舌豌豆所在豆科植物APX的基因序列。利用DNAMAN6.0软件进行核酸序列比对,根据3种豆科植物:豌豆(Pisumsativum)、大豆(Glycinemax)、蒺藜苜蓿(Medicagotruncatula)的高度保守序列,设计引物进行PCR扩增,得到了箭舌豌豆APX全序列。测序结果表明它与豌豆细胞质PsAPX01基因(序列号为X62077.1)的核苷酸序列一致性为94%。实时荧光定量PCR反应液使用SYBR Premix ExTaq(Tli RNaseH Plus, Takara)试剂盒,使用7500 Real-Time PCR系统 (Applied Biosystems, USA)检测基因表达量的变化。PCR所用APX特异性引物为,正向:5′-GCTGGTGTTGTTGCTGTTG-3′;反向:5′- CCCTCTGGTGGTGGATGG-3′。Actin 作为内参,Actin(序列号GU946218.1)特异性引物:正向:5′-TCTGGTGATGGTGTGAGTC-3′;反向:5′-ACAGCAACATAGGCAAGC-3′。PCR条件:95 ℃,30 s解链;随后95 ℃,5 s ;60 ℃,34 s,共40个循环。各处理的基因表达量与对照相比,以Actin为内参,对照表达量为1,得到处理后各目的基因的相对表达量。
1.3数据处理
使用SPSS 13.0 (SPSS Inc., Chicago, U.S.A.)数据处理软件包进行方差分析和LSD多重比较,不同字母表示差异显著(P<0.05)。使用Quantity One (Bio-Rad)软件进行凝胶条带强度的定量分析。
2 结果与分析
2.1镉胁迫对2个箭舌豌豆品种根系生长的影响
2个箭舌豌豆品种L3和ZM根在25 μmol·L-1镉处理下的生长情况如图1所示。在实验记录的1~14 d内,ZM主根的伸长生长量和根系鲜重增长量均始终小于L3,品种间差异在处理4 d以后即达到显著水平,且这种差异表现出随着处理时间延长而逐渐增加的趋势,并以主根伸长表现得更突出,如在处理14 d时,品种ZM主根伸长量和根系鲜重增长量分别比同期L3显著降低63%和41%。可见,在中度镉胁迫条件下,镉敏感品种ZM根系的生长较耐镉品种L3受到更显著的抑制。

不同字母表示处理时间之间或者品种间在0.05水平存在显著性差异;数值为平均数±标准差;下同图1 25 μmol·L-1 Cd处理下2个箭舌豌豆品种L3和ZM主根的伸长和根鲜重的增长The different normal letters indicated significant difference among cultivars or treatment times at 0.05 level;Data are means±SD (n=3);The same as belowFig. 1 Effects of 25 μmol·L-1 Cd treatment on root elongation and increase of root fresh weight in two V. sativa varieties, L3 and ZM
2.2镉胁迫下2个箭舌豌豆品种根尖的膜脂过氧化和质膜损伤
使用Schiff试剂对镉处理7 d的2个箭舌豌豆品种根尖膜脂过氧化程度进行了组织化学检测,Schiff试剂与膜脂过氧化产生的醛类化合物反应生成粉红色物质,结果如图2所示。其中,在对照(0 μmol·L-1Cd)条件下,2个箭舌豌豆品种的根尖几乎观察不到粉红色;在10~50 μmol·L-1镉处理条件下,L3和ZM根尖都出现粉红色,且随镉处理浓度的增加根尖粉红色逐渐明显,显示膜脂过氧化程度逐渐加深;在相同镉处理浓度下,ZM较L3根尖染色更深。说明镉胁迫下ZM根尖膜脂过氧化程度更严重,它受到了比L3更严重的氧化胁迫。
Evans blue(伊文思蓝)是非渗透性染料,若根尖能被Evans blue染成蓝色,说明根尖细胞对Evans blue通透,其质膜完整性受到破坏,且染色越深表示根尖细胞质膜损伤的程度越大。镉处理下2个箭舌豌豆品种根尖Evans blue 吸收量的分析表明(图3), 10~50 μmol·L-1镉处理7 d后,2个箭舌豌豆品种根尖质膜均受到明显损伤,损伤程度随镉处理浓度的增加而显著增加;在相同镉处理浓度下,ZM根尖的质膜损伤程度显著大于L3。
2.3镉胁迫对2个箭舌豌豆品种根系AsA、DHA含量和AsA/DHA比值的影响
表1结果显示,各浓度镉处理7 d后2个箭舌豌豆品种根系AsA和DHA含量都较对照(0 μmol·L-1Cd)显著升高;L3根系的AsA/DHA比值较对照显著升高,而ZM根系的AsA/DHA比值较对照显著降低。在相同镉处理浓度下,L3根系的AsA含量和AsA/DHA比值均显著大于ZM。以上结果说明,镉胁迫下耐性品种L3具有较敏感品种ZM更强的产生AsA和维持氧化还原稳态的能力。
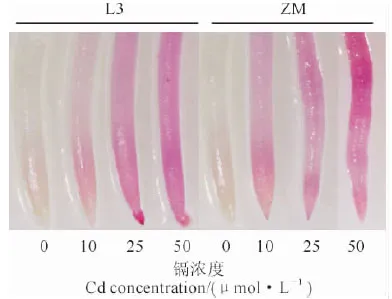
图2 不同浓度镉胁迫下2个箭舌豌豆品种L3和ZM根尖膜脂过氧化的Schiff染色Fig. 2 Histochemical detection of lipid peroxidation by Schiff’s reagent in the root tips of two V. sativa varieties, L3 and ZM
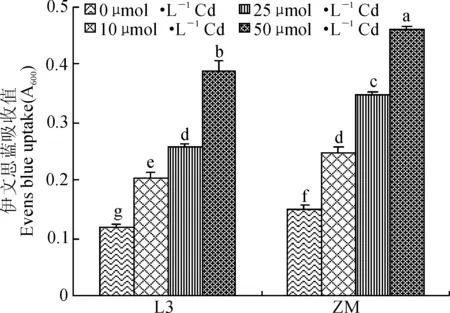
图3 不同浓度镉对2个箭舌豌豆品种L3和ZM根尖伊文思蓝吸收的影响Fig. 3 Quantitative assay of Evans blue uptake in the root tips of two V. sativa varieties, L3 and ZM
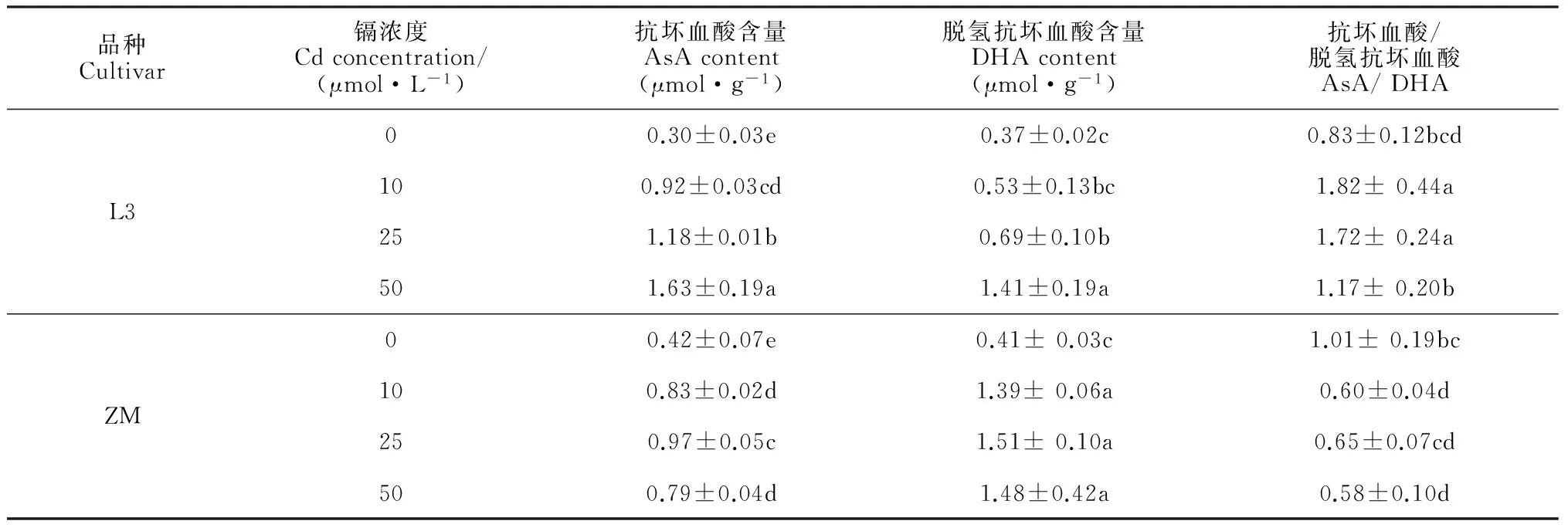
品种Cultivar镉浓度Cdconcentration/(μmol·L-1)抗坏血酸含量AsAcontent(μmol·g-1)脱氢抗坏血酸含量DHAcontent(μmol·g-1)抗坏血酸/脱氢抗坏血酸AsA/DHAL300.30±0.03e0.37±0.02c0.83±0.12bcd100.92±0.03cd0.53±0.13bc1.82±0.44a251.18±0.01b0.69±0.10b1.72±0.24a501.63±0.19a1.41±0.19a1.17±0.20bZM00.42±0.07e0.41±0.03c1.01±0.19bc100.83±0.02d1.39±0.06a0.60±0.04d250.97±0.05c1.51±0.10a0.65±0.07cd500.79±0.04d1.48±0.42a0.58±0.10d
注:结果为3次重复实验的平均值±标准差(n=3)
Note: Values are means±SD (n=3) of three different experiments
2.4镉胁迫对2个箭舌豌豆品种根系DHAR同工酶谱的影响
对镉处理7 d的2个箭舌豌豆品种根系的可溶性蛋白提取物进行活性电泳和DHAR活性染色,可见4条DHAR同工酶条带(图4)。这些同工酶的活性均随着镉处理浓度的升高而升高,其中DHAR1只在L3根系中显示,而DHAR4只在ZM根系中显示,DHAR2 和DHAR3在L3根系中的活性高于ZM。进一步对凝胶条带强度进行定量分析的结果显示,在10、25和50 μmol·L-1镉处理下L3和ZM根系中DHAR同工酶总活性均随着镉处理浓度的升高而显著升高。在25和50 μmol·L-1镉处理下,L3根系DHAR的总活性分别是ZM的1.25和1.16倍,显著高于ZM。
2.5镉胁迫对2个箭舌豌豆品种根系APX同工酶谱和基因表达的影响
对镉处理7 d的2个箭舌豌豆品种根系的可溶性蛋白提取物进行活性电泳和APX活性染色,可见11条APX同工酶条带(图5)。其中,APX 5、6、9、10、11条带在2个品种根系中均不受镉胁迫诱导;APX 1、2、4 条带在ZM根系中受镉胁迫的显著诱导,但在L3根系中不受镉胁迫的诱导;APX3条带在2个品种根系均受镉胁迫诱导,但品种间无显著差异;APX 7、8是2个主要的APX同工酶条带,在2个品种中均随着镉处理浓度的升高而升高,其中APX 8在L3根系中较ZM升高更显著。进一步对凝胶条带强度进行定量分析发现, 10、25和50 μmol·L-1镉处理下L3和ZM根系中APX同工酶总活性均较对照显著升高,在L3根系中分别是对照的1.06、1.09和1.16倍;在ZM根系中分别是对照的1.16、1.21和1.26倍;相同镉处理浓度下,L3与ZM根系中APX的总活性没有显著差异。

图4 镉胁迫下两个箭舌豌豆品种L3和ZM根系DHAR同工酶谱Fig. 4 Changes of DHAR isozyme profile under increasing Cd concentration in the roots of the two V. sativa varieties, L3 and ZM

图5 不同浓度镉胁迫下2个箭舌豌豆品种L3和ZM根系APX同工酶谱的变化Fig. 5 Changes of APX isozyme profile under increasing Cd concentration in the roots of the two V. sativa varieties, L3 and ZM
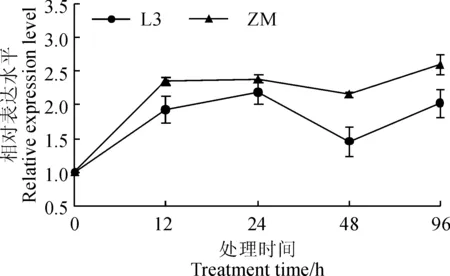
图6 25 μmol·L-1镉处理下2个箭舌豌豆品种L3和ZM根系APX基因表达的荧光定量PCR分析Fig. 6 Real time RT-PCR analysis of APX gene in response to 25 μmol·L-1 Cd treatment in the roots of two V. sativa varieties, L3 and ZM
同时,进一步通过荧光定量 RT-PCR考察了镉胁迫下2个箭舌豌豆品种根系中1个细胞质APX基因的表达情况,发现镉胁迫诱导了这一APX基因的转录表达(图6)。其中,在镉胁迫处理12 h时,2个箭舌豌豆品种根系中该APX基因的表达已见上调,随后APX基因的表达水平随镉胁迫处理时间的延长保持在对照表达量的2.0倍左右水平,而品种间没有显著差异。
3 讨 论
镉胁迫影响植物正常的生长发育[17-18],一般镉对根的抑制较地上部严重,根的伸长对镉胁迫最敏感[19];镉胁迫还常导致植物的氧化胁迫。本实验中,镉对箭舌豌豆品种ZM根生长的抑制程度显著大于品种L3;ZM根尖膜脂过氧化和质膜损伤程度也显著大于L3。这些结果证明品种ZM对镉胁迫比L3更敏感。
同时,本研究中镉胁迫使2个箭舌豌豆品种根系AsA含量都显著升高,而在相同镉处理浓度下L3根系AsA含量高于ZM,DHA含量低于ZM,AsA/DHA的比值始终大于ZM,这说明AsA参与了镉胁迫下箭舌豌豆根系的抗氧化响应,L3根系具有更强的抗氧化、保持氧化还原稳态的能力,这可能是L3较ZM具有更强镉耐性的重要原因之一。
植物体内AsA的水平取决于AsA的合成、循环、降解和转运等环节,其中AsA循环在植物胁迫响应中起着尤其重要的作用[20]。AsA氧化形成的DHA一方面可在DHAR的催化下还原为AsA,另一方面可以自发水解成2,3-二酮古洛酸[21]。DHAR催化DHA还原,可以减少DHA的分解,促进AsA的循环再生。本实验中2个箭舌豌豆品种根系共鉴定到4条DHAR同工酶带,这些同工酶的活性都随镉处理浓度的升高而显著升高,说明箭舌豌豆根系DHAR活性受镉胁迫的显著诱导。相同镉处理浓度下,耐性品种L3根系DHAR的总活性高于敏感品种ZM,这可能使L3根系较ZM更有效地促进DHA还原为AsA,而具有更高的AsA水平和AsA/DHA比值。Chen等[22]报道,在烟草和玉米叶片过表达小麦DHAR基因可提高DHAR活性,增加AsA含量和AsA/DHA比值。Yin等[23]报道过表达拟南芥DHAR基因的烟草植株AsA含量和APX活性在铝胁迫下增加,对铝的耐性提高。镉胁迫下,植物产生的ROS常积累于质外体[24],因此质外体ROS的清除对提高植物镉耐性有重要作用。本实验前期的研究发现,镉胁迫下2个箭舌豌豆品种根系ROS主要积累于细胞壁和质外体空间[25]。AsA是质外体中最重要的抗氧化分子[23]。但质外体缺乏AsA代谢相关酶,质外体中AsA氧化产生的DHA要通过AsA/DHA转运体转运过质膜,然后在共质体中由DHAR还原为AsA,AsA再转运至质外体[26]。因此,共质体中的DHAR可以同时还原共质体和质外体中的DHA为AsA。本实验中,耐镉品种L3根系较镉敏感品种ZM具有更高的DHAR活性,可以更有效地促进共质体和质外体中的DHA还原为AsA,更有效地减轻镉胁迫诱导产生的氧化胁迫,从而提高L3对镉胁迫的耐性。目前,关于根系DHAR同工酶研究的报道较少,Shimaoka等[27]曾报道分离了菠菜叶片中占90%DHA还原活性的两种DHAR同工酶。本实验中两个箭舌豌豆品种根系DHAR同工酶差异显著,这些差异对它们DHA还原能力的影响值得今后深入研究。
AsA抗氧化的主要途径是通过APX催化AsA与H2O2反应,将H2O2还原为H2O。本实验中2个不同镉耐性的箭舌豌豆品种根系APX活性都随镉处理浓度的升高而升高,说明APX活性受镉处理的诱导。高等植物中,APX存在多种同工酶,包括胞质APX、叶绿体基质APX和类囊体膜结合APX、微体(包括乙醛酸循环体和过氧化物酶体)膜结合APX和线粒体膜结合APX[28]。本实验在2个箭舌豌豆品种根系中共鉴定到11条APX同工酶带,其中APX1、2、4只在ZM根系受到诱导,而活性最高的同工酶APX8在L3根系较ZM受到更显著的诱导。推测2个箭舌豌豆品种根系APX总活性虽然没有显著差异,但不同的APX同工酶受到不同程度的诱导,可能导致2个箭舌豌豆品种根系催化H2O2分解能力的差异。本实验中2个箭舌豌豆品种根系中1个胞质APX基因在镉胁迫下显著上调表达,说明APX活性的升高与其基因表达增加有关,镉胁迫下箭舌豌豆根系APX活性存在转录水平的调控。
另外,除通过APX催化H2O2的分解、减轻植物的活性氧伤害,AsA还可能通过其它过程影响植物的镉耐性。我们前期的研究发现镉胁迫下ZM根尖较L3更明显地木质化[25],木质化过程包含H2O2参与的酚类物质的氧化,酚类物质氧化过程中会产生中间产物酚自由基,对质膜等结构造成损伤[29]。AsA是有效的酚自由基清除剂,L3的镉耐性可能与其维持较高的AsA水平,减少了酚自由基的伤害有关。AsA还可作为酶的辅因子对一系列重要的酶促反应起调控作用,影响植物细胞的分裂分化和伸展,AsA还是植物细胞的信号转导分子[30-32]。因此,AsA还可能通过影响细胞壁木质化和木栓化过程、影响细胞分裂以及根的生长,从而影响植物的镉耐性,这些都需要今后进一步深入研究。
[1]OLMOS E, MARTNEZ-SOLANO J R, PIQUERAS A,etal. Early steps in the oxidative burst induced by cadmium in cultured tobacco cells (BY-2 line) [J].J.Exp.Bot., 2003, 54(381): 291-301.
[2]PÉREZ-CHACA M V, RODRGUEZ-SERRANO M, MOLINA A S,etal. Cadmium induces two waves of reactive oxygen species inGlycinemax(L.) roots [J].PlantCellEnviron., 2014, 37(7): 1 672-1 687.
[3]GARNIER L, SIMON-PLAS F, THULEAU P,etal. Cadmium affects tobacco cells by a series of three waves of reactive oxygen species that contribute to cytotoxicity [J].PlantCellEnviron., 2006, 29(10): 1 956-1 969.
[4]DENG X,XIA Y, HU W,etal. Cadmium-induced oxidative damage and protective effects of N-acetyl-L-cysteine against cadmium toxicity inSolanumnigrumL.[J].J.Hazard.Mater., 2010, 180: 722-729.
[6]CHEN Z, GALLIE D R. Increasing tolerance to ozone by elevating foliar ascorbic acid confers greater protection against ozone than increasing avoidance[J].PlantPhysiol., 2005, 138(3): 1 673-1 689.
[7]ELTAYEB A E, KAWANO N, BADAWI G H,etal. Overexpression of monodehydroascorbate reductase in transgenic tobacco confers enhanced tolerance to ozone, salt and polyethylene glycol stresses[J].Planta, 2007, 225(5): 1 255-1 264.
[8]BURKEY K O, EASON G, FISCUS E L. Factors that affect leaf extracellular ascorbic acid contentand redox status[J].Physiol.Plantarum, 2003, 117: 51-57.
[9]SHARMA P,DUBEY R S. Involvement of oxidative stress and role of antioxidative defense system in frowing rice seedlings exposed to toxic concentrations of aluminum[J].PlantCellRep., 2007, 26:2 027-2 038.
[10]PARADISO A, BERARDINO R, DE PINTO M C,etal. Increase in ascorbate-glutathione metabolism as local and precocious systemic responses induced by cadmium in durum wheat plants[J].PlantCellPhysiol., 2008, 49(3): 362-374.
[11]SCHÜTZENDÜBEL A, POLLE A. Plant responses to abiotic stresses: heavy metal-induced oxidative stress and protection by mycorrhization[J].J.Exp.Bot., 2002, 53:1 351-1 365.
[12]YAMAMOTO Y, KOBAYASHI Y, MATSUMOTO H. Lipid peroxidation is an early symptom triggered by aluminum, but not the primary cause of elongation inhibition in pea roots[J].PlantPhysiol., 2001, 125(1): 199-208.
[13]KAMPFENKEL K, VANMONTAGU M, INZE D. Extraction and determination of ascorbate and dehydroascorbate from plant tissue[J].Anal.Biochem., 1995, 225(1): 165-167.
[14]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227(5 259): 680-685.
[15]ARAVIND P, NARASIMHA M, PRASAD V. Modulation of cadmium-induced oxidative stress inCeratophyllumdemersumby zinc involves ascorbate-glutathione cycle and glutathione metabolism[J].PlantPhysiol.Bioch., 2005, 43(2): 107-116.
[16]RAO M V, PALIYATH C, ORMROD D P. Ultraviolet B- and ozone-induced biochemical changes in antioxidant enzymes ofArabidopsisthaliana[J].PlantPhysiol., 1996, 110(1): 125-136.
[17]MOHAMED A A, CASTAGNA A, RANIERI A,etal. Cadmium tolerance inBrassicajuncearoots and shoots is affected by antioxidant status and phytochelatin biosynthesis[J].PlantPhysiol.Bioch., 2012, 57: 15-22.
[18]PODAZZA G, ARIAS M, PRADO F E. Cadmium accumulation and strategies to avoid its toxicity in roots of the citrus rootstock Citrumelo[J].J.Hazard.Mater., 2012, 215: 83-89.
[19]GUO Y T,MARSCHNER H. Uptake, distribution, and binding of cadmium and nickel in different plant species[J].J.PlantNutr., 1995, 18(12): 2 691-2 706.
[20]STEVENS R, PAGE D, GOUBLE B,etal. Tomato fruit ascorbic acid content is linked with monodehydroascorbate reductase activity and tolerance to chilling stress [J].PlantCellEnviron., 2008, 31(8): 1 086-1 096.
[21]NOCTOR G, FOYER C H. Ascorbate and glutathione: Keeping active oxygen under control[J].Annu.Rev.PlantPhysiol.PlantMol.Biol.,1998, 49:249-279.
[22]CHEN Z, GALLIE D R. Increasing vitamin C content of plants through enhanced ascorbate recycling[J].P.Natl.Acad.Sci.USA, 2003, 100(6): 3 525-3 530.
[23]YIN L, WANG S, ELTAYEB A E,etal. Overexpression of dehydroascorbate reductase, but not monodehydroascorbate reductase, confers tolerance to aluminum stress in transgenic tobacco[J].Planta, 2010, 231(3): 609-621.
[24]QUEVAL G, HAGER J, GAKIRE B,etal. Why are literature data for H2O2contents so variable? A discussion of potential difficulties in the quantitative assay of leaf extracts[J].J.Exp.Bot., 2008, 59(2): 135-146.
[25]RUI H, CHEN C, ZHANG X,etal. Cd-induced oxidative stress and lignification in the roots of twoViciasativaL. varieties with different Cd tolerances.[J]J.Hazard.Mater., 2016, 301:304-313.
[26]HOREMANS N, FOYER C H, ASARD H. Transport and action of ascorbate at the plant plasma membrane[J].TrendsPlantSci., 2000, 5(6): 263-267.
[27]SHIMAOKA T, YOKOTA A, MIYAKE C. Purification and characterization of chloroplast hydroascorbate reductase from Spinach leaves[J].PlantCellPhysiol., 2000, 10: 1 110-1 118.
[28]SHIGEOKA S, ISHIKAWA T, TAMOI M,etal. Regulation and function of ascorbate peroxidase isoenzymes[J].J.Exp.Bot., 2002, 53(372): 1 305-1 319.
[29]FECHT-CHRISTOFFERS M M, BRAUN H P, LEMAITRE-GUILLIER C,etal. Effect of manganese toxicity on the proteome of the leaf apoplast in cowpea[J].PlantPhysiol., 2003, 133(4): 1 935-1 946.
[30]PIGNOCCHI C, FOYER C H. Apoplastic ascorbate metabolism and its role in the regulation of cell signalling[J].CurrOpin.PlantBio., 2003, 6(4): 379-389.
[31]GREEN M A, FRY S C. Vitamin C degradation in plant cells via enzymatic hydrolysis of 4-O-oxalyl-L-threonate[J].Nature, 2005, 433(7 021): 83-87.
[32]HOUDE M, DIALLO A. Identification of genes and pathways associated with aluminum stress and tolerance using transcriptome profiling of wheat near-isogenic lines[J].BMCGenomics, 2008, 9: 400-412.
(编辑:裴阿卫)
Study on Ascorbic Acid and Relative Enzymes Against Cadmium Stress in the Roots ofViciasativaL.
RUI Haiyun1,2, ZHANG Xingxing2, ZHUANG Kai2, SHEN Zhenguo2, ZHANG Fenqin3
(1 Taizhou University, Taizhou, Jiangsu 225300,China; 2 College of Life Sciences, Nanjing Agricultural University, Nanjing 210095,China; 3 College of Hexi, Zhangye, Gansu 734000,China)
Two varieties ofViciasativaL. with different Cd tolerances (Cd-tolerant variety L3, Cd-sensitive variety ZM) were studied to compare concentrations of ascorbic acid (AsA), activities of dehydroascorbate reductase (DHAR) isoenzymes and ascorbate peroxidase (APX) isoenzymes, and APX gene expression in response to Cd treatment in the roots. Results showed that: (1) Cd treatment significantly increased the concentrations of AsA and dehydroascorbate (DHA) in the roots of both L3 and ZM. Cd treatment also tended to increase ratio of AsA/DHA in L3, but to decrease the ratio in ZM. At the same Cd treatment, L3 roots had higher AsA concentration and AsA/DHA ratio than that of ZM. (2) Four isoforms of DHAR were obtained in L3 and ZM roots by native PAGE and their activities generally increased with increasing Cd concentration. DHAR1 was obtained only in L3 and DHAR4 only in ZM. At equivalent Cd concentrations, the total activity of DHAR was higher in roots of L3 than that in ZM. (3) Eleven APX isoforms were obtained in both L3 and ZM roots by native PAGE. APX1, 2, 4 were induced by Cd treatment only in ZM and the activity of APX8 was more significantly induced in L3 than that in ZM. An APX gene was cloned and subjected to RT-PCR analysis. The gene expression level was upregulated under Cd stress in the roots of both varieties. These results suggested that concentration of AsA, activities of DHAR and APX, and APX gene expression level increased in response to cadmium stress in the roots of twoV.sativavarieties. It is possible that the more effective AsA recycle in the roots of L3 contributed to its higher AsA concentration than that in ZM, and this could be related to its stronger protection from ROS generation and finally contributed to its higher tolerance to Cd stress.
ViciasativaL.; cadmium tolerance; ascorbic acid; ascorbate peroxidase; dehydroascorbate reductase
1000-4025(2016)07-1391-08
10.7606/j.issn.1000-4025.2016.07.1391
2016-03-03;修改稿收到日期:2016-06-16
国家自然科学基金(31160053,31560072);泰州学院博士基金(TZXY2015JBJJ005)
芮海云(1969-),女,博士,副教授,主要从事植物逆境生理研究。E-mail: njrtz@sina.com
Q945.78
A

