NtMTP1基因过表达对增强烟草Zn胁迫耐受性的研究
冉 巧,吴婵娟,高永峰,唐运来,黄才芝,刘继恺*
NtMTP1基因过表达对增强烟草Zn胁迫耐受性的研究
冉巧,吴婵娟1, 2,高永峰1,唐运来1, 2,黄才芝1,刘继恺1, 2*
(1 西南科技大学 生命科学与工程学院,四川绵阳 621010;2 西南科技大学 核废物与环境安全国防重点实验室,四川绵阳 621010)
该研究采用实时荧光定量PCR(qRT-PCR)技术,对烟草金属耐受蛋白1(MTP1)基因(NtMTP1)在烟草不同组织以及不同质量浓度ZnSO4处理下的表达进行了分析;利用农杆菌介导法,将NtMTP1基因植物过表达载体pBI121-35S∶∶MTP1转化野生型烟草,筛选得到NtMTP1基因过表达的转基因烟草植株,并进行不同质量浓度ZnSO4处理,检测NtMTP1基因过表达对烟草Zn胁迫耐受性的影响。结果表明:NtMTP1基因在烟草中呈现组织特异性表达,主要在花与叶中表达;NtMTP1基因的表达受到Zn2+诱导,在400 μmol/L ZnSO4处理后,表达量达到最高,为对照组的3.81倍;3株转基因烟草植株中NtMTP1基因表达量分别为野生型的10.42、7.61和11.84倍,与野生型相比,过表达植株对Zn胁迫的耐受性显著增强。研究结果为阐明NtMTP1基因在烟草体内Zn2+转运过程中的生物学功能提供了重要依据。
烟草;金属耐受蛋白1;锌;耐受性
Zn是植物必需的微量营养元素之一,是植物细胞内300多种酶与2 000多个转录因子的辅助因子,与植物生长素代谢、膜的完整性和生殖发育密切相关。但细胞内Zn2+过量积累同样会对植物产生毒害作用,比如,会引起植物膜脂过氧化作用,丙二醛含量上升,叶绿素含量降低等,从而破坏植物质膜的完整性和光合系统[1-4]。为减少Zn2+等重金属离子的毒害作用,生物体进化出一套以阳离子扩散促进因子(cation diffusion facilitator,CDF)蛋白家族为载体的跨膜转运机制[5]。基于对古细菌、真细菌和真核生物中具有代表性的CDF成员进行的系统进化和功能分析结果,人们将CDF家族分为底物特异的3个大组:Zn-CDF、Fe/Zn-CDF和Mn-CDF[6-7]。
植物CDF家族成员也称为金属耐受蛋白(metal tolerance protein,MTP),能够作用于Zn2+、Fe2+、Co2+等金属离子的转运,共分为7个小组[8-9]。在结构上,第1小组MTP蛋白在跨膜区Ⅰ、Ⅱ、Ⅴ、Ⅵ中含有极性带电残基,在Ⅳ和Ⅴ之间有一个富含组氨酸的胞质环路,其被认为与转运的特异性相关,可能作为细胞质内Zn2+水平的感应器[10-12]。MTP1属于第1小组,主要作用于Zn2+转运,最早在拟南芥(Arabidopsisthaliana)中被发现,AtMTP1基因主要在幼嫩的叶片中表达,在酵母Zn敏感突变体Δzrc1cot1中异源表达AtMTP1会使突变体酵母表现出对过量Zn2+的耐受性[13]。目前,多种植物的MTP1基因已被克隆。在豆科模式植物蒺藜苜蓿(Medicagotruncatula)中补充Zn2+后,MtMTP1基因在根中的表达量降低,而在茎中的表达量升高,在叶中没有明显变化[14]。在重金属富集植物东南景天(Sedumalfredii)与遏蓝菜(Thlaspicaerulescens)中也分离出了MTP1基因,研究发现MTP1基因在这2种富集植物中存在多个拷贝,暗示MTP1蛋白在植物重金属吸收和排毒过程中的重要作用[15]。水稻(Oryzasativa)OsMTP1基因是新近发现的MTP1基因,该基因位于水稻第5号染色体上,它主要在成熟的叶和茎中高度表达,其表达量还受到重金属如Zn2+、Cd2+、Cu2+和Fe2+的诱导[16-17]。
烟草(Nicotianatabacum)是一种重要的经济作物,随着环境的日益恶化,针对其抵抗逆境的能力,特别是对重金属的耐受性的研究已成为研究人员关注的热点。Shingu等从烟草中克隆到NtMTP1基因,该基因的异源表达能够恢复酵母Zn敏感突变体Δzrc1对Zn的抗性,并发现NtMTP1蛋白定位于酵母的液泡膜上,这些结果暗示NtMTP1蛋白能够将Zn2+隔离在液泡中来减轻毒性[18]。但是,这些结果只揭示了NtMTP1基因在酵母中的功能,其在烟草体内的生物学功能仍然未知。本研究进一步分析了NtMTP1基因的表达模式,同时构建了NtMTP1基因过表达载体并将其转化到野生型烟草植株中,通过后期实验分析了NtMTP1过表达转基因植株对Zn胁迫的耐受能力,为研究烟草对重金属Zn2+的转运和分布规律提供了重要的理论和实验依据。
1 材料和方法
1.1材料
供试植物材料为烟草‘NC89’,实验室常规种植。大肠杆菌菌株DH5α、根癌农杆菌(Agrobacteriumtumefaciens)EHA105和植物表达载体pBI121均由本实验室保存。
1.2方法
1.2.1总RNA提取和cDNA合成按照Trizol试剂(Invitrogen公司)说明书提取烟草总RNA,用PrimeScriptTMRT reagent Kit with gDNAEraser 反转录试剂盒(Takara公司)进行反转录得到cDNA,置于-20 ℃冰箱保存备用。
1.2.2烟草NtMTP1基因的组织表达模式利用qRT-PCR方法分析烟草NtMTP1基因(GenBank登录号AB20124)在不同组织器官中的表达水平,以烟草NtRL2(ribosomic protein L2,GenBank登录号Z14081)作为内参基因,设计引物NtRL2 rt-F(5′-GTAAGGGAGCGGGTTCAGTCT-3′)和NtRL2 rt-R(5′-AACGGAGCACCCCTACCTG-3′);NtMTP1 rt-F(5′-TCGAGGTTGTTGGTGGTATTAAA
-3′)和NtMTP1 rt-R(5′-CGATTCTGAAAAACCCATAGGAC-3′)。采用RealMasterMix(SYBR Green I)试剂盒(天根生化科技(北京)有限公司),在Bio-Rad公司的CFX96Real-Time System进行qRT-PCR扩增。程序为:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,40个循环,65 ℃延伸5 s,然后以每秒0.5 ℃升至95 ℃,61个循环。数据采用2-ΔΔCt法计算。
1.2.3烟草NtMTP1基因在Zn胁迫下的诱导表达用1/2 Hoagland营养液[19]培养野生型烟草幼苗30 d后,选取长势良好,大小一致的幼苗转入分别含0、50、100、200和400 μmol/L ZnSO4的新鲜1/2 Hoagland营养液中,处理48 h后取幼苗样品,液氮速冻后置于-80 ℃储存备用。提取幼苗样品总RNA,经反转录得到第一链cDNA,利用qRT-PCR分析NtMTP1基因的相对表达量。
1.2.4烟草NtMTP1基因植物过表达载体的构建根据NtMTP1基因序列,利用Primer v5.0软件,设计巢式PCR引物NtMTP1 F1(5′-ATTTGATGATTTGGGTCGG-3′)和NtMTP1 R1(5′-TGAAACAGATACTGGA ACCG-3′),以及带有XbaI和SacI双酶切位点的特异性引物NtMTP1 F2(5′-TCTAGAATGGAGACGCAGAACCTGG-3′)和NtMTP1 R2(5′-GAGCTCTTACTCTCTTTCTATTTGAATGG-3′)。以野生型烟草cDNA为模板进行PCR扩增,得到NtMTP1基因片段,反应程序为94 ℃ 变性15 s,55 ℃退火15 s,72 ℃延伸10 s,30个循环,72 ℃充分延伸5 min。PCR产物与pEASY-Blunt载体(北京全式金生物公司)连接,转化大肠杆菌DH5α后提取重组质粒,送华大基因科技股份有限公司测序。测序正确后,用XbaI和SacI(Thermo公司)同时双酶切测序正确的NtMTP1基因片段和植物表达载体pBI121,将NtMTP1基因插入到CaMV35S启动子的后面,阳性克隆送华大基因科技股份有限公司测序。将重组质粒用冻融法[20]转入到农杆菌EHA105感受态细胞中。
1.2.5烟草遗传转化使用叶盘转化法[21]转化野生型烟草。用含有pBI121-35S∶∶MTP1重组质粒的农杆菌EHA105侵染野生型烟草叶片,随后将叶片置于MS[22]+3%蔗糖+0.8%琼脂+200 μmol/L乙酰丁香酮共培养基上,于(24±1)℃、黑暗条件下培养2 d后转移到含50 mg/L硫酸卡那霉素(kanamycinsulfate,Kan)和500 mg/L头孢曲松钠(ceftriaxone sodium,Cef)的MS+3.0 %蔗糖+0.8%琼脂+3.0 mg/L 6-BA+ 0.2 mg/L NAA分化培养基上,每7~15 d更换1次培养基,于上述条件下筛选培养1~2个月。当分化培养基上愈伤组织长出1.5 cm左右的新芽时,切取小芽转移至含50 mg/L Kan的1/2 MS+3.0 %蔗糖+0.5%琼脂的生根培养基上进行生根培养和筛选,获取完整的Kan抗性植株[23]。待根系发达后转移至盆中,在温室内(24±1)℃、光照16 h/d条件下培养。
1.2.6烟草NtMTP1基因过表达植株的筛选以及对Zn胁迫耐受性的检测参照刘继恺等鉴定转基因阳性植株的方法[24],对新霉素磷酸转移酶Ⅱ(neomycin phosphotransferase Ⅱ,NPTⅡ)基因片段进行扩增。随后,提取筛选到的转基因阳性植株的RNA,反转录生成cDNA,利用半定量PCR检测野生型和转基因植株NtMTP1基因的表达量,从而筛选得到在RNA水平过表达的转基因烟草植株,进一步培育筛选得到NtMTP1基因过表达纯合体植株。
选取3个NtMTP1基因过表达纯合子株系与野生型烟草株系进行Zn胁迫处理。将4个株系的种子用15% NaClO消毒后,分别播种于含有浓度为0、200、500、1 000和2 000 μmol/L ZnSO4的1/2 MS固体培养基上垂直培养,待种子萌发后,观察幼苗的生长发育情况,在第45天测定幼苗的根长。
1.2.7生物学重复和统计学方法以上实验均进行3次独立的生物学重复,每个样本含3株及以上植株,设置3次技术重复进行qRT-PCR。Zn胁迫耐受性分析中,分别测定每个浓度处理下10株以上的幼苗根长进行统计分析。利用DPS v7.05软件进行单因素试验统计分析和LSD多重比较检验处理间差异程度,采用Excel 2013软件作图。
2 结果与分析
2.1烟草NtMTP1基因的组织表达模式
分别提取野生型烟草根、茎、叶、花和种子的总RNA,反转录得到第一链cDNA,利用qRT-PCR检测NtMTP1基因在烟草不同组织中的表达情况。结果(图1)显示,NtMTP1基因主要在烟草的花与叶中表达,分别为根中16.81和7.26倍,而在根、茎和种子中表达量很低。这些结果表明,烟草NtMTP1基因具有组织特异表达的特征。
2.2Zn2+可诱导NtMTP1基因在烟草中的表达
用不同质量浓度ZnSO4处理野生型烟草48 h,利用qRT-PCR对NtMTP1基因的表达量进行分析。结果如图2所示,与用0 μmol/L ZnSO4处理的对照组烟草相比,NtMTP1基因的表达量在50 μmol/L ZnSO4处理的烟草中无明显变化,而当浓度达到100 μmol/L后,其表达量开始升高,在用400 μmol/L ZnSO4处理的烟草中达到最高,为对照组的3.81倍。这些数据表明,烟草NtMTP1基因的表达受到Zn2+的诱导。
2.3烟草NtMTP1基因过表达植株的鉴定

图1 烟草NtMTP1基因在不同组织中的表达Fig. 1 Expression profile of NtMTP1 gene in different tissues of tobacco

不同大写字母代表各处理间的显著性差异(P<0.01,LSD检验)图2 烟草NtMTP1基因对ZnSO4的响应Different letters refer to significant differences among the treatments (P<0.01, LSD test)Fig. 2 Expression analysis of NtMTP1 gene in response to ZnSO4 treatment
使用农杆菌介导的叶盘法转化野生型烟草,共获得16株组培植株,以提取获得的组培植株的DNA为模板,NPTII F/R为引物进行PCR验证阳性植株,预期扩增长度应为857 bp。结果表明(图3),野生型烟草未能扩增出条带,而抗性植株能够扩增出预期大小的条带,共检测出12株抗性植株,阳性率为75%。随后,利用半定量PCR对抗性植株中NtMTP1基因的表达水平进行初步鉴定,筛选出NtMTP1基因表达量最高的3株植株,分别为OE-6、OE-9和OE-10。利用qRT-PCR对NtMTP1基因在野生型和转基因植株中的表达情况进行定量分析。结果显示(图4,A),NtMTP1基因在3株转基因植株中的表达量显著高于野生型植株,分别为野生型的10.42、7.61和11.84倍。对NtMTP1基因过表达植株进行表型观察,发现在正常生长情况下,转基因植株与野生型相比,并没有表现出明显的差异(图4,B)。
2.4烟草NtMTP1基因过表达植株对Zn胁迫的耐受性分析
土壤中过量的重金属会对植物根的生长产生抑制作用,因此,植物根的长短常作为反映植物对重金属耐受性的一个重要指标。将野生型和3个NtMTP1基因过表达纯合体株系种子灭菌后,分别置于含有不同质量浓度ZnSO4的1/2 MS培养基上生长,观察幼苗生长的情况。结果显示(图5),生长在含有0 μmol/L ZnSO4的1/2 MS培养基上的野生型和转基因植株没有明显差异;在200 μmol/L ZnSO4处理下,野生型烟草根的生长表现出部分抑制,过表达植株的根系相比野生型要长大约3 cm;在500和1 000 μmol/L ZnSO4处理下,虽然野生型和过表达植株的生长都受到了一定程度的抑制,但过表达植株的根系仍然比野生型长;在2 000 μmol/L ZnSO4处理下,野生型和转基因烟草植株都已不能正常生长,根的生长受到严重抑制。由此可见,随着培养基中ZnSO4浓度的升高,野生型和转基因烟草
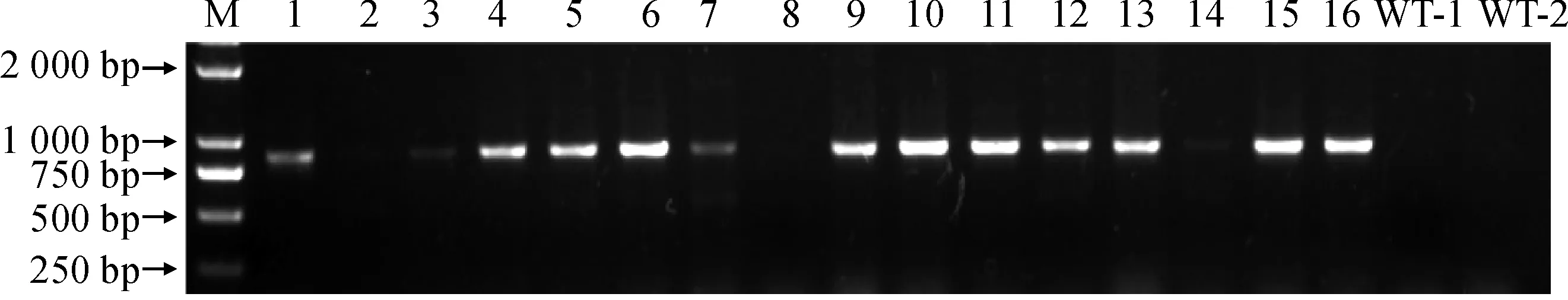
M. DL2000;1~16. 转基因植株;WT-1、WT-2. 野生型植株图3 转基因植株NTPTII基因的PCR检测M. DL2000;1~16. Transgenic plants;WT-1 and WT-2. Wild typeFig. 3 PCR analysis for NPTII gene in transgenic plants
幼苗的生长都受到一定程度的抑制,但在200、500和1 000 μmol/L ZnSO4处理下,NtMTP1基因过表达植株幼苗的根始终都比野生型烟草幼苗的长,表明NtMTP1基因的过表达增强了烟草对Zn胁迫的耐受性。
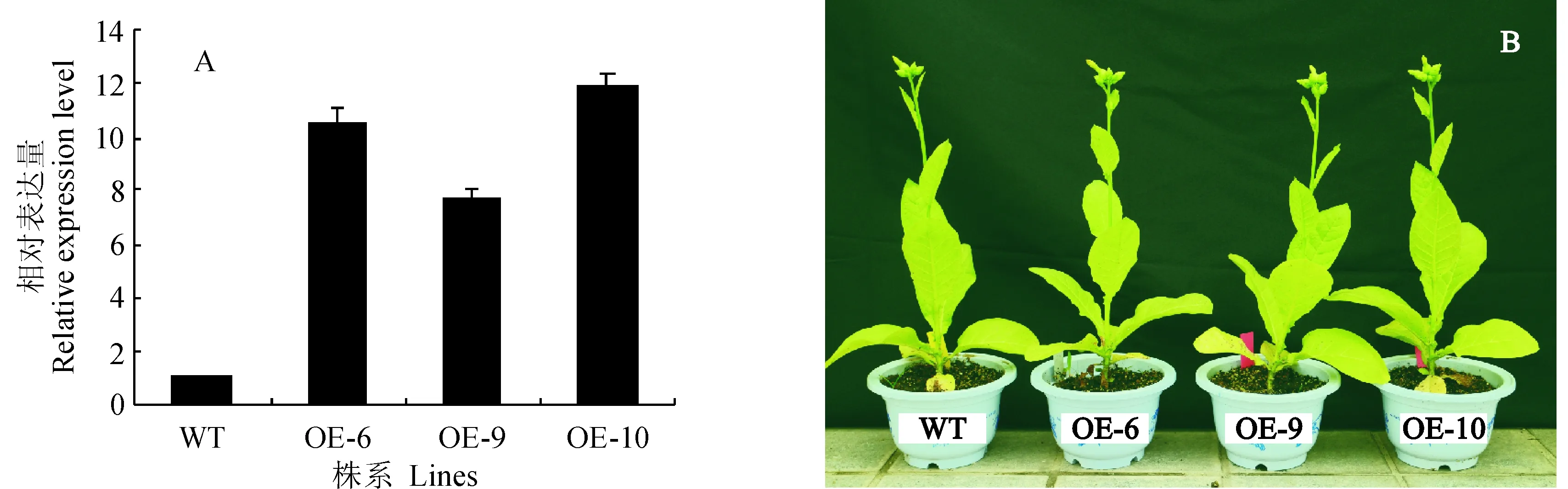
A. 转基因植株NtMTP1表达的qRT-PCR检测;B. NtMTP1基因过表达植株的表型;WT. 野生型植株;OE-6、OE-9、OE-10. 转基因烟草株系;下同图4 NtMTP1基因过表达植株的鉴定及表型A. qRT-PCR analysis for NtMTP1 relative expression level in transgenic plants;B. The phenotype of NtMTP1 gene overexpression lines;WT. Wild type;OE-6, OE-9 and OE-10. Transgenic plants;The same as belowFig. 4 Identification and the phenotype of NtMTP1 gene overexpression lines
3 讨 论
植物MTP蛋白的主要功能是将胞质中的Zn2+等重金属离子转入液泡等细胞器中进行区域隔离或者排出胞外从而提高植物对重金属的耐受性。目前,已从拟南芥等多个物种中克隆得到MTP1的同源基因,并对这些基因的功能开展了深入研究,但对烟草NtMTP1基因的研究还仅局限于酵母体内,对其在烟草体内的生物学功能的研究还未见报道。本试验对NtMTP1基因的表达特性及其对烟草Zn胁迫耐受性的影响进行了研究。
Zn是植物必需的微量营养元素,其在花、茎、叶中的含量很高,这可能与植物生长生殖对营养金属离子的需求有关[25]。研究显示,拟南芥AtMTP1基因和苜蓿MtMTP1基因主要在幼嫩的叶中表达[13-14],而水稻OsMTP1基因主要在成熟老叶和茎中表达[16]。本研究中,qRT-PCR结果显示NtMTP1基因主要在烟草的花与叶中积累,而在根、茎和种子中表达量很低。这些结果表明:一方面,MTP1基因在植物地上部的转录水平普遍高于地下部,但是其在各个物种的不同组织中的表达模式又有所差异;另一方面,也暗示MTP1基因提高植物对重金属的耐受性主要是通过地上组织细胞的区域化隔离和外排来实现的,可能并不涉及到对重金属离子的吸收。前人研究表明,Zn2+能够分别提高苜蓿MtMTP1和水稻OsMTP1基因在茎和叶中的表达水平[14,16],本研究中烟草NtMTP1基因的表达量随ZnSO4处理浓度的升高而升高,与上述结论相一致,表明NtMTP1基因能够参与烟草植株体内Zn2+的应答。
Shingu等的研究表明,NtMTP1基因的异源表达能够恢复酵母Zn敏感突变体Δzrc1对Zn的抗性[18],本研究将NtMTP1基因在烟草中过表达,结果显示与野生型相比,转基因烟草植株表现出对Zn胁迫的耐受性显著增强,揭示了NtMTP1蛋白在提高植物对重金属Zn的耐受性的重要作用。以上结果为今后采用基因工程的方法来提高烟草抗重金属胁迫的能力和遗传改良提供了重要的基因资源和理论依据。
[1]BARKER A V, PILBEAM D J. Handbook of Plant Nutrition[M]. Boca Raton. Taylor and Francis: CRC Press, 2007: 411-413.
[2]PILON-SMITS E A H, QUINN C F, TAPKEN W,etal. Physiological functions of benefical elements[J].CurrentOpinioninPlantBiology, 2009, 12: 267-274.
[3]PRASAD A S. Discovery of human zinc deficiency: 50 years later[J].JournalofTraceElementsinMedicineandBiology, 2012, 26: 66-69.
[4]蔡卓,毛培春,田小霞,等.无芒雀麦对Cd和Zn胁迫的生理响应及富集作用[J]. 草业科学, 2012, 29(6): 876-882.
CAI Z,MAO P C,TIAN X X,etal. Physiological responses and accumulation ofBromusinermisto Cd and Zn stress[J].PrataculturalScience,2012, 29(6): 876-882.
[5]MONTANINI B, BLAUDEZ D, JEANDROZ S,etal. Phylogenetic and function analysis of the cation diffusion facilitator (CDF) family: improved signature and prediction of substrate specificity[J].BMCGenomics, 2007, 8(2): 107.
[6]龚红梅,沈野. 植物对重金属锌耐性机理的研究进展[J]. 西北植物学报, 2013, 30(3): 633-644.
GONG H M, SHEN Y. Research progress in mechanisms of plant tolerance to zinc[J].ActaBotanicaBoreali-OccidentaliaSinica, 2013, 30(3): 633-644.
[7]GUSTIN J L, ZANIS M J, SALT D E. Structure and evolution of the plant cation diffusion facilitator family of ion transporters[J].BMCEvolutionaryBiology, 2011, 11(2): 76.
[8]RICACHENEVSKY F K, MENGUER P K, SPEROTTO R A,etal. Roles of plant metal tolerance proteins (MTP) in metal storage and potential use in biofortication strategies[J].FrontiersinPlantScience, 2012, 4(7): 144.
[9]武泰存,房蓓,王景安. 锌转运蛋白基因研究进展[J]. 西北植物学报, 2005, 25(10): 2 139-2 144.
WU T C, FANG B,WANG J A. Research advances about the genes of zinc-transporting proteins[J].ActaBotanicaBoreali-OccidentaliaSinica, 2005, 25(10): 2 139-2 144.
[10]KAWACHI M, KOBAE Y, MIMURA T,etal. Deletion of a histidine-rich loop of AtMTP1, a vacuolar Zn(2+)/H(+)antiporter ofArabidopsisthaliana, stimulate the transport activity[J].TheJournalofBiologicalChemistry, 2008, 283(13): 8 374-8 383.
[11]PODAR D, SCHERER J, NOORDALLY Z,etal. Metal selectivity determinants in a family of transition metal transporters[J].TheJournalofBiologicalChemistry, 2012, 287(5): 3 185-3 196.
[12]CHAO Y, FU D. Kinetic study of the antiport mechanism of anEscherichiacolizinc transporter, ZitB[J].TheJournalofBiologicalChemistry, 2004, 279(13): 12 043-12 050.
[13]BLOSS T, CLEMENS S, NIES D H. Characterization of the ZAT1p zinc transporter fromArabidopsisthalianain microbial model organisms and reconstituted proteoliposomes[J].Planta, 2002, 214(5): 783-791.
[14]CHEN M, SHEN X, LI D,etal. Identification and characterization of MtMTP1, a Zn transporter of CDF family, in theMedicagotruncatula[J].PlantPhysiologyandBiochemistry, 2009, 47(11/12): 1 089-1 094.
[15]GUSTIN J L, LOUREIRO M E, KIM D,etal. MTP1-dependent Zn sequestration into shoot vacuoles suggests dual roles in Zn tolerance and accumulation in Zn-hyperaccumulating plants[J].ThePlantJournal, 2009, 57(6): 1 116-1 127.
[16]LAN H X, WANG Z F, WANG Q H,etal. Characterization of a vacuolar zinc transporter OZT1 in rice (OryzasativaL.)[J].MolecularBiologyReports, 2012, 40(2): 1 201-1 210.
[17]王齐红. 水稻金属离子转运体基因OsMTP1的克隆与功能分析[D]. 南京: 南京农业大学, 2005.
[18]SHINGU Y, KUDO T, OHSATO S,etal. Characterization of genes encoding metal tolerance proteins isolated fromNicotianaglaucaandNicotianatabacum[J].BiochemicalandBiophysicalResearchCommunications, 2005, 331(2): 675-680.
[19]HOAGLAND D R, ARNON D I. The water-culture method for growing plants without soil[J].GalifomiaAgricultrualExperimentStationCirular, 1950, 347: 357-359.
[20]RHODES C A, PIERCE D A, M ETLLER I J. Genetically transformed maize plants from protoplasts[J].Science, 1988, 240: 204-207.
[21]HORSEH R B, FRY J E, HOFFMANN N I,etal. A simple and general method for transferring genes into plants[J].Science, 1985, 227: 1 229-1 231.
[22]MURASHIGE T,SKOOG F. A revised medium for rapid growth and bioassays with tobacco tissue culture[J].PhysiologiaPlantarum, 1962, 15(3): 473-497.
[23]王飞,邢新生,马有志,等. 根癌农杆菌介导D32基因转化烟草的条件研究[J]. 西北植物学报, 2009, 29(6):1 104-1 110.
WANG F, XING X S, MA Y Z,etal. Study on the conditions of transferringD32 gene into tobacco mediated byAgrobacteriumtumefaciens[J].ActaBotanicaBoreali-OccidentaliaSinica, 2009, 29(6):1 104-1 110
[24]刘继恺,高永峰,牛向丽,等. 番茄HP1和HP2基因RNA共干涉载体的构建及遗传转化[J]. 应用与环境生物学报, 2009, 15(5): 591-595.
LIU J K, GAO Y F, NIU X L,etal. Construction and transformation of Co-RNAi vector of tomatoHP1 andHP2 genes[J].ChineseJournalofAppliedandEnvironmentalBiology, 2009, 15(5): 591-595.
[25]汪洪,金继运. 植物对锌吸收运输及积累的生理与分子机制[J]. 植物营养与肥料学报,2009, 15(1): 225-235.
WANG H, JIN J Y. The physiological and molecular mechanisms of zinc uptake, transport, and hyperaccumulation in plants: a review[J].PlantNutritionandFertilizerScience, 2009, 15(1): 225-235.
(编辑:宋亚珍)
Overexpression ofNtMTP1 Gene fromNicotianatabacumImproved Zinc Tolerance of Tobacco
RAN Qiao1, WU Chanjuan1, 2, GAO Yongfeng1, TANG Yunlai1, 2,
HUANG Caizhi1, LIU Jikai1, 2*
(1 School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang, Sichuan 621010, China; 2 Fundamental Science on Nuclear Wastes and Environmental Safety Laboratory, Southwest University of Science and Technology, Mianyang, Sichuan 621010,China)
In this study, the relative expression ofNtMTP1 was determined by quantitative real-time PCR (qRT-PCR). The results showed thatNtMTP1 gene was highly expressed in flowers and leaves. After treatment of 400 μmol/L ZnSO4for 48 h, the expression ofNtMTP1 increased to the maximum, which was 3.81 folds of the control. Plant-expression vector pBI121-35S∶∶MTP1 was constructed, and the recombinant plasmid was introduced intoNicotianatabacumL. cv NC89 by means ofAgrobacterium-tumefaciensmediated transformation. The qRT-PCR revealed a distinct increase of endogenousNtMTP1 expression level in the overexpressing transgenic lines, which were 10.42, 7.61 and 11.84 folds of that of wild plants, respectively. Seeds of wild type and transgenic plants were treated with different concentrations of ZnSO4. The results showed that overexpression ofNtMTP1 conferred enhanced zinc tolerance. These results provide an important basis to illuminate the function ofNtMTP1 gene in Zn2 +transport in tobacco.
Nicotianatabacum; metal tolerance protein 1; zinc; tolerance
1000-4025(2016)07-1308-07
10.7606/j.issn.1000-4025.2016.07.1308
2016-04-15;修改稿收到日期:2016-06-07
国家自然科学基金(31500205);西南科技大学博士研究基金(14zx7153);西南科技大学校长机动费特殊资助(14zx1104);四川省生物质资源利用与改性工程中心项目(13zxsk02)
冉巧(1994-),女,在读本科生,主要从事植物分子生物学研究。E-mail:ranarang_april@163.com
刘继恺,博士,讲师,主要从事植物分子生物学研究。E-mail:kateryan@163.com
Q785; Q786
A

