大豆SbPRP3基因表达及转基因烟草非生物胁迫鉴定
翟 莹,张 军,杨晓杰,赵 艳,陈 阳
(1 齐齐哈尔大学 生命科学与农林学院,黑龙江齐齐哈尔 161006;2 黑龙江省兽医科学研究所,黑龙江齐齐哈尔 161005)
大豆SbPRP3基因表达及转基因烟草非生物胁迫鉴定
翟莹1,张军2,杨晓杰1,赵艳1,陈阳1
(1 齐齐哈尔大学 生命科学与农林学院,黑龙江齐齐哈尔 161006;2 黑龙江省兽医科学研究所,黑龙江齐齐哈尔 161005)
为研究大豆(GlycinemaxL.)细胞壁脯氨酸富集蛋白基因(SbPRP3)在逆境胁迫中的作用,利用实时荧光定量PCR,对SbPRP3在高盐、干旱和低温处理下的表达情况进行检测。结果显示,SbPRP3在高盐处理下表达量升高,在干旱和低温处理下表达量先升高后降低。将SbPRP3构建到植物表达载体pRI101-AN上并转化烟草,获得阳性转基因烟草3株。对转基因烟草植株进行高盐、干旱和低温胁迫处理。结果表明,与对照相比,高盐和低温处理下转基因烟草脯氨酸积累量增加,而丙二醛产生量降低。但干旱处理后转基因烟草脯氨酸和丙二醛的含量与对照相比没有显著差异。由此推测SbPRP3可以提高转基因烟草的耐盐性和耐寒性。
大豆;脯氨酸富集蛋白;SbPRP3;表达分析;抗逆性
植物细胞壁的组成和结构在细胞发育及应对不良环境因子时会发生变化。这些变化包括细胞壁中多糖(例如纤维素、果胶和半纤维素)以及结构蛋白含量的改变[1]。结构蛋白含量占植物细胞壁干重的10%左右,这些蛋白主要分为5类:富含羟脯氨酸糖蛋白(hydroxyprolin-rich glycoproteins, HRGPs)、茄科凝集素(Solanaceous lectins)、阿拉伯半乳糖蛋白(arabinogalactan proteins, AGPs)、甘氨酸富集蛋白(glycine-rich proteins, GRPs)和脯氨酸富集蛋白(proline-rich proteins, PRPs)[2-3]。PRPs是一类广泛分布于植物中的富含脯氨酸和羟脯氨酸的蛋白质。自1985年首次在伤害诱导的萝卜中被发现后,目前已在大豆、棉花、小麦和玉米等多种植物中发现PRPs的存在[4-7]。
研究表明,PRPs基因的表达通常受病原菌侵染、激素、伤害、低温、干旱和高盐胁迫等因素的影响[2]。例如,伤害、高温、紫外线照射和干旱等都可以诱导菜豆脯氨酸富集蛋白基因PvSR1的表达[8];冷胁迫可以诱导棉花中GhHyPRP4的表达[6];低温可以诱导油菜BnPRP的表达,而高温、干旱和伤害则不影响其表达[9]。大豆中的2个PRPs基因,SbPRP和GmPRP均可被多种生物及非生物因子诱导上调表达,GmPRP可以提高转基因拟南芥的耐盐性[3,10-11]。相反,芝麻SiPRP和海岛棉GbHyPRP1则受病菌诱导后下调表达[12-13]。这些结果表明,PRPs在植物应对生物和非生物胁迫的反应中可能发挥重要作用。
从大豆中最早分离出的3个PRPs基因:SbPRP1、SbPRP2和SbPRP3[5,14]。其中,SbPRP1主要在成熟的下胚轴、根部和未成熟胚种皮中表达,SbPRP2主要在下胚轴顶端表达,而SbPRP3则主要在叶片中表达,表明这3个基因表达具有明显的发育阶段特异性和组织特异性。但有关这3个基因在逆境条件下的表达情况及在大豆抗逆中发挥的作用并未见报道。本实验对大豆SbPRP3基因在高盐、干旱和低温处理下的表达情况进行检测,并将其转化烟草进行抗性鉴定,为后续SbPRP3在抗逆育种中的应用提供理论依据。
1 材料与方法
1.1试验材料及处理
大豆(GlycinemaxL.)品种‘合丰46’由齐齐哈尔大学遗传实验室保存。将四叶期大豆幼苗置于含有200 mmol/L NaCl的MS培养液中进行高盐处理;置于含有20% PEG8000的MS培养液中进行模拟干旱处理;置于4 ℃培养箱中进行低温处理。分别处理0、1、2、5、10和24 h后取样,剪取叶片迅速置于液氮中,-80 ℃保存备用。
1.2方法
1.2.1总RNA提取与cDNA 合成采用Plant RNAzol试剂(鼎国公司)提取大豆不同处理时间点叶片的总RNA,按照cDNA第一链合成试剂盒(鼎国公司)说明书合成第一链cDNA,-20 ℃保存备用。
1.2.2实时荧光定量PCR分析根据SbPRP3基因序列(GenBank登录号J05209)设计荧光定量PCR引物YF(5′-GGCTTCCTTTGTATCCTTCCTA-3′)和 YR(5′-ATGGGTGTTGTCCTCTACTGG-3′)。在BIO-RAD CFX96 Real-Time PCR仪上,以大豆组成型表达基因β-Tubuin(GenBank登录号GMU12286)作为内参基因,引物为TF(5′-GGAAGGCTTTCTTGCATTGGTA-3′)和 TR(5′-AGTGGCATCCTGGTACTGC-3′),以大豆不同处理时间点叶片cDNA为模板。反应体系为2×SYBR Premix ExTaq(TaKaRa公司)10 μL、ROX Reference Dye Ⅱ 0.2 μL、cDNA 2 μL、正反向引物各 0.4 μL,双蒸水补至总体积20 μL。反应程序为95 ℃预变性10 s,95 ℃变性 20 s,58 ℃退火20 s,72 ℃延伸30 s,40个循环。各处理均做3次重复,计算基因的相对表达量。试验结果利用BIO-RAD CFX Manager软件进行数据分析。
1.2.3植物表达载体构建根据SbPRP3基因序列设计引物JF(5′-ACGCGTCGACATGGCTTCCTTTGTATCCTTCC-3′)和JR(5′-GGAATTCGCTTGCTTTAGGCATGGGTG-3′,下划线分别代表SalⅠ和EcoRⅠ酶切位点),从大豆叶片cDNA中扩增SbPRP3基因全长序列(退火温度59 ℃)。PCR产物经切胶回收后连接至pMD-18T载体上,送上海生工生物工程公司测序。测序正确后,将目的基因连接到pRI101-AN植物表达载体上。重组载体转化大肠杆菌DH5α,提取质粒,经质粒双酶切鉴定后采用冻融法转化根癌农杆菌EHA105。
1.2.4烟草转化用含有植物表达载体pRI101-SbPRP3的农杆菌菌液经叶盘法转化烟草NC89[15],MS培养基中卡那霉素筛选浓度为50 mg/L。以具有卡那霉素抗性的烟草转化幼苗叶片cDNA为模板,pRI101-SbPRP3质粒为阳性对照,非转基因烟草叶片cDNA为阴性对照,进行转基因植株的RT-PCR鉴定。单株收获T0代呈阳性植株的种子,将其继续在含有30 mg/L卡那霉素的MS培养基上进行抗性筛选,获得T1代抗性植株。继续对T1代抗性植株叶片进行RT-PCR检测,获得T1代阳性转基因植株。
1.2.5转基因烟草非生物胁迫处理选取T1代中RT-PCR目的条带最亮的转基因株系进行非生物胁迫抗性鉴定。将正常生长于花盆中6周龄野生型烟草和T1代转基因烟草用400 mmol/L NaCl水溶液浇透,处理5 h,进行盐胁迫处理;停止浇水10 d,进行干旱胁迫处理;烟草连同花盆一起置于4 ℃培养箱中12 h,进行冷胁迫处理。每个处理3次重复。脯氨酸含量测定采用Bates等[16]的方法。丙二醛含量测定采用Shao等[17]的方法。
2 结果与分析
2.1逆境胁迫下 SbPRP3基因表达分析
为研究SbPRP3在大豆逆境胁迫过程中的功能,通过实时荧光定量PCR检测大豆叶片中SbPRP3在高盐、干旱和低温处理下的表达情况。结果显示(图1),高盐处理后,SbPRP3表达量升高,在处理24 h达到最大值,是对照的12倍。PEG8000模拟干旱处理后,SbPRP3表达量在1 h迅速升高,是对照的13倍,之后又迅速下降并一直低于对照。低温处理后,SbPRP3表达量在1 h达到最高,是对照的35倍,之后逐渐降低,到24 h表达量已恢复到对照水平。
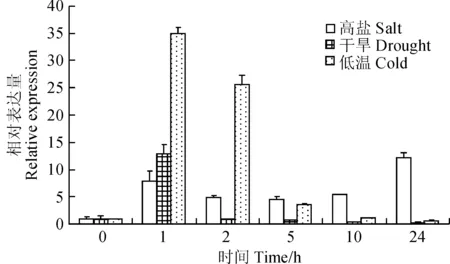
图1 SbPRP3在逆境处理下的表达Fig. 1 Expression of SbPRP3 with different stress treatments
2.2植物表达载体的构建
通过RT-PCR从大豆叶片中扩增出273 bp的SbPRP3基因全序列(图2)。将SbPRP3构建到植物表达载体pRI101-AN上,经质粒双酶切鉴定(图2),酶切条带与期望值一致,说明目的基因已整合进植物表达载体中。将阳性质粒转化农杆菌EHA105即获得转基因工程菌。
2.3转基因烟草的筛选
取无菌条件下培养的烟草叶片进行遗传转化。待抗性芽生长至1 cm左右时(图3,A),将其从愈伤组织中分离并转到生根培养基中。约4~5周抗性芽长出根系并逐渐成苗(图3,B、C)。经RT-PCR检测(图4),共获得SbPRP3阳性转基因烟草3株。
2.4转基因烟草耐盐性鉴定
脯氨酸测定结果显示(图5,A),正常条件下,野生型烟草和转基因烟草脯氨酸含量没有显著差别。当盐胁迫处理5 h时,野生型烟草和转基因烟草脯氨酸含量都明显升高,但转基因烟草脯氨酸含量极显著高于野生型烟草;丙二醛测定结果显示(图5,B),正常条件下,野生型烟草和转基因烟草丙二醛含量没有显著差别。当盐胁迫处理5 h时,野生型烟草和转基因烟草丙二醛含量都有所升高,但转基因烟草丙二醛含量显著低于野生型烟草。以上结果表明SbPRP3可以提高转基因烟草植株在高盐胁迫下脯氨酸的积累,降低丙二醛的产生,提高烟草耐盐性。
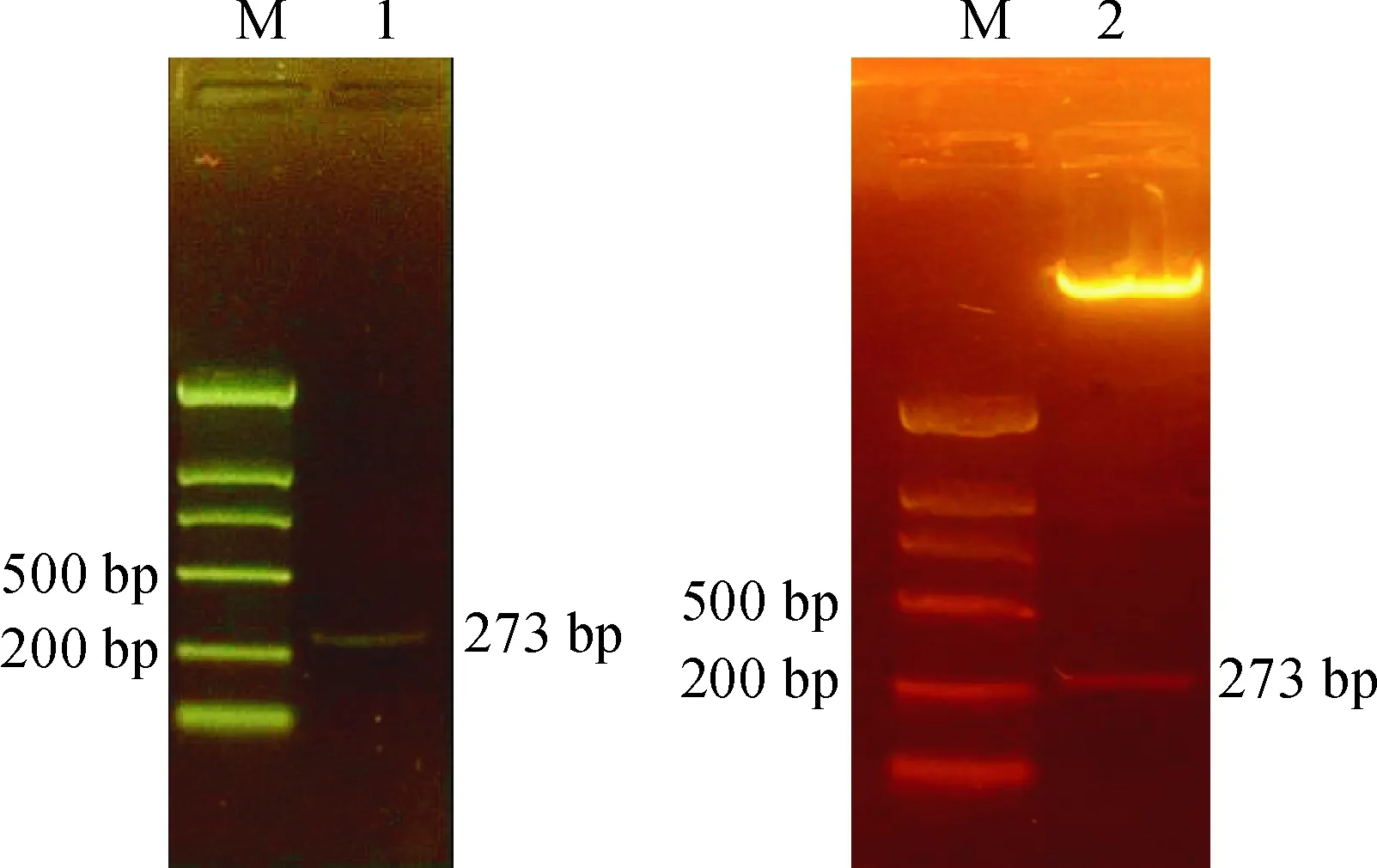
M. DL2000; 1. SbPRP3 PCR扩增产物; 2. SbPRP3质粒双酶切图2 SbPRP3 PCR扩增和质粒双酶切结果M. DL2000; 1. PCR products of SbPRP3; 2. Products of SbPRP3 plasmid double digestionFig. 2 PCR products and plasmid double digestion of SbPRP3

图3 SbPRP3转基因烟草植株筛选Fig. 3 Screening of SbPRP3 transgenic tobacco

M. DL2000; 1、5. 野生型烟草; 2~4. 转基因烟草; 6. 阳性质粒图4 SbPRP3转基因烟草的RT-PCR检测结果M. DL2000; 1,5. Wild type tobacco; 2-4. Transgenic tobacco; 6. Positive plasmidFig. 4 RT-PCR detection resu1ts of SbPRP3 transgenic tobacco
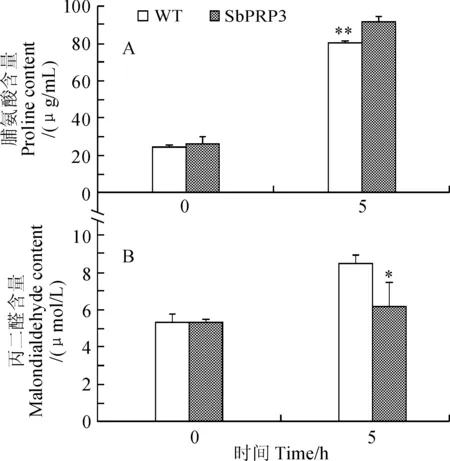
WT. 野生型烟草; **和*分别表示在1%和5%概率水平上差异显著; 下同图5 SbPRP3转基因烟草盐处理5 h的叶片脯氨酸和丙二醛含量WT. Wild type tobacco; ** and * indicate significant difference at P < 0.01 and P < 0.05 respectively; The same as belowFig. 5 Proline and malondialdehyde contents of SbPRP3 transgenic tobacco plants after salt treatment for 5 h
2.5转基因烟草耐旱性比较
脯氨酸测定结果显示(图6,A),当停止浇水10 d时,野生型烟草和转基因烟草脯氨酸含量都明显升高,转基因烟草脯氨酸含量与野生型烟草没有显著差异;丙二醛测定结果显示(图6,B),当停止浇水10 d时,野生型烟草和转基因烟草丙二醛含量都明显升高,转基因烟草丙二醛含量与野生型烟草没有显著差异。以上结果表明SbPRP3对转基因烟草耐旱性没有显著影响。
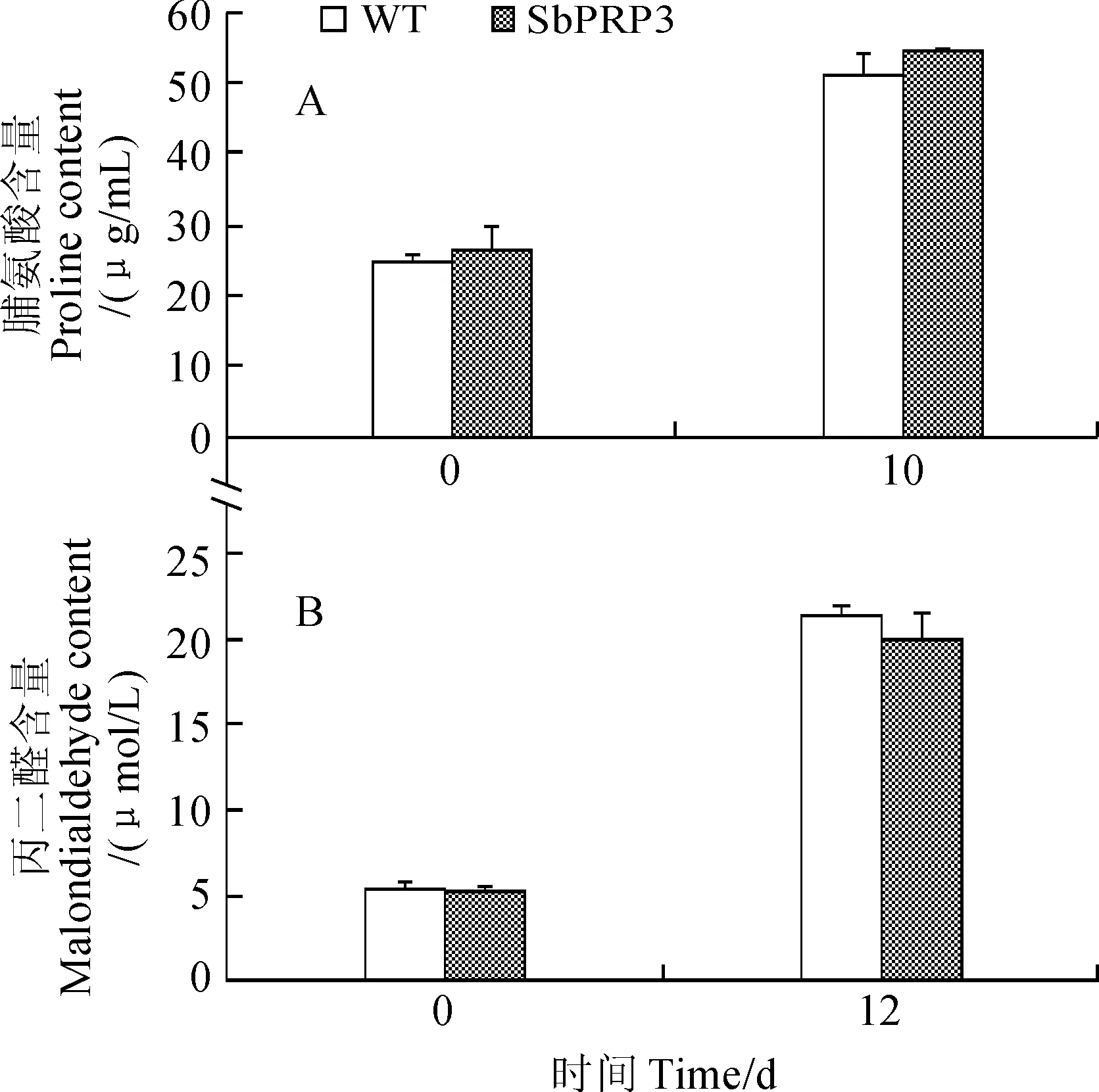
图6 SbPRP3转基因烟草干旱处理10 d的叶片脯氨酸和丙二醛含量Fig. 6 Proline and malondialdehyde contents of SbPRP3 transgenic tobacco plants after drought treatment for 10 d
2.6转基因烟草耐寒性比较
脯氨酸测定结果显示(图7,A),当低温胁迫处理12 h时,野生型烟草和转基因烟草脯氨酸含量都明显升高,但转基因烟草脯氨酸含量显著高于野生型烟草;丙二醛测定结果显示(图7,B),当低温胁迫处理12 h时,野生型烟草和转基因烟草丙二醛含量都有所升高,但转基因烟草丙二醛含量显著低于野生型烟草。以上结果表明SbPRP3可以提高转基因烟草植株在低温胁迫下脯氨酸的积累,降低丙二醛的产生,提高烟草耐寒性。
3 讨 论
植物细胞壁直接与外界接触,一旦植物遭受逆境时,首先需要细胞壁的一系列变化适应这些不利环境,因此可以预见植物细胞壁蛋白可能在植物抗逆中发挥重要作用。研究表明,PRPs基因的过量表达能够提高植物叶片的木质化程度,使细胞壁变厚,因而在细胞壁的建造和细胞的防御过程中发挥重要作用[18-19]。Deutch等认为,PRPs可能通过蛋白的双功能域在细胞壁和膜之间起牢固的连接作用,来确保细胞的完整性,从而提高植物抗性[9, 20]。例如,水稻细胞壁蛋白OsPRP3基因的超表达可以提高转基因水稻的抗冷性[21];木豆CcHyPRP基因在拟南芥中超表达可以提高拟南芥的对干旱、高盐和高温的抵抗能力[22]。相反,将拟南芥中编码HyPRP的EARLI1基因敲除后,突变植株的细胞在冷胁迫下更易受到破坏[23]。同样将拟南芥中的另一个编码PRP的SICKLE(SIC)基因敲除后,突变植株与正常拟南芥相比对冷和盐胁迫更加敏感[24]。
本研究对大豆中较早克隆的细胞壁脯氨酸富集蛋白基因SbPRP3进行逆境处理表达分析,结果显示高盐、干旱和低温处理均能不同程度地诱导SbPRP3的表达,但响应模式不完全一致。高盐处理24 h内SbPRP3的表达量一直升高,而干旱和低温处理后,SbPRP3的表达量先升高后降低。前人也有类似的研究结果,油菜BnPRP基因能够被低温诱导表达,而干旱、高温和伤害则不影响其表达[9]。拟南芥中的PRP4、PRP11和PRP16能够被线虫感染诱导表达,而PRP9和PRP10则能够被假单胞菌侵染所诱导[25]。大豆SbPRP基因能够被干旱和盐胁迫诱导表达,而脱落酸、激动素和茉莉酸甲酯则抑制其表达[10]。由此推测SbPRP3可能在大豆应对不同的胁迫过程中发挥不同的作用。
鉴于SbPRP3可能在大豆应对非生物胁迫时发挥功能,我们将其导入烟草中并对相关逆境生理指标进行检测。保持水分、维持渗透调节、降低植株细胞膜损伤是植物抵抗非生物胁迫的几个关键因素。本研究表明SbPRP3在转基因烟草中通过提高渗透调节物质脯氨酸的含量以及降低细胞膜的损伤可以提高转基因烟草的耐盐性和耐寒性,但对转基因烟草的耐旱性没有显著影响。这可能与SbPRP3对不同胁迫的响应模式不一致有关,因为模拟干旱处理后,SbPRP3的表达量仅在1 h时高于对照,之后一直低于对照。正如前人所说,某些条件下胁迫基因表达水平的上调可能不足以提高对胁迫的抗性[26]。本研究结果为进一步深入探讨大豆细胞壁结构蛋白中脯氨酸富集蛋白的抗逆机制及应用奠定了良好基础。
[1]VAMER J E, LIN L S. Plant cell wall architecture[J].Cell, 1989, 56(2): 231-239.
[2]韩青, 陈瑞, 杨野, 等. 植物富含脯氨酸蛋白的研究进展[J]. 植物生理学报, 2015, 51(8): 1 179-1 184.
HAN Q, CHEN R, YANG Y,etal. Progress on plant proline-rich protein[J].PlantPhysiologyJournal, 2015, 51(8): 1 179-1 184.
[3]翟莹, 张军, 陈阳, 等. 大豆GmPRP转基因拟南芥抗盐性鉴定[J]. 大豆科学, 2015, 34(2): 345-348.
ZHAI Y, ZHANG J, CHEN Y,etal. Salt tolerance identification of soybeanGmPRPtransgenicArabidopsis[J].SoybeanScience, 2015, 34(2): 345-348.
[4]CHEN J, VAMER J E. Isolation and characterization of cDNA clones for carrot extensin and a proline-rich 33-kDa protein[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1985, 82(13): 4 399-4 403.
[5]HONG J C, NAGAO R T, KEY J L. Characterization of a proline-rich cell wall protein gene family of soybean[J].TheJournalofBiologicalChemistry, 1990, 265(5): 2 470-2 475.
[6]HUANG G, GONG S, XU W,etal.GhHyPRP4, a cotton gene encoding putative hybrid proline-rich protein, is preferentially expressed in leaves and involved in plant response to cold stress[J].ActaBiochimicaetBiophysicaSinica, 2011, 43(7): 519-527.
[7]VIGNOLS F, JOSE-ESTANYOL M, CAPARROS-RUIZ D,etal. Involvement of a maize proline-rich protein in secondary cell wall formation as deduced from its specific mRNA localization[J].PlantMolecularBiology, 1999, 39(5): 945-952.
[8]柴团耀, 张玉秀. 菜豆富含脯氨酸蛋白质基因在生物和非生物胁迫下的表达[J]. 植物学报, 1999, 41(1): 111-113.
CHAI T Y, ZHANG Y X. Gene expression analysis of a proline-rich protein from bean under biotic and abiotic stress[J].ActaBotanicaSinica, 1999, 41(1): 111-113.
[9]GOODWIN W, PALLAS J A, JENKINS G I. Transcripts of a gene encoding a putative cell wall-plasma membrane link er protein are specifically cold-induced inBrassicanapus[J].PlantMolecularBiology, 1996, 31(4):771-781.
[10]HE C Y, ZHANG J S, CHEN S Y. A soybean gene encoding a proline rich protein is regulated by salicylic acid, an endogenous circadian rhythm and by various stresses[J].TheoreticalandAppliedGenetics, 2002, 104(617): 1 125-1 131.
[11]翟莹, 雷婷婷, 闫帆, 等. 大豆逆境诱导基因GmPRP的克隆与表达[J]. 作物学报, 2011, 37(12): 2 152-2 157.
ZHAI Y, LEI T T, YAN F,etal. Cloning and expression of a stress-inducedGmPRPgene in soybean (Glycinemax)[J].ActaAgronomicaSinica, 2011, 37(12): 2 152-2 157.
[12]吕高强, 吴向阳, 王心宇. 芝麻中一个富含脯氨酸新基因的克隆与特征分析[J]. 作物学报, 2015, 41(12): 1 810-1 818.
LÜ G Q, WU X Y, WANG X Y. Cloning and characterization of a novel gene encoding proline-rich protein in sesame[J].ActaAgronomicaSinica, 2015, 41(12): 1 810-1 818.
[13]杨君, 张艳, 王伟巧, 等. 海岛棉GbHyPRP1克隆及其转基因拟南芥抗黄萎病验证[J]. 植物遗传资源学报, 2015, 16(3): 594-602.
YANG J, ZHANG Y, WANG W Q,etal. Cloning ofGbHyPRP1 fromGossypiumbarbadenseand validation of verticillium wilt resistance in transgenicArabidopsis[J].JournalofPlantGeneticResources, 2015, 16(3): 594-602.
[14]HONG J C, NAGAO R T, KEY J L. Characterization and sequence analysis of a developmentally regulated putative cell wall protein gene isolated from soybean[J].JournalofBiologicalChemistry, 1987, 262(17): 8 367-8 376.
[15]HOEKEMA A, HIRSCH P R, HOOYKAAS P J,etal. A binary plant vector strategy based on separation of vir- and T-region of theAgrobacteriumtumefaciens Ti-plasmid[J].Nature, 1983, 303(5 913): 179-180.
[16]BATES L S, WALDREN R P, TEARE I D. Rapid determination of free proline for water stress studies[J].PlantandSoil, 1973, 39(39): 205-207.
[17]SHAO H B, LIANG Z S, SHAO M A. Osmotic regulation of 10 wheat (TriticumaestivumL.) genotypes at soil water deficits[J].Colloids&SurfacesBBiointerfaces, 2006, 47(2): 132-139.
[18]BRADLEY D J, KJELLBOM P, LAMB C J. Elicitor-and wound-induced oxidative cross-linking of a proline-rich plant cell wall protein: a novel, rapid defense response[J].Cell, 1992, 70(1): 21-30.
[19]BRISSON L F, TENHAKEN R, LAMB C. Function of oxidative cross-Linking of cell wall structural proteins in plant disease resistance[J].ThePlantCell, 1994, 6(12): 1 703-1 702.
[20]DEUTCH C E, WINICOV I. Post-transcriptional regulation of a salt inducible alfalfa gene encoding a putative chimeric proline-rich cell wall protein[J].PlantMolecularBiology, 1995, 27(2): 411-418.
[21]GOTHANDAM K M, NALINI E, KARTHIKEYAN S,etal.OsPRP3, a flower specific proline-rich protein of rice, determines extracellular matrix structure of floral organs and its overexpression confers cold-tolerance[J].PlantMolecularBiology, 2010, 72(1): 125-135.
[22]PRIYANKA B, SEKHAR K, SUNITA T,etal. Characterization of expressed sequence tags (ESTs) of pigeonpea (CajanuscajanL.) and functional validation of selected genes for abiotic stress tolerance inArabidopsisthaliana[J].MolecularGeneticsandGenomics, 2010, 283(3): 273-287.
[23]ZHANG Y, SCHLAPPI M. Cold responsive EARLI1 type HyPRPs improve freezing survival of yeast cells and form higher order complexes in plants[J].Planta, 2007, 227(1): 233-243.
[24]ZHAN X, WANG B, LI H,etal.Arabidopsisproline-rich protein important for development and abiotic stress tolerance is involved in microRNA biogenesis[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2012, 109(44): 18 198-18 203.
[25]SHOWALTER A M, KEPPLER B D, LICHTENBERG J,etal. A bioinformatics approach to the identification, classification, and analysis of hydroxyproline-rich glycoproteins[J].PlantPhysiology, 2010, 153(2): 485-513.
[26]KIM K N, CHEONG Y H, GRANT J J,etal. CIPK3, a calcium sensor-associated protein kinase that regulates abscisic acid and cold signal transduction inArabidopsis[J].ThePlantCell, 2003,15(2): 411-423.
(编辑:宋亚珍)
Expression ofSbPRP3 in Soybean and Resistance Ability in Transgenic Tobacco to Abiotic Stress
ZHAI Ying1, ZHANG Jun2, YANG Xiaojie1, ZHAO Yan1, CHEN Yang1
(1 College of Life Science and Agro-Forestry, Qiqihar Univesity, Qiqihar, Heilongjiang 161006, China; 2 Heilongjiang Institute of Veterinary Science, Qiqihar, Heilongjiang 161005, China)
Plant proline-rich proteins (PRPs) are putative cell wall proteins, which are usually associated with different abiotic stresses. The expression ofSbPRP3 under abiotic stress treatments in soybean was detected by real-time fluorescence quantitative PCR. The expression ofSbPRP3 increased under salt treatment, while it increased firstly and thereafter declined under drought and cold treatments. Furthermore,the ORF ofSbPRP3 was cloned into the plant expression vector of pRI101-AN and then introduced into tobacco by Agrobacterium-mediated transformation. Three positive transgenic tobacco plants were obtained. The transgenic tobacco plants were treated with salt, drought and cold stresses. The results showed that the transgenic plants maintained higher levels of proline and lower level of malondialdehyde compared to wild-type plants under salt and cold stresses. While the levels of proline and malondialdehyde in transgenic plants had no significant differences compared to wild-type plants under drought stress. These data indicated that the transgenic tobacco plants constitutively expressingSbPRP3 showed an increased tolerance to salt and cold compared to wild-type plants.
soybean; proline-rich protein;SbPRP3; expression analysis; stress tolerance
1000-4025(2016)07-1331-06
10.7606/j.issn.1000-4025.2016.07.1331
2016-04-04;修改稿收到日期:2016-05-16
黑龙江省教育厅科学技术研究项目(12541889)
翟莹(1982-),女,博士,讲师,主要从事大豆分子育种研究。E-mail:fairy39809079@126.com
Q785;Q786
A

