马铃薯X病毒荧光定量PCR检测体系的建立及应用
尚晓楠, 吴蓓蕾
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
马铃薯X病毒荧光定量PCR检测体系的建立及应用
尚晓楠,吴蓓蕾*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京100193)
马铃薯X病毒(Potato virus X,PVX)是危害茄科作物的一种重要病毒,为了建立特异性检测PVX的实时荧光定量PCR体系,本研究以PVX-1985分离物中外壳蛋白(coatprotein,CP)基因序列为模板,设计引物构建重组质粒并选择扩增效率高、特异性强的引物成功构建出标准曲线。利用建立的体系,成功检测到以含pCaPVX440侵染性克隆载体的农杆菌C58C1接种后的本氏烟(Nicotiana benthamiana)中PVX病毒RNA的拷贝数。
马铃薯X病毒;荧光定量PCR;本氏烟
马铃薯X病毒(Potato virus X,PVX)属于甲型线形病毒科(Alphaflexiviridae)马铃薯X病毒属(Potexvirus)[1],主要侵染茄科作物,如马铃薯、烟草和番茄等。PVX主要通过汁液摩擦传播[2],单独侵染引起症状较轻,而与马铃薯Y病毒(Potato virus Y,PVY)、马铃薯S病毒(Potato virus S,PVS)、烟草蚀纹病毒(Tobacco etch virus,TEV)和烟草脉斑病毒(Tobacco vein mottling virus,TVMV)等马铃薯Y病毒属成员复合侵染时造成更严重的危害[35]。目前,用于检测PVX病毒的方法主要有血清学检测[68]、生物学检测和分子生物学检测如核酸分子杂交(nucleicacidhybridization)技术、反转录聚合酶链式反应(reversetranscriptionpolymerasechainreaction)技术和实时荧光定量PCR(real-timefluorescentquantitativePCR)技术等[910]。与实时荧光定量PCR技术相比,其他方法都存在耗时长、灵敏度低和不能对病毒进行定量检测等缺点。实时荧光定量PCR技术具有特异性强、灵敏度高,同时可以对样本进行实时快速定量检测等优点[11]。本研究建立了PVX实时荧光定量PCR检测体系,有助于检测以侵染性克隆为基础的PVX在单一寄主或多个寄主中连续接种多代后病毒RNA拷贝数的变化趋势,从而有助于分析以侵染性克隆为基础的PVX在单一寄主或多寄主侵染循环中的进化特点。另一方面,为监测预警PVX引起的病害提供技术手段。
1 材料与方法
1.1材料
供试材料:质粒pCaPVX440含有完整PVX外壳蛋白(coatprotein,CP)基因,来自PVX-1985分离物,由山东农业大学李向东教授馈赠,用于构建实时荧光定量PCR的标准品,同时由本实验室转化至农杆菌C58C1感受态中持续活化保存;本氏烟(Nicotiana benthamiana)由本实验室长期种植保存,经含质粒pCaPVX440的农杆菌C58C1接种后,用于验证所构建体系的可行性。
供试试剂:Wizard®SVGelandPCRClean-UpSystem和pGEM-TEasy试剂盒购于Promega公司;感受态Trans 109 E. coli购于Transgene公司;AxyPrepPlasmidMiniprepKit购于Axygen公司;SuperReal荧光定量预混试剂增强版(SYBRGreen)和FastQuantRTKit(withgDase)购自天根生化科技有限公司;TRIzol购于Invitrogen公司;TaKaRaTaqTM,dNTPs,10×PCRbuffer(Mg2+plus),DL2000DNAmarker,DL500DNAmarker购自TaKaRa公司。
1.2引物设计与合成
根据GenBank中的PVX-1985分离物中PVXCP基因的序列(登录号:EU571480),集合世界已公布的63个PVX-cp基因,利用MEGA5.0分析该分离物CP核酸序列与NCBI中PVX其他分离物的CP序列的相似性,结果显示与亚洲、澳洲、部分欧洲分离物的核酸序列相似性为94.1%~100%,与美洲、部分欧洲分离物的核酸相似性为74.7%~76.1%。利用PrimerPremier3.0软件设计引物PVX-F和PVX-R,用于普通PCR检测。同时,设计1对用于构建阳性质粒(实时荧光定量PCR的标准品)的引物BZP5和BZP3,在2个引物之间设计引物PVX-F1与PVX-R1用于荧光定量检测PVX。引物均由上海生工生物工程(股份)有限公司合成。引物序列和扩增片段长度见表1。
1.3实时荧光定量方法的建立
1.3.1PVX片段的克隆和测序及重组质粒制备
以pCaPVX440质粒为模板,BZP5和BZP3为引物,扩增PVX部分片段。目的片段长度为653bp。在梯度PCR仪(Eppendorf)上设定程序为:94℃ 5min;94℃ 45s, 62℃ 90s, 72℃ 90s,30个循环;最后72℃ 10min。经1%琼脂糖电泳检测后利用Wizard®SVGelandPCRClean-UpSystem(Promega)试剂盒回收PCR产物并与pGEM-TEasy(Promega)载体连接,将连接产物转化到感受态Trans 109 E. coli(Transgene),经测序确定阳性克隆,用AxyPrepPlasmidMiniprepKit(Axygen)提取阳性重组质粒。
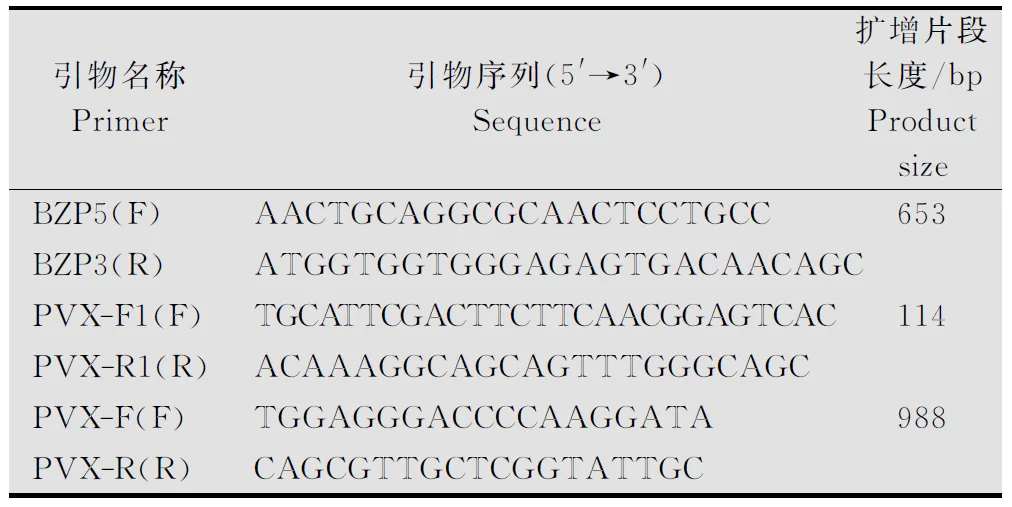
表1 检测PVX的引物1)
1)F:上游引物;R:下游引物。
F:Forwardprimer;R:Reverseprimer.
1.3.2PVX 实时荧光定量PCR标准曲线的制作
经NanoDrop-2000分光光度计测定,阳性质粒浓度为140ng/μL,该重组质粒的大小为3 668bp,根据公式:A=(B×6.022×1023)/(C×650×109)[其中A为拷贝数/μL,B为质粒浓度,C为重组质粒长度]计算出拷贝数为3.54×1010/μL,将计算出的拷贝数转换成2×108拷贝/3μL,再进行10倍梯度稀释,得到2×104~2×108拷贝/3μL的重组质粒,保存在-70℃,作为标准品使用。
以2×104~2×108拷贝/3μL的重组质粒DNA为模板,利用SuperReal荧光定量预混试剂增强版(SYBRGreen)试剂盒进行PCR反应,共5个梯度,每个梯度3个重复。以RNase-free超纯水为空白对照。总反应体系20μL:DNA/cDNA模板3μL,正向引物(10μmol/L)0.6μL,反向引物(10μmol/L)0.6μL,2×SuperRealPremixPlus10μL,50×ROXReferenceDye0.4μL,RNase-free超纯水 5.4μL。体系配好之后在7500RealTimePCR仪器(AppliedBiosystems)上运行。反应程序:95℃预变性15min; 95℃ 10s,60℃ 32s,72℃ 32s,40个循环;之后进入溶解曲线阶段95℃ 15s,60℃ 1min,95℃ 30s,60℃ 15s。反应结束后,系统会自动生成标准曲线,计算出标准曲线的斜率(slope)和引物的扩增效率。Efficiency(%)=(10(-1/slope)-1)×100。
1.4利用实时荧光定量PCR体系定量检测本氏烟草中的PVX的 RNA拷贝数
用悬浮溶液(10mmol/LMgCl2,10mmol/LMES(pH=5.6),0.1mmol/L乙酰丁香酮)悬浮含pCaPVX440侵染性克隆载体的农杆菌C58C1菌体,调整浓度使其A600为0.5左右,28℃静置3h。选取本氏烟植株(5~6周龄)的第4~6片真叶,取不含针头的5mL一次性注射器吸取菌液进行注射接种15株本氏烟(N. benthamiana)[12],同时,吸取悬浮液进行注射作为阴性对照,观察植株发病症状,采集发病症状明显的植株、健康植株和阴性对照植株提取RNA(参照TRIzol试剂的说明书)。提取的RNA用1%琼脂糖电泳检测其完整性,NanoDrop-2000分光光度计检测其纯度。
利用FastQuantRTKit(withgDase)反转录1μgRNA得到cDNA第一条链。以PVX-F1与PVX-R1为引物,以2×104~2×108拷贝/3μL的重组质粒DNA为模板,利用建立的PVX实时荧光定量PCR体系定量检测本氏烟草中的PVX的RNA拷贝数。
2 结果与分析
2.1PVX片段的克隆和重组质粒测序
以pCaPVX440质粒为模板,BZP5和BZP3为引物扩增,1%琼脂糖凝胶电泳结果显示,特异的扩增片段约为653bp(图1a)。回收产物与pGEM-TEasy载体的连接产物转入大肠杆菌感受态Trans 109 E. coli,PCR检测得到阳性克隆(图1b),最终选取4个阳性克隆摇菌提取质粒,经测序鉴定插入序列,通过VectorNT10.0软件将测序结果与PVX-1985分离物CP序列(EU571480)比对,序列一致性达到100%,说明PVXCP基因的部分片段已经成功插入克隆载体。选取质粒浓度为140ng/μL,A260/A280为1.80的重组质粒作为标准质粒。
2.2PVX实时荧光定量PCR标准曲线的建立
分别以2×104~2×108拷贝/3μL的重组质粒为模板,采用引物PVX-F1与PVX-R1扩增,每个模板3个重复,建立PVX荧光定量PCR的标准曲线。图2a为建立的荧光定量PCR标准曲线,扩增效率为109.39%,决定系数R2为0.999,Ct值与标准品浓度的对数之间存在很好的线性关系。图2b是2%琼脂糖凝胶电泳检测荧光定量PCR的产物,目的条带单一,即引物扩增特异性好。
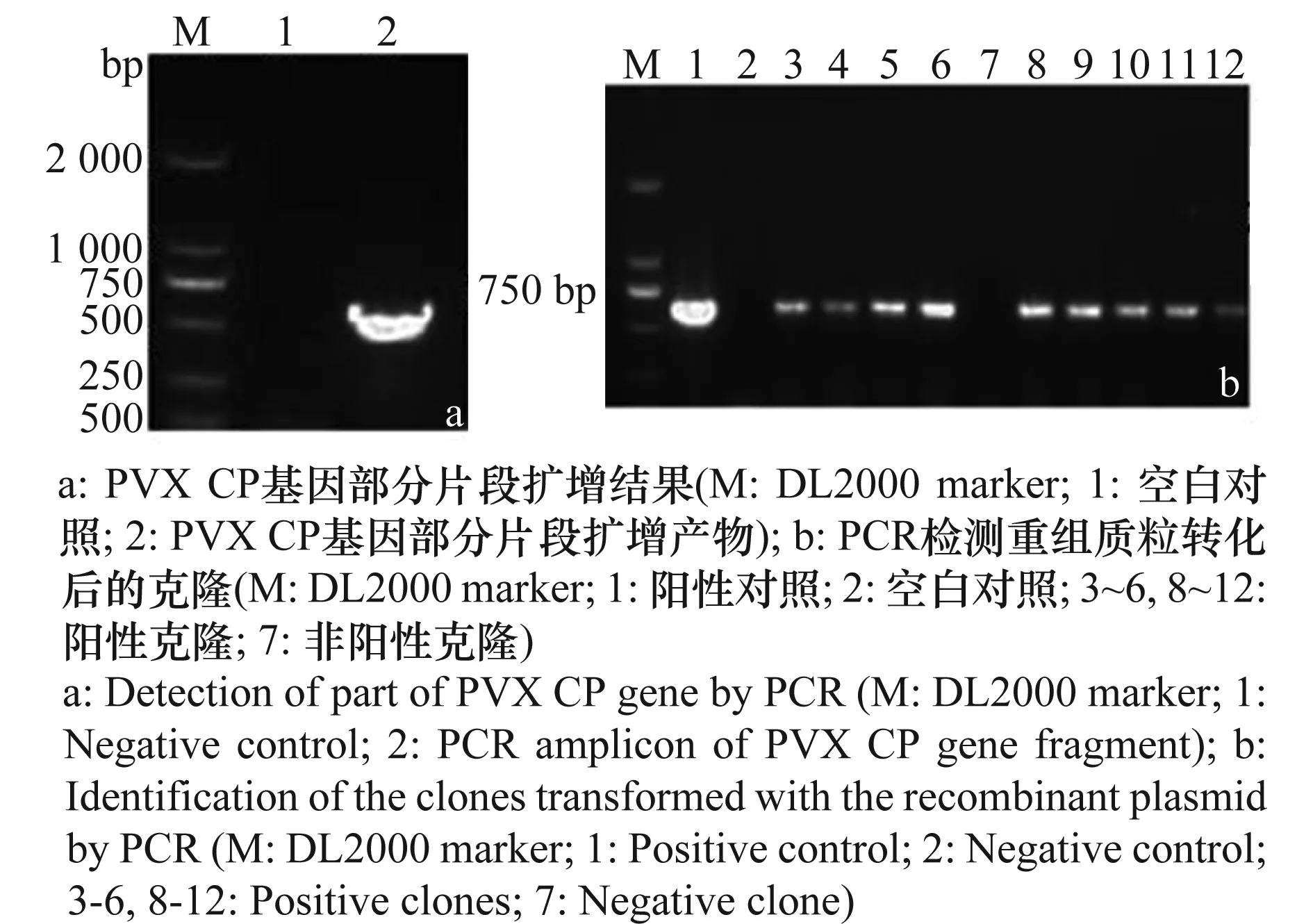
图1 重组质粒的检测结果Fig.1 Detection of the recombinant plasmid
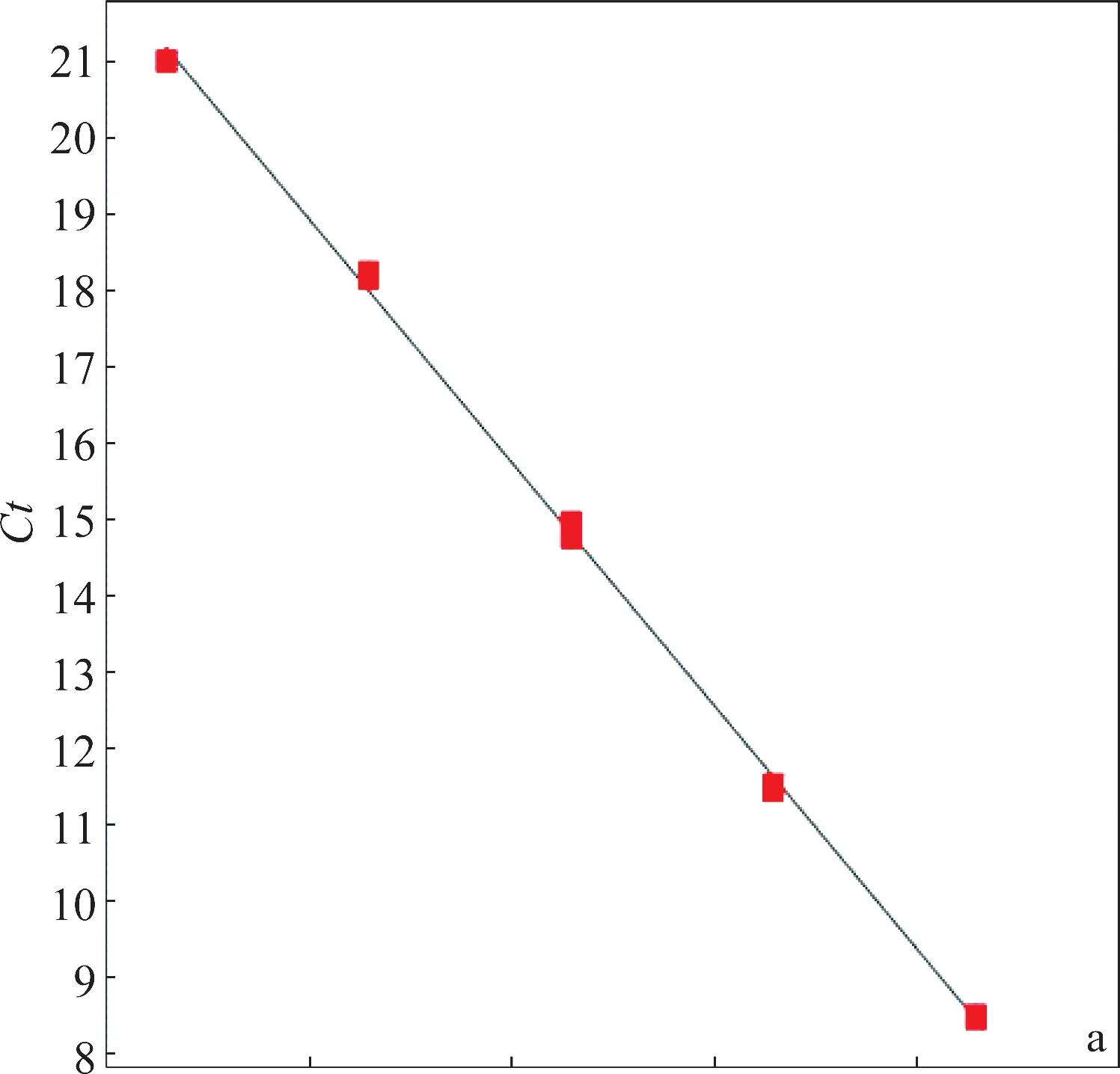



图2 PVX荧光定量PCR标准曲线的建立Fig.2 Establishment of the real time quantitative PCR standard curve of PVX
2.3PVX实时荧光定量PCR定量方法的应用
2.3.1经农杆菌接种的本氏烟中PVX的普通RT-PCR检测
接种14d后,在本氏烟植株顶端叶片出现花叶症状,如图3a。选取发病症状明显的植株6株、健康植株和阴性对照植株共计8株提取RNA,图3b为经农杆菌接种的本氏烟RNA电泳图。供试的每个样品的RNA均为3条带即28S、18S和5S,说明RNA完整性很好。利用FastQuantRTKit反转录1μgRNA得到cDNA第一条链。以cDNA为模板,使用引物PVX-F和PVX-R进行PCR扩增,扩增结果见图3c。由图可知,每株发病植株均检测到PVX。
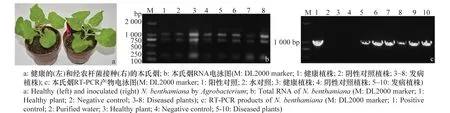
图3 经农杆菌接种的本氏烟中PVX的普通RT-PCR检测Fig.3 Detection of PVX in Nicotiana benthamiana inoculated by Agrobacterium by RT-PCR
2.3.2检测发病本氏烟中PVX的RNA拷贝数
以拷贝数为2×104~2×108的标准质粒和6株发病明显植株的cDNA为模板,使用引物PVX-F1与PVX-R1,在同一反应条件下进行荧光定量PCR。系统会自动生成标准曲线和计算出每个待测样品(RNA含量为1μg)中PVX的RNA拷贝数(表2),扩增效率为106.359%,决定系数R2为0.999,标准曲线方程为:y=-3.178x+34.848。由表中数据看出,每个样品都落在了标准曲线范围内。

表2 RNA含量为1 μg时本氏烟中PVX的RNA拷贝数
3 讨论
目前已有超过40种病毒可以侵染马铃薯,其中危害严重而且常见的主要有PVX、PVS、PVY、PLRV等[13]。检测PVX的分子生物学技术大多为RT-PCR[9]和核酸斑点杂交(nucleicacidspothybridization,NASH)[14]等。这些方法只是定性检测PVX,而且存在假阳性现象,为了可以定量检测PVX,本试验以PVXCP基因保守区域序列设计引物,建立了荧光定量PCR体系。由于PVX-1985与亚洲、澳洲、部分欧洲分离物的核酸序列相似性为94.1%~100%,该方法可以实时、高灵敏度地检测样品中病毒RNA的拷贝数, 并对我国的样品具有较为广泛的适用性。
目前世界上只获得了17个PVX分离物的基因组全序列,分别来自中国、日本、韩国、伊朗、俄罗斯、英国、荷兰、南美和阿根廷。其中包含3个中国分离物,PVX-1985 (EU571480)、FX21 (EF423572)和Taiwan(AF272736)。世界上的PVX包含4个株系,集合17个PVX分离物的系统进化分析发现PVX群体分为两大类群,一个来自欧亚群体,另一个来自美洲群体。它们的寄主分别有马铃薯、烟草、千日红等。PVX-1985的基因组全序列与欧洲和亚洲其他分离物的核苷酸相似性在94.2%以上,氨基酸相似性在97.1%以上,而与美洲分离物的核苷酸相似性为80.2%,氨基酸相似性为90.3%[15]。但以侵染性克隆为基础,该病毒在单个或多个寄主中侵染循环的进化特点仍是研究空白。本试验建立的PVX实时荧光定量PCR体系可以定量检测到PVX的RNA拷贝数,为研究该病毒在单一寄主或多个寄主侵染循环中的进化特点奠定基础,具有实用价值。
[1]AdamsMJ,AntoniwJF,FauquetCM.MolecularcriteriaforgenusandspeciesdiscriminationwithinthefamilyPotyviridae[J].ArchivesofVirology, 2005, 150(3):459479.
[2]HarrisonBD.Advancesingeminivirusresearch[J].AnnualReviewofPhytopathology, 1985, 23(1):5582.
[3]BanceVB.ReplicationofPotato virus XRNAisalteredincoinfectionswithPotato virus Y [J].Virology, 1991, 182(2):486494.
[4]JamalA,NasirIA,TabassumB,etal,MolecularcharacterizationofcapsidproteingeneofPotato virus XfromPakistan[J].AfricanJournalofBiotechnology, 2012,11(74):1385413857.
[5]NyalugweEP,WilsonCR,CouttsBA,etal.BiologicalpropertiesofPotato virus Xinpotato:EffectsofmixedinfectionwithPotato virus Sandresistancephenotypesincultivarsfromthreecontinents[J].PlantDisease,2012, 96:4354.
[6]AwasthiLP,SinghSP,ChaubeyAN,etal.MolecularcharacterizationofpotatovirusesthroughRT-PCRandelectron-microscopy[J].CaribbeanJournalofScienceandTechnology, 2014, 2:405410.
[7]NosheenQ,HameedS,MughalSM,etal.SerologicalidentityofPotato virus X (PVX)andPCRcharacterizationofitscoatprotein(CP)gene[J].InternationalJournalofPlantPathology,2013, 2(2):9296.
[8]朱国春, 朱国庆. 用DTBA方法检测马铃薯病毒[J]. 中国马铃薯, 2000, 14(1):5960.
[9]吴兴泉, 陈士华, 谢联辉. 马铃薯X病毒的分子鉴定与检测技术[J]. 河南农业科学, 2006(2):7275.
[10]袁青, 殷幼平, 王中康. 马铃薯病毒病分子检测技术研究进展[J]. 中国马铃薯, 2003, 17(1):3336.
[11]AryaM,ShergillIS,WilliamsonM,etal.Basicprinciplesofreal-timequantitativePCR[J].ExpertReviewofMolecularDiagnostics,2005, 5(2):209219.
[12]JiaHongge,PangYongqi,FangRongxiang.Agroinoculationasasimplewaytodeliveratobaccomosaicvirus-basedexpressionvector[J].ActaBotanicaSinica, 2003, 45(7):770773.
[13]GrammatikakiG,AvgelisA,SonninoA.BehaviorofpotatogametoclonalplantsagainstthenecroticstrainofpotatoYpotyvirus[J].RussianJournalofPlantPhysiology, 2007, 54(4):507512.
[14]RobertsIM,HarrisonBD.Detectionofpotatoleafrollandpotatomop-topvirusesbyimmunosorbentelectronmicroscopy[J].AnnalsofAppliedBiology, 1979, 93(3):289297.
[15]YuXiaoqing,JiaJinlei,ZhangChengling,etal.Phylogeneticanalysesofanisolateobtainedfrompotatoin1985revealedPotato virus XwasintroducedtoChinaviamultipleevents[J].VirusGenes, 2010, 40(3):447451.
(责任编辑:杨明丽)
Developmentandapplicationofareal-timequantitativePCRsystemfordetectionofPotato virus X
ShangXiaonan,WuBeilei
(StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
Potato virus X (PVX)isanimportantvirusinfectingmanysolanaceouscrops.Inordertodevelopareal-timequantitativePCRsystemforspecificdetectionofPVX,thestandardcurvewasestablishedsuccessfullybasedontherecombinantplasmidandhighefficientandspecificprimersderivedfromcoatproteingenesequenceofPVX-1985isolate.WesuccessfullydetectedthecopyquantityofRNAfromPVXintheNicotiana benthamianawhichinjectedbytheAgrobacteriumC58C1containingpCaPVX440plasmid.
Potato virus X(PVX);real-timequantitativePCR;Nicotiana benthamiana
20150319
20150514
中国农业科学院科技创新工程(2014)
E-mail:blwu@ippcaas.cn
S432.41;S532
ADOI:10.3969/j.issn.05291542.2016.03.029

