内蒙古和黑龙江的核盘菌菌丝融合群分化及致病性研究
刘春来, 王 爽, 夏吉星, 杨 帆, 李新民, 孟庆林, 刘 宇, 苏宝华, 张匀华
(黑龙江省农业科学院植物保护研究所, 哈尔滨 150086)
内蒙古和黑龙江的核盘菌菌丝融合群分化及致病性研究
刘春来,王爽,夏吉星,杨帆,李新民, 孟庆林,刘宇,苏宝华,张匀华*
(黑龙江省农业科学院植物保护研究所, 哈尔滨150086)
为明确核盘菌的遗传多样性,对采自内蒙古和黑龙江不同地区的44株核盘菌进行了菌丝融合群确定,并比较了不同菌丝融合群间菌丝生长速度、致病力、草酸和总酸产量的差异。结果表明:供试44个菌株分为25个融合群,其中有14个融合群仅由单一菌株组成,所占比例为56.0%。菌丝融合群内和菌丝融合群间菌丝生长速度、致病力、草酸和总酸产量都表现出显著差异(P <0.001),并与菌株的地理来源无关。相关分析表明核盘菌菌株的致病力与菌株草酸产量呈正相关(r=0.484, P ≤0.01),与pH呈负相关(r =-0.580, P ≤0.01),与菌株的生长速度无关;草酸产量与pH高低(表示总酸的分泌量)负相关(r=-0.392, P ≤0.01),进一步表明核盘菌菌株产生的总酸中草酸量占了很大的比例。
核盘菌;草酸;致病性;生长速度
核盘菌[Sclerotinia sclerotiorum (Lib.)deBary]是一种具有广泛寄主范围和地理分布的病原菌。它至少能够引起75个科、278个属和408个种及42个变种或亚种的植物发生病害,其中包括许多重要的蔬菜和经济作物[1]。该菌的生活周期中90%是以菌核的形式在土壤中度过的,菌丝体和子囊孢子出现的时间都较为短暂,由于菌核抗逆性很强,使得核盘菌成为一种较难防治的病原菌[2]。
菌丝融合群(myceliacompatibilitygroups,MCGs) 检测是通过真菌多位点基因控制的自我或非自我识别分类系统,是一种基于宏观和表型的研究[3]。Kohn等鉴定了田间作物核盘菌的克隆种群并表明几个克隆种群可侵染同一田块[4]。MCGs是检测克隆种群的标准方法之一,当配对培养时,同一个菌丝融合群的所有菌株能够融合形成一个均匀一致的菌落,无反应线产生。同时,这些菌株也共有唯一的DNA指纹图谱[3,5]。目前,菌丝亲和性已被证明是研究核盘菌群体结构及遗传多样性的有效方法并得到了广泛的应用[610]。
草酸(OA)被认为是核盘菌致病的一种重要的决定性因素[11]。目前,研究的热点也主要集中于核盘菌产生草酸的量及草酸参与发病机制的作用机理:(1)降低了被侵染组织的pH水平,增强了病菌分泌的胞外酶的活性[12];(2)草酸根阴离子螯合了细胞壁Ca2+,软化了植物细胞壁并削弱了以Ca2+为基础的防御反应功能[12];(3)对寄主植物产生直接的毒害作用,弱化了植物,有利于病原菌入侵[13];(4)抑制了寄主植物活性氧迸发[14]。所以,草酸在核盘菌的致病过程研究中起到了非常重要的作用。
研究确定不同融合群与主要致病因子之一草酸之间的联系,将为核盘菌病害的防治提供理论依据。本研究的主要目的是确定来自内蒙古和黑龙江不同地区的44株核盘菌的菌丝融合群,并综合比较不同融合群间致病性差异与菌株致病力、菌丝生长速度、草酸和总酸产量间的关系,分析这些因子与致病性的相关关系。
1 材料与方法
1.1供试菌株
研究所用44株核盘菌(S.sclerotiorum)菌株主要来源于内蒙古阿荣旗孤山镇和黑龙江省不同地区(包括哈尔滨、齐齐哈尔、牡丹江、佳木斯、大庆、绥化、黑河、双鸭山、鹤岗等地区),分离菌株的寄主植物主要为向日葵、大豆、红小豆和菜豆(见表1)。供试菌株均由不同地区发病植株上的菌核经75%乙醇浸泡30s,再用1‰升汞表面消毒3~5min后,经无菌水洗涤3次,转移至PDA平板上培养3d,用接种针挑取先端菌丝至少3次,使其成为遗传稳定菌株。

表1 来自不同地区寄主植株上的核盘菌菌株1)
1) 采自内蒙古地区的菌株来源于同一地块。
StrainswerefromthesamefieldinInnerMongolia.
1.2核盘菌菌丝体融合群测定方法
用打孔器在培养2~3d的菌落边缘打取生长速度一致的菌饼(d=7mm),每两个菌株接种到同一个含50mg/L的溴酚蓝(bromophenolblue,BPB)马铃薯葡萄糖琼脂(PDA)平板上,两菌饼相距5cm。其中溴酚蓝的作用主要是更加清楚地观测到菌丝不亲和的反应线。作为亲和组的对照,每一个菌株本身也进行了成对的比较。接种后的培养皿在23~25℃恒温下暗培养7d。测定的原则,首先选取来自同一个地区的核盘菌菌株进行培养,测定出它们的融合群。然后,每一个融合群选取一个代表菌株分别与其他融合群的代表菌株进行亲和性检测。当两个菌落交汇处具有一条黄色分界线或黄色到绿色的反应线说明这两个菌株不亲和,不属于同一个菌丝融合群;而两个菌落间没有明显的反应线,两者生长融合为一体的为融合,属于一个菌丝融合群,每次融合群测定设3个重复,并且对有疑问的亲和组再进行重复验证。
1.3核盘菌菌株生长速度测定方法
菌株经纯化接入PDA平板上,待菌株培养2~3d后,于菌落边缘打取d=7mm的菌碟,转接至装有PDA(含50mg/LBPB)平板的中央位置,接种后的培养皿用Parafilm膜封好,放于恒温培养箱中 23~25℃黑暗培养48h后,测量菌落直径,各菌株重复4次,以确定不同菌株生长速度的差异。
1.4核盘菌菌株对向日葵致病力测定
取长方形塑料盘,用75%乙醇棉擦拭盘面。在塑料盘底部铺两层灭过菌的吸水滤纸,倒入适量无菌水使得吸水滤纸刚好完全湿润。取苗龄为30d左右的大小较为一致的向日葵(‘丰葵杂1号’)叶片,自来水冲洗干净,用吸水滤纸吸干叶片表面多余水分,然后将叶片均匀地放于瓷盘内,叶片背面朝上。用打孔器在菌落的边缘打取菌丝琼脂块(d=4mm),再用接菌针挑取单个菌丝琼脂块,准确接种在叶片主叶脉的两侧,每个菌株接种5个叶片,每个叶片接种1个菌丝琼脂块,以没有接菌的琼脂块作为接种对照。接种后,用保鲜膜封住塑料盘,置于恒温恒湿培养箱中培养(23~25℃)。48h后观察发病情况,用十字交叉法量取病斑直径大小。
1.5核盘菌菌株产草酸(OA)能力和pH测定方法
于生长一致的菌落边缘打取1个直径7mm的菌碟,转至50mL三角瓶中(含30mLPDB,2%葡萄糖和0.4%马铃薯液,用蒸馏水配制),室温静止培养3d。真空抽滤到已干燥并称重好的滤纸上,将带有菌丝体的滤纸在鼓风干燥箱中干燥至恒重,并测得带有菌丝体滤纸的重量,减去滤纸自身的重量得到干菌丝体的重量。上清液用于草酸和pH(用pH计)的测定。
草酸的测定参考Durman等[15]的方法,反应液包含:0.2mL的样品液(或标准草酸溶液),0.11mL的BPB(1mmol/L),0.198mL的硫酸(1mol/L),0.176mL(100mmol/L)的重铬酸钾,4.8mL蒸馏水。将混合物放入60℃的水浴锅中反应10min后,加入0.5mL(1.0mol/L)氢氧化钠溶液终止反应。然后在分光光度计(T6新世纪紫外可见分光光度计)中测定600nm的吸光值,PDB溶液作为对照。菌株产草酸的量通过与标准曲线比较计算出,并以μg草酸/mg干菌丝来表示。各菌株总酸的产量通过pH计(赛多利斯PB-10)测定溶液的pH来表示。试验设3次重复。
1.6数据分析
确定的25个菌丝融合群菌株的菌丝生长速度、致病力、pH及草酸产量的数据采用单一变量方差分析,最小显著差异测定(OnewayANOVA:LSDtest)。不同菌丝融合群的菌丝体生长速度、致病力、pH及草酸产量的平均数用于分析4个因素之间的相关关系。所有试验数据均采用SPSS12.0软件分析完成。
2 结果与分析
2.1菌丝体融合群的确定
由表2可知,44株供试菌株共分成25个融合群。其中有14个融合群仅由单一菌株组成,所占比例为56.0%。最大的融合群为MCG3,分别由来自内蒙古,黑龙江双鸭山、绥化3个地区的5个菌株组成;其他的融合群分别由2~4个菌株组成。通过对44株供试菌株进行菌丝融合群测定表明,采集自内蒙古和黑龙江省内的核盘菌菌株存在着丰富的遗传多样性,表现在同一地区内的菌株可被分成不同的融合群,同一地区同一田块采集的菌株也被分在了不同的融合群(如内蒙古地区菌株)。
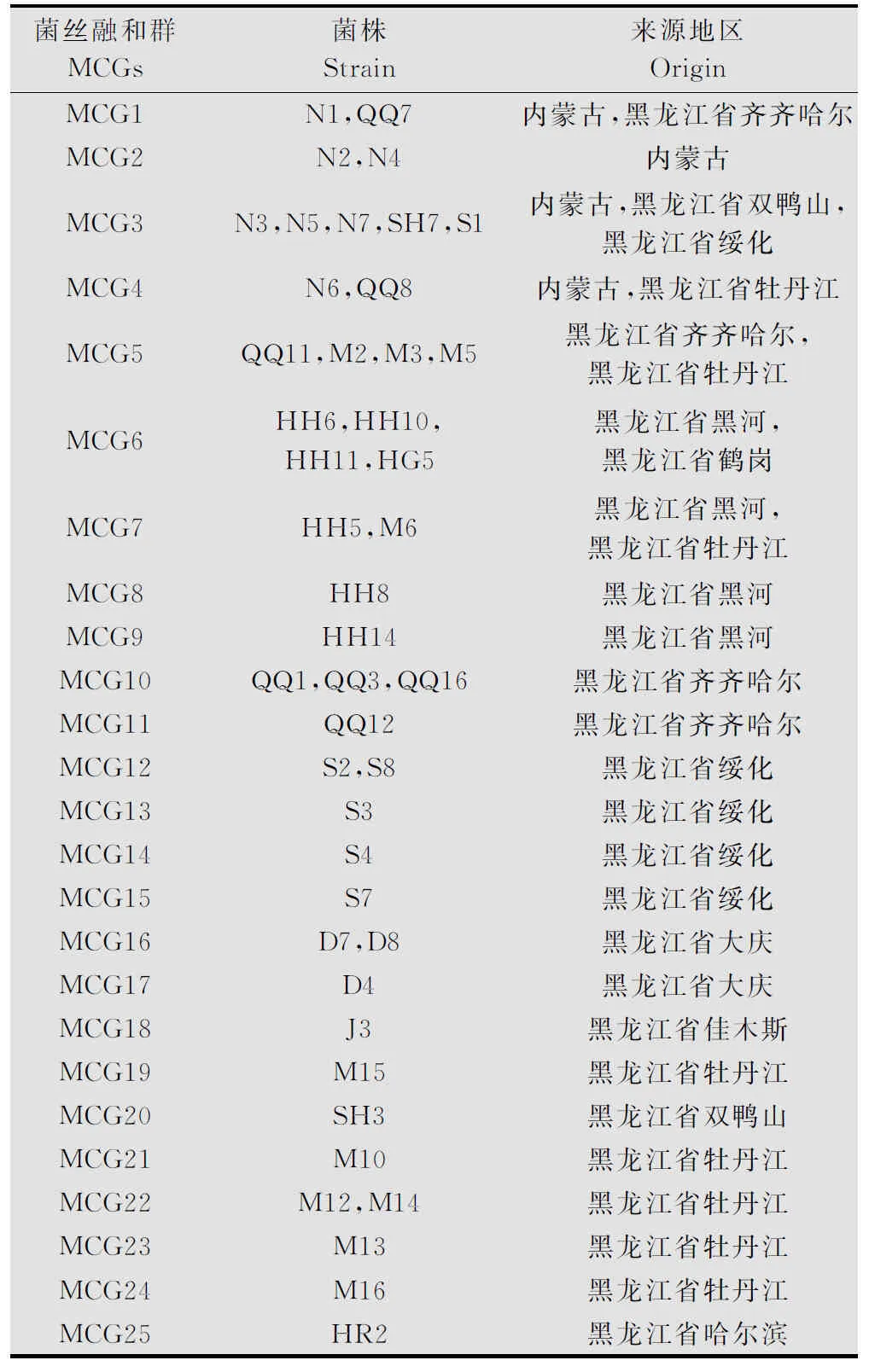
表2 菌丝融合群分组结果
2.2菌株生长速度测定结果
供试菌株在PDA(加BPB)培养基上都生长迅速。培养48h后测定菌落直径范围,最小为2.30cm(M13菌株),最大直径为8.62cm(QQ7菌株)。菌株生长速度表现出显著差异,并与菌株地理来源和菌丝融和群无关(数据未给出)。当利用菌丝融合群方法对供试菌株进行分组,培养48h后菌落平均直径变化范围为最小2.32cm(MCG23)到最大8.56cm(MCG11)(表3),融合群间菌丝的生长速度达极显著差异(P<0.001)(表4)。 这种极显著差异不仅表现在来源于不同地区融合群间,如来源于齐齐哈尔的MCG11、来源于牡丹江的MCG23和来源于绥化的MCG14,而且表现为来源于同一地区的融合群间,如来源于牡丹江的MCG20菌丝平均生长速度比MCG22和MCG23快(表2~3)。
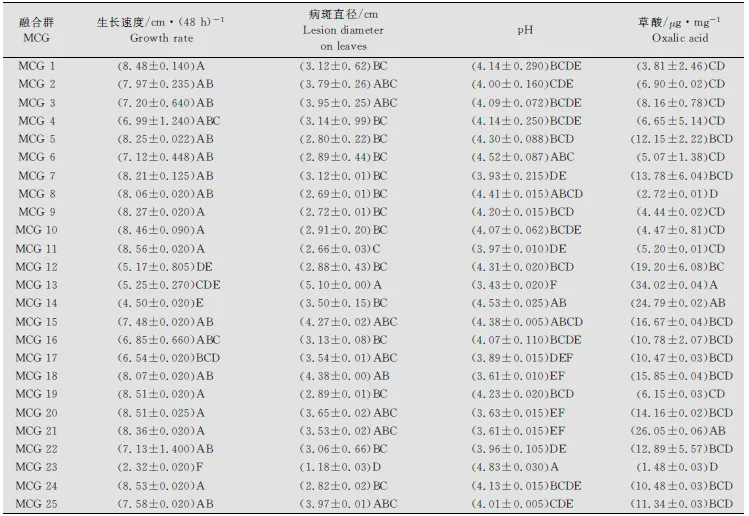
表3 核盘菌不同菌丝融合群生长速度、病斑直径、pH及草酸产量1)
1) 按邓肯新复极差测验(P=0.01),同列后附不同字母的均值有极显著差异。
DatawithinsamecolumnfollowedbydifferentletterswereextremelysignificantdifferentaccordingtoDuncan’smultiplerangetestat0.01probabilitylevel.
2.3核盘菌对向日葵品种致病力测定结果
利用菌碟贴接离体向日葵叶片,经保湿培养,12h后在叶片上即可出现明显的水浸状病斑,随保湿时间的延长病斑生长迅速。48h测定病斑直径的大小从1.20cm(M13菌株)到5.10cm(S3菌株)。从融合群间看,病斑直径的差异达到了极显著性水平(P<0.001)(见表4),病斑直径变化的范围为1.18cm(MCG23)到5.10cm(MCG13)(见表3)。不同菌株间及亲合群间致病力的显著性差异未发现与菌株的地理来源有关。
2.4核盘菌产草酸(OA)能力和pH测定结果
不同的融合群之间,菌株产草酸的量变化范围为1.48 (MCG23)到34.02(MCG13)μg/mg干菌丝(见表3)。融合群间草酸产生能力差异很大,并达到了极显著差异(P<0.001)(见表4)。同时,研究发现这种极显著差异不仅表现在所划分的所有不同融合群间,也表现在同一地区的不同融合群间,例如来源于牡丹江地区的不同融合群间,MCG21比MCG22、MCG23和MCG24产生草酸的量都多。
菌株在液体培养的过程中除了产生草酸外,还可能产生其他的未知酸类物质,致使培养液的pH产生很大的变化。测定结果显示未接入菌碟前原始培养液(CK)的平均pH为5.03,接入菌后MCG13培养液的pH最小,达到了3.43(表3)。当以pH(表示总酸的分泌量)变化比较各融合群间总酸产量差异时,各融合群间表现出极显著差异(P<0.001)(表4)。MCG13产生的总酸量最大(pH=3.43),而MCG23产生的总酸量最小(pH=4.83)(表3)。
2.5与致病力有关的4个因子间的相关性分析
通过对菌株生长速度、病斑直径、草酸产量及培养液pH进行相关性分析(表5)。结果表明,菌株的致病力与菌株产生的草酸量呈正相关(r=0.484, P≤0.01),与产生的总酸(pH)之间呈负相关(r=-0.580, P ≤0.01),与菌株的生长速度无关;而生长速度与菌株产草酸量、总酸及致病力都无关;草酸产量与菌株产生总酸(pH)呈负相关(r=-0.392, P≤0.01),也就说明了总酸的产量与草酸的释放间存在明显的相关关系,进一步表明核盘菌菌株产生的总酸中草酸量占了很大的比例。
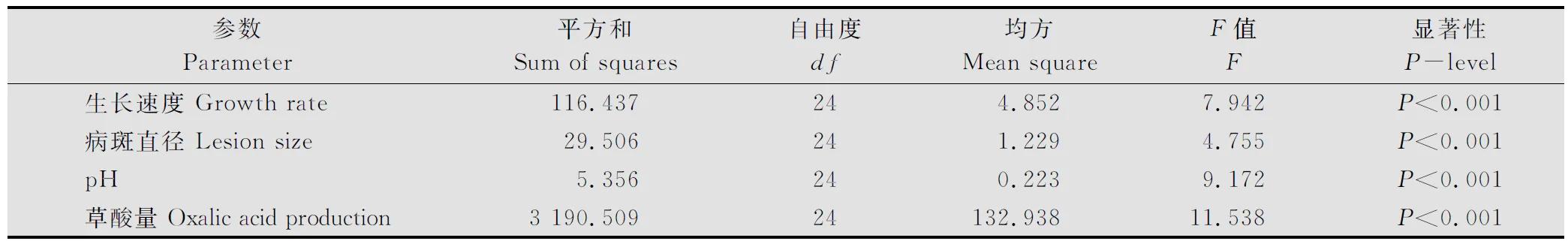
表4 核盘菌不同融合群间生长速度、病斑直径、pH及草酸产量方差分析表
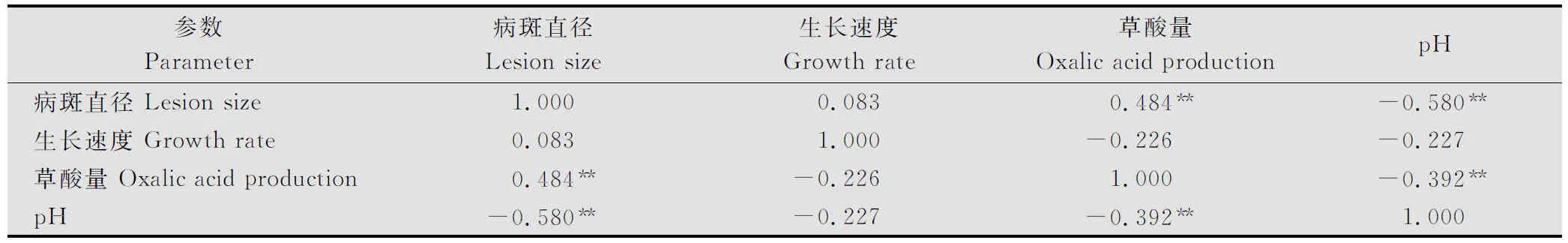
表5 菌丝体融合群间菌丝生长速度、病斑直径、草酸产量和总酸产量的相关性分析1)
1) 表中数据为相关系数(r),**代表相关显著性水平P≤0.01。
Datainthetablearecorrelationcoefficient(r),**indicatecorrelationissignificantat0.01level.
3 讨论
本研究对采集于内蒙古一个地区和黑龙江省不同地区的核盘菌种群进行了融合群分析,44个菌株被分为25个融合群,其中有14个融合群仅由单一菌株组成,所占比例为56.0%。初步说明供试菌株存在较大的异质性,这与国内外相关研究报道的结果相符。Osofee等[9]对25个菌株进行亲和性测定得到的17个菌丝融合群(MCGs)中,13个是由单个仅与自身亲和的菌株组成;Li等[10]对205个菌株进行菌丝融合性测定得到的39个菌丝融合群(MCGs)中,61%是由单个仅与自身亲和的菌株组成;Barari等[16]进行菌丝融合性测定得到的39个菌丝融合群(MCGs)中,26个是由单个仅与自身亲和的菌株组成;李伟[17]对采集自江苏省范围内的145株油菜菌核病菌菌株进行了菌丝融合性测定,共鉴定出了131个菌丝融合群,其中114个是由单个仅与自身亲和的菌株组成; 李沛利等[18]对四川不同生态环境和寄主来源的80个核盘菌菌株进行了菌丝融合性测定,得到63个菌丝体融合群(MCGs),其中52个菌丝融合群(MCGs)是由单个仅与自身亲和的菌株组成;杨丹[19]对来自湖北省10个县市的60个油菜核盘菌进行菌丝融合性的测定,分为27个融合群,其中12个仅由单个菌株组成,占融合群的44.4%。对于菌丝融合群与菌株的地理来源的关系,多数学者认为核盘菌的菌丝融合群与菌株的地理来源并无明显的相关性。本研究的结果也如此,具体表现为不同地区来源的菌株可能属于同一菌丝融合群,也可能属于不同的菌丝融合群,同一地区来源的菌株表现相同的结果。
许多研究已经表明核盘菌存在致病性分化的现象,表现在不同融合群菌株的致病力会明显不同,即使是同一融合群内也存在致病性明显不同的菌株,而且这种致病力分化的现象与菌株的地理来源无关。所以,在评价某一地区的核盘菌菌株的致病性或者进行抗病育种筛选时,要尽可能多地收集菌株,才能得到更好的结果。
草酸一直以来被认为与核盘菌的致病性密切相关,作为核盘菌重要的致病因素已引起愈来愈多的关注。Godoy等[20]发现核盘菌的突变体会失去合成草酸的能力,而变为非致病菌株,当恢复突变后,菌株会重新恢复合成草酸的能力,变为正常的具有致病力的菌株。本研究证实核盘菌融合群间致病力存在显著差异,并与产生的草酸量成正相关,与融合群的地理来源无相关性。同Durman等[15]和Li等[10]的研究结果一致。
[1]BolandGJ,HallR.IndexofplanthostsofSclerotinia sclerotiorum[J].CanadianJournalofPlantPathology,1994,16:93108.
[2]AdamsPB,AyersWA.EcologyofSclerotiniaspecies[J].Phytopathology,1979,69:896899.
[3]CarboneI,AndersonJB,KohnLM.Patternsofdescentinclonallineagesandtheirmultilocusfingerprintsareresolvedwithcombinedgenegenealogies[J].Evolution,1999,53:1121.
[4]KohnLM.Theclonaldynamicinwildandagriculturalplantpathogenpopulations[J].CanadianJournalofBotany,1994,73:S1231S1240.
[5]KohnLM,StasovskiE,CarboneI,etal.MycelialincompatibilityandmolecularmarkersidentifygeneticvariabilityinfieldpopulationsofSclerotinia sclerotiorum [J].Phytopathology,1991,81:480485.
[6]王玉杰. 向日葵菌核病病原菌遗传多样性及致病力分化的研究[D]. 呼和浩特:内蒙古农业大学,2011.
[7]张吉清,张学雷,肖炎,等.黑龙江省大豆菌核病菌生长特性及菌丝体亲和型测定[J].中国油料作物学报,2013,35(3):307312.
[8]李易初.黑龙江大豆菌核病菌生物学特性、融合群及遗传多样性研究[D]. 哈尔滨:东北农业大学,2014.
[9]OsofeeH,HameedKM,MahasnedhA,etal.RelatednessamongindigenousmembersofSclerotinia sclerotiorumbymycelialcompatibilityandRAPDanalysisintheJordanValley[J].ThePlantPathologyJournal,2005,21(2):106110.
[10]LiZiqin,ZhangMin,WangYingchun,etal.MycelialcompatibilitygroupandpathogenicityvariationofSclerotinia sclerotiorumpopulationinsunflowerfromChina,CanadaandEngland[J].PlantPathologyJournal,2008,7(2):131139.
[11]DickmanMB,MitraA. Arabidopsis thalianaasamodelforstudyingSclerotinia sclerotiorumpathogenesis[J].PhysiologicalandMolecularPlantPathology,1992,41:255263.
[12]BatemanDF,BeerSV.SimultaneousproductionandsynergisticactionofoxalicacidandpolygalacturonaseduringpathogenesisbySclerotium rolfsii [J].Phytopathology,1965,58:204211.
[13]NoyesRD,HancockJG.RoleofoxalicacidintheSclerotinia sclerotiorumwiltofsunflower[J].PhysiologicalPlantPathology,1981,18(2):123132.
[14]CessnaSG,SearsVE,DickmanMB,etal.Oxalicacid,apathogenicityfatorforSclerotinia sclerotiorum,suppressestheoxidativeburstofthehostplant[J].PlantCell,2000,12:21912199.
[15]DurmanSB,MenendezAB,GodeasAM.VariationinoxalicacidproductionandmyceliacompatibilitywithinfieldpopulationsofSclerotinia sclerotiorum [J].SoilBiologyandBiochemistry,2005,37:21802184.
[16]BarariH,AlaviV,BadalyanSM.GeneticandmorphologicaldiversitiesinSclerotinia sclerotiorumisolatesinnorthernpartsofIran[J].WorldAppliedSciencesJournal,2010,8(3):326333.
[17]李伟. 江苏省油菜菌核病菌群体遗传结构分析[D]. 南京:南京农业大学,2007.
[18]李沛利,秦芸,严吉明,等. 四川省核盘菌的营养体亲和性[J]. 四川农业大学学报,2010,28(3):324327.
[19]杨丹. 湖北省油菜菌核病病菌多样性研究[D]. 武汉:华中农业大学,2010.
[20]GodoyG,SteadmanJR,DickmanMB,etal.UseofmutantstodemonstratetheroleofoxalicacidinpathogenicityofSclerotinia sclerotiorumonPhaseolus vulgaris [J].PhysiologicalandMolecularPlantPathology, 1990,37:179191.
(责任编辑:田喆)
MycelialcompatibilitygroupandpathogenicityvariationofSclerotinia sclerotiorumpopulationsfromInnerMongoliaandHeilongjiang
LiuChunlai,WangShuang,XiaJixing,YangFan,LiXinmin,MengQinglin,LiuYu,SuBaohua,ZhangYunhua
(PlantProtectionInstituteofHeilongjiangAcademyofAgriculturalSciences,Harbin150086,China)
ToidentifythegeneticdiversityofSclerotinia sclerotiorum, 44isolatesfromInnerMongoliaandHeilongjiangwereascertainedbymycelialcompatibilitygroups(MCGs)screeningmethods,andthedifferencesamongMCGswereobservedbycomparingtheirdifferencesinmyceliagrowthrate,pathogenicityandproductionofoxalicacidandtotalacids.Theresultsshowedthatthe44isolatesweregroupedin25MCGs,amongwhich14MCGsconsistedofonlyoneisolate,withaproportionof56.0%.Significantdifferenceswerefoundinmyceliagrowthrate,pathogenicityandproductionofoxalicacidandtotalacidswithinandamongMCGs(P<0.001)regardlessoftheirgeographicorigins.CorrelationanalysisindicatedthatS. sclerotiorumpathogenicitywaspositivelyrelatedtooxalicacidproduction(r=0.484, P ≤0.01)andnegativelyrelatedtopH(r=-0.580, P≤0.01),butnotrelatedtothemyceliagrowthrate.TherewasanegativerelationshipbetweenpHvaluesandoxalicacidproduction(r=-0.392, P ≤0.01),suggestingthatoxalicacidproductioncontributedmosttothetotalproductionofacidsreleasedbyS. sclerotiorum.
Sclerotinia sclerotiorum;oxalicacid;pathogenicity;growthrate
20150602
20150817
国家现代农业产业技术体系(CARS-16)
E-mail:yhzhang9603@126.com
Q935
ADOI:10.3969/j.issn.05291542.2016.03.025

