添加胰岛素对胎儿宫内发育迟缓新生仔猪胰腺生长发育的影响
薛萍 王恬(1.福建农业职业技术学院动物科学系福州350119;2.南京农业大学动物科技学院210095)
添加胰岛素对胎儿宫内发育迟缓新生仔猪胰腺生长发育的影响
薛萍1,2王恬2*
(1.福建农业职业技术学院动物科学系福州350119;2.南京农业大学动物科技学院210095)
(目的和方法)为研究添加胰岛素对IUGR新生仔猪胰腺重量、酶活性的影响,试验选择初生IUGR仔猪15头,分为新生对照组(N)、牛乳组(M)和试验组即牛乳添加胰岛素(60 IU/L)组(I),人工饲喂3 d后宰杀取样。(结果)结果显示,与N组相比,饲喂3 d后,M组和I组仔猪胰腺重量、胰腺重/体重、蛋白质含量、DNA含量、RNA含量、胰淀粉酶活性、胰脂肪酶总活性、胰高血糖素总含量均不同程度提高,而胰总蛋白水解酶活性、胰蛋白酶活性、胰糜蛋白酶总活性、胰腺胰岛素总含量均不同程度降低,变化较明显。与M组相比,I组胰腺蛋白质含量、蛋白质/DNA比值分别提高了61.43%、60.54%(P<0.01);I组胰总蛋白水解酶活性、胰淀粉酶活性、胰脂肪酶总活性、胰腺胰岛素总含量、胰高血糖素含量分别提高了10.59%、10.40%、9.37%、14.30%、12.30%(P>0.05);胰腺重、胰腺重/体重、胰腺DNA含量、RNA含量、RNA/DNA比值也不同程度提高(P>0.05);而I组与M组间胰蛋白酶活性、胰糜蛋白酶活性差异不显著。(结论)表明IUGR仔猪生后胰腺生长发育较迅速,添加胰岛素能在一定程度上刺激IUGR仔猪胰腺细胞增殖和增大,能显著促进IUGR仔猪胰腺蛋白质合成和沉积,有刺激胰腺内外分泌部发育、提高胰腺酶活性提高、刺激组织激素分泌的趋势,对IUGR仔猪出生后胰腺的生长具有一定的补偿作用。
胰岛素IUGR猪胰腺生长发育
在母猪怀孕期间,若营养摄入不平衡、肠道吸收功能不良、食入饲料毒素、环境应激或管理不当,初生仔猪发生胎儿宫内发育迟缓(Intrauterine growth retardation,IUGR)的比率高达9%~11%,造成小猪体重低、消化系统功能障碍、生长缓慢或死亡,影响生产效益。因此,研究通过营养调控手段促进IUGR仔猪出生后消化系统的生长发育,从而促进仔猪的补偿生长是非常重要的。目前,关于调控IUGR仔猪出生后胰腺生长发育的研究报道非常少。胰岛素是一种乳中天然存在的生物活性肽,在新生动物早期胃肠道快速发育过程中发挥着重要的生物学功能,其主要作用是促进糖原、蛋白质、脂肪合成,抑制其分解。本试验通过在乳中添加胰岛素研究其对新生IUGR仔猪胰腺生长发育的影响,以期为猪生产中促进IUGR仔猪出生后补偿生长、提高生产效益提供依据。
1 材料与方法
1.1试验动物及试验设计IUGR仔猪选择标准:采用Xu等的两个标准差法[1]。对苏州市第一种猪场苏太猪多年生产记录进行统计分析,获得该猪种新生仔猪的平均初生重和标准差,体重低于平均体重两个标准差的新生仔猪被确定为IUGR仔猪。
试验选用苏太猪(太湖猪×杜洛克),采用随机区组设计。从5窝初生仔猪中选出15头(每窝选3头)IUGR仔猪,随机分到新生对照组(N),牛乳组(M)和试验组即牛乳添加胰岛素组(I)。M和I组仔猪全部在吮乳前称取初生重,人工饲喂3 d,M组喂牛乳,I组在牛乳中添加60 IU/L胰岛素。饲喂量按每千克体重30 mL/次,3 h饲喂一次。饲喂结束称重、屠宰取样。
1.2试验材料
1.2.1牛乳乳粉(Fernleaf)与蒸馏水按1:6体积比例混合成试验用牛乳。混合后每100 mL牛乳含热量3.100 MJ、蛋白质3.69 g、乳糖5.99 g、脂肪3.96 g、维生素A 448 IU、维生素D 60 IU、维生素C 7.5mg。
1.2.2I组牛乳添加胰岛素的配制I组在牛乳中添加胰岛素60 IU/L。胰岛素(提取自牛胰腺)为SIGMA公司产品,26.5 U/mg。经检测牛乳中胰岛素的浓度为0.34m IU/L。
1.3样本采集仔猪心脏采血致死后,迅速分离消化器官,置于冰盘上,并立即从系膜连接的消化器官中迅速分离出胰腺(剥除多余的脂肪和结缔组织),称重,贮存于-70℃超低温冰箱备用。
1.4胰腺组织指标测定将冷冻保存的胰腺组织样本于4℃下解冻,用眼科小剪剪碎,加入冷生理盐水匀浆备用。
1.4.1蛋白质、DNA和RNA含量的测定将冷冻保存的胰腺组织样本于4℃下解冻,用眼科小剪剪碎,加入冷生理盐水匀浆备用。采用Lowry等(1951)改良福林酚试剂法[2]测定胃组织匀浆中蛋白质含量。用John-Chandler法[3]提取组织匀浆中的DNA和 RNA,并采用Giles和Myers(1965)改良的Burton二苯胺法[4-5]测定DNA含量,Fleck和Begg(1994)的紫外吸收法[6]测定RNA含量。
1.4.2胰酶活性的测定采用福林酚法测定胰总蛋白水解酶活性[7],Geiger和Fritz(1984)的方法[8]测定胰蛋白酶活性,Geiger(1984)的方法[9]测定胰糜蛋白酶活性。采用南京建成生物工程研究所的医用淀粉酶试剂盒测定胰淀粉酶活性。参照比浊法测定胰腺组织中的脂肪酶活性[10]。
1.4.3胰岛素和胰高血糖素含量的测定组织中胰岛素和胰高血糖素含量分别采用中国原子能科学研究院同位素研究所提供的125I-胰岛素放射免疫分析试剂盒和125I-胰高血糖素放射免疫分析试剂盒测定。
1.5统计分析采用SPSS 11.5软件进行统计分析。各组间采用单因子方差(One-Way ANOVA)分析,多重比较采用最小显著差数法(LSD)。数据以平均值±标准差(±SD)表示。
2 结果与分析
2.1体重和胰腺重由表1可见,与N组相比,M组、I组仔猪体重均减轻;M组与I组间差异不显著(P>0.05)。M组和I组胰腺重量分别比N组提高了29.64%和38.93%(P<0.01),且I组高于M组,差异不显著。M组和I组仔猪胰腺重/体重比值(胰腺相对重量)分别比N组提高了38.19%和49.61%(P<0.01),且I组高于M组(P>0.05)。
2.2胰腺蛋白质、DNA和RNA含量及蛋白质/ DNA由表2可见,与N组相比,M组和I组胰腺蛋白含量分别提高了29.54%和109.11%(P<0.01);I组较M组高61.43%,差异达到极显著水平(P<0.01)。与N组相比,M组和I组胰腺DNA含量分别提高了42.27和42.82%(P<0.01);I组胰腺DNA含量略高于M组,但差异均未达到统计学显著水平(P>0.05)。与N组相比,M组和I组胰腺RNA含量极显著提高(P<0.01);I组高于M组(P>0.05)。与N组相比,M组和I组仔猪胰腺RNA/DNA比值分别提高了12.71%(P>0.05)和21.45%(P<0.05);I组高于M组(P>0.05)。与N组相比,M组仔猪胰腺蛋白质/DNA比值略微降低(P>0.05),而I组仔猪极显著提高(P<0.01);I组蛋白质/DNA较M组高60.54%(P<0.01)。
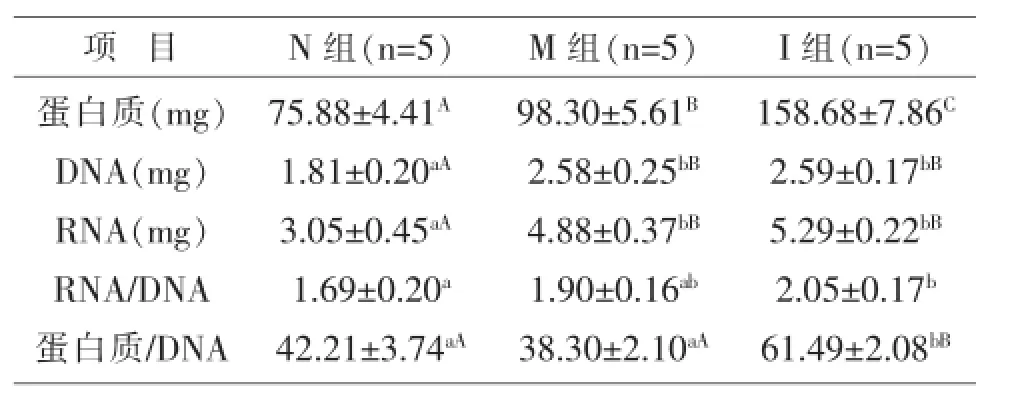
表2 添加胰岛素对IUGR仔猪胃蛋白质、DNA、RNA含量的影响
2.3胰酶活性三组试验仔猪胰总蛋白水解酶、胰蛋白酶、胰糜蛋白酶、胰淀粉酶和胰脂肪酶总活性见表3。由表3可见,与N组相比,M组和I组仔猪胰总蛋白水解酶活性、胰蛋白酶活性均极显著降低(P<0.01);且I组胰总蛋白水解酶活性较M组高10.59%(P>0.05);I组与M组间胰蛋白酶活性差异不显著(P>0.05)。与N组相比,M组和I组胰糜蛋白酶总活性分别降低了20.95%(P<0.05)和19.47%(P>0.05);I组和M组间差异不显著(P>0.05)。与N组相比,M组和I组仔猪胰淀粉酶活性均极显著提高(P<0.01);而I组较M组高10.40%(P>0.05)。与N组相比,M组和I组胰脂肪酶总活性分别提高17.88%(P>0.05)和28.92%(P<0.01);而I组较M组高9.37%(P>0.05)。
2.4胰岛素和胰高血糖素含量由表4可见,与N组相比,M组和I组胰腺胰岛素总含量均不同程度降低(P>0.05);I组较M组高14.30%(P>0.05)。与N组相比,M组和I组胰高血糖素总含量分别提高了56.64%和76.99%(P<0.05);I组较M组高12.30%(P>0.05)。

表3 添加胰岛素对IUGR仔猪胰总蛋白水解酶、胰蛋白酶、胰糜蛋白酶、胰淀粉酶和胰脂肪酶总活性的影响

表4 添加胰岛素对IUGR仔猪胰岛素和胰高血糖素含量的影响
3 讨论
消化器官的生长发育会影响动物体重的增长和身体其他各系统的功能。胰腺虽小,但它是动物消化系统中一个极为重要的兼具内、外分泌功能的腺体,外分泌主要成分是胰液,内含碱性的碳酸氢盐和各种消化酶,其主要功能是中和胃酸,消化糖、蛋白质和脂肪;内分泌可合成和分泌胰高血糖素、胰岛素、生长抑素、胰多肽。动物器官的生长发育与细胞的数量、大小、分化密切相关,蛋白质含量、DNA含量、蛋白质与DNA含量的比值是衡量细胞数量、细胞大小的重要指标[11]。石现瑞等(2005)试验结果表明,IUGR仔猪胰腺重量、蛋白质含量、DNA含量和RNA含量、胰腺腺泡大小和腺泡细胞大小、胰蛋白酶总活性、胰凝乳酶总活性、胰脂肪酶总活性、胰淀粉酶总活性均不同程度低于正常仔猪,提示IUGR显著影响仔猪胰腺的重量、生化组成和酶的活性[12]。
胰岛素是初乳中重要生长因子之一,一些体内外研究表明,胰岛素能够显著促进肠道上皮细胞增殖,促进肠道蛋白质合成,提高消化酶活性[13-15]。沈峰等(2005)添加本试验相同剂量胰岛素饲喂IUGR仔猪发现,口饲胰岛素能显著提高IUGR仔猪小肠黏膜DNA、RNA含量,刺激小肠黏膜上皮细胞的增生和小肠黏膜麦芽糖酶、乳糖酶总活性的升高[16]。但目前有关通过外源添加胰岛素对IUGR仔猪胰腺生长发育的影响未见报道。本试验研究发现,与自然哺乳仔猪相比,IUGR仔猪人工饲喂牛乳或牛乳补加胰岛素3 d后,胰腺各生长发育指标的变化规律相差不明显,均可促进胰腺迅速生长发育;与仅喂牛乳组相比,牛乳添加胰岛素组仔猪胰腺蛋白质含量、蛋白质/DNA极显著提高(P<0.01),胰腺重/体重、胰腺DNA含量、RNA含量、胰总蛋白水解酶活性、胰淀粉酶活性、胰脂肪酶总活性、胰腺胰岛素总含量、胰高血糖素含量也不同程度提高(P>0.05)。表明IUGR仔猪出生后胰腺生长发育较迅速,添加胰岛素能在一定程度上刺激IUGR仔猪胰腺细胞增殖和增大,显著促进IUGR仔猪胰腺蛋白质合成和沉积,有刺激胰腺内外分泌部发育、提高胰腺酶活性、刺激组织激素分泌的趋势,对IUGR仔猪出生后胰腺生长具有一定的补偿作用。
胰岛素调节新生仔猪胰腺生长发育的机制尚不十分清楚,综合前人的研究[15-29]推测,胰岛素能在新生动物胃肠道中稳定存在,可以完整的结构发挥生物活性作用,其对于早期仔猪肠道的影响可能更多的是直接作用于消化道表面,而不是被吸收后通过血液循环起作用;主要是通过与高亲和力胰岛素受体结合、与Ⅰ型胰岛素样生长因子(IGF-I)受体结合或促进肝脏释放IGFs间接作用等方式,发挥促进细胞生长、促进细胞增殖分裂与分化、参与体内物质代谢和能量代谢等作用,且作用效果与细胞膜上胰岛素受体密度、亲和力、受体功能状态以及受体后途径等因素有关,与添加剂量和添加时间有关。若采用更大剂量、更长时间添加胰岛素的方式,对IUGR仔猪出生后胰腺的生长发育、仔猪整体的生长发育是否存在更好的影响以及其作用机制还有待进一步深入研究。
[1]Xu R J,Mellor D J,Brittles M J,et al.Impact of intrauterine grow th retardation on the gastrointestinal tract and the pancreas in newborn pigs[J].J Pediatr Gastroenterol Nutr, 1994,18:232-240.
[2]Low ry O H,Rosebrough N J,Farr A L,et al.Protein measurement w ith the Follin phenol reagent[J].JBiol Chem, 1951,193:265-275.
[3]Johnson L R,Chandler A M.RNA and DNA of gastric and duodenalmucosa in antractomized and gastrin-treated rats[J].Am JPhysiol,1973,224:937-940.
[4]Giles K,M yers A.An improved diphenylamine method for the estimation of deoxyribomucleic acid[J].Nature, 1965,206:93.
[5]Burton K A.Study of the conditions and mechanism sof the diphenylam ine reaction for the colorimetric estimation of deoxyribonucleic acid[J].Biochem J,1965,62:315-323.
[6]Fleck A,Begg D.The estimation of ribonucleic acid using ultravioletabsorptionmeasurement[J].Biochem Biophys Acta,1994,108:333-339.
[7]高雯,蒋培荣,张之佳,等.食品酶学分析方法[M].哈尔滨:黑龙江科学技术出版社,1991.
[8]Geiger R,Hans F.Trypsin[M].In:Bergmeyer H U.Methods of enzymatic analysis.3rd edition.W einhein,Verlag Chem ie,German,1984:119-124.
[9]Geiger R.Chymotrypsin[M].In:Bergmeyer H U.M ethods of enzymatic analysis.3rd edition.Weinhein,Verlag Chem ie,German,1984:99-107.
[10]金宗廉,文镜,唐粉芳,等.功能食品评价原理及方法[M].北京:北京大学出版社,1995:107-109.
[11]Xu R J,Tungthanathanich P,Birtles M J,et al.Grow th and morphological logical changes in the small and the large intestine in pigs during the first three days after birth[J].J Dev Physiol,1992,18:162-172.
[12]石现瑞,霍永久,王恬,等.子宫内发育迟缓对新生仔猪胰腺和胃发育的影响[J].家畜生态学报,2005,25(1):26-31.
[13]Arsenault P,Menard D.Insulin influences the maturation and proliferation of suckling mouse intestinal mucosa in serum-free organ cu-lture[J].Biol Neonate,1984,46(5):229-236.
[14]Shulman R J,Tivey D R,Sunitha I,et al.Effect of oral insulin on lactase activity,mRNA,and posttranscriptional processing in the new born pig[J].JPediatr Gastroenterol Nutr,1992,2:166-172.
[15]邹仕庚,王恬,郑春田,等.胰岛素和酶解配方乳对初生仔猪胃肠道生长发育影响的研究[J].动物营养学报, 2001,213(1):19-24.
[16]沈峰,王恬.胰岛素对子宫内生长迟缓新生仔猪小肠生长发育的影响[J].肠外与肠内营养,2005,12(1):5-8.
[17]Wei Hua Shen.Gastrointestinal stability and absorption of insulin in suckling pigs[J].Com parative Biochem istry and Physiology,2000,125(3):389-401.
[18]Hill D J,N ilner R D G.Insulin asa grow th factor[J].Rediatr Res,1985,9:879-886.
[19]Now ak JW,Styczyńska E,Slebodziński A B.Insulin receptors:the binding capacity and localization in the digestive tract during the rabbits neonatal period[J].Reprod Nutr Dev,1996,36(5):513-521.
[20]Termanini B,Nardi R V,Finan T M,et al.Insulin like grow th factor I receptors in rabbit gastrointestinal tract. Characterization and autoradiographic localization[J].Gastoenterology,1990,99(1):51-60.
[21]Chen M C,Lee A T,Soll A H.M itogenic response of canine fundic epithelial cells in short-term culture to transform ing grow th factor alpha and insulin like grow th factor I[J].JClin Invest,1991,87(5):1716-1723.
[22]伊正辉,王林杰,常迎彬.不同年龄大鼠胰腺组织中胰岛素受体与磷脂酰肌醇3激酶表达水平的研究[J].中国医学创新,2012,9(14):1-3.
[23]Obici S,Fang Z,KarkaniasG,et al.Decreasing hypothalam ic insulin receptor cause hyperphagia and insulin resistance in rats[J].Nat Neurosci,2002,5(6):566-572.
[24]Barreto SG,Carati C J,Toouli J,et al.The islet-acinar axis of the pancreas:more than just insulin[J].Am JPhysiol Gastrointest Liver Physiol,2010,299(1):10-22.
[25]Philippe M F,Benabadji S,Barbot-Trystram L,etal.Pancreatic volume and endocrine and exocrine functions in patientsw ith diabetes[J].Pancreas,2011,40(3):359-363.
[26]Ralph A B,Edw ard A D.FOXO T ranscription Factors:Key Targetsof the PI3K-Akt Pathway that Regulate Cell Proliferation,Survival,and Organismal Aging[J].Regulation of Organelle and Cell Compartment Signaling,2011,210(6):43-51.
[27]Saltiel A R,Kahn C R.Insulin signaling and the regulation of glucose and lipidmetabolism[J].Nature,2001,414(6865):799-806.
[28]Ye H(叶华).2型糖尿病患者及其一级亲属和非糖尿病者骨骼肌的胰岛素信号传导[J].Clin JDiabetes(中国糖尿病杂志),2003,11(2):151-152.
[29]李瑶,辛颖.宫内发育迟缓大鼠胰腺肝脏骨骼肌中胰岛素受体底物的表达[J].中国循证儿科杂志,2011,6(3):225-229.
Effects of oral insulin on the pancreatic grow th and development of IUGR pigs
Xue Ping1,2Wang Tian2*
(1.Departmentof Animal Science,Fujian Vocational College of Agriculture,350119;2.College of Animal Science and Technology,Nanjing Agricultural University,210095)
Abstract(Objective and Method)In order to investigate the effects of oral insulin on the growth and development of pancreatic in intrauterine growth retardation(IUGR)piglets,fifteen Sutai IUGR pigletswere selected and divided into three groups:newborn group(N),milk group(M)and milk supplemented with insulin(60 IU/L)group(I).The piglets in group M and Iwere fed artificially for 3 days,respectively.Compared with newborn group,pancreatic tissue weight,the raito tissue weight to body weight,content of protein,content of DNA,content of RNA,total activities of amylase and lipase,content of glucagon in bottled-fed pigletswere higher,but total activities of protease,trypsin,chymotrypsin,and content of insulin were lower.Compared with M group,content of protein,the ratio protein to DNA in pancreas of Igroup were increased by 61.43%、60.54%(P<0.01),respectively.Compared with M group,total activities of protease,amylase and lipase,and content of Insulin and glucagon in pancreatic of group Iwere increased by 10.59%、10.40%、9.37%、14.30%、12.30%(P>0.05),respectively.Compared with M group,pancreatic tissueweight,the raito tissueweight to bodyweight,content of DNA,content of RNA,the ratio RNA to DNA also showed the similar increased tendency(P>0.05).And these difference between total activities of trypsin and chymotrypsin in group M with these in group Ididn't reach statistical significantly level.(Conclusion)The results show that the pancreatic Growth and Development of IUGR piglets were quickly during the early postnatal period,and oral insulin could promote the proliferation and enlargement of pancreatic cells,and could promote synthetic and deposit of protein,and could promote the development of exocrine section and endocrine section in pancreatic to some extent,and could increase activities of protease enzyme,and could promote secretion of hormone,and could promote the pancreatic compensatory growth and development of IUGR Pigs.
Oral insulin IUGR Piglets Pancreas Growth and development
A
1003-4331(2016)03-0010-05
国家自然科学基金项目(30771569)资助。
薛萍,女,讲师,硕士。主要从事单胃动物营养研究,xp200216@sina.com。
王恬,教授,博士生导师,tianwang@njau.edu.cn。

