电子胃镜对早期胃癌边界的评估
王 玮 王道蓉
电子胃镜对早期胃癌边界的评估
王玮王道蓉
胃癌是临床常见的恶性肿瘤之一。早期胃癌局限于黏膜层,因而淋巴转移的概率较低,内镜下微创切除成为主要的治疗方法[1]。内镜下切除胃癌时,准确判断胃癌的边界十分重要,不清晰的边界可能会影响内镜切除的效果,导致肿瘤残存,进而引起胃癌复发以及再次内镜切除。近年来放大内镜、色素内镜、荧光内镜、超声内镜、近红外线电子内镜等在早期胃癌的诊断和治疗中发挥了相应的作用[2]。然而,由于普通电子内镜的普及性高,在临床上已被广泛应用,因此准确使用电子内镜评估早期胃癌的边界还是十分必要的。本研究旨在评价普通电子内镜对早期胃癌边界的辨别价值以及胃癌边界不清晰的相关因素。
1 材料和方法
1.1临床资料
本研究采用回顾性分析方法,研究对象为2008年5月至2015年5月于襄阳市中心医院消化内科治疗的104例早期胃癌患者。纳入标准:(1)内镜活检确诊为黏膜内浸润癌或黏膜下浸润癌;(2)辅助检查未见淋巴结转移;(3)无其他恶性肿瘤;(4)无心、肺、肝、肾等重要脏器功能明显缺陷。收集所有患者的临床记录、内镜图像及病理报告等。本研究经过医院伦理委员会批准和同意,所有患者均签署知情同意书。
1.2方法
1.2.1电子内镜检查在内镜检查前20 min,将20 000 U链霉蛋白酶(北京泰德制药股份有限公司,H20110030)和1 g碳酸氢钠加入50 mL纯水中,溶解后给予患者口服,可提高内镜检查图像的可见度。按照普通电子内镜(奥林巴斯公司,GIF-Q240)的常规程序进行检查,如发现可疑病变区域则行靛胭脂(西南药业股份有限公司,H50021944)染色,由内镜专家重新评估,对可疑部位进行活组织病理检查。
1.2.2观察指标首先分析早期胃癌边界不清晰病变的发生率,其次分析早期胃癌边界不清晰与患者年龄、性别、肿瘤直径、肿瘤位置、肿瘤颜色、肿瘤类型、肿瘤表面平坦、溃疡、黏液腺癌以及病变周围肠上皮化生等因素的关系。
1.3统计学分析
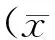
2 结果
2.1胃癌边界的鉴定
内镜医生根据病变部位和周围黏膜的颜色、表面形态及高度是否超过周围组织来评估肿瘤边界是否清晰。如果病变部位的颜色、形态和高度与周围组织不一致,定义为边界清晰(图1),如果均无显著差异则定义为边界不清晰(图2)。
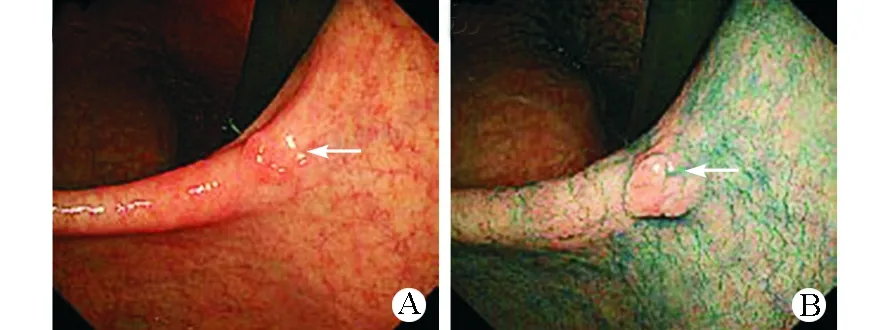
图1 胃癌边界清晰的病变 A 靛胭脂染色前 B 靛胭脂染色后
图2 胃癌边界不清晰的病变 A 靛胭脂染色前 B 靛胭脂染色后
2.2边界不清晰病变的发生率
104例早期胃癌患者中,边界不清晰病变的发生率为20.2%(21/104),边界清晰病变的发生率为79.8%(83/104)。电子内镜下取组织进行病理学检查,结果显示有17例电子内镜检测不准确,87例检测正确,检测准确率是83.7%。104例早期胃癌患者的基线特征见表1。

表1 104例早期胃癌患者的基线特征
2.3边界不清晰病变的相关因素分析
边界清晰和不清晰的胃癌患者特征比较结果见表2,与胃癌边界不清晰相关的6个因素分别是肿瘤位置、肿瘤颜色、肿瘤表面平坦、肿瘤直径、溃疡和黏液腺癌。根据Tanabe等[3]的研究结论,肿瘤直径≥21 mm是胃癌不清晰边界形成的因素,故本研究中肿瘤长径以此作为标准。
多变量回归分析肿瘤位置、肿瘤颜色、肿瘤表面平坦、肿瘤直径≥21 mm、溃疡黏液腺癌这些因素,结果见表3。结果提示,肿瘤颜色、肿瘤表面平坦、肿瘤直径、溃疡和黏液腺癌与胃癌边界不清晰相关。
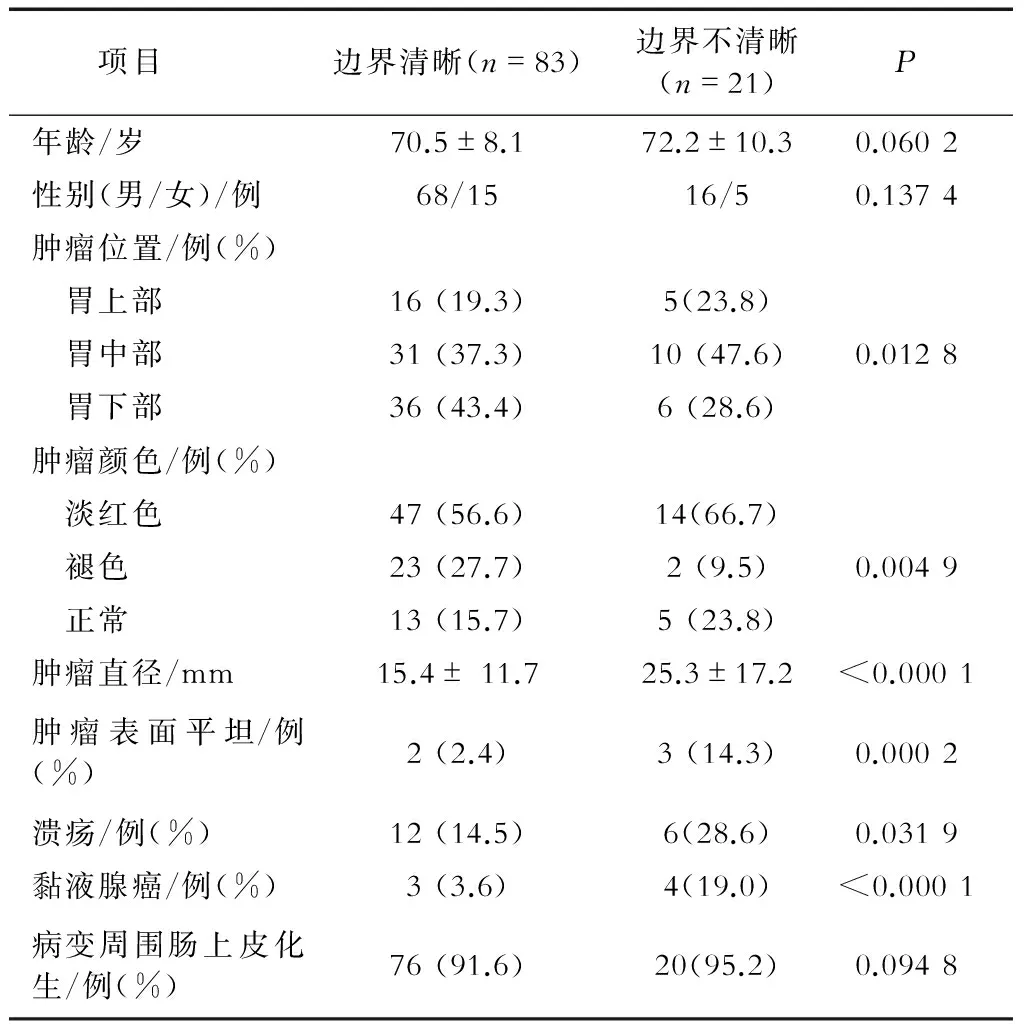
表2 早期胃癌边界清晰和不清晰的患者特征比较
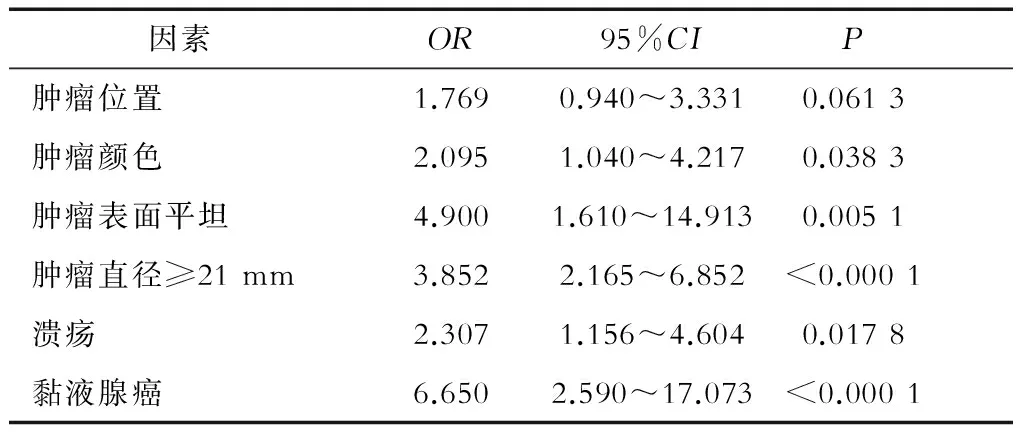
表3 多变量回归分析早期胃癌边界不清晰的相关因素
3 讨论
目前早期胃癌最主要的治疗手段是内镜下切除。以往的研究提出使用普通内镜评估早期胃癌边界的准确率是80%~85%,但是目前尚无划分边界的统一标准[4-6]。本研究利用内镜图像评估边界清晰的准确率,与以往报道的准确率相似。Asada-Hirayama等[7]的研究内容与本研究相似,但其准确率为92.6%,高于本研究和以往的研究,这可能是由于采用的内镜不一样所致,本研究使用的是普通电子内镜,而Asada-Hirayama等使用的是放大内镜。
Tanabe等报道促使胃癌边界不清晰形成的因素包括肿瘤直径≥21 mm 、肿瘤表面平坦、轻度非典型腺癌、胃黏蛋白表型(G型)腺癌、癌细胞侵入黏膜的中间部位等[3]。在本研究中,肿瘤直径≥21 mm和肿瘤表面平坦这两个相关因素与该报道是一致的,但另3个与胃癌边界不清晰相关的因素尚未见其他研究报道。要实现完全切除胃癌,就要观察促使胃癌边界不清晰形成的因素。普通胃镜检查可显示肿瘤大小和溃疡,但有时很难确定平面区域组成。放大内镜、荧光内镜等可以解决这一困难[8-9]。Yao等[10]报道用放大内镜加靛胭脂染色可以准确划定肿瘤边界。此外,Shu等[8]报道用放大内镜加靛胭脂染色可以确定普通内镜无法确定的不清晰边界,准确率是72.6%。利用这些先进成像技术可以使内镜医生更容易明确早期胃癌的边界。
本研究具有一定的局限性:(1)样本量较少,故准确率数据不一定准确;(2)本研究是回顾性研究,内镜下切除肿瘤的医生和重新评估病变的医生非同一人,也会增加评估的不准确性。
总之,本研究中有20.2%的早期胃癌在电子胃镜下表现为边界不清晰,肿瘤颜色、肿瘤表面平坦、肿瘤直径≥21 mm、溃疡和黏液腺癌等因素影响边界的划分。因此,在内镜下切除胃癌时,内镜医生在评估病变边界时应考虑导致病变边界不清晰的相关危险因素。
1 沙杰, 李学. 早期胃癌内镜诊断进展[J]. 国际消化病杂志, 2011, 31: 209-212.
2 吴德强, 王铁艳. 应用内镜诊断早期胃癌的临床分析[J]. 中医临床研究, 2010, 2: 59.
3 Tanabe H, Iwashita A, Haraoka S, et al. Pathological evaluation concerning curability of endoscopic submucosal dissection (ESD) of early gastric cancer including lesions with obscure margins[J]. Stom Intest, 2006, 41: 53-66.
4 Chen XZ, Zhang WH, Hu JK. Individualized proximal margin for early gastric cancer patients[J]. World J Gastroenterol, 2014, 20: 16793-16794.
5 Choi HS, Chun HJ, Seo MH, et al. Endoscopic submucosal tunnel dissection salvage technique for ulcerative early gastric cancer[J]. World J Gastroenterol, 2014, 20: 9210-9214.
6 Kim HH, Kim JH, Kim GH, et al. Causes of missed synchronous gastric epithelial neoplasms with endoscopic submucosal dissection: a multicenter study[J]. Scand J Gastroenterol, 2013, 48: 1339-1346.
7 Asada-Hirayama I, Kodashima S, Goto O, et al. Factors predictive of inaccurate determination of horizontal extent of intestinal-type early gastric cancers during endoscopic submucosal dissection: a retrospective analysis[J]. Dig Endosc, 2013, 25: 593-600.
8 Shu K, Jun N, Masaaki S, et al. Usefulness of magnifying endoscopy with narrow-band imaging for determining gastric tumor margin[J]. J Gastroenterol Hepatol, 2010, 25: 1636-1641.
9 Osawa H, Yamamoto H, Miura Y, et al. Diagnosis of extent of early gastric cancer using flexible spectral imaging color enhancement[J]. World J Gastrointest Endosc, 2012, 4: 356-361.
10 Yao K, Anagnostopoulos GK, Ragunath K. Magnifying endoscopy for diagnosing and delineating early gastric cancer[J]. Endoscopy, 2009, 41: 462-467.
(本文编辑:林磊)
441021湖北省襄阳市中心医院消化内科
王道蓉,Email: 1592224842@qq.com
10.3969/j.issn.1673-534X.2016.02.017
2015-09-06)

