microRNA在肝细胞癌中的临床意义
余湘南 黄晓曦
microRNA在肝细胞癌中的临床意义
余湘南黄晓曦
肝细胞癌(HCC)是世界范围内常见的消化系统恶性肿瘤,早期诊断较困难,治疗方法有限,预后总体较差。近年来微小核糖核酸(microRNA,miRNA)与HCC的关系受到重视,目前研究表明,miRNA在HCC组织或血液循环中的异常表达与HCC的发生发展相关,参与HCC的多种生物学行为,可以作为HCC诊断和预后的标志物。此外,miRNA还可以作为HCC治疗靶点以及影响HCC对化学治疗药物的敏感性。此文就miRNA在HCC中临床意义的最新研究进展作一综述。
肝细胞癌;microRNA;诊断;预后;治疗靶点
肝细胞癌(HCC)是指起源于肝细胞的恶性肿瘤,占原发性肝癌的绝大部分。HCC在全球最常见恶性肿瘤中居第6位,在肿瘤引起的死亡中居第3位[1]。目前由于HCC的早期诊断较困难、易复发、对化学治疗及放射治疗不敏感,其预后很不理想。病毒性肝炎、黄曲霉毒素、代谢因素及遗传因素等都与HCC的发生有关。中国是HCC发病的高发区,中国报道的HCC患者中大多数与乙型肝炎病毒(HBV)感染有关。
微小核糖核酸(microRNA,miRNA)是一组由20~25个核苷酸组成的非编码RNA,通过与目标mRNA的3′非翻译区结合抑制基因的表达。miRNA的表达失调与许多肿瘤的发生发展有关,如脑肿瘤、肺癌、乳腺癌、HCC、结直肠癌(CRC)及白血病等。通过以类似促癌基因或抑癌基因的方式,miRNA在肿瘤细胞的增殖、凋亡、分化、血管生成、浸润及转移的过程中扮演着重要的角色。目前miRNA与肿瘤的关系已成为研究热点,迄今已发现超过1 000种人类miRNA,其中100种以上miRNA在HCC患者中表达异常。
1 miRNA与HCC
miRNA虽不编码蛋白质,但多种miRNA在HCC的各个阶段均有异常表达,能作用于靶基因mRNA 3′非翻译区,以干扰mRNA翻译的方式负向调控基因的表达,参与HCC的多种生物学行为。在HCC异常表达的miRNA分为两类:一类在HCC组织或血液循环中高表达,在HCC患者正常组织中低表达,称为“促癌性miRNA”,如miR-106b[2]、miR-221[3]和miR-362-5p[4]等;另一类在HCC组织或血液循环中低表达,在HCC患者正常组织中高表达,称为“抑癌性miRNA”,如miR-26a[5]、miR-125b[6]和miR-195[7]等。
miRNA参与了HCC的转移。Yau等[2]的研究建立了原位HCC转移动物模型,发现miR-106b能通过上调Rho GTPases、RhoA 和RhoC的表达来促进癌细胞转移和应力纤维形成,miR-106b的这些功能与其对上皮细胞-间充质转化(EMT)的激活有关。Ni等[4]的研究发现,miR-362-5p在HCC中表达上调,通过调节其目标基因CYLD,促进肿瘤细胞的增殖和转移。异常表达的miRNA通过调控B细胞淋巴瘤因子-2(Bcl-2)家族,引起促凋亡和抑凋亡蛋白表达失衡,导致线粒体膜通透性改变,从而参与线粒体介导的细胞凋亡。如miR-221作为促癌miRNA,在50%~70%HCC患者中表达上调,能作用于促凋亡蛋白Bmf,使其表达下调[3];miR-125b可通过抑制抑凋亡蛋白Mcl-1和Bcl-w,降低线粒体膜电位,加快天冬氨酸特异性半胱氨酸蛋白酶-3(caspase-3)酶原裂解,促进细胞凋亡[6]。miRNA可通过调节细胞周期蛋白、细胞周期蛋白依赖性激酶(CDK)与CDK抑制剂来影响细胞增殖,从而引起细胞增殖与凋亡的失衡,有利于肿瘤形成。如在HCC中表达显著下调的miR-195通过作用于细胞周期蛋白D1、CDK6和细胞周期调控蛋白E2F3,抑制Rb-E2F信号通路,阻断G1/S的转化[7]。还有些microRNA可以调节HCC的血管生成。如PIK3C2α是miR-26a的下游靶基因,miR-26a可以通过PIK3C2α/Akt/HIF-1α/VEGFA信号通路负向调节HCC的血管生成[5]。
2 miRNA在HCC中的临床意义
2.1miRNA与HCC的诊断
灵敏度高和特异度高的诊断标志物对于HCC的早期诊断和筛查是至关重要的。长期以来,血清甲胎蛋白(AFP)最常用于HCC的诊断,但其灵敏度和特异度均不高,尤其是用于HCC早期诊断(肿瘤<3 cm),而且在肝炎和肝硬化患者中,AFP也可有升高。许多miRNA在HCC中表达失调,这预示着miRNA检测在HCC诊断中的潜在价值。近年来研究发现,miRNA在血液循环中具有高度稳定性,能作为一种较好的标志物,特别适用于HCC的早期诊断[8]。
2.1.1单一miRNA检测的诊断价值有研究报道,miR-21在HCC组血浆中的表达水平比慢性肝炎组和健康对照组显著升高,miR-21的受试者工作特征曲线(ROC曲线)分析表明,鉴别HCC组和健康组时,曲线下面积(AUC)为0.953,灵敏度为87.3%,特异度为92.0%,鉴别HCC组和慢性肝炎组时,AUC为0.773,灵敏度为61.6%,特异度为83.3%,两组值均优于AFP检测[9]。有研究将miR-18a用于鉴别乙型肝炎病毒(HBV)阳性的HCC组和健康对照组,AUC为0.881,灵敏度为86.1%,特异度为75.0%;鉴别HCC和慢性肝炎或肝硬化时,AUC为0.775,灵敏度为77.2%,特异度为70.0%[10]。上述研究结果可见,单一miRNA检测用于鉴别HCC患者和健康人群的诊断价值较高,但用于鉴别HCC患者与肝炎或肝硬化患者则并不理想。
2.1.2多个miRNA联合检测或miRNA联合HCC传统诊断标志物的诊断价值在一项回顾性队列研究中,miR-15b和miR-130b联合检测用于临床验证HCC,AUC为0.98,灵敏度为98.2%,特异度为91.5%,即使在AFP<20 ng/mL的HCC亚组中,诊断HCC的灵敏度也达96.7%,诊断HCC早期阶段的特异度和灵敏度优于AFP[11]。在鉴别HCC和慢性肝病方面,miR-16比传统标志物AFP、甲胎蛋白异质体比值(AFP-L3% )、脱-γ-羧基凝血酶原(DCP)的灵敏度高,而miR-16、AFP、AFP-L3%、DCP联合检测的灵敏度(92.4%)高于这4种标志物单一检测的灵敏度[12]。上述研究结果可见,多个miRNA联合检测或miRNA联合HCC传统诊断标志物检测对于HCC有较高的诊断价值,但这些研究的样本较少,结果还需要不同种族的大样本试验的验证。
miRNA可以作为HCC的诊断方法,但其有不足之处,因为HCC分期、肝损害严重程度、化学治疗史、合并症等因素都会影响HCC患者血液循环中miRNA的表达[13]。因此,当用血循环miRNA表达谱来诊断HCC时要将这些因素考虑在内。
2.2miRNA与HCC的预后
目前越来越多的研究证明miRNA可以判断HCC的预后(见表1)。Murakami等[14]的研究发现,miR-18b在HCC组织中高表达和其靶基因TNRC6B的下调可以加速肿瘤细胞增殖,减缓肿瘤细胞黏附,与HCC的不良预后有关。反之,miR-200a在HCC组织中表达下调可以提示HCC预后不良[15]。
对于HCC术后患者,肿瘤细胞的转移和复发是影响预后的两大因素。有研究表明,有些miRNA通过参与HCC的转移来影响HCC术后患者的预后。miR-17-5p在HCC组织中的表达水平比其在癌旁组织中明显升高,且miR-17-5p上调与HCC转移风险增加密切相关,Kaplan-Meier生存分析方法显示,miR-17-5p表达量低的术后患者的总生存时间和无瘤生存时间明显比表达量高的术后患者长[16]。此外,miR-185可以抑制HCC转移,miR-185表达下调能导致早期HCC患者的总生存时间缩短[17]。还有一些miRNA影响HCC术后患者的预后机制是通过参与HCC复发。Zhu等[18]的研究发现,miR-29-5p在HBV阳性HCC组织中的高表达与HCC早期复发和生存时间较短有关,miR-29-5p是HCC术后早期复发的独立预测指标。Fan等[19]的研究发现,miR-20a的表达水平在肝移植术后HCC复发的患者中显著降低,而且miR-20a下调参与了HCC复发,提示HCC预后不良。
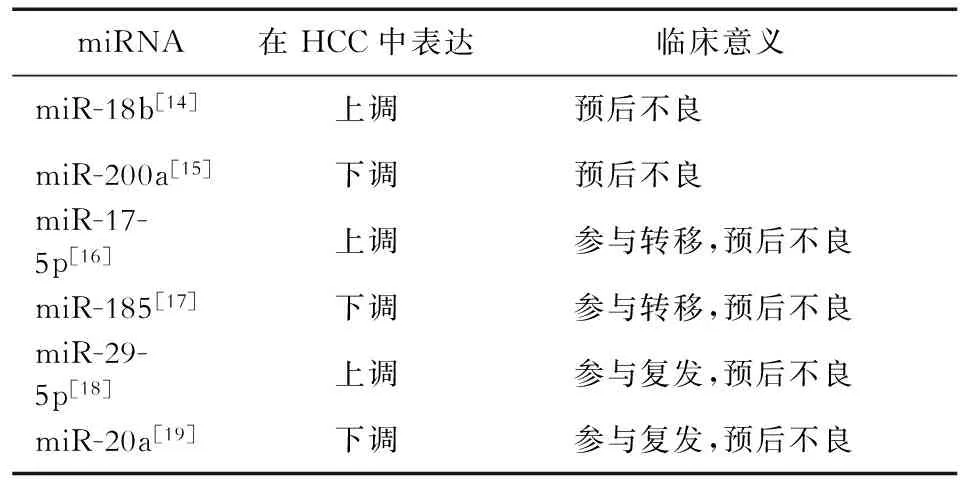
表1 一些miRNA在HCC预后中的作用
近年来的研究表明,有些miRNA中的单核苷酸多态性(SNP)与HCC的预后有关。Xie等[20]的研究发现,携带let-7中的rs10877887 C等位基因的HCC患者的死亡风险明显比那些携带T等位基因的HCC患者高,let-7中的rs10877887 SNP可以作为HCC患者预后的预测指标。Qi等[21]的研究发现,miR-106b-25中的rs999885(A→G)SNP可以改善中国人群中HBV阳性的中晚期HCC患者的预后。这些结果还需经过不同人群的大样本研究的验证。
2.3miRNA与HCC的治疗
目前治疗HCC的主要方法有外科手术、血管介入、射频消融术、化学治疗和放射治疗等,但HCC患者总的5年生存率仍很不理想。许多miRNA的异常表达在HCC的发生发展中起着促癌或抑癌的作用,这为HCC的治疗提供了新思路与新方向。
miRNA可以作为HCC的治疗靶点。有研究表明,可以上调或补充抑癌性miRNA,从而在HCC中表达发挥其抗癌作用。在小鼠HCC模型中,利用阳离子脂质纳米粒作为媒介,向模型中导入miR-122拟似物,发现其可负向调节HCC细胞增殖与血管新生[22]。另有研究发现,用溶瘤腺病毒载体使得miR-34a 和白细胞介素-24(IL-24)在HCC体内外模型中过表达,可发挥抗癌作用[23]。MRX34是第一种用于临床试验的miRNA拟似物,能补充或替代miR-34在HCC中的表达,从而抑制癌细胞生长,促进癌细胞凋亡。有些miRNA在HCC中呈高表达,可促进HCC的发生发展,可应用反义寡核苷酸技术沉默其表达,从而抑制其促癌作用。如在小鼠HCC模型中,胆固醇偶联miR-221反义寡核苷酸能明显下调HCC中miR-221的表达水平,从而抑制癌细胞增殖,提高小鼠的存活率[24]。有研究设计出能作用于miR-96发夹前体的小分子,其取自寡核苷酸序列,能抑制miRNA-96发夹前体生物合成,从而发挥抗肿瘤作用[25]。
miRNA可以影响HCC对化学治疗药物的敏感度(见表2)。HCC细胞被转染miR-21前体后,明显对干扰素-α/5-氟尿嘧啶(IFN-α/5-FU)联合治疗不敏感,而且miR-21的表达水平与HCC对IFN-α/5-FU联合治疗的耐受有关[26]。另有研究表明,在用吲哚-3-甲醇(I3C)治疗的HCC细胞中,miR-21的表达显著下调,而且应用miR-21抑制物减少miR-21的表达,可以明显提高HCC对I3C的敏感度[27]。miR-216a/217集群能够使HCC对索拉菲尼的敏感度下降[28]。而有些miRNA可以使HCC对化学治疗药物的敏感度提高。在HBV阳性的HCC中,miR-193b表达下调,应用miR-193b拟似物能使HBV阳性HCC对索拉菲尼的敏感度提高,促进索拉菲尼诱导的细胞凋亡[29]。恢复miR-101在HCC中的表达可以提高HCC对多柔比星[30]和顺铂[31]的敏感度。这些发现为化学治疗药物联合miRNA治疗HCC奠定了基础。

表2 一些miRNA对化学治疗药物治疗
miRNA为HCC的治疗开辟了新思路。在以miRNA为基础的靶向治疗中,安全有效的导入方式是靶向治疗能否成功的关键。以病毒为载体的传统导入方式会引起或加重感染细胞的免疫反应,其安全性有待提高,以非病毒为载体的导入方式的安全性较前者有所提高,但在有效性等方面有所减弱。此外,由于miRNA与目标基因之间复杂的相互作用关系,同一miRNA可以作用于多个目标基因,而同一目标基因的表达可能受多个miRNA调控,因此miRNA在HCC治疗中的脱靶效应也是需要特别注意的。
3 小结和展望
miRNA在HCC组织或血液循环中表达失调,在血液循环中稳定表达,且不编码蛋白质,一般不具有免疫原性,这些生物学特性使其可以成为HCC诊断、治疗及判断预后的手段,而且在某些方面具有很大的应用前景,如多个miRNA联合检测或miRNA联合HCC的传统诊断标志物检测用于HCC诊断以及miRNA用于HCC的靶向治疗。目前仍需解决一些问题,如miRNA作为HCC诊断及预后标志物的研究结果还需得到不同人群的大样本研究的验证,miRNA靶向基因治疗的脱靶效应以及导入方式的安全性和有效性等。相信随着研究的深入,miRNA在HCC诊断、治疗及预后中的作用将越来越重要。
1 Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2012, 379: 1245-1255.
2 Yau WL, Lam CS, Ng L, et al. Over-expression of miR-106b promotes cell migration and metastasis in hepatocellular carcinoma by activating epithelial-mesenchymal ansition process[J]. PLoS One, 2013, 8: e57882.
3 Gramantieri L, Fornari F, Ferracin M, et al. MicroRNA-221 targets Bmf in hepatocellular carcinoma and correlates with tumor multifocality[J]. Clin Cancer Res, 2009, 15: 5073-5081.
4 Ni F, Zhao F, Cui HQ, et al. MicroRNA-362-5p promotes tumor growth and metastasis by targeting CYLD in hepatocellular carcinoma[J]. Cancer Letters, 2015, 356: 809-818.
5 Chai ZT, Kong J, Zhu XD, et al. MicroRNA-26a inhibits angiogenesis by down-regulating VEGFA through the PIK3C2α/Akt/HIF-1α pathway in hepatocellular carcinoma[J]. PLoS One, 2013, 8: e77957.
6 Gong J, Zhang JP, Li B, et al. MicroRNA-125b promotes apoptosis by regulating the expression of Mcl-1, Bcl-w and IL-6R[J]. Oncogene, 2013, 32: 3071-3079.
7 Xu T, Zhu Y, Xiong Y, et al. MicroRNA-195 suppresses tumorigenicity and regulates G1/S transition of human hepatocellular carcinoma cells[J]. Hepatology, 2009, 50: 113-121.
8 Petrelli A, Perra A, Cora D, et al. MicroRNA/gene profiling unveils early molecular changes and nuclear factor erythroid related factor 2 (NRF2) activation in a rat model recapitulating human hepatocellular carcinoma (HCC) [J]. Hepatology, 2014, 59: 228-241.
9 Tomimaru Y, Eguchi H, Nagano H, et al. Circulating microRNA-21 as a novel biomarker for hepatocellular carcinoma[J]. J Hepatol, 2012, 56: 167-175.
10 Li L, Guo Z, Wang J, et al. Serum miR-18a: a potential marker for hepatitis B virus-related hepatocellular carcinoma screening[J]. Dig Dis Sci, 2012, 57: 2910-2916.
11 Liu AM, Yao TJ, Wang W, et al. Circulating miR-15b and miR-130b in serum as potential markers for detecting hepatocellular carcinoma: a retrospective cohort study[J]. BMJ Open, 2012, 2: e000825.
12 Qu KZ, Zhang K, Li H, et al. Circulating microRNAs as biomarkers for hepatocellular carcinoma[J]. J Clin Gastroenterol, 2011, 45: 355-360.
13 Borel F, Konstantinova P, Jansen PL. Diagnostic and therapeutic potential of miRNA signatures in patients with hepatocellular carcinoma[J]. J Hepatol, 2012, 56: 1371-1383.
14 Murakami Y, Tamori A, Itami S, et al. The expression level of miR-18b in hepatocellular carcinoma is associated with the grade of malignancy and prognosis[J]. BMC Cancer, 2013, 13: 99.
15 Xiao F, Zhang W, Zhou L, et al. MicroRNA-200a is an independent prognostic factor of hepatocellular carcinoma and induces cell cycle arrest by targeting CDK6[J]. Oncol Rep, 2013, 30: 2203-2210.
16 Chen L, Jiang M, Yuan W, et al. MiR-17-5p as a novel prognostic marker for hepatocellular carcinoma[J]. J Invest Surg, 2012, 25: 156-161.
17 Zhi Q, Zhu J, Guo X, et al. Metastasis-related miR-185 is a potential prognostic biomarker for hepatocellular carcinoma in early stage[J]. Biomed Pharmacother, 2013, 67: 393-398.
18 Zhu HT, Dong QZ, Sheng YY, et al. MicroRNA-29a-5p is a novel predictor for early recurrence of hepatitis B virus-related hepatocellular carcinoma after surgical resection[J]. PLoS One, 2012, 7: e52393.
19 Fan MQ, Huang CB, Gu Y, et al. Decrease expression of microRNA-20a promotes cancer cell proliferation and predicts poor survival of hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2013, 32: 21.
20 Xie K, Liu J, Zhu L, et al. A potentially functional polymorphism in the promoter region of let-7 family is associated with survival of hepatocellular carcinoma[J]. Cancer Epidemiol, 2013, 37: 998-1002.
21 Qi F, Huang M, Pan Y, et al. A genetic variant in the promoter region of miR-106b-25 cluster predict clinical outcome of HBV-related hepatocellular carcinoma in Chinese[J]. PLoS One, 2014, 9: e85394.
22 Hsu SH, Yu B, Wang X, et al. Cationic lipid nanoparticles for therapeutic delivery of siRNA and miRNA to murine liver tumor[J]. Nanomedicine, 2013, 9: 1169-1180.
23 Lou W, Chen Q, Ma L, et al. Oncolytic adenovirus co-expressing miRNA-34a and IL-24 induces superior antitumor activity in experimental tumor model[J]. J Mol Med(Berl), 2013, 91: 715-725.
24 Park JK, Kogure T, Nuovo GJ, et al. MiR-221 silencing blocks hepatocellular carcinoma and promotes survival[J]. Cancer Res, 2011, 71: 7608-7616.
25 Velagapudi SP, Gallo SM, Disney MD. Sequence-based design of bioactive small molecules that target precursor microRNAs[J]. Nat Chem Biol, 2014, 10: 291-297.
26 Tomimaru Y, Eguchi H, Nagano H, et al. MicroRNA-21 induces resistance to the anti-tumour effect of interferon-α/ 5-fluorouracil in hepatocellular carcinoma cells[J]. Br J Cancer, 2010, 103: 1617-1626.
27 Wang X, He H, Lu Y, et al. Indole-3-carbinol inhibits tumorigenicity of hepatocellular carcinoma cells via suppression of microRNA-21 and upregulation of phosphatase and tensin homolog[J]. Biochim Biophys Acta, 2015, 1853: 244-253.
28 Xia H, Ooi LL, Hui KM. MicroRNA-216a/217-induced epithelial-mesenchymal transition targets PTEN and SMAD7 to promote drug resistance and recurrence of liver cancer[J]. Hepatology, 2013, 58: 629-641.
29 Mao K, Zhang J, He C, et al. Restoration of miR-193b sensitizes Hepatitis B virus-associated hepatocellular carcinoma to sorafenib[J]. Cancer Lett, 2014, 352: 245-252.
30 Xu L, Beckebaum S, Iacob S, et al. MicroRNA-101 inhibits human hepatocellular carcinoma progression through EZH2 downregulation and increased cytostatic drug sensitivity[J]. J Hepatol, 2014, 60: 590-598.
31 Xu Y, An Y, Wang Y, et al. MiR-101 inhibits autophagy and enhances cisplatin-induced apoptosis in hepatocellular carcinoma cells[J]. Oncol Rep, 2013, 29: 2019-2024.
(本文编辑:林磊)
单位:570000海口,中南大学湘雅医学院附属海口医院消化内科
通信作者:黄晓曦,Email: 383086040@qq.com
10.3969/j.issn.1673-534X.2016.02.009
2015-07-08)

