硫化氢对肝硬化门脉高压症大鼠胃窦Cajal间质细胞及神经元的影响
黄 蔚 钱静蓉
·基础研究·
硫化氢对肝硬化门脉高压症大鼠胃窦Cajal间质细胞及神经元的影响
黄蔚钱静蓉
肝硬化门脉高压症患者常伴有胃动力障碍,表现为胃排空延迟、胃电节律紊乱、胃动力相关激素异常等,但目前仍无一致性结论。Cajal间质细胞(ICC)是分布于胃肠道的一种与神经密切联系的间质细胞,主要参与胃肠道慢波电活动,是胃肠道的起搏细胞,与肝硬化胃肠动力障碍有关[1-2]。硫化氢(H2S)被称为是第三种气体信号分子,近年来的研究发现在消化道中也能产生H2S,且对胃动力具有双重调节作用[3]。本研究通过观察H2S干预后肝硬化门脉高压症大鼠胃窦ICC和神经元的变化,以探讨H2S对胃动力的影响。
1 材料与方法
1.1材料
SPF级健康SD大鼠共30只,体质量224.60±12.98 g,购于第二军医大学动物中心[许可证号SCXK(沪)2013-0016];硫氢化钠(NaHS)购于国药集团化学试剂有限公司(生产批号:20121123);硫代乙酰胺(TAA)购于常州千杏生物科技有限公司(生产批号:20130125)。SD大鼠饲养于中国人民解放军海军医学研究所,温度18℃~22℃,湿度50%左右,按实验要求提供相应饲料,自由进食和饮水。
1.2方法
1.2.1动物造模及药物干预适应性喂养1周后,参照随机数字表随机分为3组:造模组10只,H2S干预组10只,正常对照组10只,给予编号、称重,饲以普通饲料并自由进食及饮水。造模组采用TAA制备肝硬化门脉高压症大鼠模型方法,制备3% TAA(1.5 g TAA溶于50 mL水中),隔日每100 g大鼠注射0.33 mL,造模时间为9周[4-5]。H2S干预组在造模组基础上每日腹腔注射NaHS(体外实验H2S的常用供体) 10 μmol · kg-1· d-1,造模时间为9周。正常对照组:常规喂养,自由饮水及觅食。各组每周称重并记录,根据体质量调节药物用量。
1.2.2胃黏膜大体标本制备造模9周后大鼠禁食12 h,饮水,3%戊巴比妥0.1 mL/100 g腹腔内麻醉后暴露腹腔取出全胃,以0.9% NaCl溶液冲洗胃内容物,剪取胃窦部2 mm×4 mm大小的组织两块,其中一块放入4%多聚甲醛固定石蜡包埋,4 μm厚连续切片,行HE染色。另一块胃窦组织-80℃保存待用。
1.2.3肝功能及凝血酶原时间测定以Bayer1650全自动生化分析仪测定血清丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、总胆红素(TBiL)含量,Philips IU22全自动凝血分析仪检测血浆凝血酶原时间(PT)和国际标准化比值(INR)。
1.2.4免疫组织化学染色检测胃窦组织c-kit蛋白表达胃窦标本放入4%甲醛溶液中固定24 h,常规梯度乙醇脱水,石蜡包埋。切片放入二甲苯和乙醇中脱蜡至水,蒸馏水冲洗;EDTA抗原修复,0.01 mmol/L磷酸盐缓冲液(PBS)洗涤5 min×3次;3% H2O2放入湿盒中室温避光孵育25 min,0.01 mmol/L PBS洗涤5 min×3次;组化笔在组织周围画圈封闭非特异性抗原,3%牛血清白蛋白(BSA)均匀覆盖组织,室温封闭30 min,甩干;滴加1∶50 c-kit一抗,4℃过夜,次日0.01 mmol/L PBS洗涤5 min×3次;滴加1∶1二抗,室温孵育50 min,0.01 mmol/L PBS洗涤5 min×3次;滴加DAB显色液,室温避光显色10 min,水洗终止显色,苏木素复染,常规脱水、透明、树脂封片,光镜下先定性观察,400倍高倍镜下每张切片挑选3个视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0图像分析系统计算c-kit蛋白的累积光密度(IOD)值。1.2.5免疫荧光实验检测胃窦组织胆碱能神经元胃窦标本以0.01 mmol/L PBS漂洗5min×3次,组化笔在组织周围画圈封闭非特异性抗原,3% BSA均匀覆盖组织,室温封闭30 min;滴加1∶100 ChAT一抗,4°C过夜,次日0.01 mmol/L PBS洗涤5 min×3次;滴加1∶400荧光二抗,室温孵育50 min,0.01 mmol/L PBS洗涤5 min×3次。荧光显微镜下观察,每只大鼠取6张铺片,在200倍高倍镜下每张铺片随机取2个视野,应用Image-Pro Plus 6.0图像分析系统计算ChAT阳性神经的IOD值。
1.3统计学处理

2 结果
2.1造模情况
H2S干预组有1只大鼠在第7周死亡,造模组有2只大鼠分别在第6周及第8周死亡,故最终27只大鼠存活,正常对照组10只,H2S干预组9只,造模组8只。
2.2肝功能和PT测定
造模组ALT和TBiL水平明显高于正常对照组(P=0.042,P=0.025),H2S干预后两个指标都有所下降,但与造模组相比较,差异无统计学意义(P=0.311,P=0.058)。3组间ALB、PT、INR水平相比较,差异均无统计学意义(P>0.05)。见表1。
2.3胃窦组织c-kit蛋白表达
光镜下免疫组织化学染色显示c-kit阳性ICC呈棕黄色,位于环形肌与纵行肌之间,肌间分布较明显,形状以圆形、细长型较多见。模型组胃窦c-kit阳性ICC染色浅,分布少,明显低于正常对照组(P=0.026);H2S干预后胃窦c-kit阳性ICC染色加深,分布明显增加,与造模组相比较,差异有统计学意义(P=0.035)。见图1、表2。
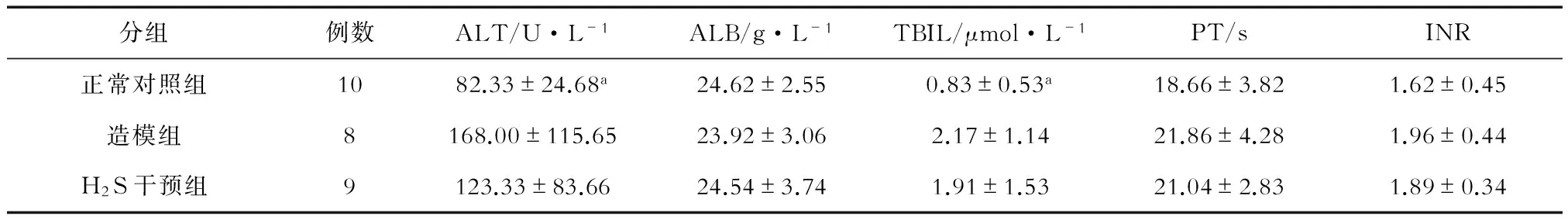
表1 各组大鼠肝功能及凝血酶原时间比较
注:与造模组相比较,aP<0.05

图1 免疫组织化学检测胃窦组织c-kit蛋白表达情况(×400) A H2S干预组 B 造模组 C 正常对照组
2.4胃窦组织ChAT免疫荧光实验
免疫荧光染色显示,ChAT抗体可使胆碱能神经元和神经纤维染色,但神经元边界不甚清楚,辨认较为困难。与正常对照组相比较,造模组兴奋性胆碱能神经IOD值明显降低(P=0.000),给予H2S干预后指标明显提高,与造模组相比较,差异有统计学意义(P=0.01)。见图2、表2。

表2 各组大鼠c-kit蛋白和ChAT阳性神经元比较
注:与造模组相比较,aP<0.05,bP<0.01
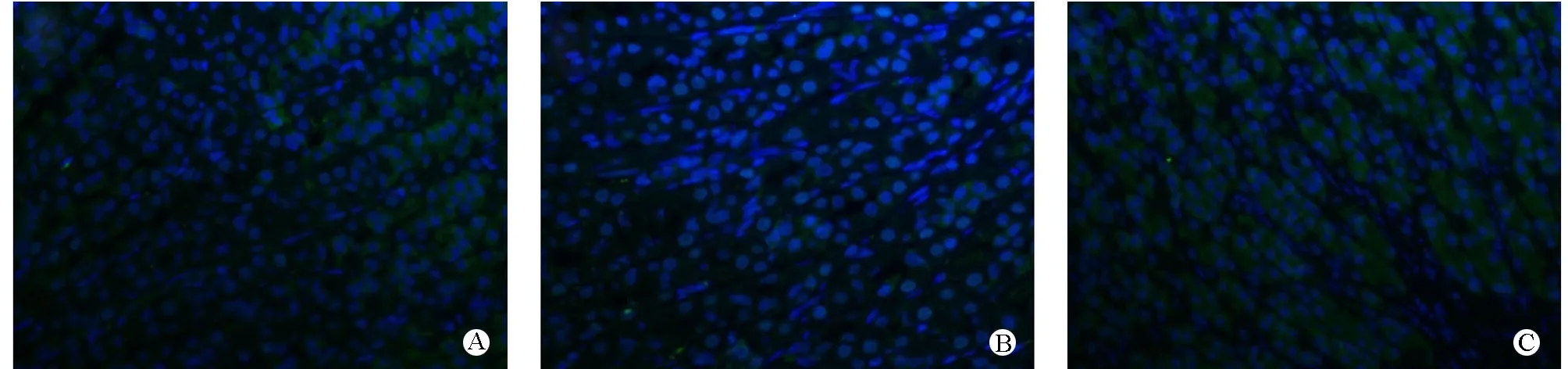
图2 免疫荧光检测ChAT阳性神经元表达(×200) A H2S干预组 B 造模组 C 正常对照组
3 讨论
胃肠道动力是由ICC、平滑肌细胞和肠神经共同调控的。肝硬化门脉高压症患者由于门静脉压力升高,出现腹水、脾大和门体侧支循环形成等一组临床综合征,存在明显胃肠动力障碍,表现为食欲减退、恶心、腹胀等症状,导致进食减少,加重营养不良的发生。近年来研究显示,胃肠道ICC数量减少及超微结构改变、胃肠道神经元病变可能与发病有关,本课题组前期研究发现,肝硬化门脉高压症大鼠胃窦ICC数量明显减少,胞浆空泡变性,核周异染色质增加,核周间隙增宽[6]。
H2S是一种第三类气体信号分子,哺乳动物的内源性H2S主要以半胱氨酸为底物,由胱硫醚-β-合成酶(CBS)和胱硫醚-γ-裂解酶(CSE)代谢生成。H2S具有舒张血管、降低血压、抑制血管平滑肌细胞增生和心肌负性肌力的多种生物学效应[7-8]。有研究发现,CSE在肝细胞和星状细胞表达,星状细胞活化时,CSE含量下降,H2S合成减少,对Ⅰ、Ⅲ型胶原蛋白的抑制降低[9]。H2S可能通过以下途径参与肝硬化门静脉高压的形成:(1)参与调节平滑肌舒张;(2)抑制血管平滑肌细胞增殖;(3)诱导平滑肌细胞凋亡[10]。
本课题组前期通过预防性给予肝硬化门脉高压症大鼠NaHS后观察到,胃窦ICC超微结构明显改善,细胞数量增加[6],提示H2S可显著减轻ICC损伤。c-kit是ICC的一种跨膜蛋白,其配体干细胞因子(SCF)由神经元细胞和平滑肌细胞产生,对于促进ICC生长、分化和维持ICC正常生理功能具有重要作用,通过标记c-kit蛋白能够间接反映ICC的数量和密度。本研究结果显示H2S干预组胃窦组织c-kit蛋白表达较造模组明显增加,提示H2S对胃窦ICC具有保护作用。张观坡等[11]研究认为,H2S对缺血再灌注大鼠小肠回缩功能具有保护作用,其机制可能与减轻肠神经元尤其是兴奋性神经元的损伤有关。免疫荧光结果亦证实,与造模组相比较,H2S组肌间神经丛兴奋性胆碱能神经元的IOD值明显升高,提示H2S对胃窦运动功能保护作用的主要机制为减轻兴奋性神经元的损伤。
研究证实,H2S能促进微血管内皮细胞增殖及血管形成,抑制血管基质重塑[12],其机制有以下几种可能:(1)促进细胞外信号调节激酶(ERK)1/2、p38分裂原激活蛋白激酶(p38 MAPK)的磷酸化;(2)增加血管平滑肌细胞中血管内皮因子的表达及血管内皮细胞中血管内皮生长因子受体的磷酸化;(3)激活下游蛋白激酶B(Akt)信号转导途径,直接激活磷脂酰肌醇3-激酶(PI3K)/Akt/survivin信号通路;(4)上调黏附分子(如整合素αvβ3)的表达。此外,H2S作为一种潜在的舒血管物质,通过打开血管平滑肌细胞上ATP敏感性钾离子(KATP)通道或电压依赖性钾离子通道直接诱导血管舒张[13-14]。由此可见,H2S减轻胃窦ICC和神经元损伤是否与其具有保护血管内皮细胞的功能有关,仍有待进一步研究。
本研究结果显示,H2S能够减轻肝硬化门脉高压症大鼠胃窦起搏细胞ICC的损伤,降低门脉高压对胃窦神经元尤其是兴奋性神经元的损害,为以H2S为供体的药物用于临床治疗提供了理论基础。
1 翁超, 袁琴, 范莹. Cajal间质细胞的研究进展[J]. 世界华人消化杂志, 2012, 20: 1848-1852.
2 朱金照, 王艳丽, 吕勇, 等. 肝硬化大鼠小肠Cajal间质细胞超微结构及平滑肌细胞线粒体膜电位的变化[J].中华实验和临床感染病杂志(电子版), 2010, 4: 278-282.
3 刘颖, 罗和生. 硫化氢与消化道动力的研究进展[J]. 胃肠病学, 2015, 20: 52-54.
4 张谊, 张启瑜, 廖毅, 等. 硫代乙酰胺剂量个体化诱导大鼠肝硬化门脉高压模型[J]. 肝胆胰外科杂志, 2007, 19: 164-167.
5 Abraldes JG, Pasarín M, García-Pagán JC. Animal models of
portal hypertension[J]. World J Gastroenterol, 2006, 12: 6577-6584.
6 钱静蓉, 黄蔚. 硫化氢对肝硬化门脉高压症大鼠胃窦Cajal间质细胞超微结构的影响[J]. 中南药学, 2015, 13: 609-612.
7 Huang Q, Sparatore A, Del Soldto P, et al. Hydrogen sulfide releasing aspirin, ACS14, attenuates high glucose-induced increased methylglyoxal and oxidative stress in cultured vascular smooth muscle cells[J]. PLoS One, 2014, 9: e97315.
8 Olas B. Hydrogen sulfide in hemostasis: friend or foe[J]. Chem Biol Interact, 2014, 217: 49-56.
9 王慧, 任嫱, 陈卫刚, 等. PI3K/Akt信号转导通路在硫化氢影响肝星状细胞Ⅰ和Ⅲ型胶原表达中的作用[J].中华肝脏病杂志, 2014, 22: 430-433.
10 宋丽秀, 郑勇. 气体信号分子在肝硬化门静脉高压形成中的作用[J]. 世界华人消化杂志, 2009, 17: 1962-1966.
11 张观坡, 高峻, 李桂香, 等. 硫化氢对大鼠肠缺血再灌注后回肠收缩活性的保护作用[J]. 胃肠病学, 2012, 17: 119-123.
12 索荣, 姜志胜. 硫化氢与血管内皮细胞的功能[J]. 心血管病学进展, 2012, 33: 54-56.
13 Linden DR. Hydrogen sulfide signaling in the gastrointestinal tract[J]. Antioxid Redox Signal, 2014, 20: 818-830.
14 Li YB, Zhang GZ, Yang XC, et al. Effect of hydrogen sulfide on the KATP current in isolated rat ventricular myocytes[J]. Zhonghua Xin Xue Guan Bing Za Zhi, 2009, 37: 445-448.
(本文编辑:周骏)
上海市卫生和计划生育委员会课题(20124211)
200333上海市利群医院消化科
10.3969/j.issn.1673-534X.2016.02.014
2015-11-25)

