清肺理痰方对急性肺损伤大鼠肺组织NF-κB 和Toll样受体4表达的影响*
王 凯 潘俊辉 王 鹏(广州医科大学附属第一医院,广东 广州 510120)
清肺理痰方对急性肺损伤大鼠肺组织NF-κB 和Toll样受体4表达的影响*
王凯潘俊辉△王鹏
(广州医科大学附属第一医院,广东 广州 510120)
目的 研究清肺理痰方对脂多糖(LPS)诱导的急性肺损伤(ALI)大鼠肺组织NF-κB和Toll样受体4表达的影响。方法 SD大鼠72只,随机分为正常对照组、模型对照组,地塞米松组、清肺理痰方低、中、高剂量组,共6组,每组12只。各治疗组大鼠按试验剂量给予相应浓度的药液,每日1次,连续7 d。末次给药1 h后,模型组与各治疗组大鼠采用气管内每只注射0.2 mL mg/mL的脂多糖溶液复制急性肺损伤模。24 h后取肺组织进行HE染色观察肺组织病理变化,采用ELISA法检测大鼠血清IFN-γ浓度,用Western Blot法和qRT-PCR法测定大鼠肺组织NF-κB p65和TLR4蛋白和mRNA的表达。结果 与正常对照组比较,模型对照组大鼠肺组织呈现明显的肺组织损伤,血清IFN-γ浓度上升,NF-κB p65和TLR4蛋白和mRNA的表达明显升高(P<0.01);与模型对照组比较,清肺理痰方低、中、高剂量组血清IFN-γ浓度下降,NF-κB P65和TLR4蛋白和mRNA的表达明显降低(P<0.01),且中、高剂量组低于低剂量组。结论 清肺理痰方能改善内毒素诱导的急性肺损伤大鼠肺组织的损伤,对肺组织损伤有一定的保护作用,其机制可能与抑制肺组织NF-κB和TLR4 mRNA表达有关。
急性肺损伤清肺理痰方核转录因子-κBTLR4
【Abstract】Objective:To investigate the role of LPS(lipopolysaccharide)in acute lung injury(ALI)and protective effect of Qingfei Litan(QFLT)decoction.Methods:72 SD male rats were randomly divided into 6 groups:the normal control group,the model group,dexamethasone group and QFLT low-dose,middle-dose,high-dose group,12 rats in each group.The experiment lasted for 7 d.LPS(8 mg/mL)was injected into the trachea of rats to perform ALI model.The normal control group and the model group were given the same volume of physiological saline.After 24 hours,Western Blot and qRT-PCR were used to detect NF-κB andTLR4 mRNA and protein in lung tissue.The pathological manifestation of the lung was observed.Results:Compared with the normal group,the expressions of the levels of IFN-γ,NF-κB p65 and TLR4 mRNA and protein was significantly higher in QFLT group(P<0.01);compared with the model group,the expressions of the levels of IFN-γ,NF-κB p65 and TLR4 mRNA and protein was significantly lower(P<0.01).High dose group was lower than that of low dose group.Conclusion:Qingfei Litan decoction can less the injury of lung tissue and has protective effects on rats with ALI induced by LPS.The mechanism is possibly related to the inhibition of the expressions of NF-κB and TLR4 mRNA in injured lung tissues.
【Key words】Acute lung injury;QFLT decoction;NF-κB;Toll-like receptor 4
急性肺损伤(ALI)是肺部的全身炎症反应表现,炎性介质调控失衡在ALI的发病过程中起重要作用,细胞因子则构成了ALI炎症反应网络。如何通过中医药的干预来调控ALI的分子机制已成为治疗ALI的重要研究方向。
清肺理痰方源自国家中医药管理局 《风温肺热病中医诊疗方案》[1-2],在本课题前期的临床研究中疗效显著[3],并且本课题组在前期动物实验中初步探讨了其对NF-κB信号通路的蛋白表达的作用机制[4]。Toll样受体4(TLR4)作为脂多糖(LPS)的重要受体[5],通过刺激细胞内信号转导通路影响ALI的表达机制,在前期研究基础上,深入研究清肺理痰方对脂多糖内毒素诱导的急性肺损伤大鼠肺组织NF-κB和TLR4表达的影响,进一步明确ALI的发病机制,为中医药治疗ALI提供新的分子治疗靶点。现报告如下。
1 材料与方法
1.1实验动物
SPF级品系和级别:SPF级SD大鼠,雌雄各半,72只,200~220 g,由广东省医学实验动物中心提供,实验动物生产许可证号为SCXK(粤)2013-0002,实验动物质量合格证明编号为44007200019456、44007200021999,实验证明编号为00110197、00114773;专用标准饲料、水喂养。
1.2药物与试剂
清肺理痰方由青天葵10 g,石膏30 g,瓜蒌皮15 g,黄芩15 g,浙贝母 15 g,鱼腥草20 g,芦苇茎15 g,北杏仁10 g,桔梗15 g,甘草10 g组成,药物饮片购于广州医科大学附属第一医院,实验前由武汉康乐药业有限公司制成中药浸膏,4℃冰箱备用。地塞米松磷酸钠注射液(天津金耀集团湖北天药药业股份有限公司,批号:51411032);脂多糖内毒素 (Escherichia coli,055:B5,Sigma公司);IFN-γ试剂盒(购于武汉华美生物工程有限公司,批号:J27013191)。一抗p65,一抗TLR4(生产商:abcam);大鼠NF-κB、TLR4引物探针序列由广州莱德尔生物科技有限公司合成。
1.3仪器
BS224S电子分析天平(感量0.0001g,德国Sartorius)、KDC-2046低速冷冻离心机(科大创新股份有限公司中佳分公司)、酶标仪(赛默飞世尔仪器有限公司,序列号:3530910449)、超声仪细胞破碎仪(宁波新芝生物科技股份有限公司,JY92-IIN)。
1.4分组与给药
大鼠随机分为正常对照组、模型对照组、地塞米松组及清肺理痰方低、中、组高剂量组,共6组,每组12只。根据人与动物药物剂量换算公式[6],经过提取后对应中药浸膏每剂36.47 g,每只大鼠所对应的相对剂量为3.95 g/kg,再结合本课题前期动物实验研究[4],低剂量组3.95 g/kg体质量,中剂量组7.90 g/kg体质量,高剂量组15.80 g/kg体质量。第1~7日,清肺理痰方低、中、高剂量组动物分别灌胃给予相应的药物,灌胃体积为12 mL/kg体质量,每日1次。第6、7日,地塞米松组动物腹腔注射地塞米松磷酸钠注射液,每日1次,连续2 d,腹腔注射体积为1mL/kg体质量。
1.5模型制备
末次给药1 h后,制作急性肺损伤模型[7-8]。经水合氯醛麻醉后,模型对照组、地塞米松组和低、中、高剂量组的动物分别用注射器经气管注入8 mg/mL的脂多糖溶液,正常对照组注入等体积0.9%氯化钠注射液,每只0.2 mL。
1.6标本采集与检测
造模后24 h,动物3%戊巴比妥钠麻醉,腹主动脉取血,约0.5 mL至EDTA-K2抗凝真空采血管,约4 mL至普通真空采血管,2500 r/min离心10 min,吸取上层血清分装于2个EP管中,标记,-20℃保存,备用,ELISA法测定其IFN-γ含量。剪取左肺,计算湿/干重比;分离右肺上叶,用4%中性甲醛固定,待检,用于病理检测及肺组织NF-κB和TLR4 mRNA蛋白表达检测;右肺下叶置于液氮罐中作NF-κB和TLR4 mRNA表达检测。
1.6.1肺组织病理学观察右上肺组织用4%中性甲醛固定,常规HE染色,光镜下观察组织变化。制作好的H.E染色切片置于光学显微镜下,从低倍到高倍,观察SD大鼠肺组织有无肺水肿、肺出血、炎性细胞浸润、肺泡壁增厚、小气道损伤等病理改变。按程度积分总和,作为肺损伤程度积分,评分方法参照相关文献[9]。
1.6.2血清IFN-γ检测将以上装有全血的促凝管静置1 h,2500 r/min离心10 min,吸取上层血清分装到EP管中-20℃冻存待测。ELISA双抗体夹心法测定血清IFN-γ的含量,操作步骤严格按照试剂盒说明书进行。
1.6.3Western Blot法检测肺组织中NF-κB p65和TLR4蛋白的表达采用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)法,使用BeyoECL Plus(P0018)等ECL类试剂来检测肺组织中NF-κB p65和TLR4蛋白的表达,用FluorChemQ多功能成像和定量分析系统将胶片成像。
1.6.4实时荧光定量PCR法检测肺组织中NF-κB p65和TLR4 mRNA的表达按美国Invitrogen公司Trizol试剂提取总RNA后,逆转录合成cDNA。12 μL反应体系中,10 mmol/L dNTP 1 μL,随机引物1 μL,标本RNA 2 μg,混匀后于65℃5 min,快速插入冰水中,离心,冰上加入:5×buffer 4 μL,DTT(100 mmol/L)2 μL,RNAsin(40 U/μL)1 μL,M-MLVRT反转录酶(200 U/μL)1 μL,37℃50 min,70℃15 min,-20℃保存。PCR扩增:Sybr green 10 μL,上游引物(5 μmol/L)2 μL,下游引物(5 μmol/L)2 μL,反转录产物2 μL,扩增条件:1)95℃10 s;2)95℃5 s,60℃20 S,40个循环。
1.7统计学处理
2 结 果
2.1各组大鼠肺组织病理学形态观察及肺损伤指数光镜观察:正常对照组肺泡结构清晰,肺泡壁薄,肺间质无炎细胞浸润,肺泡内未见水肿液和肺出血。模型对照组各级支气管黏膜上皮细胞部分变性、脱落,间隔增厚,间隔内及肺泡腔明显中性粒细胞浸润。地塞米松组见上皮细胞部分变性、脱落,肺泡间隔轻度增厚,中性粒细胞明显浸润。清肺理痰方各组大鼠肺组织病理改变轻于模型组,肺泡间间隔增厚,中性粒细胞浸润减轻,未见肺水肿和肺出血(见图1)。肺损伤的轻重程度评分:与正常对照组比较,模型对照组肺损伤的评分明显升高(P<0.05)。与模型对照组比较,地塞米松组和清肺理痰方各组肺损伤的评分水平明显降低 (P< 0.05)。见表1。
表1 各组大鼠血清IFN-γ水平、肺损伤指数比较(±s)
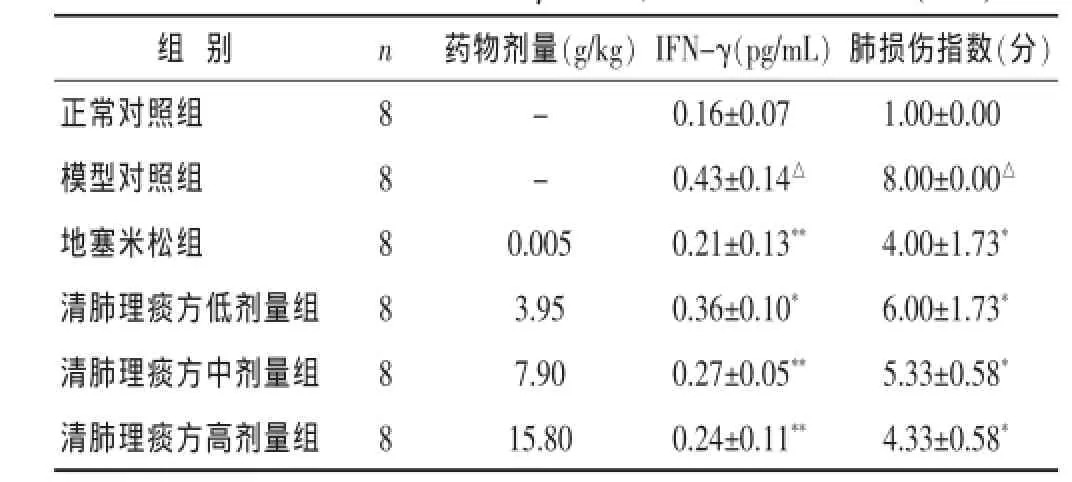
表1 各组大鼠血清IFN-γ水平、肺损伤指数比较(±s)
与模型组比较,*P<0.05,**P<0.01;与正常对照组比较,△△P<0.01。下同。
药物剂量(g/kg)IFN-γ(pg/mL)- 0.16±0.07- 0.43±0.14△0.005 0.21±0.13**清肺理痰方低剂量组 8 6.00±1.73*组别 n 肺损伤指数(分)正常对照组 8 1.00±0.00模型对照组 8 8.00±0.00△地塞米松组 8 4.00±1.73*3.95 0.36±0.10*清肺理痰方中剂量组 8 7.90 0.27±0.05** 5.33±0.58*清肺理痰方高剂量组 8 15.80 0.24±0.11** 4.33±0.58*
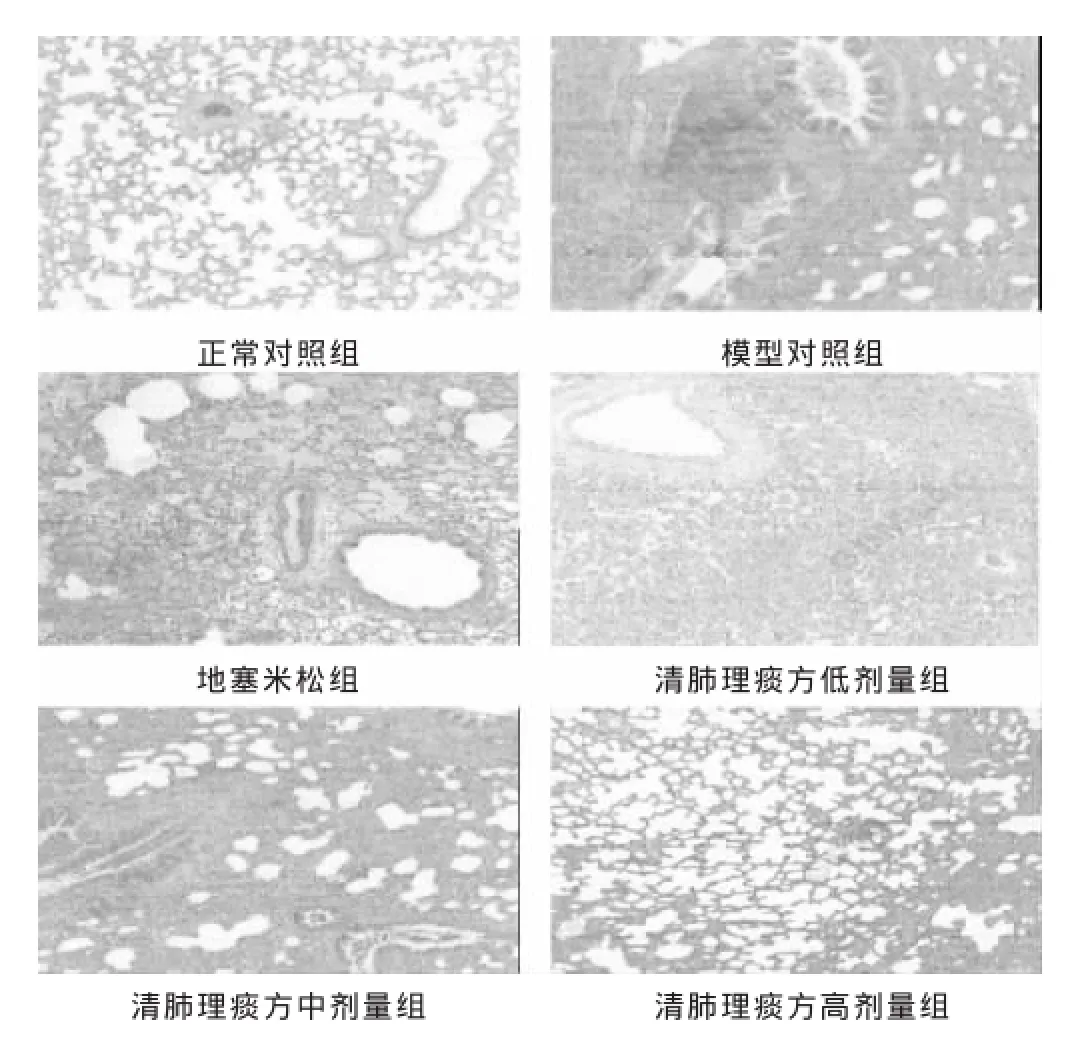
图2各组大鼠肺组织病理光镜下图片(HE染色,100倍)
2.2各组血清炎症因子IFN-γ水平比较见图2。与正常对照组比较,模型对照组炎症因子IFN-γ的水平明显升高(P<0.01)。与模型对照组比较,地塞米松组和清肺理痰方各组IFN-γ的水平明显降低(P<0.01),且高剂量组低于中剂量组,中剂量组低于低剂量组。
2.3各组大鼠肺组织NF-κB p65和TLR4蛋白表达比较见表2。与正常对照组比较,模型对照组NF-κB p65和TLR4蛋白表达均明显升高(P<0.01)。与模型对照组比较,地塞米松组和清肺理痰方各组的NF-κB p65和TLR4蛋白表达均降低,且与剂量呈负相关(P<0.01)。
表2 各组大鼠肺组织NF-κB p65/TLR4蛋白IOD值的比较(±s)
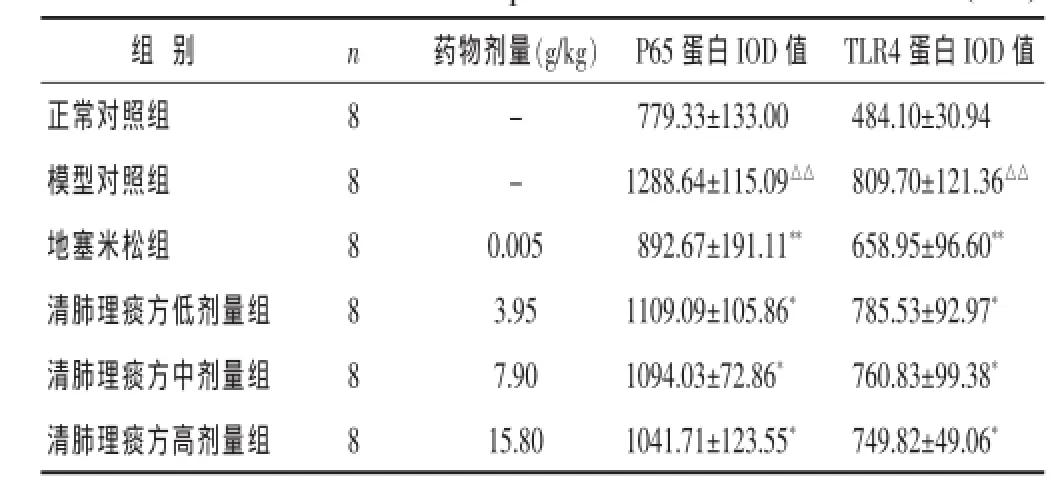
表2 各组大鼠肺组织NF-κB p65/TLR4蛋白IOD值的比较(±s)
组别 n TLR4蛋白IOD值正常对照组 8 484.10±30.94模型对照组 8 809.70±121.36△△地塞米松组 8 658.95±96.60**药物剂量(g/kg) P65蛋白IOD值- 779.33±133.00- 1288.64±115.09△△0.005 892.67±191.11**清肺理痰方低剂量组 8 785.53±92.97*3.95 1109.09±105.86*清肺理痰方中剂量组 8 7.90 1094.03±72.86* 760.83±99.38*清肺理痰方高剂量组 8 15.80 1041.71±123.55* 749.82±49.06*
2.4各组大鼠肺组织NF-κB p65和TLR4 mRNA表达比较见表3。与正常对照组比较,模型对照组NF-κB p65和TLR4 mRNA相对表达量均明显升高 (P< 0.01)。与模型对照组比较,地塞米松组和清肺理痰方各组的NF-κB p65和TLR4 mRNA相对表达量均降低,且与剂量呈负相关(P<0.05或P<0.01)。
表3 各组急性肺损伤大鼠肺组织P65/TLR4 mRNA的CT值相对表达量比较(×10-3,±s)
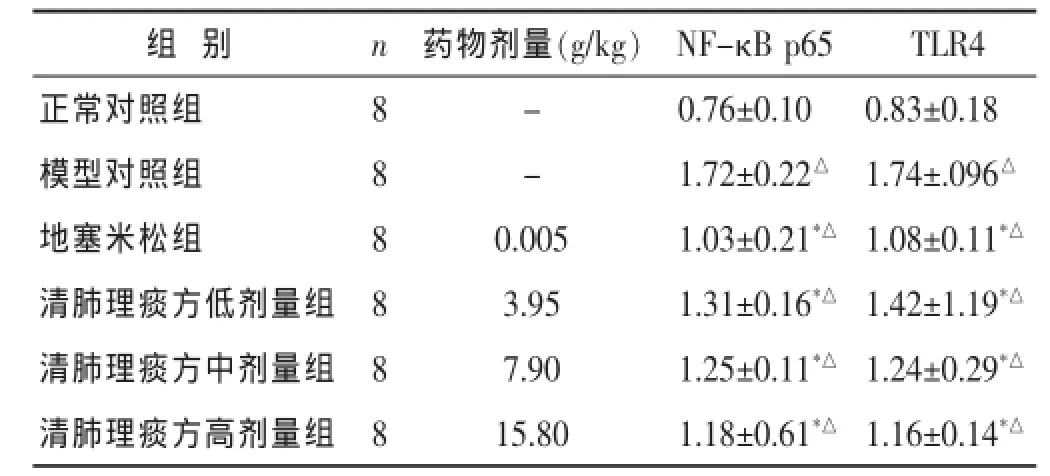
表3 各组急性肺损伤大鼠肺组织P65/TLR4 mRNA的CT值相对表达量比较(×10-3,±s)
与模型组比较,*P<0.01;与正常对照组比较,△P<0.01。
组别 n TLR4正常对照组 8 0.83±0.18模型对照组 8 1.74±.096△地塞米松组 8 1.08±0.11*△药物剂量(g/kg) NF-κB p65- 0.76±0.10- 1.72±0.22△0.005 1.03±0.21*△清肺理痰方低剂量组 8 1.42±1.19*△3.95 1.31±0.16*△清肺理痰方中剂量组 8 7.90 1.25±0.11*△ 1.24±0.29*△清肺理痰方高剂量组 8 15.80 1.18±0.61*△ 1.16±0.14*△
3 讨 论
研究表明,LPS信号通路的表达是通过跨膜传导的“门户蛋白”TLR4来实现的[10-11],TLR4/NF-κB途径参与了LPS诱导的 ALI[12-13],发现在LPS介导的脓毒症中NF-κB持续表达,和病情的严重程度正相关,这些都提示 TLR4/NF-κB通路可能是触发炎症反应和器官损伤的关键靶点。风温肺热病是风温病与肺热病的合称,由风热病毒引起的,而以冬春两季多发的急性外感热病;以发热、咳嗽、咯痰、胸闷、舌红苔白或黄、脉数为主症,相当于西医的急性肺炎等急性肺部感染疾病[14]。本病病因主要为外感火热毒邪、风热或风寒邪气。其病变部位主要在肺,痰瘀互阻,导致肺脏功能失调[15]。本方由石膏、青天葵、瓜蒌皮、黄芩等10味中药组成,具有解肌清热,除烦止渴的功效,适用于肺热实证。
实验研究结果表明,模型组大鼠肺泡腔内充满炎性渗出物和出血,肺损伤评分明显增高,提示造模成功。与正常组相比,模型对照组NF-κB p65和TLR4蛋白和mRNA相对表达量均升高,结合前期实验探究的机制可能是通过抑制NF-κB信号通路转导活性,从而减少细胞因子分泌以减轻脏器组织损伤,进而发挥抗炎保护作用,提示ALI的病理变化与NF-κB p65和TLR4 mRNA表达的升高有关。用清肺理痰方灌胃处理大鼠,能使LPS诱导的ALI肺组织水肿、出血等损伤程度明显减轻。与模型对照组比较,清肺理痰方各组血清IFN-γ含量下降、肺损伤的轻重程度评分降低,NF-κB p65和TLR4蛋白和mRNA表达水平下调,同时清肺理痰方各组随着剂量增加肺损伤程度减低,表明清肺理痰方对内毒素致ALI大鼠有保护作用。其机制可能与其能降低内毒素致ALI大鼠肺组织NF-κB p65和TLR4蛋白和mRNA的表达有关。
鉴于以上结果,清肺理痰方对ALI的大鼠具有一定的保护作用,为中医药治疗临床ALI提供了研究方向,对中西医结合治疗肺部疾病提供了新思路。
[1]朱琳,潘俊辉,刘昌秀.风温肺热病的中医临床路径研究初探[J].新中医,2012,3(44):20-21.
[2] 苏中昊,杨爱东,王利霞,等.宣白承气汤对急性肺损伤大鼠肺组织脂多糖结合蛋白和Toll样受体4 mRNA表达的影响[J].南京中医药大学学报,2013,55(2):155-158.
[3] 曾俊飞,潘俊辉,王鹏,等.中西医结合治疗肺炎喘嗽(痰热壅肺证)的多中心临床研究[J].中国实验方剂学杂志,2012,18(13):259-262.
[4]刘官斌,潘俊辉,王鹏,等.清肺理痰方各有效成分组对脂多糖诱导的急性肺损伤大鼠的影响[J].中国实验方剂学杂志,2014,15(20):154-159.
[5]朱琳,李振球,刘昌秀,等.综合疗法治疗痰热型社区获得性肺炎的临床研究[J].中华中医药学刊,2013,32(11):2443-2444.
[6]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[7]张均田.现代药理实验方法[M].北京:北京医科大学/中国协和医科大学联合出版社,1999:1420.
[8]李新甫,汪建新.急性肺损伤动物模型研究进展[J].国外医学:呼吸系统分册,2005,28(7):506-508,511.
[9]李敏,沈良贤,张湘燕,等.两种抗补体蛋白对脂多糖致急性肺损伤的保护作用比较研究[J].中国药理学通报,2012,28(4):521-526.
[10]黄权,王俊峰.浅谈使用中医药治疗风温肺热病的近况[J].当代医药论丛,2015,13(10):20-21.
[11]黄继义,刘才文,林建东,等.内毒素急性肺损伤TLR4-LPS信号传导对NF-κB活性的影响[J].临床肺科杂志,2014,19(2):223-226.
[12]杨玉荣,佘锐萍,梁宏德.Toll-NF-κB信号途径及其介导的功能[J].细胞生物学杂志,2007,29(4):483-486.
[13]田巍,孙文萍,邓光慧,等.七叶皂苷钠对油酸制备大鼠急性肺损伤干预研究[J].中国药理学通报,2009,25(12):1589-1594.
[14]陈立,熊旭东.风温肺热病的中医药治疗近况[J].中国中医急症,2008,17(7):985-986.
[15]何雅琴.中医治疗风温肺热型肺炎观察[J].中国实用医药,2011,6(30):166.
Ef fect of Qingfei Litan Decoction on NF-κB and TLR4 Expressions in LPS-induced Rats with Acute Lung Injury
WANG Kai,PAN Junhui,WANG Peng. The First Affiliated Hospital of Guangzhou Medical University,Guangdong,Guangzhou 510120,China.
R285.5文献标志码:A
1004-745X(2016)06-1001-04
10.3969/j.issn.1004-745X.2016.06.016
广东省广州市科技计划项目(2012J4300068)
△(电子邮箱:pan-jh@163.com)
(2016-03-01)

