伴有EGFR突变的非小细胞肺癌血清CYFRA21-1和CEA水平与EGFR-TKIs的疗效关系
王群慧 郑华 胡范彬 张红梅 胡瑛 李杰 张同梅 刘赞 鲁葆华 胡爱民 李宝兰
肺癌是全世界发病率和死亡率最高的恶性肿瘤,5年生存率仅为16.8%[1]。非小细胞癌(non-small cell lung cancer, NSCLC)约占所有肺癌病理类型85%,而且>70%的患者确诊都是晚期[2]。全身化疗一直是这部分人群主要治疗方法。21世纪初随着分子生物学研究不断深入,开启了NSCLC以表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变为指导的靶向治疗时代,而IPASS、NEJGSG、WJTOG3405、OPTIMAL、EURTAC、LUX-Lun3及ICOGEN等研究,进一步确立表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors, EGFR-TKIs)在EGFR基因突变的NSCLC晚期患者治疗地位[3-9]。
血清癌胚抗原(carcinoembryonic antigen, CEA)和细胞角蛋白19片段(cytokeratin-19 fragments, CYFRA21-1)是最常见肿瘤标志物,应用于肺癌的诊断、预后和监测。目前认为CEA是肺腺癌较好的肿瘤标志物,而CYFRA21-1则是肺鳞癌诊断的最好肿瘤标志物。本文回顾性研究伴有EGFR基因的突变NSCLC晚期患者治疗前血清CEA和CYFRA21-1的水平和EGFR-TKIs疗效及预后的关系,希望给临床EGFR-TKIs靶向治疗的个体化提供参考依据。
1 资料与方法
1.1 对象 本研究收集首都医科大学附属北京胸科医院于2010年10月-2015年3月EGFR基因突变且应用EGFRTKIs治疗的患者194例,所有患者均通过病理及免疫组化诊断为NSCLC,并且为IIIb期-IV期或者手术后复发的晚期患者。患者年龄30岁-85岁(中位年龄58岁),男性86例(44.3%),女性108例(55.7%)。PS评分0分-1分166例(85.6%),2分-4分28例(14.4%)。吸烟67例(34.5%),非吸烟127例(65.5%)。IIIb期患者6例(3.1%),IV期188例(96.9%),中心型26例(13.4%),周围型168例(86.6%)。腺癌179例(92.3%),鳞癌9例(4.6%),非小细胞癌3例(1.5%),腺鳞癌2例(1%),大细胞癌1例(0.5%)。患者的临床特征见表1。
1.2 治疗方法 所有患者都给予埃克替尼或者吉非替尼、厄洛替尼治疗。埃克替尼125 mg,每日3次口服;吉非替尼250 mg,每日1次;厄洛替尼150 mg每日1次。接受埃克替尼治疗115例(59.3%),吉非替尼44例(22.7%),厄洛替尼35例(18%)。
1.3EGFR基因检测 采取两种方法:一种PCR-Sanger测序法,由北京海思特临床检验所检测;一种ARMS荧光定量PCR,检测试剂为厦门艾德人类EGFR基因突变检测试剂盒。应用PCR-Sanger测序法123例(63.4%),ARMS法71例(36.6%)。标本来源:气管镜活检47例(24.2%),肺穿刺活检88例(45.4%),胸水沉淀包埋31例(16%),手术标本13例(6.7%),淋巴结活检14例(7.2%),骨转移穿刺1例(0.5%)。EGFR基因检测结果:19外显子缺失突变112例(57.7%),21外显子错义突变72例(37.1%),少见突变3例(G719X)(1.5%),伴有原发T790m突变1例(0.5%),EGFR基因突变2例(1.0%),伴有Kras突变2例(1.0%),19外显子错义突变2例(1.0%)。
1.4 血清CEA和CYFRA21-1的检测 EGFR-TKIs治疗前清晨空腹静脉血,分离血清后,使用上海透景生命科技股份有限公司试剂盒及Luminex多功能流式点阵仪应用流式荧光发光法进行测定。根据我院试剂盒正常参考值进行结果判定:CEA≤6 ng/mL为正常,CEA>6 ng/mL为表达水平增高;CYFRA21-1≤6 ng/mL为正常,CYFRA21-1>6 ng/mL为表达水平增高。
1.5 疗效评定及生存指标 治疗前2周对疾病状况进行评估,治疗后4周复查。以后每2个月-3个月随访1次。按实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)评价近期疗效,分为完全缓解(complete response, CR)、部分缓解(partial response,PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。生存指标为无进展生存时间(progression-free survival, PFS)定义为EGFR-TKI治疗开始至疾病进展或未进展死亡的时间。总生存(overall survival,OS)定义为EGFR-TKI治疗开始到死亡或末次随访时间。
1.6 统计学方法 使用SPSS V22.0软件,采用Kaplan-Meier法并进行Log-rank检验生存分析,用Cox比例风险模型进行多因素分析,所有统计结果以P<0.05为差异有统计学意义。所有患者均随访至2015年12月31日,其中死亡103例,存活90例,1例失访。死亡病例为截尾数据,存活病例为未截尾数据。
2 结果
2.1 EGFR-TKIs疗效及多因素生存分析 本研究中患者的总体疗效:CR、PR、SD、DCR及PD分别为0.5%(1例)、68.6%(133例)、24.2%(47例)、93.3%(181例)和6.7%(13例)。中位PFS为9.0个月(95%CI: 7.3-10.7);中位总生存OS为23.0个月(95%CI:20.2-25.8)。单因素生存分析显示:年龄>70和年龄≤70岁PFS分别为9.0个月和10.5个月(P=0.495);OS分别为23.0个月和24个月(P=0.441);男性和女性PFS分别为10.5个月和8.2个月(P=0.391);OS分别为24.0个月和21.8个月(P=0.717);吸烟和非吸烟PFS分别为10.5个月和8.9个月(P=0.406);OS分别为24.1个月和21.8个月(P=0.886);19外显子缺失突变和21外显子错义突变PFS分别为9.0个月和8.2个月(P=0.375);OS分别为24.1个月和17.2个月(P=0.143);以上单因素分析均无统计学差异。PS评分0分-1分和2分-4分PFS分别为10.5个月和5.3个月(P<0.001);OS分别为24.8个月和9.7个月(P<0.001);腺癌和鳞癌PFS分别为9.0个月和4.1个月(P=0.009);OS分别为23.1个月和8.1个月(P<0.001);治疗前基线无脑转移和伴有脑转移PFS分别为10.9个月和7.5个月(P=0.001);OS分别为26.1个月和14.3个月(P<0.001);无肝转移和伴有肝转移PFS分别为10.2个月和7.0个月(P=0.002);OS分别为23.7个月和12.0个月(P=0.008)。上述单因素分析有统计学差异。多因素生存分析显示PS评分状态和是否伴有脑转移PFS和OS都有统计学意义。而组织类型中腺癌和鳞癌PFS无统计学差异,但在OS还是有统计学差异(表2,表3)。
2.2 治疗前血清CYFRA21-1水平与PFS、OS的相关性分析194例患者中129例血清水平CYFRA21-1正常,65例血清CYFRA21-1水平增高,血清水平CYFRA21-1正常和增高的PFS分别为11.9个月和7.0个月(P<0.001),OS分别为28.0个月和12.6个月(P<0.001),均有统计学差异(表2)。亚组分析中,腺癌组120例血清CYFRA21-1水平正常,59例血清水平增高,它们的PFS分别为12.0个月和7.0个月(P<0.001),OS分别为28.1个月和13.1个月(P<0.001)均有统计学差异(表4)。多因素分析中(表3),PFS(P=0.006, HR=0.62, 95%CI: 0.44-0.87)(图1),OS(P<0.001, HR=0.30, 95%CI: 0.19-0.47)(图2),也均有统计学差异。鳞癌组4例血清水平CYFRA21-1正常,5例血清水平增高,它们的PFS分别为4.1个月和3.1个月(P=0.529),OS分别为8.1个月和7.0个月(P=0.359),均无统计学差异。

表 1 194例携带EGFR突变的NSCLC患者的临床特征Tab 1 Characteristics of the 194 NSCLC patients harboring EGFR mutations
2.3 治疗前血清CEA水平与PFS和OS的相关性分析 血清CEA水平正常69例,血清CEA水平增高125例。它们的PFS分别为10.2个月和8.9个月(P=0.294),OS分别为24.0个月和21.8个月(P=0.122)均无统计学差异。腺癌亚组血清CEA水平正常及增高的PFS均为9.0个月(P=0.436),无统计学差异(图3);OS分别为24.8个月和23.0个月(P=0.104),无统计学差异(图4)。鳞癌亚组血清CEA水平正常2例,血清水平增高7例;它们的PFS分别为7.8个月和3.1个月(P=0.103),无统计学差异;OS分别为9.1个月和7.0个月(P=0.381),无统计学差异(表2-表4)。

表 2 单因素生存分析Tab 2 Factor associated with PFS and OS

表 3 多因素生存分析Tab 3 Multivariate analysis of PFS and OS

表 4 血清CEA、CYFRA21-1水平亚组生存分析Tab 4 Subset analysis of PFS and OS

图 1 肺腺癌患者血清CYFRA21-1水平和PFS生存曲线关系。血清CYFRA21-1水平正常和增高PFS分别为12.0个月和7.0个月(P=0.006,HR=0.62, 95%CI: 0.44-0.87)。Fig 1 Kaplan-Meier survival curves of progression-free survival(PFS) according to serum CYFRA21-1 level in lung adenocarcinoma patients. PFS in normal- and high serum CYFRA21-1 level was 12.0 months and 7.0 months, respectively (P=0.006, HR=0.62, 95%CI:0.44-0.87).

图 2 肺腺癌患者血清CYFRA21-1水平和OS生存曲线关系。血清CYFRA21-1水平正常和增高OS分别为28.1个月和13.1个月(P<0.001, HR=0.30, 95%CI:0.19-0.47)。Fig 2 Kaplan-Meier survival curves of overall survival (OS) according to serum CYFRA21-1 level in lung adenocarcinoma patients. OS in normal- and high serum CYFRA21-1 level was 28.1 months and 13.1 months, respectively (P<0.001, HR=0.30, 95%CI: 0.19-0.47).
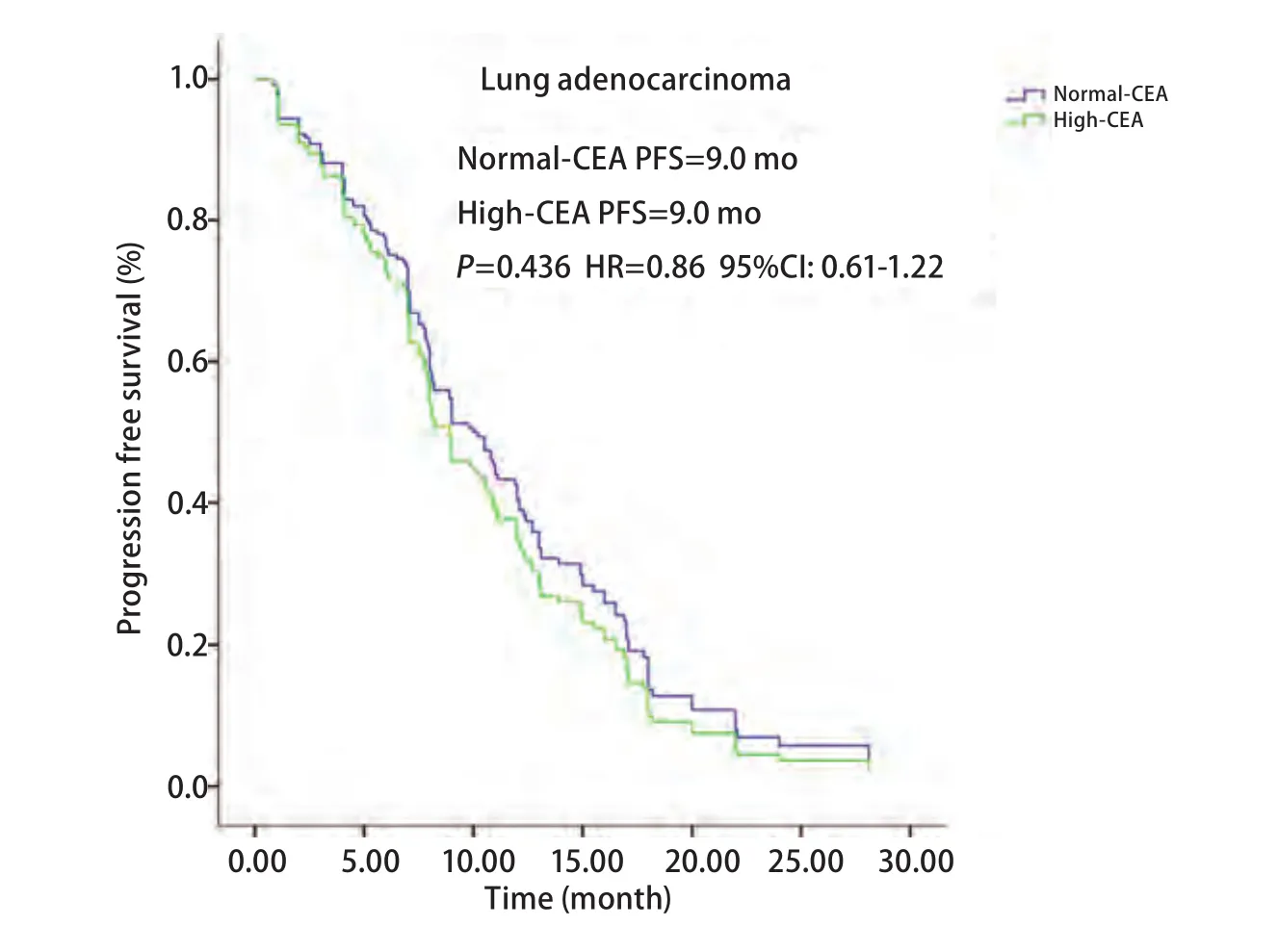
图 3 肺腺癌患者血清CEA水平和PFS生存曲线关系。血清CEA水平正常和增高PFS均为9.0个月(P=0.436, HR=0.86, 95%CI: 0.61-1.22)。Fig 3 Kaplan-Meier survival curves of progression-free survival (PFS)according to serum CEA level in lung adenocarcinoma patients. PFS in normal- and high serum CEA level both were 9.0 months (P=0.436,HR=0.86, 95%CI: 0.61-1.22).

图 4 肺腺癌患者,血清CEA水平和OS生存曲线关系。血清CEA水平正常和增高OS分别为24.8个月和23.0个月(P=0.104, HR=0.72, 95%CI:0.47-1.11)。Fig 4 Kaplan-Meier survival curves of overall survival (OS) according to serum CEA level in lung adenocarcinoma patients. OS in normaland high serum CEA level was 24.8 months and 23.0 months,respectively (P=0.104, HR=0.72, 95%CI: 0.47-1.11).
3 讨论
2004年Lynch等[10]研究发现EGFR基因突变状态与EGFR-TKIs的疗效相关,并且近几年多项国际多中心的临床研究已显示EGFR-TKIs在EGFR基因突变的NSCLC晚期患者有着非常好的疗效及低毒性[3-9]。2012年在美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)NSCLC临床实践指南推荐对于EGFR基因突变的晚期,复发或转移的NSCLC患者EGFR-TKIs作为一线治疗。随着对EGFR-TKIs进一步研究,发现同样有EGFR基因突变,但不同的临床特征,EGFR-TKIs疗效是有差异的。Lee等[11]meta分析中认为女性,非吸烟患者,腺癌及19外显子缺失突变,相对疗效更好一些。我们的研究显示,性别、年龄、吸烟状态及EGFR基因敏感突变类型之间无统计学差异。但是PS评分0分-1分较2分-4分疗效更好,有统计学差异;腺癌较鳞癌患者EGFR-TKIs疗效更好,有统计学差异。在合并有远处转移,有脑转移和肝转移的患者PFS和OS均有缩短。多因素生存分析显示:PS状态差,鳞癌和伴有脑转移的患者预后差,OS有统计学意义。
CYFRA21-1是我们临床实践中肺癌诊断常用肿瘤标志物。当肿瘤细胞发生溶解时,其中的细胞角质蛋白释放入血,而使血中CYFRA21-1升高。其对肿瘤的诊断敏感性约为50%,且以鳞癌敏感性最高。有报道其对鳞癌的敏感性和特异性分别为66.5%和95%[12],因此众多学者一致认为CYFR21-1是鳞癌鉴别诊断的最好肿瘤标志物,其水平高低和敏感度与病情呈正相关。近年Tanaka等[13]提出伴有EGFR突变的NSCLC,治疗前血清CYFRA21-1水平是预测EGFR-TKIs疗效的指标,但相关报道国内外还是比较少。我们的研究显示治疗前血清水平CYFRA21-1正常和增高的PFS分别为11.9个月和7.0个月(P<0.001),OS分别为28.0个月和12.6个月(P<0.001),均有差异。亚组分析中,腺癌组血清CYFRA21-1水平正常和增高的PFS分别为12.0个月和7.0个月(P<0.001),OS分别为28.1个月和13.1个月(P<0.001)均有差异。多因素分析中,PFS(P=0.006,HR=0.62, 95%CI: 0.44-0.87),OS(P<0.001, HR=0.30,95%CI: 0.19-0.47)也均有统计学差异。鳞癌组血清水平CYFRA21-1正常和增高的PFS分别为4.1个月和3.1个月(P=0.529), OS分别为8.1个月和7.0个月(P=0.359),均无差异。我们研究显示伴有EGFR基因突变的肺腺癌患者,治疗前血清CYFRA21-1水平增高较正常水平相比较,PFS和OS都有缩短;治疗前血清CYFRA21-1水平可以预测EGFR-TKIs疗效及预后。而肺鳞癌在我们研究中由于病例数较少,并未显示治疗前血清CYFRA21-1水平与EGFR-TKIs的疗效和预后的关系。
EGFR基因突变,在肺腺癌患者比较常见,PIONEER临床试验显示东亚肺腺癌患者50.2%的EGFR基因的突变率[14]。而肺鳞癌患者EGFR基因的突变比较少见,Dearden等[15]meta分析中,东亚肺鳞癌患者EGFR基因的突变率仅为4.6%,而中国报道肺鳞癌患者EGFR基因的突变则在14%-25%[16-18]。并且在既往的报道EGFR基因突变肺鳞癌患者采用EGFR-TKIs治疗的PFS和OS明显低于肺腺癌,PFS在3个月-7个月,OS在9.4个月-14.7个月[19-21]。本研究中EGFR基因的突变患者鳞癌患者9例,为4.6%。与肺腺癌相比PFS分别为4.1个月和9.0个月(P=0.009),OS分别为8.1个月和23.1个月(P<0.001)。肺鳞癌EGFR突变患者临床受益程度明显低于EGFR突变肺腺癌患者,似乎提示肺鳞癌中具有EGFR突变基因也许并不是靶向治疗的“驱动基因”,可能存在其他肿瘤驱动机制。肺癌的组织类型较多,且以腺癌的组织分型最复杂,异质性最明显。Travis等[22]认为由于肿瘤组织的异质性,基于小标本的病理组织诊断是有限,有可能会带来相反的组织类型诊断。并且由于肿瘤组织的异质性,小标本病理活检有可能未体现出整体的病理组织类型状态。我们的研究患者均为IIIb期-IV期晚期患者,标本来源:气管镜活检47例(24.2%),肺穿刺活检88例(45.4%),胸水沉淀包埋31例(16%),手术标本13例(6.7%),淋巴结活检14例(7.2%),骨转移穿刺1例(0.5%),绝大部分是小标本的病理活检。肺腺癌患者血清水平CYFRA21-1异常增高,我们考虑由于肿瘤异质性,可能混有鳞癌的成份,而肺鳞癌较肺腺癌相比较,EGFR-TKIs疗效不佳,那么治疗前血清CYFRA21-1水平异常增高可能带来EGFR-TKIs治疗的不佳疗效。而我们研究也显示伴有EGFR基因突变的肺腺癌者,治疗前血清CYFRA21-1水平增高,PFS和OS都短,血清CYFRA21-1水平可能是预测EGFR-TKIs治疗的疗效及预后的指标。
CEA是最早发现,目前临床应用最广的一种肿瘤抗原,在成人肺、乳腺和胃肠等腺癌组织有表达。肺癌细胞可合成和释放CEA,目前认为CEA是肺癌尤其是腺癌的进展、疗效和预后评估较好的一个肿瘤标志物[23]。与血清CYFRA21-1不同,近年的相关报道显示治疗前血清CEA水平并不能预测EGFR-TKIs治疗的疗效。我们的研究显示治疗前血清CEA水平正常和增高的PFS分别为10.2个月和8.9个月(P=0.294),OS分别为24.0个月和21.8个月(P=0.122)均无统计学差异。腺癌亚组血清CEA水平正常及增高的PFS均为9.0个月(P=0.436),无统计学差异;OS分别为24.8个月和23.0个月(P=0.104),无统计学差异。鳞癌亚组血清CEA水平正常和增高的PFS分别为7.8个月和3.1个月(P=0.103),OS分别为9.1个月和7.0个月(P=0.381),均无统计学差异。这些表明治疗前血清CEA水平与伴有EGFR突变的NSCLC的EGFR-TKIs治疗的疗效无关,并不能预测EGFR-TKIs治疗的疗效。
我们的研究显示,肺腺癌中治疗前血清水平CYFRA21-1增高与正常相比较EGFR-TKIs治疗PFS和OS都有缩短,而国外相关研究报道治疗前血清水平CYFRA21-1增高的患者EGFR-TKIs治疗仅有PFS缩短,因为进展后的相关治疗,两组总的OS是无统计学差异的。那么在我们的研究中出现的OS的显著性缩短,分析其原因可能是,我们研究中194例患者中有159例出现进展,而42例(26.4%)患者随后未再进行化疗、放疗或者其他的靶向药物治疗,而仅仅给予姑息维持治疗,从而导致OS进一步缩短。说明在我们临床实践中初次的EGFRTKIs治疗明显影响OS。NCCN指南中,对于伴有EGFR突变的NSCLC的推荐单药EGFR-TKIs一线治疗,但关于如何延长EGFR-TKIs治疗PFS的探索性研究近年不断涌现。FASTACTII、NEJ005及JO2557等[24-26]多中心的临床研究显示,EGFR-TKIs和化疗交替应用,或者联合化疗药物,抗血管药物可以延长PFS至15个月-16个月。但由于临床研究设计的局限性或两药联合应用增加的副反应,给这些研究带来许多争议。那么对于肺腺癌EGFR基因突变患者,治疗前血清CYFRA21-1水平异常增高且预测单药EGFR-TKIs可能疗效不佳,给予EGFR-TKIs和化疗交替应用或者联合化疗药物,是否能延长这部分人群PFS,从而提高OS,这还需要将来临床实验进一步探索研究。
我们的研究存在许多局限性和不足,首先这是个回顾研究,随访时间2个月-3个月随访一次;并且EGFR基因突变的检测方法没有统一,而是采取两种方法,PCRSanger测序法和ARMS荧光定量PCR法,但两种方法PFS和OS都没有统计学差异;我们的研究应用EGFR-TKIs药物也不是统一,包括有埃克替尼、吉非替尼和厄洛替尼,但是在我们的研究里,这三个EGFR-TKI药物无论PFS和OS也都没有统计学差异。虽然有许多局限性和不足,但是从我们的研究中可以看到伴有EGFR突变的NSCLC的EGFR-TKIs治疗疗效还是有许多差异,提示我们可以针对特定人群给予个体化治疗。
综上所述,我们研究的结论是:伴有EGFR突变的NSCLC的EGFR-TKI治疗中,PS状态差、鳞癌和伴有脑转移的患者EGFR-TKIs治疗预后差。小标本病理有其局限性,有时是不能代表整体病理组织类型。伴有EGFR突变的肺腺癌患者,治疗前血清水平CYFRA21-1增高者与正常者相比,EGFR-TKIs治疗的PFS和OS均有缩短,治疗前血清CYFRA21-1水平可以作为预测EGFR-TKIs疗效指标,也可能是EGFR-TKIs治疗的预后指标;而治疗前血清CEA水平则不能预测EGFR-TKIs疗效。

