广西普通油茶种质资源遗传多样性的SSR分析
张恩慧,王晓云,覃子海,赵文东,韦长江,王鹏良*
( 1. 江西中医药大学 江西民族传统药现代科技与产业发展协同创新中心,南昌 330004; 2. 广西林业科学研究院 广西优良用材林资源培育重点实验室,广西特色经济林开发和利用重点实验室,南宁 530002; 3. 广西国有三门江林场,广西 柳州 545006 )
广西普通油茶种质资源遗传多样性的SSR分析
张恩慧1,王晓云1,覃子海2,赵文东3,韦长江3,王鹏良2*
( 1. 江西中医药大学 江西民族传统药现代科技与产业发展协同创新中心,南昌 330004; 2. 广西林业科学研究院 广西优良用材林资源培育重点实验室,广西特色经济林开发和利用重点实验室,南宁 530002; 3. 广西国有三门江林场,广西 柳州 545006 )
普通油茶(Camelliaoleifera)是我国分布最广、产量最多的山茶属中一个重要油料树种。广西是普通油茶的重要分布区,种质资源十分丰富。为深入了解广西普通油茶种质资源的遗传变异,服务于种质保存和品种选育,该研究首先对已开发的SSR分子标记进行多态性筛选和评价,在此基础上利用多态性较高的引物,对97份广西有代表性的普通油茶种质资源进行遗传多样性分析。结果表明:(1) 在已开发的10对油茶SSR分子标记中,7对能稳定扩增且表现为共显性,2对扩增不稳定,另外1对无法扩增出产物。(2) 7对共显性SSR标记总共检测到33个等位基因,每对标记检测到等位基因数目的变化范围为3~6个,平均每个位点等位基因数为4.714 3个,有效等位基因数目的变化范围为2.084 2~4.314 8,平均有效等位基因数为2.828 8;基因多样性变化范围为0.520 2~0.768 2,平均每个位点基因多样性为0.628 1。(3) 参试群体中绝大多数位点未处于Hardy-Weinberg平衡,存在遗传结构;观测杂合度和期望杂合度的变化范围分别为0.413 0~0.670 1和0.523 3~0.772 4,其平均值分别为0.569 8和0.631 6。(4) 种质资源间遗传距离变化范围为0.05~0.791 7,平均遗传距离为0.354 5;UPGMA聚类显示相同来源的种质资源无法聚成一类,在同一聚类分支上混有不同来源的种质资源。这表明已开发的油茶SSR分子标记适用于广西普通油茶,广西普通油茶种质资源拥有较丰富的遗传多样性。该研究结果为广西普通油茶资源的深度开发和高效利用提供了科学依据。
普通油茶, SSR标记, 遗传多样性, 遗传结构, 复等位基因
油茶是山茶属种子含油量高、有栽培价值物种的统称(陈永忠等, 2005a)。普通油茶(Camelliaoleifera)是油茶中分布面积最广、 总产量最多的一个物种,常用于榨取高质量的食用茶油;此外,榨油剩余物可进一步加工,用作化工、纺织和农药等行业的原材料。其用途广、价值高(姚小华等, 2012)。油茶是我国特有的重要油料树种,主要分布于我国南方18个省市区(庄瑞林, 2007)。目前,普通油茶的遗传多样性研究逐渐开展。陈永忠等(2005b)利用RAPD (Rapid Amplified Polymorphic DNA)标记鉴定油茶湘林系列的优良无性系;林萍等(2010)和彭绍峰等(2011)分别利用SRAP (Sequence-Related Amplified Polymorphism)标记对长林系列12个优良无性系和14个高产良种开展分子鉴定;黄永芳等(2006)利用RAPD技术对湖南、广东和广西三省(区)的部分油茶种质资源进行遗传多样性分析;王保明等(2008)和于小玉等(2013)分别利用ISSR (Inter-Simple Sequence Repeat)技术对湖南和湖北等部分品种开展遗传多样性分析;张婷等(2011a,b)分别利用SRAP和AFLP (Amplifed Fragment Length Polymorphism)两种标记分别对湖北野生油茶资源开展遗传多样性研究,这为普通油茶遗传资源的开发奠定了坚实基础。
广西是油茶的最重要产区之一,种质资源十分丰富(张乃燕, 2003)。然而,到目前为止,仅见王鹏良等(2014)利用SRAP分子标记对广西普通油茶的遗传多样性开展初步分析。SRAP标记是显性分子标记。与RAPD、ISSR、SRAP和AFLP4种显性分子标记相比,SSR为共显性标记,能区分纯合子和杂合子,而且能检测复等位基因,在遗传多样性检测中更具优势。为了更加深入地了解广西普通油茶的遗传变异,本研究采用已开发的油茶SSR分子标记对广西普通油茶种质资源的遗传多样性开展研究,为广西普通油茶种质资源更加合理、高效地开发利用提供了可靠的科学依据。
1 材料与方法
1.1 材料
从广西各地搜集的具有代表性的97份普通油茶种质资源,均种植于柳州市城中区柳东乡广西国有三门江林场三门江分场的湖广坪林区。
1.2 方法
1.2.1 普通油茶基因组DNA提取以97份种质资源的嫩叶为材料,利用改良的CTAB-SDS法(何卫龙等, 2013)提取普通油茶基因组DNA,并稀释成20 ng·μL-1,保存于-20 ℃冰箱,待用。
1.2.2 PCR反应及产物检测PCR反应体系参照王鹏良等(2014):模板DNA 1 μL,2.5 mmol·L-1dNTPs 1 μL,10 × Buffer 1 μL,10 mmol·L-1上下游引物各0.4 μL,Taq聚合酶1.5 U,用ddH2O补足到10 μL体系。SSR反应程序参照彭婵等(2013):预变性94 ℃ 4 min;变性94 ℃ 30 s,退火59 ℃ 30 s (Δ ℃=-1 ℃),延伸72 ℃ 45 s,9个循环;变性94 ℃ 30 s,退火55 ℃ 30 s, 延伸72 ℃ 30 s,21个循环,72 ℃延伸10 min,4 ℃保存。PCR反应结束后,在effendorf管中加入6×Loading buffer 2 μL,混合均匀,吸取2 μL在8.0%聚丙烯胺凝胶上180 V电压下电泳1.5 h,再进行快速银染,显影,照相。
1.2.3 SSR引物多态筛选及群体扩增从97个参试样本中随机抽取8个样本作为模板,对彭婵等(2013)的10对引物(表1)进行多态性筛选。在此基础上,将筛选到的多态引物用于群体的扩增。
1.3 谱带记录和数据分析
同一引物扩增的迁移率相同的为同一等位基因,据此原则,对所得图片进行人工读带,从小到大按照A,B,C,D,E……进行记录,将扩增所得的纯合子用相同字母表示,例如记为“AA”或“BB”,将杂合子用不同字母表示,例如记为“AB”。利用PopGene 1.32软件分析等位基因变异总数(A),有效等位基因数(Ne),观测杂合度(Ho), 期望杂合度(He), 固定指数(F)及Hardy-Weinberg平衡检测;利用PowerMarker V3.25软件(Liu & Muse, 2005)计算基因多样性(H),多态信息含量指数(Polymorphism Information Content, PIC),样本间的遗传距离,按照非加权类平均法(unweighted pair-group method using arithemtic average, UPGMA)进行样本间的聚类分析,利用MEGA6.0 (Molecular Evolutionary Genetics Analysis)软件生成聚类图。
2 结果与分析
2.1 SSR引物筛选和评价
本研究根据彭婵等(2013)已发表的10对油茶SSR序列信息合成引物,在参试群体中随机抽取8个样本作为模板开展多态引物筛选。结果表明7对引物能稳定扩增出产物,且呈多态性,表现为共显性,另2对(NJFUC57和NJFUC129)扩增不稳定(表1),仅有1对引物(NJFUC69)无法扩增出产物。
2.2 遗传多样性分析
从表2可以看出,7对引物总共检测到33个等位基因,每个位点等位基因数目变化范围为3~6,其中NJFUC53、NJFUC157和NJFUC833为6个等位基因,NJFUC787为3个等位基因,平均每个位点等位基因数目为4.714 3;有效等位基因数最高为4.314 8(NJFUC157),最低值为2.084 2(NJFUC273),平均有效等位基因数为2.828 8;基因多样性的变化范围为0.520 2~0.768 2,平均每个位点的基因多样性为0.628 1;多态信息含量(PIC)的变化范围为0.475 1~0.731 8,平均每个位点的多态信息含量为0.573 7。
2.3 遗传结构和杂合度分析
表3结果表明,7个位点中,6个SSR位点不处于Hardy-Weinberg平衡,仅1个位点处于Hardy-Weinberg平衡,这表明参试群体存在遗传结构。同时利用SSR标记检测了观测杂合度和期望杂合度,它们的变化范围分别为0.413 0~0.670 1和0.523 3~0.772 4,平均每个位点的观测杂合度和期望杂合度分别为0.569 8和0.631 6。通过对固定指数分析发现,NJFUC53、NJFUC273、NJFUC787和NJFUC833四个位点的固定指数F值为负数,其余3个位点的固定指数F值为正数。其中,NJFUC53、NJFUC157、NJFUC601 3个位点的数值较大。NJFUC53的固定指数F值(表3)表明,该位点杂合子过多;NJFUC157和NJFUC601表明这2个位点纯合子过多;其余4个位点纯合子和杂合子比例与期望比例接近。固定指数的平均值为0.076 4,说明纯合子略多,但接近Hardy-Weinberg平衡。
2.4 遗传距离和聚类分析
根据7对SSR标记扩增得到的遗传信息,采用PowerMarker V3.25计算研究种质资源之间的遗传距离,种质资源间最大的遗传距离为0.791 7,最小的遗传距离为0.05,平均遗传距离为0.354 5。在种质资源间遗传距离最大的有3对,分别是56(FM)与111(BS)、56(FM)与146(G)、93(SBL)与155(BS);距离最小遗传的为33(LN)与164(QS)。在对97份种质资源遗传距离计算的基础上,按照UPGMA方法对参试种质资源开展聚类分析,再利用MEGA6.0软件生成聚类图。从图1可以看出,相同来源的种质资源不能很好地聚类成一个分支,同时在同一聚类分支上还混有一个或多个不同来源的种质资源,从而形成了复杂的遗传关系。
3 讨论
SSR分子标记重复性好、呈共显性、分布均匀且能检测复等位基因(Varshney et al, 2005)。但油茶中SSR分子标记开发和应用的研究进展缓慢,范小宁等(2011)建立了油茶SSR的反应体系,史洁等(2012)和温强等(2013)分别分析油茶不同转录组的SSR分布特征,但未开发SSR分子标记。目前,仅彭婵等(2013)实质上利用SSR对湖北油茶种质的遗传多样性开展了研究。将彭婵等(2013)报道的SSR标记用于本研究,发现10对SSR引物中,2对扩增不稳定,1对无法扩增出产物。这可能由于引物结合位点的缺失、插入、替换等突变或不同引物扩增效率不同造成的(Saha et al, 2004)。

表 1 本研究所用引物序列Table 1 Primer sequences used in this study
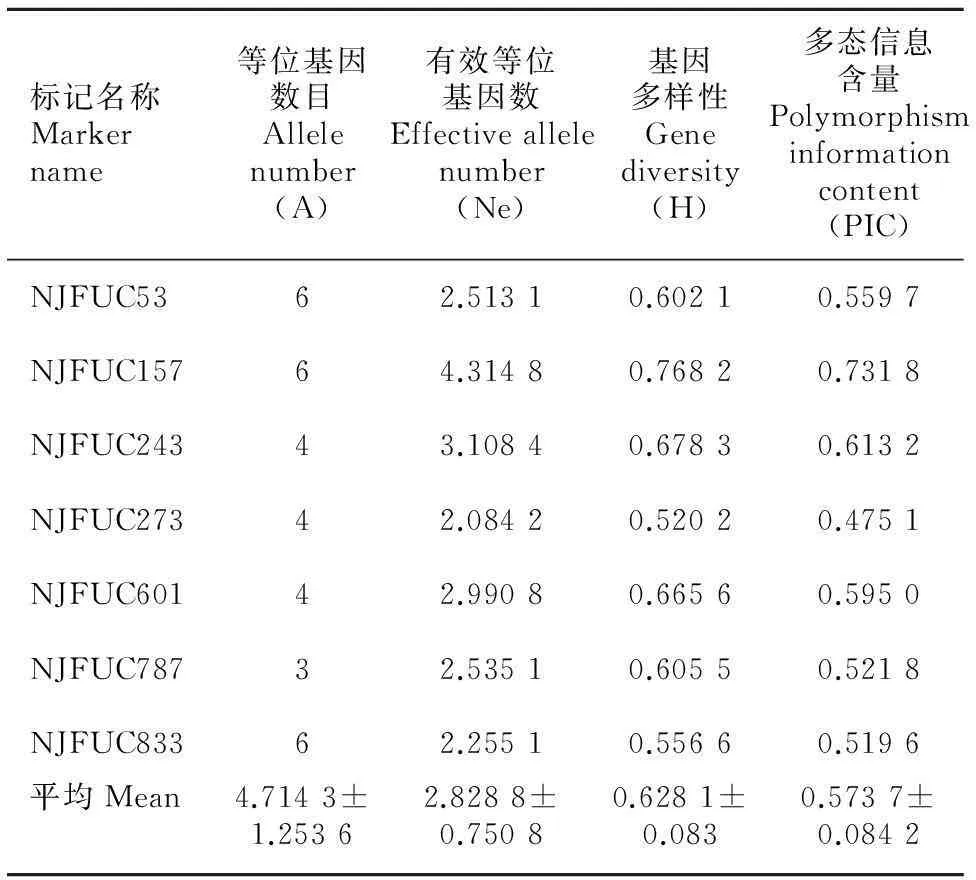
表 2 遗传多样性信息Table 2 Information of genetic diversity
7对稳定、多态的共显性SSR标记总共检测到33个等位基因,每个位点等位基因数目为3~6个,平均等位基因数目为4.714 3,存在较丰富的遗传多样性;但与陈赢男等(2014)和彭婵等(2013)的报道相比,本研究等位基因数目相对略少,这可能由于所研究材料来自多个省,遗传基础较宽所致。
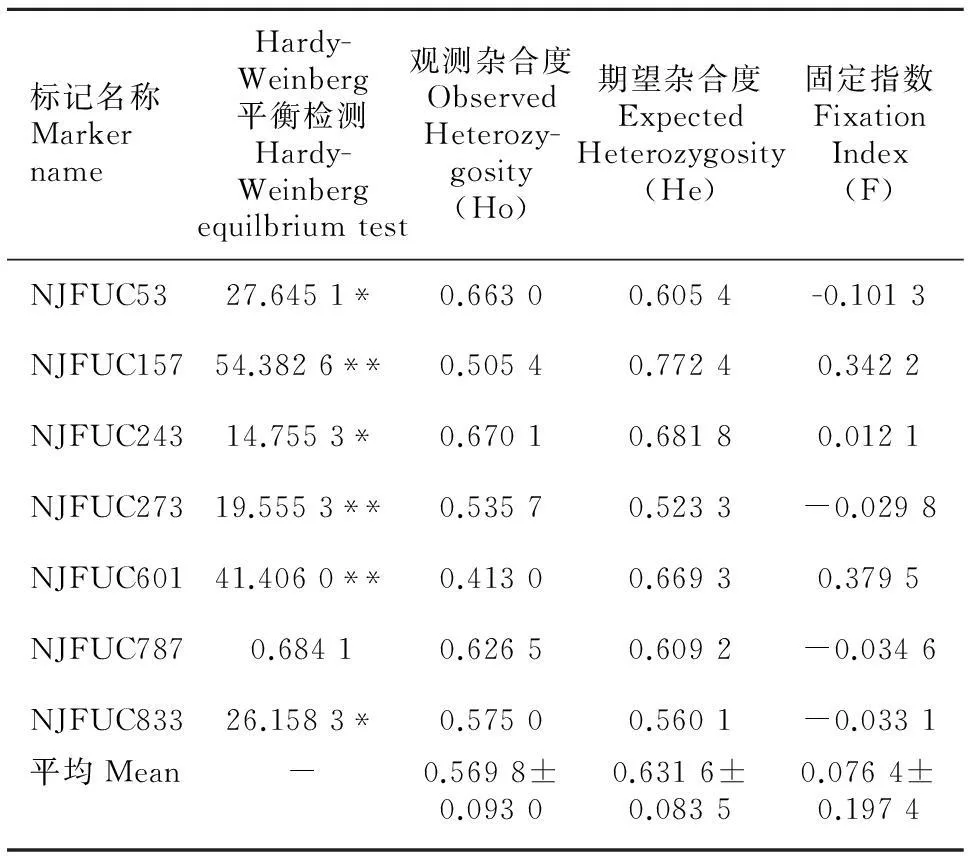
表 3 遗传结构和杂合度信息Table 3 Information of heterozygosity and genetic structure
注:**表示似然比检测达极显著水平,*表示似然比检测达显著水平。
Note: **denote significant level at 0.01 probability; *denote significant level at 0.05 probability.
通过对本研究参试的种质资源开展Hardy-Weinberg平衡检测,发现NJFUC787位点处于平衡状态,而其余6位点均处于不平衡状态。这说明参试群体总体上存在遗传结构,很可能是由于在种质资源收集过程的选择因素造成的。本研究的平均观测杂合度为0.573 7,期望杂合度为0.631 6,尽管比之前的报道(彭婵等, 2013)略低,也反映出了普通油茶的杂合度较高。这与油茶异交的交配特性相吻合(向晖等, 2013; 庄瑞林, 2007),也是普通油茶杂种优势产生的基础。同时,不同位点间的观测杂合度、期望杂合度及固定指数F都表明,位点间存在不同的选择压力。在不同的选择压力下,位点的进化速度也不相同。因此,尽管本研究所用的材料基本一致,但聚类结果与SRAP标记(王鹏良等, 2014)有较大差异,这可能与SSR分子标记有关,SSR标记的多态是由滑动和重组两个主要原因产生的,另外伴随突变,SSR的进化比较复杂,因此不一定能很好地反映出油茶的亲缘关系(Ellegren, 2004; Li et al, 2002)。但仍然有一点与SRAP标记结果一致,即种质资源聚类结果无法与种源相匹配。
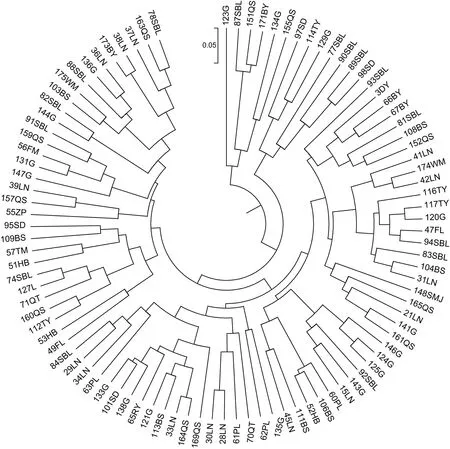
图 1 参试材料的聚类图 LN. 立农; DY. 都阳; FL. 富林; HB. 黄宝; ZP. 古袍; FM. 枫木; TM. 铁帽; PL. 平乐; RY. 仁勇; BY. 半月; QT. 七团; SBL. 三伯岭; SD. 三道; BS. 百色; TY. 田阳; G. 桂; L. 龙; SMJ. 三门江; QS. 区所; WM. 武鸣。Fig. 1 Dendrogram of materials in this study LN. Linong; DY. Duyang; FL. Fulin; HB. Huangbao; ZP. Zuopao; FM. Fengmu; TM. Tiemao; PL. Pingle; RY. Renyong; BY. Banyue; QT. Qituan; SBL. Sanboling; SD. Sandao; BS. Baise; TY. Tianyang; G. Gui; L. Long; SMJ. Sanmenjiang; QS. Qusuo; WM. Wuming.
此外,在本研究中发现最大遗传距离有3对,这可能是由于采用的分子标记区分度不足所致。为了更好地服务于普通油茶基因组研究和分子标记辅助育种,高质量的SSR分子标记亟待大量开发。
CHEN YN, ZHANG XY, DAI XG, 2014. A case study on cultivar identification inCamelliaL. by using SSR markers [J]. Nonw For Res, 32:140-143. [陈赢男, 张新叶, 戴晓港, 2014. 利用微卫星标记鉴别油茶品种[J]. 经济林研究, 32:140-143.]CHEN YZ, YANG XH, PENG SF,et al, 2005a. The developing strategy and research perspects of breeding of elite trees ofCamelliaoleiferain our country [J]. Chin For Sci Technol, 19(4):1-4. [陈永忠, 杨小胡, 彭邵锋,等, 2005a. 我国油茶良种选育研究现状及发展策略 [J]. 林业科技开发, 19(4):1-4.]
CHEN YZ, ZHANG ZJ, TAN XF,2005b. Identification of oil tea (Camelliaoleifera) superior clones by RAPD molecular marker [J]. J Centr S For Univ, 25(4):40-45. [陈永忠, 张智俊, 谭晓风,2005b. 油茶优良无性系的RAPD分子鉴别[J]. 中南林学院学报, 25(4):40-45.]FAN XN, LIN P, ZHANG SZ,2011. Optimization of SSR-PCR system forC.oleifera[J]. J Anhui Agric Sci, 39(23):14 098-14 102. [范小宁, 林萍, 张盛周,2011. 油茶SSR-PCR反应体系的优化研究[J]. 安徽农业科学, 39(23):14 098-14 102.]
ELLEGREN H, 2004. Microsatellites: simple sequences with complex evolution [J]. Nat Rev Genet,5: 435-445.
HE WL, YANG LH, WANG XF, et al,2013. Efficient DNA extraction from endosperm ofPinusmassonianaand SSR-PCR system optimization [J]. Chin For Sci Technol,27(1):15-18. [何卫龙, 杨立恒, 王晓锋, 等,2013. 马尾松胚乳DNA高效提取及SSR-PCR体系优化[J]. 林业科技开发,27(1):15-18.]
HUANG YF, CHEN XM, ZHUANG XY, et al,2006. Analysis of genetic diversity inCamelliaoleiferagermplasm[J]. Sci Silv Sin, 42(4):38-43. [黄永芳, 陈锡沐, 庄雪影, 等,2006. 油茶种质资源遗传多样性分析[J]. 林业科学, 42(4):38-43.]
LI YC, KOROL AB, FAHIMA T, et al, 2002. Microsatellites: genomic distribution, putative functions and mutational mechanisms: a review [J]. Mol Ecol,11: 2 453-2 465.
LIN P, YAO XH, WANG KL, et al, 2010. Identification and genetic analysis ofCamelliaoleiferaChanglin Series superior clones by SRAP molecular marker [J]. J Agric Biotechnol,18(2):272-279. [林萍, 姚小华, 王开良, 等, 2010. 油茶长林系列优良无性系的SRAP分子鉴别及遗传分析[J]. 农业生物技术学报,18(2):272-279.]LIU K, MUSE SV, 2005. Power Marker: Integrated analysis environment for genetic marker data[J]. Bioinformatics, 21: 2 128-2 129.
PENG C, LI ZF, CHEN HL, et al, 2013. Genetic analysis of the germplasm ofCamelliaoleiferafrom Hubei Province based on SSR marker [J]. Hubei For Sci Technol, 42(5):1-5. [彭婵, 李振芳, 陈慧玲, 等, 2013. 湖北油茶种质资源SSR分析[J]. 湖北林业科技, 42(5):1-5.]
PENG SF, ZHANG DQ, CHEN YZ, et al, 2011. Genetic diversity analysis of elite cultivars ofCamelliaoleiferaby SRAP [J]. J Centr S Univ Sci Technol: Nat Sci Ed, 31(1):80-85. [彭邵锋, 张党权, 陈永忠, 等, 2011. 14个油茶良种遗传多样性的SRAP分析[J]. 中南林业科技大学学报·自然科学版, 31(1):80-85.]
SAHA MC, MIAN MAR, EUJAYL I,et al, 2004. Tall fescue EST-SSR markers with transferability across several grass species[J]. Theor Appll Genet, 109: 783-791.
SHI J, YIN TM, GUAN HW, et al, 2012. Characteristic analysis of microsatelliates ofCamelliaspp. [J]. J Nanjing For Univ: Nat Sci Ed,36(2):47-51. [史洁, 尹佟明, 管宏伟, 等, 2012. 油茶基因组微卫星特征分析[J]. 南京林业大学学报·自然科学版,36(2):47-51.]
VARSHNEY RK, GRANER A, SORRELLS ME, 2005. Genic microsatellite markers in plants: features and applications[J]. Trends Biotechnol, 23: 48-55.
WANG BM, CHEN YZ, TAN XF, et al,2008. Genetic diversity of elite clones ofCamelliaoleiferaby ISSR [J]. J NE For Univ, 36(6):19-23. [王保明, 陈永忠, 谭晓风, 等,2008. 应用ISSR分析油茶无性系的遗传多样性 [J]. 东北林业大学学报, 36(6):19-23.]
WANG PL, CAI L, WEI CJ, et al, 2014. Genetic diversity analysis ofCamelliaoleiferain Guangxi Province using SRAP molecular markers [J]. Mol Plant Breed, 12(4):681-686. [王鹏良, 蔡玲, 韦长江, 等, 2014. 广西普通油茶遗传多样性SRAP分析 [J]. 分子植物育种, 12(4):681-686.]
WEN Q, XU LC, JIANG XM, et al, 2013. Survey and analysis of microsatellites from DNA sequences inCamelliaspecies using 454 pyrosequencing [J]. Sci Silv Sin, 49(8):43-50. [温强, 徐林初, 江香梅, 等, 2013. 基于454测序的油茶DNA序列微卫星观察与分析[J]. 林业科学, 49(8):43-50.]
XIANG H, YUAN DE, GAO C, et al, 2013. Observation of flower characteristics and analysis of pollen characteristics of four superior single-plant of the second generation ofCamelliayuhsienensisHu [J]. Acta Agric Univ Jiangxi,35(2), 352-356. [向晖, 袁德义, 高超, 等, 2013. 攸县油茶F2代4个优良单株花器特征观测及花粉特性分析[J]. 江西农业大学学报,35(2), 352-356.]
YAO XH, WANG KL, REN HD, et al, 2012. The research on oil camellia resources and its scientific utilization[M]. Beijing:Science Press:1-10. [姚小华, 王开良, 任华东, 等, 2012. 油茶资源与科学利用研究[M]. 北京:科学出版社:1-10.]
YU XY, YU FY, LIU JB, et al,2013. Identification and genetic diversity analysis ofCamelliaoleiferavarieties using ISSR marker [J]. J Nanjing For Univ: Nat Sci Ed, 37(1):61-66. [于小玉, 喻方圆, 刘建兵, 等,2013. ISSR在油茶品种鉴别和遗传多样性分析中的应用 [J]. 南京林业大学学报·自然科学版, 37(1):61-66.]
ZHANG NY, 2003. The developing strategy and perspects of elite trees ofcamelliaoleiferain Guangxi [J]. Guangxi For Sci, 32(4):211-214. [张乃燕, 2003. 广西油茶良种化的现状及发展策略 [J]. 广西林业科学, 32(4):211-214.]
ZHANG T, LIU SQ, MEI H, et al, 2011, Genetic diversity ofCamelliaoleiferafrom Hubei Province revealed by SRAP analysis [J]. J Huazhong Norm Univ: Nat Sci Ed, 45(3):477-484. [张婷, 刘双青,梅辉, 等, 2011, 湖北省油茶资源遗传多样性的SRAP分析[J]. 华中师范大学学报·自然科学版, 45(3):477-484.]
ZHANG T, LIU SQ, MEI H, et al, 2011. AFLP analysis on the genetic diversity ofCamelliaoleiferafrom different regions of Hubei Province [J]. J Anhui Agric Sci, 39(23):14 070-14 071. [张婷, 刘双青, 梅辉, 等, 2011. 湖北省不同地区油茶遗传多样性的AFLP分析[J]. 安徽农业科学, 39(23):14 070-14 071.]
ZHUANG RL,2007. ChinaCamellia[M]. 2nd ed. Beijing: China Forest Publishing House:1-8. [庄瑞林,2007. 中国油茶[M]. 2版. 北京: 中国林业出版社:1-8.]
Genetic diversity analysis of Camellia oleifera in Guangxi using SSR markers
ZHANG En-Hui1, WANG Xiao-Yun1, QIN Zi-Hai2, ZHAO Wen-Dong3,WEI Chang-Jiang3, WANG Peng-Liang2*
( 1. Collaborative Innovation Center for the Modern Technology and Industrial Development of Jiangxi Minority Traditional Medicine,JiangxiUniversityofTraditionalChineseMedicine, Nanchang 330004, China; 2.GuangxiKeyLaboratoryofsuperiorTimberTreesResourceCultivation,GuangxiKeyLaboratoryofSpecialNon-woodForestCultivation&Utilization,GuangxiForestryResearchInstitute, Nanning 530002, China; 3.GuangxiState-ownedSanmenjiangForestryFarm, Liuzhou 545006, China )
Oil tea (Camelliaoleifera) is the important oiltree in our country with the vastest area of distribution and the most products in the genus ofCamellia. Guangxi Zhuang Autonomous Region, the important distribution area of oil tea, abounds in oil tea germplasm resources. In order to evaluate genetic variation of germplasm resources of oil tea in Guangxi for germplasm conservation and cultivar selection, 10 SSR primer pairs were screened and evaluated in the present study, then genetic diversity of 97 representive germplasm resources of oil tea in Guangxi was analysed based on the polymorphic SSR markers. The findings indicated as follows: Firstly, of the ten developed SSR primer pairs, seven codominant primer pairs could produced stable amplicons, and another two primers could produce unstable amplicons; the remaining one yielded no band on the gel. Secondly, a total of 33 alleles were detected among 97 oil tea germplasm resources using seven codominant SSRs, and the number of alleles was from three to six with an average of 4.714 3 for every pair of primers; the number of effective allele ranged from 2.084 2 to 4.314 8 with an average of 2.828 8, and the gene diversity was from 0.520 2 to 0.768 2 with an average of 0.628 1. Thirdly, almost loci out of Hardy-Weinberg equilibrium meant genetic structure in the population, the ranges of observed and expected heterozygosity were 0.413 0-0.670 1 and 0.523 3-0.772 4,with the averages of 0.569 8 and 0.631 6. Finally, the range of genetic distances among germplasm resources was 0.05-0.791 7, with an average of 0.354 5. The cluster analysis based on UPGMA method revealed that the germplasm resources from the same places could not cluster in the same branch, on the other hand, the germplasm resources in one branch came from several places. The foregoing results reveavled that the developed SSRs of oil tea were suitable to work in the oil tea in Guangxi and the genetic diversity of germplasm resources in Guangxi was relatively higher. Those findings provide the scientific evidences for deep exploitation and efficient utilization of genetic resources of oil tea in Guangxi.
oil tea (Camelliaoleifera), SSR marker, genetic diversity, genetic structure, multiple alleles
10.11931/guihaia.gxzw201502002
2015-05-02
2015-07-18
国家自然科学基金(31460208)[Supported by the National Natural Science Foundation of China(31460208)]。
张恩慧 (1990-),女,河南宝丰人,在读硕士研究生,主要研究方向为药用植物分子生物学,(E-mail)993587028@qq.com。
王鹏良,博士,高级工程师,研究方向为植物分子育种,(E-mail) pengliang_wang@163.com。
Q949
A
1000-3142(2016)07-0806-06
张恩慧,王晓云,覃子海,等. 广西普通油茶种质资源遗传多样性的SSR分析[J]. 广西植物,2016,36(7):806-811
ZHANG EH,WANG XY,QIN ZH,et al. Genetic diversity analysis ofCamelliaoleiferain Guangxi using SSR markers[J]. Guihaia,2016,36(7):806-811

