白及内生真菌多样性研究
韦艳梅,周雅琴,李 力,谭小明
( 西南濒危药材资源开发国家工程实验室,广西药用植物园,南宁 530023 )
白及内生真菌多样性研究
韦艳梅,周雅琴,李力,谭小明*
( 西南濒危药材资源开发国家工程实验室,广西药用植物园,南宁 530023 )
白及(Bletillastriata)是兰科地生型多年生植物,也是我国传统中药材之一。利用菌根技术进行白及的保护和人工栽培,需要获得白及可培养的内生真菌。该研究以广西野生的白及根和叶为材料,采用分离培养法分离内生真菌,并结合真菌形态特征,及其核糖体的转录间隔区(ITS)序列分析,确定内生真菌的分类地位。结果表明:从2株白及植物90块组织中分离获得37株内生真菌,鉴定为15个分类单元,由9个属组成,分属于2门4纲7目8科,包括锤舌菌纲(Leotiomycetes)、座囊菌纲(Dothideomycetes)和粪壳菌纲(Sordariomycetes),伞菌纲(Agaricomycetes)。从根中分离获得内生真菌12种,蜡壳菌属为优势属;从叶中分离获得内生真菌3种,刺盘孢属为优势属;刺盘孢菌属(Colletotrichum)和蜡壳菌属(Sebacina)真菌的相对多度值均达到20%;4株担子菌均分布于根中,叶组织中未有分布。根组织中内生真菌的多样性指数(H=1.863)高于叶组织(1.098)。该研究结果及其所分离培养的担子菌类真菌,为更好地利用菌根技术进行白及等兰科植物资源的保护与可持续利用奠定了基础。
白及,可培养内生真菌,蜡壳菌属,多样性, 鉴定
白及(Bletillastriata)为兰科(Orchidaceae)白及属(BletillaReichb. f.)地生型多年生植物,其花色艳丽,极具观赏价值,还是目前我国濒危紧缺的中药材之一,其根茎中富含药用成分白及胶质,具有收敛止血、清热解毒、消肿生肌等作用(国家药典委员会,2015),疗效确切,经济价值很高。但是,由于白及种子无胚乳,自然条件下难以萌发,仅靠无性繁殖,繁殖系数极低;加之近年来野生白及栖息地环境恶化和多年来的乱采乱挖,导致野生白及资源几近枯竭,市场供不应求,严重限制了其在医药、食品、化状品及其他方面的应用(刘光斌等, 2005)。因此,如何实现白及资源的保护与资源再生,是一个重要而急切的课题。
研究表明,所有兰科植物均与内生真菌形成互惠互利的菌根共生关系,这种关系在兰科植物的生活史中扮演着重要作用。首先,菌根真菌能促进兰科植物种子萌发。兰科植物种子仅有原胚,自身贮存的营养物质有限,自然条件下萌发困难,需依靠真菌的侵染提供营养才能萌发。Bernard首次从兰科鸟巢兰属(Neottia)植物中发现促进兰科植物种子萌发的菌根真菌,并提出了兰科植物种子自然条件下靠消化菌根真菌才能萌发的经典的共生萌发理论(Selosse et al, 2011)。Tan et al(2014)从120多种兰科植物中分离并筛选获得了12种促进铁皮石斛种子萌发的菌根真菌,其中金钗石斛菌根真菌JC-02和JC-05,可显著促进铁皮石斛种子萌发和幼苗的生长。这些优良菌根真菌的发现,为今后有效利用真菌进行田间栽培试验奠定了菌种基础。其次,菌根真菌能促进兰科植物幼苗生长和发育。Guo & Cao(2000)率先利用菌根共生技术解决石斛属植物的资源再生难题,先后从石斛属植物中发现7种可与铁皮石斛幼苗共生的真菌,对幼苗具有显著促生作用。同时,菌根真菌也是植物组培苗产生药用成分的重要诱导因子(Selosse et al, 2011)。
目前,通过组织培养繁育白及的研究已取得一定的进展(鲁光耀, 2015),但试管苗存在着退化、移栽成活率低、生长缓慢、活性成分偏低等诸多现实问题。近年来,国内外针对白及的研究主要集中在化学、药理、组织培养和引种驯化等方面,而对于白及内生真菌分离鉴定及多样性研究的报道较少。本研究通过对白及内生真菌及多样性进行研究,旨在为深入研究白及与内生真菌的共生关系提供可利用的菌种资源,为在生产实践中有效地利用白及内生真菌提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料供试材料为2株野生白及,采自广西桂林市资源县(海拔1 350 m; 110°63′ E,26°03′ N)。
1.1.2 分离培养基采用马铃薯葡萄糖(PDA)培养基分离培养内生真菌。PDA培养基的配方及制作:马铃薯200 g,洗净后去皮切成小块,开水煮30 min,4层纱布过滤,取滤液加入葡萄糖20 g,琼脂15 g,加热至完全溶解,加入蒸馏水定容1 000 mL,pH自然。121 ℃灭菌20 min,备用。
1.2 方法
1.2.1 内生真菌的分离方法选取健康白及植物的根和叶,在自来水下冲洗干净,切成1 cm的小段。在无菌条件下,先用70%的酒精浸泡30 s,再用2%次氯酸钠浸泡消毒3~5 min,无菌水冲洗3~5次,去除残留的次氯酸钠。用无菌滤纸,吸取材料表面的水分,然后用手术刀将材料切成5 mm(根)或5 mm × 5 mm(叶),接种至含有硫酸链霉素(50 mg·L-1)和四环素(50 mg·L-1)的 PDA培养基,25 ℃暗培养7~15 d。每皿接种组织块9块,根和叶均重复5皿,每个器官接种45块组织。
1.2.2 内生真菌的纯化及保藏待组织块边缘长出真菌菌丝,及时将菌丝接种至新鲜的PDA培养基上进行纯化培养;当菌落长至培养基的2/3面积时,根据菌落的形态特征(生长速度、颜色、气生菌丝有无等),合并相同菌株;将形态各异纯化后的内生真菌菌株分为两部分,一部用于4 ℃或-80 ℃保藏,另一部分用于真菌形态鉴定。
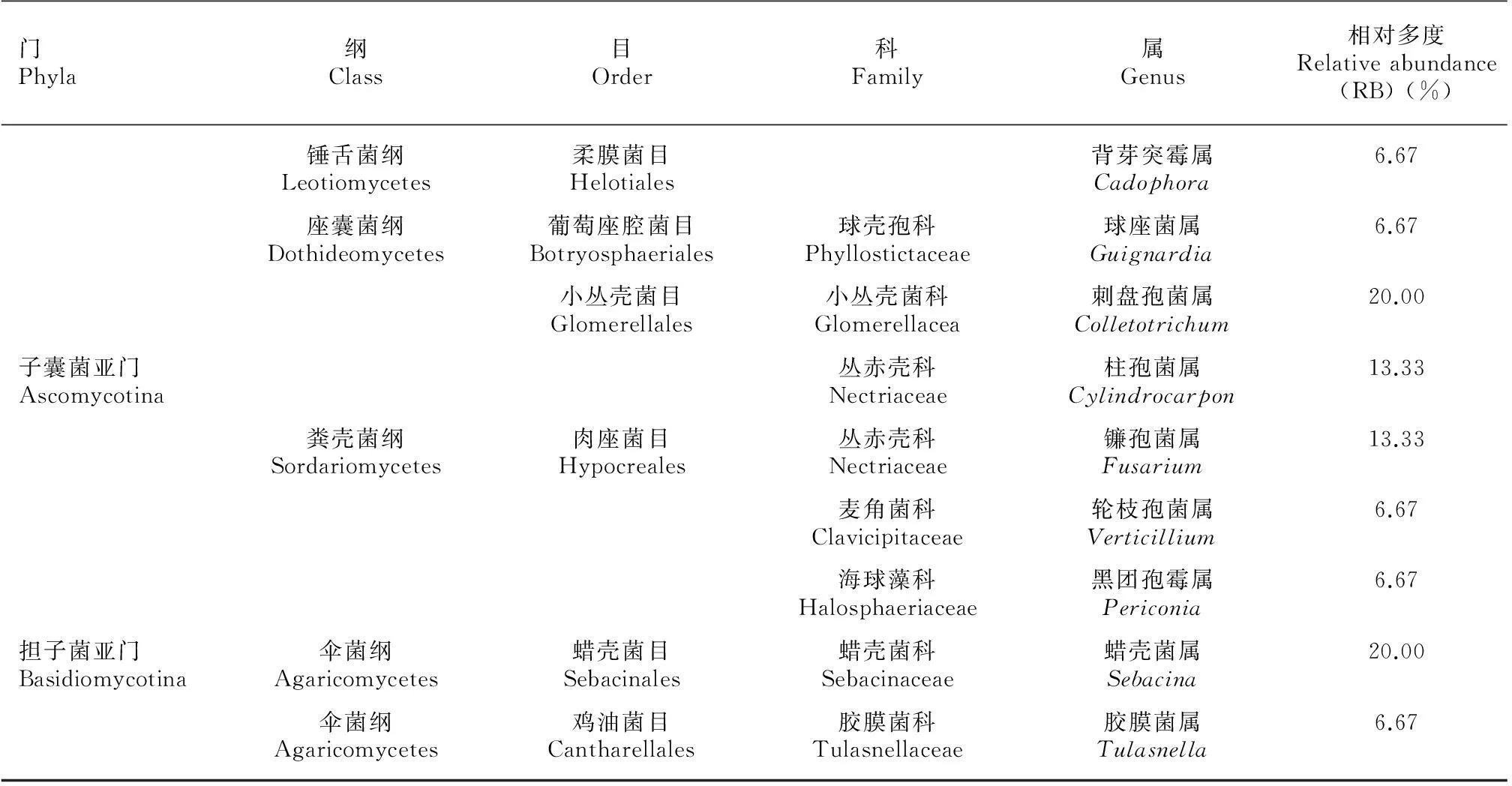
表 1 白及根和叶可培养内生真菌种群组成Table 1 Culturable endophytic fungi isolated from roots and leaves of Bletilla striata

图 1 基于rDNA-ITS 建立的NJ系统进化发育树,显示15株白及内生真菌与其他相关类群真菌的系统发育关系以Armillaria sinapina为外类群。Bootstrap值≥50%显示在每个分支的节点上。Fig. 1 Phylogenetic relationships among fifteen endophytic fungi from B. striata and fungi associated with other related taxa Armillaria sinapina was used as the outgroup. Bootstrap values (≥50%) are indicated along to relevant nodes.
1.2.3 内生真菌的形态学鉴定主要参考《真菌鉴定手册》及其他已发表的文献资料(魏景超,1979; Ellis, 1971; Bailey & Jeger, 1992; Nontachaiyapoom et al, 2010; Chen et al, 2010),根据宏观的菌落特征和显微特征,对分离到的白及内生真菌进行鉴定,确定真菌的分类地位。
1.2.3.1 显微特征观察采用透明胶带粘取菌丝,置于表面加有1滴10% KOH的载玻片上,在生物显微镜下,观察分生孢子和孢子梗的大小、形状、颜色、表面纹饰、产孢方式等,并进行测量和拍照。为了观察自然生长的菌丝形态,可以用插片法在PDA培养基上培养真菌。
1.2.3.2 繁殖结构的诱导内生真菌大多数不产生分生孢子,往往需要诱导产孢。本研究采用低温诱导法、紫外线照射法等培养真菌,促使真菌产生繁殖结构和分生孢子,进行形态学鉴定。
1.2.4 内生真菌的分子鉴定利用ITS-rDNA进行内生真菌分子鉴定。参照真菌DNA提取试剂盒的使用指南进行总DNA的提取(E. Z. N. ATM Fungal DNA Kit,Omega BioTek,Doraville,Georgia,USA);采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTG-CGG-3′)和ITS4(5′-TCCTCCGCTTATFGATATGC-3′)扩增ITS1,5.8S和ITS2全序列。50 μL PCR扩增反应体系:Mix 25 μL;引物各2 μL (5 μmol·L-1);模板2~10 μL;ddH2O补足50 μL。PCR扩增反应条件:94 ℃ 预变性3 min;94 ℃变性30 s;55 ℃退火30 s;72 ℃延伸25 s;共30个循环后,72 ℃再延伸7 min,4 ℃保存。取5 μL PCR扩增产物,用0.8%琼脂糖凝胶电泳检测。电泳结束后,在紫外灯下观察,有条带的PCR产物送上海生工生物工程公司测序。测序所用引物与扩增反应相同。将获得的目标ITS序列在GenBank数据库中进行网上比对分析,利用Clustal W1.6软件进行全序列比对,并用MEGA 4.0.2软件进行聚类分析,构建NJ系统发育树,对内生真菌进行分子鉴定。
1.3 内生真菌多样性分析
本研究采用相对多度和多样性指数度量白及根和叶组织中内生真菌的丰度。内生真菌相对多度可以反映某种内生真菌在该物种中出现的频率;多样性指数则能反映白及内生真菌种群的丰富程度,用来分析其物种的多样性。
相对多度(relative abundance,RB)是指分离得到的某种内生真菌菌株数量占该植物内生真菌总菌株数量的百分率。
内生真菌的多样性参照香农多样性指数(Shannon-Wiener diversity index,H′)的公式进行计算,公式如下:
式中,k代表内生真菌的总分离株数;Pi代表某种内生真菌占总菌株数的百分比(Pielou, 1975)。
2 结果与分析
2.1 白及内生真菌的分离与鉴定
采用组织块分离法从野生白及叶和根中,分离获得37株可培养的内生真菌,经菌落特征和真菌显微特征的观察,分为15个分类单元。然而,这些内生真菌往往不产生分生孢,影响了进一步的分类鉴定。因此,基于ITS-rDNA序列信息,以Armillariasinapina为外类群,构建白及内生真菌与其他相关真菌类群的NJ系统发育树(图1)。
通过分析系统发育树,可将这15株真菌分为9个属,涉及2门4纲7目8科。子囊菌亚门真菌有7种,担子菌亚门真菌有2种。这些子囊菌包括锤舌菌纲(Leotiomycetes)、座囊菌纲(Dothideomycetes)和粪壳菌纲(Sordariomycetes)。其中,粪壳菌纲的种类最多。刺盘孢菌属(Colletotrichum)和蜡壳菌属(Sebacina)真菌为优势菌群,均占总分离菌株数的20%(表1)。
2.2 白及根和叶中内生真菌的分布
4种担子菌均分离于根中,其中,蜡壳菌属(Sebacinasp.1)(BS11)、Sebacinasp.2(BS12)、Sebacinasp.3(BS13)等3种和胶膜菌属(Tulasnellasp.)(BS14)1种。另外,2种镰孢菌属(Fusariumsp.1)(BS7)和sp.2(BS8)、1种背芽突霉属(Cadophorasp.) (BS1)、2种刺盘孢菌属(Colletotrichumsp.1) (BS2)和Colletotrichumsp.2 (BS3)、2种柱孢菌属(Cylindrocarponsp.1) (BS5)、Cylindrocarponsp.2 (BS6)和1种轮枝孢菌属(Verticilliumsp.) (BS15)由根组织中分离获得。从叶片分离到1种刺盘孢菌属(Colletotrichumsp.3) (BS3)、1种黑团孢霉属(Periconiasp.) (BS10)、1种球座菌属(Guignardiasp.) (BS9)。
2.3 白及内生真菌多样性
内生真菌的Shannon-Wiener多样性指数H=1.483,其中,根组织中内生真菌的Shannon-Wiener多样性指数H=1.8638,叶组织中Shannon-Wiener多样性指数H=1.098。
3 讨论与结论
对广西野生白及根和叶组织中内生真菌的分离和鉴定结果表明,不同组织器官中的内生真菌的数量和种类及多样性存在较大的差异。这种差异性的出现在以往的研究中得到证实。谭小明等(2014)从濒危药用植物八角莲根茎叶中分离到内生真菌以根中最多。而陈佳昕等(2008)从药用植物茅苍术叶中分离到14株内生真菌,而根和茎各只有一株;周雅琴等(2015)对广西野生南方红豆杉内生真菌进行了分离,从茎中分离获得的内生真菌比根和叶多。这种差异性与不同植物内生真菌对营养需求的特殊性可能相关;不同植物生长的宏观因素,如季节、年限、干湿等,以及植物体内微环境如化学成分组成及植物结构,也可能是影响植物内生真菌种群和数量及多样性的重要因子。
组织块分离法是植物内生真菌多样性研究的方法之一。这一方法可以获得可以培养的内生真菌,但由于人工合成培养基的局限性,不是所有的内生真菌都能够在人工合成的培养基上生长,这一类内生真菌被称为未培养真菌。Amann et al(1995)的研究表明,自然界中有85%~99.9%的内生真菌是无法在培养基上进行纯培养的。近年来,分子生物学技术如宏基因组测序方法也常应用于内生真菌多样性的研究,让人们能更全面地认识植物内生真菌的种类和多样性,当然也包括未培养内生真菌;但无法获得可用于培养的内生真菌。因此,组织块分离法还是目前植物内生真菌研究的主要方法。
所有兰科植物都与菌根真菌存在密切的共生关系。这些菌根真菌大多属于担子菌。在本研究中,从根中分离获得3种蜡壳菌属真菌和1种胶膜菌属(Tulasnella)真菌。研究表明,蜡壳菌属和胶膜菌属真菌是兰科植物菌根真菌中常见的种类(Nontachaiyapoom et al, 2010),这些真菌有的可以促进植物种子的萌发,有的可以促进植物生物量的增加,或增强植物的抗逆能力。因此,开展蜡壳菌属和胶膜菌属真菌与白及植物的共生关系研究,将是下一步工作的重点。
AMANN RI, LUDWIG W, SCHLEIFER K, et al,1995. Phylogentic identification andinsitudetection of individual microbial cells without cultivation [J]. Microbiol Rev, 59(1): 143-169.
BAILEY JA, JEGER MJ,1992. Collectotrichum: biology, pathology and control [M]. Wallingford, UK: CAB International Press:1-46.
CHEN J, DONG HL, MENG ZX, et al,2010.CadophoramalorumandCryptosporiopsisericaeisolated from medicinal plants of the Orchidaceae in China [J]. Mycotaxon, 112: 457-461.
CHEN JX, DAI CC, LI X,et al,2008. Endophytic fungi screening fromAtractylanceaand inoculating into the host plantlet [J]. Guihaia, 28(2): 256-260. [陈佳昕,戴传超,李霞,等,2008.茅苍术内生真菌的分离鉴定及在组培苗中的回接 [J].广西植物, 28(2): 256-260.]
ELLIS MB,1971. Dematiaceous hyphomycetes [M]. England: CABI Publishing: 1-608.
GUO SX, CAO WQ,2000. Isolation and biological activity of mycorhizal fungi fromDendrobiumcandidumandD.nobile[J]. Chin M J Chin Mat Med, 25(6): 338-340.
LIU GB,HUANG Z,HUANG CG,et al,2005. Functions and application in cosmetics ofBletillastriata(thunb) reichb. F [J]. Deterg & Cosm,28(8): 22-24. [刘光斌,黄忠,黄长干,等,2005. 天然植物白芨胶的功能及在化妆品中的应用 [J].日用化学品科学,28(8): 22-24.]
LU GY,YANG X,JIANG RB,et al,2015. Rapid propagation ofBletillastriata[J]. J Zhejiang Univ Trad Chin Med,39(5): 383-390. [鲁光耀,杨仙,蒋瑞彬,等,2015.白芨组培快速繁殖体系研究 [J].浙江中医药大学学报,39(5): 383-390.]
NONTACHAIYAPOOM S,SASIRAT S,MANOCH L,et al,2010. Isolation and identification ofRhizoctonia-like fungifrom roots of three Orchid genera,Paphiopedilum,Dendrobium, andCymbidium, collected in Chiang Rai and Chiang Mai provinces of Thailand [J]. Mycorrhiza, 20: 459-471.
PIELOU EC,1975. Ecological diversity [M]. New York: John Wiley and Sons Inc: 1-165.
SELOSSE M A, BOULLARD B, RICHARDSON D,2011. No⊇l Bernard (1874-1911): Orchids to symbiosis in a dozen years, one century ago [J]. Symbiosis, 54(2): 61-68.STATE PHARMACOPOEIA COMMITTEE, 2015. The pharmacopoeia
(Continueonpage831)(Continuefrompage836)
of the People’s Republic of China. Part Ⅰ [M].Beijing:China Pharmaceutical science and Technology Publishing House:103. [国家药典委员会,2015.中华人民共和国药典(一部) [M].北京:中国医药科技出版社:103.]TAN XM, YU LY, ZHOU YQ, 2014. Isolation, identification and antimicrobial activities of endophytic fungi ofDysosmaversipellis(Hance)M. Cheng [J]. Chin Pharml J,49(5):363-366. [谭小明,余丽莹,周雅琴, 2014.濒危药用植物八角莲内生真菌分离鉴定及抗菌活性研究 [J].中国药学杂志,49(5):363-366.]
TAN XM, WANG CL, CHEN XM, et al, 2014.Invitroseed germination and seedling growth of an endangered epiphytic orchid,Dendrobiumofficinale, endemic to China using mycorrhizal fungi (Tulasnellasp.) [J]. Sci Hortic, 165(22): 62-68.
WEI JC, 1979. Fungal identification manual [M].Shanghai: Shanghai Science and Technology Press:1-780. [魏景超, 1979.真菌鉴定手册 [M].上海: 科学技术出版社:1-780.]YU J, ZHOU F, CHEN J, et al,2011. Diversity of endophytic fungi fromCistanchedeserticola[J]. Chin J Chin Mat Med,36(5):542-546. [于晶,周峰,陈君, 等, 2011.肉苁蓉内生真菌多样性研究 [J].中国中药杂志,36(5):542-546.]
ZHOU YQ,TAN XM,CHEN J,et al,2015. Isolation of endophytic fungi fromTaxuschinensisvar.maireiCheng et L. K and its antimicrobial activity [J]. Chin Pharm J,50(1):19-22. [周雅琴,谭小明,陈娟,等,2015.南方红豆杉内生真菌的分离及抗菌活性筛选研究 [J].中国药学杂志,50(1):19-22.]

Divetsity of endophytic fungi associated withBletillastriata
WEI Yan-Mei, ZHOU Ya-Qin, LI Li, TAN Xiao-Ming*
( National Engineering Laboratory of Southwest Endangered Medicinal Resources Development, National Development andReformCommission,GuangxiBotanicalGardenofMedicinalPlant, Nanning 530023, China )
Bletillastriata, as atraditional Chinese herbal medicine, is a terrestrial and perennial medicinal plant. It is necessary to obtain the culturable endophytic fungi in the application of mycorrhizal technology for the protection and artificial cultivation ofB.striata. The independent fungal isolates were isolated from the roots and leaves ofB.striata, and identified based on the fungal morphological characteristics and the analysis of the fungal internal transcribed spacer (ITS) of rDNA sequences. The results showed that thirty-seven independent fungal isolates were obtained from forty-five root tissues and forty-five leaf tissues of two wild plants ofB.striata. The isolates were identified to 15 taxa, belonging to nine genera,eight families, seven orders,four classes, and two phyla. The four classes are corresponding to Leotiomycetes, Dothideomycetes, Sordariomycetes and Agaricomycetes. Twelve endophytic fungi were isolated from the roots, andSebacina were dominant genus. Three endophytic fungi were isolated from the leaves, andColletotrichumwere dominant genus. The relative abundance ofSebacina orColletotrichumwas 20%. Four basidiomycetes all were not isolated from the leavf tissues but the roots. The diversity index of endophytic fungi in roots (H′=1.863) was higher than that in leaves (H′=1.098). The positive results in this report demonstrated that fungi isolated fromB.striatacould be used for the protection and artificial cultivation of the host. Moreover, these Basidiomycetous fungi simultaneously clould be used as a valuable candidate sources for the protection and sustainable utilization of orchid resources by mycorrhizal technology.
Bletillastriata, culturable endophytic fungi,Sebacina, diversity, identification
10.11931/guihaia.gxzw201512004
2015-12-03
2016-04-14
广西自然科学基金(2015GXNSFDA139012);广西药用植物园科研基金(桂药基201401)[Supported by the Natural Science Foundation of Guangxi(2015GXNSFDA139012);Research Fund of Guangxi Medicinal Botanical Garden(201401)。]
韦艳梅(1983-),女(壮族),广西都安人,硕士,工程师/助理研究员,主要从事园林景观建设、植物栽培研究,(E-mail) weiyanmei99@126.com。
谭小明,博士,副研究员,主要从事药用植物菌根生物学研究,(E-mail) txm1978@126.com。
Q943
A
1000-3142(2016)07-0832-05
韦艳梅,周雅琴,李力,等. 白及内生真菌多样性研究 [J]. 广西植物,2016,36(7):832-836
WEI YM, ZHOU YQ, LI L, et al. Divetsity of endophytic fungi associated withBletillastriata[J]. Guihaia,2016,36(7):832-836

