云南南部野生大叶千斤拔资源遗传多样性的ISSR分析
王桂娟,肖文祥,唐寿贤
( 中国科学院西双版纳热带植物园,云南 勐腊 666303 )
云南南部野生大叶千斤拔资源遗传多样性的ISSR分析
王桂娟*,肖文祥,唐寿贤
( 中国科学院西双版纳热带植物园,云南 勐腊 666303 )
应用ISSR分子标记技术,对云南南部7个地区的野生大叶千斤拔(Flemingiamacrophylla)居群进行了遗传多样性分析。结果表明:云南野生大叶千斤拔具有较高的遗传多样性。在物种水平上,平均每个位点的多态位点百分率(PPL)为94.85%,有效等位基因数(Ne)为1.462 7,Nei’s基因多样性指数(He)为0.281 5,Shannon’s多样性信息指数(Ho)为0.433 7;在居群水平上,PPL= 43.44%,Ne = 1.298 1,He = 0.170 4,Ho = 0.249 9。基于Nei’s遗传多样性分析可得出,居群间的遗传分化系数(Gst)为0.397 5,表明居群内的遗传变异为60.25%,居群间的遗传变异为39.75%,这说明居群间的遗传分化要低于居群内的遗传分化。根据遗传多样性分析和聚类结果,应在大叶千金拔遗传多样性较高的勐腊易武(MY)、丘北(QB)和宁洱(NE)地区,设立保护点对其进行就地保护。
大叶千金拔, 遗传多样性, ISSR
大叶千斤拔(Flemingiamacrophylla)属豆科(Leguminosae)千金拔属(FlemingiaRoxb.),分布于印度、孟加拉、缅甸、老挝、越南、柬埔寨、马来西亚和印度尼西亚等亚洲热带和亚热带地区。在中国主要分布于云南、广西、贵州、广东、台湾、海南和四川,其中以云南的资源最为丰富(韦裕宗,1991)。大叶千斤拔常生长于海拔260~1 800 m的草地和灌木丛,其根部具有祛风除湿、舒筋活络、强筋壮骨及消炎止痛等功效,是妇科千金片、金鸡胶囊、复方挫伤灵和活络止痛丸等中成药的主要原料(张丽霞等,2007)。大叶千金拔种子、叶片及嫩枝可作为畜禽的优质蛋白饲料,是优良的牧草资源(赵茜,2002)。此外,由于大叶千金拔具有较强的固氮作用,还可以用来改良土壤(吕福基等,1991)。近年随着对大叶千金拔需求的加大,以及大量荒山和坡地被开垦,野生的大叶千金拔资源日趋减少,因此对其遗传资源的研究及保护工作已十分必要。
ISSR(Inter-Simple Sequence Repeat)作为一种分子标记方法,由于其技术简单方便、费用低、通用性好,在植物的遗传多样性研究中被广泛使用(向振勇等,2007;Wang et al,2012;Liu et al,2013)。张忠廉等(2011)应用ISSR技术对千斤拔属的14种植物亲缘关系进行分析,表明千斤拔属植物具有丰富的遗传多样性。千斤拔属植物的主要活性成分为黄酮类物质,此外还含有香豆素类、萜类、挥发性油类、脂肪酸类等物质,具有抗炎镇痛、抗病原微生物、抗氧化、抗血栓、保护神经及脑组织等功能(李莉等,2009;李宝强等,2009;李昌松等,2011)。此外,对大叶千金拨的地理分布及种子生物学等方面也有一定的研究(管艳红等,2009;管志斌等,2011)。本研究采用ISSR分子标记技术对云南省分布的野生大叶千金拔居群进行研究,对其居群遗传多样性水平和遗传结构进行分析,为科学合理地保护和利用现有的野生大叶千金拔资源提供理论依据和技术支持。
1 材料与方法
1.1 植物材料
研究材料采自云南的澜沧、宁洱、丘北、象明、易武、杨武和嘎洒地区(图1),共计7个居群,135个样本。采集过程中,对于个体数大于20株的居群按照均匀分布、随机取样的原则进行采样,而对于个体少于此数的居群进行全部个体采样,采集新鲜叶片,记录各居群的采集地、生境、海拔、地理位置,所有样本均在中国科学院西双版纳热带植物园进行迁地保存(表1,图1)。
1.2 基因组DNA提取
采用改良后的CTAB法提取基因组DNA,用0.8%的琼脂糖凝胶电泳检测其质量,并在紫外分光光度计(Beckman DU 800)下检测其质量和浓度,最后稀释标定到10 ng·μL-1, 放入-20 ℃冰箱里储存备用。
1.3 引物筛选与PCR扩增
所用引物参照加拿大哥伦比亚大学UBC公司公布的第9套ISSR引物序列,由生工生物工程(上海)股份有限工司合成。每个居群选取2个模版在20 μL 的反应体系中进行扩增筛选,从前60个引物中选取11个扩增条带清晰、重复性好的引物(表2)用于全部7个居群样本分析。
PCR扩增反应在Bio-Rad PCR仪上进行,经过比较与优化确定最佳的ISSR扩增条件为20 μL的反应体系,内含1 × Buffer,2.0 mmol·L-1MgCl2, 250 μmol·μL-1dNTPs,0.5 μmol·μL-1引物,0.5 UTaqDNA聚合酶(TOYOBO),25 ng 模版DNA。PCR扩增程序为95 ℃预变性7 min;之后进行35个循环:95 ℃变性45 s,46~54 ℃退火(退火温度随引物而定,表2)45 s,72 ℃延伸42 s;72 ℃温育7 min。
1.4 产物检测
PCR扩增产物用1%的琼脂糖凝胶进行电泳,溴化乙锭染色,在80 V电压下电泳30 min左右,Marker用100 bp DNA lader(昆明云科生物技术有限公司),在凝胶成像系统(UVP)中观察、记录和保存图像。
1.5 数据统计分析
对电泳图谱中同一位置上DNA带的有无进行统计,有带的记为“1”,无带的记为“0”,仅记录清晰、稳定、且长度在300~1 500 bp范围内的扩增带,形成0/1矩阵图输入计算机。应用POPGENE 软件(Yeh et al,1997)对全部居群和各单个居群分别进行遗传参数分析,分别计算了多态位点百分率(PPL)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s(1973)基因多样性指数(He)、Shannon信息指数(Ho)、居群总基因多样性(Ht)、居群内基因多样性(Hs)、居群间的遗传分化系数(Gst)、Nei’s(1978)遗传距离(D)和遗传一致度(I)。根据Nei’s遗传距离,利用NTSYS-pc2.1软件进行居群UPGMA聚类分析(Rohlf,2000)。居群间的基因流用公式Nm = 0.5(1-Gst)/Gst间接推算。
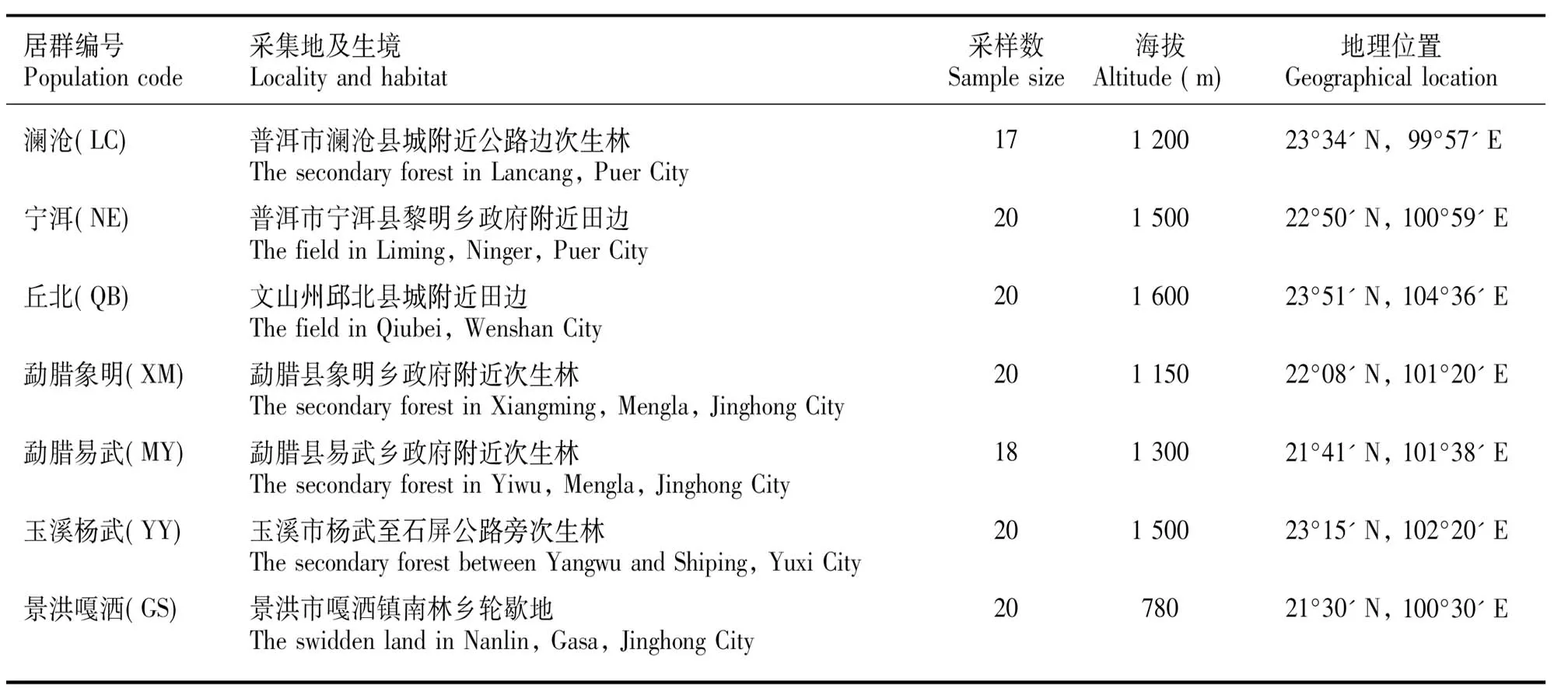
表 1 云南野生大叶千金拔居群取样分布的采集地、生境、海拔、地理位置及采样数Table 1 Locality, habitat, altitude, geographical location and sample size of Flemingia macrophylla populations from Yunnan
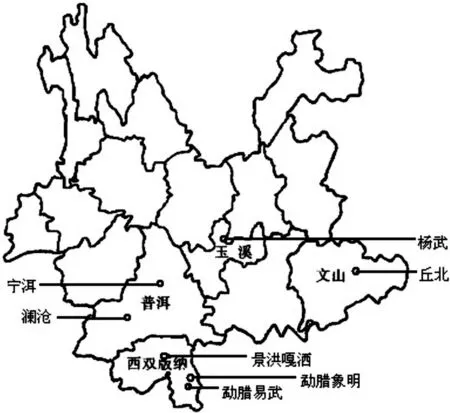
图 1 7个云南野生大叶千金拔居群的取样分布图 居群代号同表1Fig. 1 Locations of the 7 sampled Flemingia macrophylla populations Population codes are the same as those in Table 1
2 结果与分析
2.1 物种和群体水平的遗传多样性分析
用筛选到的11条ISSR引物,共检测到97个位点(每条引物产生6~11个位点),其中多态性位点92个。在物种水平上,多态位点百分率 (PPL) 为94.85%,Nei’s基因多样性指数(He)为0.281 5,Shannon信息指数(Ho)为0.433 7(表3)。在居群水平上,每个位点等位基因数(Na)为1.257 7~1.628 9,平均为1.434 4。有效等位基因数(Ne)为1.161 6~1.436 0,平均为1.298 1。多态位点百分率(PPL)在25.77%~62.89%之间,平均为43.44%,最高的是勐腊易武(MY)居群,最低的是玉溪杨武(YY)居群。居群的Nei’s基因多态性指数 (He)在0.094 9~0.247 5之间,平均为0.170 4。Shannon信息指数(Ho)在0.141 1~0.362 1之间,平均为0.249 9。两者大小与居群多态位点百分率的趋势基本一致(表3),由高到低依次为勐腊易武(MY)> 丘北(QB)> 宁洱(NE)> 勐腊象明(XM)> 景洪嘎洒镇南林山(GS)> 澜沧(LC)> 玉溪杨武(YY)。各居群间均有遗传多样性差异。其中勐腊易武(MY)居群的遗传多样性水平最高,PPL= 62.89%,Ne = 1.436 0,He = 0.247 5,Ho = 0.362 1;玉溪杨武居群的遗传多样性水平最低,PPL= 25.77,Ne = 1.161 6,He = 0.094 9,Ho = 0.141 1。
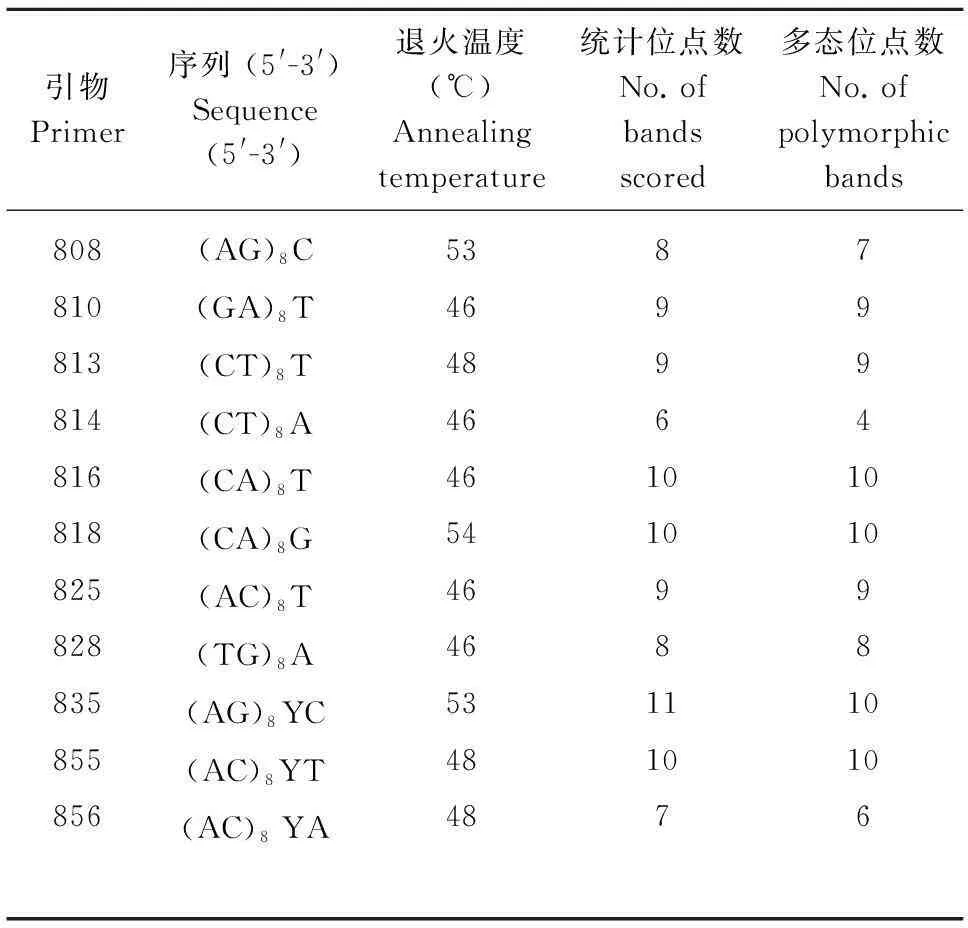
表 2 对大叶千金拔7个居群,135株 个体进行扩增的ISSR引物Table 2 ISSR primers used for generating ISSR markers from 135 individuals of 7 Flemingia populations
Note:Y=(C,T).
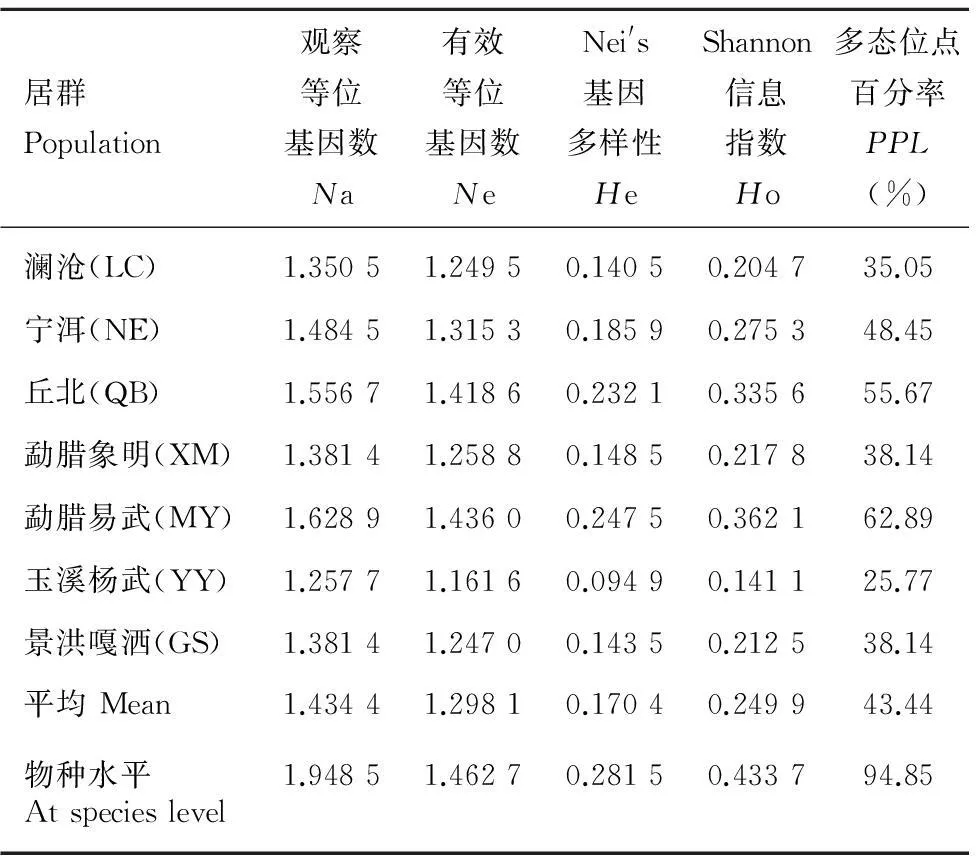
表 3 大叶千金拔居群的遗传多样性Table 3 Genetic diversity of Flemingia populations
Note:Na. Observed number of alleles;Ne. Effective number of alleles;He. Nei’s gene diversity;Ho. Shannon’s information index;PPL. Percentage of polymorphic loci.
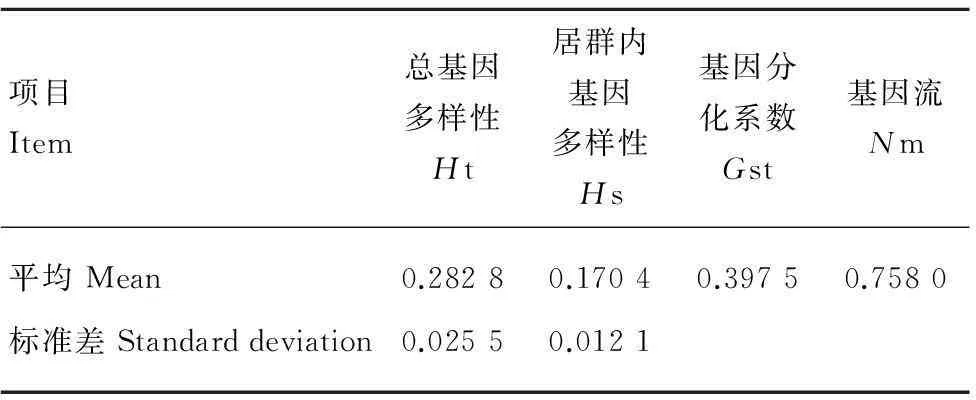
表 4 大叶千金拔居群基因多样性Nei′s(1987)分析Table 4 Nei’s(1987) analysis of gene diversity in Flemingia populations
Note:Ht. total gene diversity;Hs. gene diversity within populations;Gst. coefficient of gene differentiation;Nm. gene flow.(Nm = 0.5(1-Gst)/Gst)
2.2 居群间遗传分化程度的比较
大叶千金拔各居群间存在着一定的遗传分化(表4)。7个自然居群总的遗传多样性Ht = 0.282 8,其中居群内遗传多样性Hs = 0.170 4,居群间的基因多样度(Dst =Ht-Hs)为0.112 4,Nei’s基因分化系数Gst = 0.397 5,表明有39.75%的遗传变异存在于居群间,有60.25%的遗传变异存在于居群内,居群内的遗传分化大于居群间的分化。居群间基因流(Nm = 0.5(1-Gst)/Gst)为0.758 0。
2.3 聚类分析
大叶千金拔7个居群间的Nei’s遗传一致度I值的变化范围为0.783 2 ~ 0.904 1,遗传距离D值的变化范围为0.100 8 ~ 0.244 4(表5)。UPGMA法聚类分析表明,景洪嘎洒(GS)和玉溪杨武(YY)居群的遗传一致度最高(0.904 1),遗传距离最近(0.100 8),因此,在图中这两个居群首先聚在一起;而景洪嘎洒(GS)与澜沧(LC)居群的遗传一致度最低(0.783 2),遗传距离最远(0.244 4),在图中的距离也最远(图2)。
3 讨论
3.1 大叶千斤拔的遗传多样性
本研究利用11条ISSR引物从大叶千斤拔7个居群的135个样品中共检测到97个位点,其中92个是多态性位点。在物种水平上,Nei’s基因多样性指数(He)为0.281 5,高于双子叶植物的平均值(He = 0.191)(Nybom & Bartish,2004;Nybom,2000),表现出较高的遗传多样性,但在居群平均水平上He为0.179 4,相对较低。物种水平上的遗传多样性较高,可能是由于大叶千斤拔分布于物种多样性丰富的热带和亚热带地区,生境差别较大,有利于多样性的形成。广布种比狭布种分布的物种具有更高的遗传多样性,物种分布的地理范围与遗传多样性紧密相关,物种分布越广泛,其遗传多样性越丰富(Hamrick et al,1991;Hamrick & Godt,1989)。本文云南野生大叶千斤拔的PPL= 94.85%,Na = 1.948 5,He = 0.281 5,Gst = 0.397 5,大叶千斤拔的多态位点百分率(PPL),基因多样性指数(He)及遗传分化系数(Gst)均明显偏高,说明大叶千斤拔具有较高的遗传多样性,这可能与大叶千斤拔是多年生植物,花期长,异花传粉的习性,有利于基因间的交流有关。在大叶千斤拔各居群中,勐腊易武(MY)居群的遗传多样性最高,多态性位点百分率PPL为62.89%,He为0.247 5,推测该居群是云南南部大叶千斤拔较早的分布中心。象明和易武都属勐腊地区,但象明居群(XM)的多态位点百分率PPL仅为38.14%,He仅为0.148 5,产生这么大差异的原因可能是由于云南特殊的地理位置,复杂的山川所致。
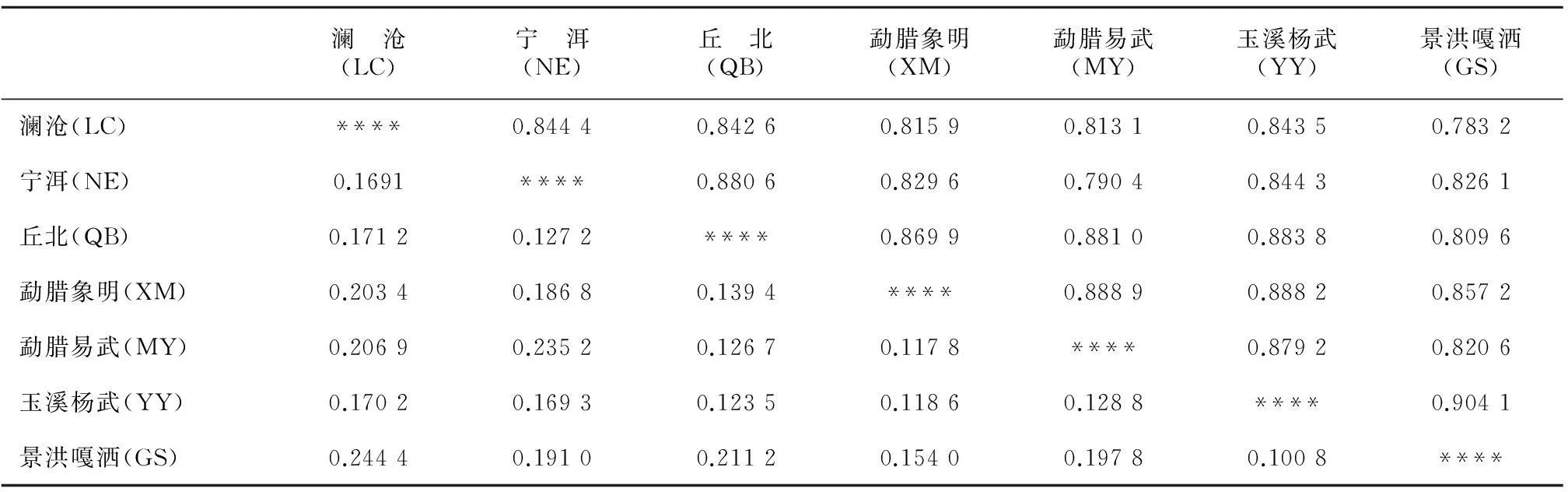
表 5 大叶千金拔7个居群间的Nei′s(1978)遗传一致度 (I) 和遗传距离 (D)Table 5 Nei’s(1978) genetic identity and genetic distance of 7 Flemingia populations
注:Nei’s遗传一致度 (对角线上) 和遗传距离 (对角线下)。
Note:Nei’s genetic identity (above diagonal) and genetic distance (below diagonal).
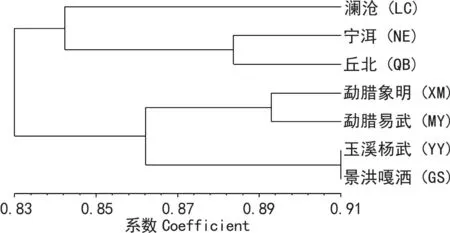
图 2 大叶千斤拔居群间的Nei’s遗传一致度UPGMA聚类图Fig. 2 UPGMA dendrogram for 7 Flemingia populations based on Nei’s genetic identity
3.2 大叶千斤拔的遗传结构
大叶千斤拔的遗传变异分析结果表明,居群内的遗传变异(60.25%)大于居群间的变异(39.75%),遗传变异主要发生在居群内,推断可能在居群内存在一定的基因交流障碍,由于海拔、降雨量和地理环境等因素的影响。因此,在进行大叶千斤拔的就地或迁地保护时,应注意考虑同一居群内的不同种质资源。大叶千斤拔居群间的基因流Nm为0.758 0 < 1,显示居群间也存在着一定的基因交流障碍,这很可能由于云南的地理环境和气候条件形成。大叶千斤拔的聚类分析表明(图2),7个大叶千斤拔居群大致可以分为两大支,即澜沧、宁洱、丘北为一支;玉溪杨武、为一支。地理距离较远的居群,如丘北与澜沧和宁洱,玉溪杨武与象明、勐腊易武和景洪嘎洒,在亲缘关系上却较近,可能与云南地区的特殊地理环境和气候条件有或人为因素有关。象明和易武居群在地理距离和亲缘关系都较近,建议在进行种质资源收集时,可作为一个地点进行样品采集。
GUAN YH,MA J,PENG JM,et al, 2009. Investigation on resources ofFlemingiaRoxb. ex Ait. et Ait. f. in Xishuangbanna [J]. Chin Med Mat,32(10):1 514-1 516. [管艳红,马洁,彭建明,等, 2009. 西双版纳千金拔属植物资源调查 [J]. 中药材,32(10):1 514-1 516. ]
GUAN ZB,ZHANG LX,GAO WW, 2011. Study on germination characteristics ofFlemingiamacrophyllaseeds [J]. Chin Agric Sci Bull,27(13):116-120. [管志斌,张丽霞,高微微, 2011. 大叶千金拔种子萌发特性研究 [J]. 中国农学通报,27(13):116-120.]
HAMRICK JL,GODT MJW,MURAWSKI DA, et al, 1991. Correlations between species traits and allozyme diversity:implications for conservation biology [M]//FALK DA,HOLSINGER KE. Genetics and conservation of rare plants. New York:Oxford University Press:75-86.
HAMRICK JL,GODT MJW, 1989. Allozyme diversity in plant species [C] // BROWN AHD,CLEGG MT,KAHLER AL, et al. Plant population genetics,breeding and genetic resources[C]. Sunderland,Massachusetts,USA ,Sinauer:43-63.
LI BQ,SONG QS, 2009. Chemical constituents in roots ofFlemingiamacrophylla[J]. Chin Tradit Herb Drugs,40(2):179-182. [李宝强,宋启示, 2009. 大叶千金拔根的化学成分 [J]. 中草药,40(2):179-182.]
LI CS,ZHANG LX,ZHAO JL,et al, 2011. Comparison of isoflavones content ofMoghaniamacrophyllafrom different areas of Yunnan Province [J]. Mod Chin Med,13(10):30-32, 42. [李昌松,张丽霞,赵俊凌,等, 2011. 云南地区大叶千金拔不同种质的异黄酮含量比较 [J]. 中国现代中药,13(10):30-32, 42.]LI L,QING MJ,ZHANG LX,et al, 2009. Advance in the study on the chemcal composition and biological activity ofFlemingiaRoxb. ex Ait. et Ait. f. [J]. Drugs Clin,24(4):203-211. [李莉,秦民坚,张丽霞,等, 2009. 千斤拔属植物的化学成分与生物活性研究进展 [J]. 现代药物与临床,24(4):203-211.]
LIU JF,SHI SQ,CHANG E,et al, 2013. Genetic diversity of the critically endangeredThujasutchuenensisrevealed by ISSR markers and the implications for conservation [J]. Intern J Mol Sci,14(7):14 860-14 871.
LV FJ,YANG CY,TANG QR,et al, 1991. Study of various economic benefit Pueraria ofWallichiiandFlemingiamacrophylla[J]. For Invent Plann,(4):13-16. [吕福基,杨成源,唐乾若,等, 1991. 马鹿花和大叶千金拔的多种经济效益研究 [J]. 林业调查规划,(4):13-16. ]
NYBOM H,BARTISH IV, 2000. Effects of life history traits and sampling strategies on genetic diversity estimates obtained with RAPD markers in plants [J]. Persp Plant Ecol Evol Syst,3(2):93-114.
NYBOM H, 2004. Comparison of different nuclear DNA markers for estimating intraspecific genetic diversity in plants [J]. Mol Ecol,13(5):1 143-1 155.
ROHLF FJ, 2000. NTSYS-pc:numerical taxonomy and multivariate analysis system,version 2.1 [M]. New York:Exeter Software.WANG HF,ZONG XX,GUAN JP,et al, 2012. Genetic diversity and relationship of global faba bean (Vicia faba L. ) germplasm revealed by ISSR markers [J]. Theor Appl Genet,124(5):789-797.
WEI YZ, 1991. Preliminary study on the ChinaFlemingiagenus [J]. Guihaia,11(3):198-204. [韦裕宗, 1991. 中国千斤拔属植物的初步研究 [J]. 广西植物,11(3):198-204.]
XIANG ZY,SONG SQ,WANG GJ,et al, 2007. Genetic diversity ofJatrophacurcas(Euphorbiaceae) collected from southern Yunnan, detected by inter-simple sequence repeat(ISSR) [J]. Acta Bot Yunnan,29(6):619-624. [向振勇,宋松泉,王桂娟,等, 2007. 云南南部不同种源地小桐子遗传多样性的ISSR分析 [J]. 云南植物研究,29(6):619-624. ]
YEH FC,YANG RC,BOYLE T,et al, 1997. POPGENE,the user friendly shareware for population genetic analysis [M]. Edmonton:University of Alberta.ZHANG LX,PENG JM,MA J, 2007. Research progress ofFlemingia[J]. Chin Med Mat,30(7):887-890. [张丽霞,彭建明,马洁, 2007. 千斤拔研究进展 [J]. 中药材,30(7):887-890.]
ZHANG ZL,ZHANG LX,SONG MF,et al,2011. Analysis of genetic relationship and quality assessment on plants inFlemingiaRoxb. ex Ait. et Ait. f. [J]. Chin Trad Herb Drugs,42(9):1 817-1 821. [张忠廉,张丽霞,宋美芳,等,2011. 千斤拔属植物亲缘关系分析及其初步质量评价 [J]. 中草药,42(9):1 817-1 821.]
ZHAO Q, 2002. Flemingia macrophylla-excellent forage germplasm resource in tropical area of Yunnan [J]. Sichuan Grassl,(4):31-33. [赵茜, 2002. 大叶千金拔-云南热区优良牧草种质资源 [J]. 四川草原,(4):31-33.]
Analysis of genetic diversity of Flemingia macrophylla resources from South Yunnan by ISSR
WANG Gui-Juan*,XIAO Wen-Xiang,TANG Shou-Xian
( Xishuangbanna Tropical Botanical Garden, Chinese Academy of Sciences, Mengla 666303, China )
The genetic diversity of 135 individuals collected from 7 wild populations ofFlemingiamacrophyllawas estimated using ISSR method. An high level of genetic diversity was detected in wild populations ofF.macrophyllafrom South Yunnan Province. At species level, the percentage of polymorphic lociPPL= 94.85%, effective number of allelesNe = 1.462 7, Nei’s gene diversityHe = 0.281 5, and Shannon’s information indexHo = 0.433 7; at population level,PPL= 43.44%,Ne = 1.298 1, Nei’s gene diversityHe = 0.170 4, and Shannon’s in formation indexHo = 0.249 9. The level of genetic differentiation (39.75%) among populations is lower than that within populations (60.25%). Based on the results, we suggest that the protected areas ofF.macrophyllashould be build in MY, QB and NE because of the high level of genetic diversity.
Flemingiamacrophylla, genetic diversity, ISSR
10.11931/guihaia.gxzw201407050
2014-07-30
2015-01-31
中国科学院西双版纳热带植物园创新工程试点项目(0501073003)[Supported by Innovation Project Pilot Funding of Xishuangbana Tropical Botanical Garden, Chinese Academy of Sciences(0501073003)]。
王桂娟(1974-),女,内蒙古通辽人,硕士,实验师,主要从事生物多样性研究,(E-mail)wanggj@xtbg.org.cn。
Q949.7
A
1000-3142(2016)07-0812-06
王桂娟,肖文祥,唐寿贤. 云南南部野生大叶千斤拔资源遗传多样性的ISSR分析 [J]. 广西植物,2016,36(7):812-817
WANG GJ,XIAO WX,TANG SX,et al. Analysis of genetic diversity ofFlemingiamacrophyllaresources from South Yunnan by ISSR [J]. Guihaia,2016,36(7):812-817

