FOX家族介导的上皮间质转化在肿瘤转移中的研究进展
蒋宗胜,阮君山,王少明
(1.福建医科大学药学院,2.福建医科大学省立临床医学院,3.福建省立医院中医药分子生物学实验室,福建 福州 350001)
FOX家族介导的上皮间质转化在肿瘤转移中的研究进展
蒋宗胜1,3,阮君山2,3,王少明2,3
(1.福建医科大学药学院,2.福建医科大学省立临床医学院,3.福建省立医院中医药分子生物学实验室,福建 福州350001)
doi:10.3969/j.issn.1001-1978.2016.08.005
在肿瘤的侵袭转移进程中,上皮间质转化(epithelial mesenchymal transition,EMT)是其中一个重要的生物学过程。但由于EMT复杂的信号通路和未尽阐明的分子机制,治疗EMT仍然是世界性的难题。但多种研究也证实了EMT并非是不可逆转的过程。近年来对叉头框转录因子(FOX)基因家族在EMT中的研究,显示了其在肿瘤转移中具有重要的调控作用。该文综述了FOX基因家族介导的EMT过程在肿瘤多种生物学过程的研究,以期对EMT的信号网络有更好的了解,并为有效干预EMT提供新的依据。
EMT;FOX;转录;分子靶标;肿瘤干细胞;耐药性
上皮间质转化(epithelial mesenchymal transition,EMT)是癌症发生发展中的重要过程,在肿瘤侵袭转移、肿瘤耐药性、肿瘤干细胞特性中发挥着重要的作用[1-2]。其生物学过程为细胞间失去相互黏附力,间质化表型显露,成为恶性的根源。早期对EMT的研究主要是胚胎发育、损伤修复、神经嵴的形成等,在这些进程中,上皮样细胞表现为强大的可塑性。近年对EMT的研究富集于肿瘤转移方面,具有复杂的信号调控网络,包括Wnt/β-catenin、TGF-β和生长因子受体等[3],其机制在无数的研究中被探讨,但并未详细阐明。这些EMT信号的改变,与恶性肿瘤的进展和预后密切相关,并成为近年来抗肿瘤药物的重要靶点。
叉头框转录因子(forkhead box,FOX)家族最早在果蝇中被发现[4],目前分属为19个亚家族,分别是FOXA到FOXS,他们在结构上的最大特点是具有100多个保守氨基酸序列组成的FOX的DNA结合域[5]。FOX基因家族介导了多种生物学功能,如DNA损伤修复、胚胎发育、细胞周期和一些代谢平衡调控[6-7],这提示我们FOX基因家族有可能也参与了肿瘤发生发展等多个复杂进程。在各种肿瘤患者的组织样本中均检测到了FOX基因家族的表达变化,尤其是近年来对肿瘤EMT的研究,发现FOX基因通过EMT介导了肿瘤干细胞形成和特性的维持、肿瘤的耐药等过程;有些FOX基因能够促进EMT,而有些却能够抑制EMT,并有多种miRNA参与了这一复杂调控网络。因此,探讨FOX基因家族在EMT中的作用及其分子机制,对干预肿瘤转移、干细胞治疗以及肿瘤耐药具有重要的意义。
1 部分FOX具有促进EMT的作用
大量实验和分析均表明,FOXC1、FOXC2、FOXM1、FOXQ1能够抑制E-cadherin表达,或与恶性间质化表型肿瘤的相关蛋白协同表达,促进肿瘤发生EMT,成为肿瘤获得侵袭转移能力的根源。同时,它们也是在EMT中研究最多、最为深入的FOX家族分子。其可能作用的分子靶标总结于Tab 1。
1.1FOXC亚家族复发转移是肝细胞癌术后的致死性因素,研究发现FOXC1在肝细胞癌中的表达明显高于癌旁组织,FOXC1活化了Snail的转录,这一过程使E-cadherin表达下调,引起了EMT[8],成为肝细胞癌转移的重要原因。FOXC1的异位表达可以诱导Snail、Twist、TGF-β1的表达增强,而它们的表达在FOXC1沉默之后被下调,这提示我们FOXC1的表达可以影响EMT分子开关[9];沉默FOXC1后,细胞骨架发生改变,肿瘤的侵袭转移能力被抑制。Huang等[10]研究发现,IL-8能够诱导Huh-7、SMMC7721等多种肝癌细胞活化PI3K/Akt和HIF-1α通路,上调FOXC1的表达,促进肝癌细胞的侵袭能力。
FOXC2受到TGF-β1信号网络的调节,它的表达被发现与EMT有关[11]。多数研究认为FOXC2的高表达引起EMT,成为癌症患者不良预后的一个指标[12-14]。正常上皮形态的乳腺癌细胞,它的FOXC2主要存在于细胞质中;而当FOXC2向核内聚集发挥转录功能时,EMT发生,这和CK2的β亚基功能缺失有关[15-16];敲除CK2β亚基,FOXC2定位由细胞质转向核内,E-cadherin表达下调,α-SMA、波形蛋白表达增加。
1.2FOXM1EMT可以由多种转录因子所调控,包括Snail、Slug、ZEB1、ZEB2、Twist等,它们对于E-cadherin的表达具有抑制作用,这些分子开关都可以被FOXM1所调控。Kong等[17]的研究表明,FOXM1与有吸烟史的患者有明显的相关性;FOXM1诱导产生的EMT是通过活化Akt/p70S6K通路,造成了非小细胞肺癌患者的不良预后。类似的研究[18]也发现FOXM1诱导非小细胞肺癌发生EMT,造成患者生存质量降低。在胰腺癌中,FOXM1能调节ZEB1、ZEB2、Snail2、E-cadherin和 vimentin,促进EMT过程[19]。胰腺癌细胞系高表达FOXM1的c亚型,因而具有较强的细胞侵袭、转移能力,并证实这一过程是FOXM1结合于尿激酶纤溶酶原受体uPAR的启动子,增加它的表达造成的[20]。在对FOXM1的b亚型研究中,发现它介导了肝细胞癌的EMT过程[21]。在其他对肝细胞癌研究中,鉴定出FOXM1能够激活微囊蛋白cav1的表达促进EMT,通过RNA干扰技术则出现抑制侵袭转移的效果[22],提供了干预FOXM1/cav1通路的治疗手段。
1.3FOXQ1FOXQ1在直结肠癌的表达高于其他类型的肿瘤,由上游Wnt通路活化介导EMT过程[23]。在直结肠癌中,对其下游分子的研究中发现,FOXQ1能够激活Twist的表达,增强肿瘤侵袭转移能力,促进EMT[24]。其激活Twist的表达在肝细胞癌中也被检测到[25]。FOXQ1的作用靶点除Twist外还有ZEB2。同时,FOXQ1还能诱导多能蛋白聚糖的表达,促进肝癌细胞分泌趋化因子配体CCL2,增加了肿瘤相关巨噬细胞的迁移和浸润,加速肿瘤进程[26]。在非小细胞肺癌[27-28]、乳腺癌[29-30]、卵巢癌[31-32]中也发现FOXQ1参与EMT。在对膀胱癌的研究中发现,用RNA干扰技术抑制FOXQ1表达,能够逆转EMT[33]。因此,FOXQ1是肿瘤患者不良预后的危险标志。
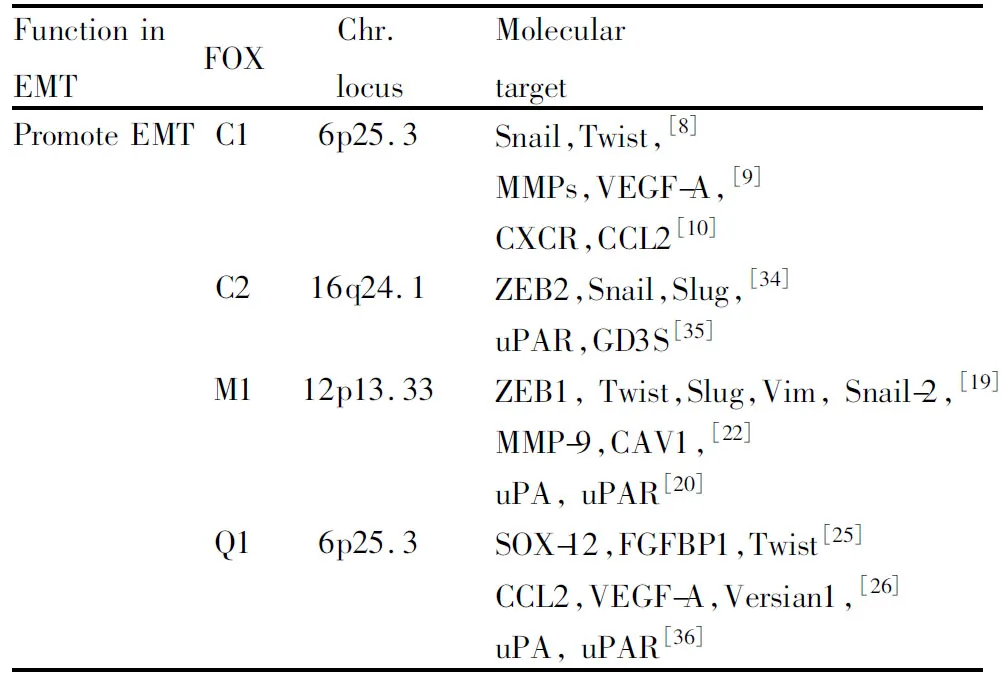
Tab 1 Promote EMT:molecular target of FOX
2 FOX对EMT的抑制作用
2.1FOXO亚家族FOXO亚家族包括FOXO1、FOXO2、FOXO3和FOXO4[37]。FOXO亚家族能够结合于其下游靶分子DNA或与蛋白质结合,调控它们的转录或蛋白活性,包括Snail、β-catenin等,是EMT的重要分子开关。多数研究结果发现FOXO3a和FOXO1具有明显抑制EMT的作用。
失去E-cadherin是EMT的第一步,FOXO1具有与E-cadherin竞争结合miR-9的作用,解除miR-9对E-cadherin的抑制[38]。Ni等[39]的生物信息学分析结果显示,FOXO3a是与肾透明细胞癌转移的相关分子,下调FOXO3a的表达,下游Snail表达增加,肾透明癌细胞发生EMT。FOXO3a能够直接结合于β-catenin,阻断其对下游靶分子的作用,干预肿瘤恶性进程[40]。FOXO3a对EMT的抑制作用,为防治肿瘤转移提供了新的靶点。
2.2FOXA亚家族FOXA1和FOXA2隶属于FOXA亚家族,其亚家族还包括FOXA3,它们在早期的胚胎发育、损伤修复及癌症的进程中发挥着重要作用,被誉为“先锋因子”[41]。但介导肿瘤EMT研究多为FOXA1和FOXA2。
FOXA1是FOXA亚家族的典型代表,它在结构上包含了氨基端的转录活化域,中部的FOX保守序列,以及羧基端的组蛋白结合域[42]。FOXA1的调控网络包括FOXA2、FGA、FGB、FGG和FGL1,而它本身作为转录因子介导EMT的负性调节,在肺癌初期转移中发挥重要的作用[43]。在乳腺癌细胞株SkBr3中沉默FOXA1,触发EMT过程,而过表达FOXA1能阻止这一过程的发生[44]。Slug是EMT的重要分子开关,在对前列腺癌的研究中发现,Klf4和FOXA1的表达能够起到抑制Slug的作用,由此Klf4/FOXA1/Slug信号轴可以为干预EMT提供治疗靶点[45]。Jin等[46]的研究显示,FOXA1对前列腺癌的增殖和转移存在一定的矛盾,其在增殖时表现为对雄激素通路的激活,而在抑制EMT时表现为对雄激素通路的抑制。FOXA1的下游分子还包括CCNE1、E2F等[47],这些都可能成为防治EMT、肿瘤侵袭转移的治疗靶点。
FOXA2在作为转录调控时常表现为促进转录的作用,然而在介导EMT时,除正性调控E-cadherin的表达外[48],对间质化表型的相关分子表现出负性调控的作用。例如,在对乳腺癌EMT的研究中发现,FOXA2不但能刺激E-cadherin的表达,还能够招募TLE3,共同结合于ZEB2,起到阻遏作用[49]。FOXA2在肝细胞癌中的表达降低,并和EMT有关,它能够降低金属基质蛋白酶MMP-9的表达,起到对肝癌细胞抗侵袭转移的作用[50]。FOXA2干预肺癌的EMT是通过结合于间质化表型开关Slug的启动子,抑制了它的转录[51]。
2.3其他FOX对EMT的抑制作用FOXF2表达低下与乳腺癌的不良预后有关,在基底样乳腺癌中,这种缺失往往介导了EMT过程;FOXF2对EMT的抑制作用是通过下调它的靶点Twist的表达而产生的[52]。Cai等[53]的研究发现,FOXF2能干预EMT,抑制基底样乳腺癌的转移。而FOXF2启动子附近CpG岛的DNA甲基化可以造成其表达缺失[54]。在其他的研究中,FOX分子家族对EMT有抑制作用,例如FOXD3[55-56]、FOXK1[57]、FOXL1[58],均有相应的报道。
Tab 2对FOX干预EMT的靶点进行了总结。
3 FOX基因维系了EMT和干细胞特性
肿瘤干细胞有着极强的自我更新能力和高致瘤效应,它能够通过促进血管生成、免疫抑制等方式促进肿瘤发生发展,是肿瘤产生和复发转移的根源[59]。但对于肿瘤干细胞的理解和认知仍然存在争议,它究竟是起源于肿瘤细胞的可塑性引起的转移病灶,还是起源于正常组织细胞的病变转化,至今是个谜团。近年来的研究表明,EMT在促进肿瘤细胞的侵袭转移过程中,能够赋予其强大的自我更新能力,使其具有干细胞特性[60]。EMT过程中的某些相关分子,如ZEB、TGF-β都能够对干细胞特性有所调控[61]。因此,我们不能忽视EMT在肿瘤干细胞特性的获得和维持中的作用。
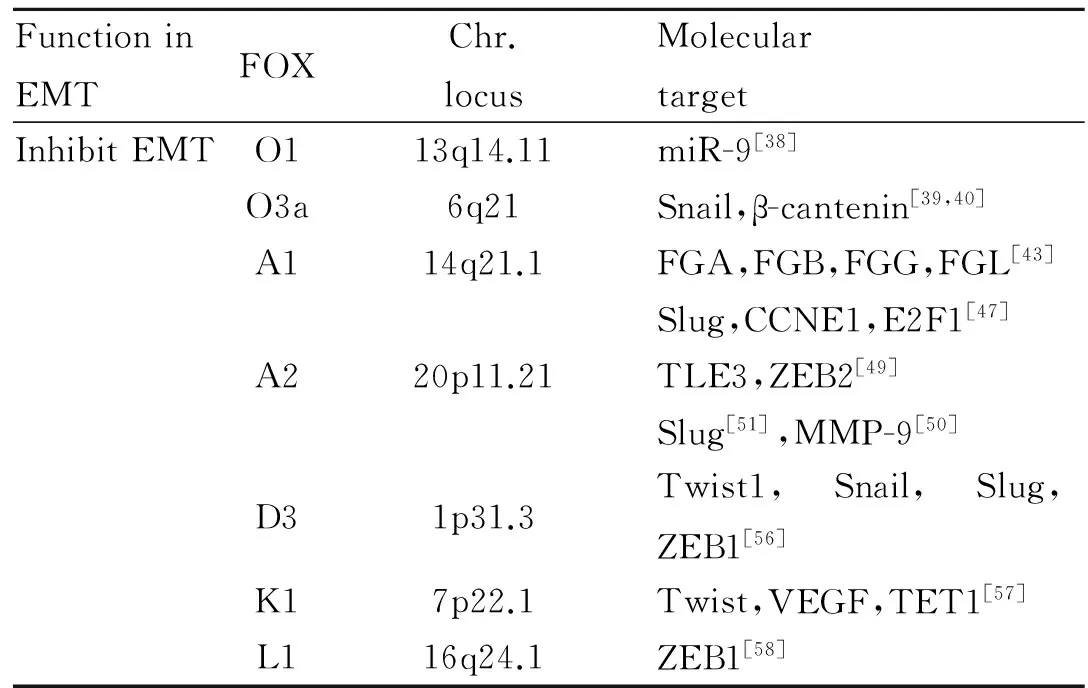
Tab 2 Inhibit EMT:molecular target of FOX
FOX家族介导的EMT,在肿瘤干细胞特性的获得和维持中发挥着重要的作用。在乳腺癌细胞中,FOXC2能诱导多种EMT信号网络的改变[34],干细胞样细胞也由这种异常活化的通路所产生,减弱FOXC2的表达,能够明显改善间质化表型和干细胞的特性[62]。FOXQ1同样被发现能够使乳腺癌细胞形态学发生改变,并获得干细胞样的特性[63]。FOXM1不但是肺癌不良预后的标志,同时也介导了干细胞特性获得的过程,这一过程被发现可能与EMT有关,成为耐药性和复发转移的根源[64]。在胰腺癌中,高表达的FOXM1能够引起下游ZEB1、ZEB2、Snail2和波形蛋白的表达激活,间质化表型和干细胞特性因此产生[19]。这些FOX家族分子的作用,充分说明了FOX、EMT与干细胞特性三者是相互关联的。随着研究的深入,更多的证据将被展现出来。
4 FOX家族介导的EMT引起耐药
肿瘤能够表现出对治疗药物发生抵抗的作用,这种作用的产生与EMT有关,是化疗失败的重要原因,成为当前临床治疗的一大障碍。EMT作为恶性肿瘤侵袭转移的始动环节,针对EMT中的细胞黏附分子、金属基质蛋白酶等的靶向药物可以成为防治肿瘤转移的里程碑[65]。
在对鼻咽癌的研究中,FOXC2的高表达增加了鼻咽癌对紫杉醇的耐药,耐药的鼻咽癌有EMT特征出现;沉默FOXC2,能够逆转耐药细胞的EMT过程,异种移植的小鼠模型中,下调FOXC2的表达能够增加其对紫杉醇的敏感性[66]。FOXC家族的另一成员FOXC1介导了基底样乳腺癌的耐药性[67]。Chiu等[64]对106例卵巢癌进行分析,其高表达的FOXM1与癌症的进程密切相关,这种高表达FOXM1的现象介导了EMT和干细胞特性的获得,从而导致了对铂类药物的耐药性。非小细胞肺癌产生EMT是导致化疗失败的重要原因,FOXQ1的表达介导了其对传统化疗药物的抵抗,敲除FOXQ1的非小细胞肺癌细胞表现出转移能力的降低以及对药物敏感性的增加[27]。对FOXQ1在乳腺癌细胞的研究中,也发现了耐药性的产生[29]。这些证据都说明FOX家族在EMT与肿瘤耐药性中扮演了重要角色。
5 FOX是药物干预EMT靶点
90%以上的肿瘤患者死亡是由于肿瘤转移引起的。而FOX基因介导了EMT过程,他们可以成为防治肿瘤转移的靶点。现有的一些实验已经证实了药物对EMT的干预是通过调节FOX来实现的。
白藜芦醇能逆转非小细胞肺癌细胞的EMT过程,从而抑制它的侵袭和转移,体内外实验均证明这种抑制作用通过抑制FOXC2的表达而产生[68]。编码神经节苷酯合酶GD3S的基因是FOXC2的靶点,FOXC2通过诱导它的表达介导EMT。雷公藤甲素能够抑制GD3S的表达,间接抑制了FOXC2轴对EMT的调控[35]。硫链丝菌素是FOXM1的抑制剂,它能够抑制鼻咽癌细胞的EMT[69]。高表达FOXM1的卵巢癌能对铂类药物耐受,而顺铂联合硫链丝菌素能够逆转这一作用[64]。FOXM1在恶性前列腺癌中的表达明显高于其在良性瘤中的表达,二甲双胍能够有效抑制FOXM1来抑制这一恶性进程[70]。异硫氰苄酸酯BITC能够有效抑制乳腺癌细胞中FOXQ1的表达,上调E-cadherin,下调uPA、uPAR,表现出对EMT的抑制作用[36]。FDA核准的PDGFR抑制剂舒尼替尼能够间接抑制FOXC2,减少肿瘤转移的发生[62]。
6 miRNA参与了FOX家族介导的EMT过程
近年来的研究很多集中于非编码RNA的层面,很多疾病及生物学过程都围绕着miRNA展开,其中就包含了EMT。并且miRNA也参与了FOX基因家族对EMT的调控。
miR-9能够结合于E-cadherin的mRNA 3′UTR区而抑制其表达,具有促进EMT的作用;而FOXO1能起到类似于CeRNA的作用,与miR-9相互结合,干预miR-9对E-cadherin的抑制,逆转EMT[38]。FOXA1是miR-584和miR-1290的靶点,过表达miR-584和miR-1290之后,FOXA1抑制EMT的作用被下调,肿瘤侵袭转移能力增强;其中miR-584是通过ERK1/2发挥作用,miR-1290活化了NF-κB通路[71]。以上研究证明miR-9、miR-584、miR-1290等对EMT具有促进作用,介导了肿瘤的恶性化进程。
FOXM1、FOXC1、FOXC2等是EMT的活化分子,一些miRNA能对它们的表达起到抑制作用。研究发现,miR-200[19]、miR-194[72]、miR-134[73]对FOXM1的表达具有抑制作用,连同下调下游ZEB1、ZEB2、Twist等分子开关,干预甚至逆转EMT,有望成为干预肿瘤转移的靶点。白藜芦醇能抑制FOXC2的表达,使恶性的肺癌细胞产生间质细胞上皮化过程,这是对miR-520h的调控来实现的[68]。TGF-β诱导的舌鳞癌细胞在发生EMT时,miR-639表达下调,通过Luciferase实验发现miR-639能结合于FOXC1的启动子,通过抑制其表达进而干预EMT[74]。适当miR-122的表达是调控EMT和MET的平衡点,过表达miR-122,其下游有323种基因表达下调,59种基因表达上调,其中FOXA1的上调作用十分明显[75]。FOXA1的表达使E-cadherin表达增加,进一步维持了肿瘤细胞的上皮形态。在前列腺癌的研究中,FOXO3a作为EMT的抑制分子,除直接绑定于β-catenin外,还能够反式激活miR-34b/c;miR-34b/c结合于β-catenin mRNA的3′UTR区,抑制其表达,导致其下游靶基因无法活化转录[40]。
7 结语
EMT是肿瘤恶性的重要来源,其复杂的信号调控网络使其介导了肿瘤的多种生物学过程,尤其是在侵袭转移、干细胞特性和耐药性的获得。然而,正是由于EMT信号网络的复杂性,使用单一的分子靶向药物治疗,可能会有旁通路的信号重新引发EMT过程,使得传统的一些分子靶向药均不能起到有效的治疗和干预。本文介绍了FOX基因家族介导的EMT,在肿瘤的发生发展中发挥着重要的作用。例如,FOXQ1参与了多种肿瘤的EMT过程,能够影响Twist、ZEB等分子开关,下调FOXQ1能够逆转EMT过程。在非小细胞肺癌的研究中,FOXA2能够结合于Slug的启动子,引起下游信号改变,干预了肿瘤的侵袭和转移。多种miRNA,如miR-9、miR-200、miR-122等参与了FOX基因调控网络。在这些例子中,FOX基因家族作为上游重要的转录因子,能够影响介导EMT的多个重要分子开关的表达,进而影响E-cadherin、N-cadherin等细胞表型的蛋白分子。并且针对某些FOX基因家族时,不但能够干预肿瘤的侵袭转移,还能够对干细胞特性和耐药性起到良好的作用。因此,对FOX基因家族进行干预,可能解决单一分子靶向治疗无效的问题,为干预和治疗EMT带来的肿瘤侵袭转移、干细胞特性和耐药性带来新的思路。
[1]Kong D, Sethi S, Li Y, et al. Androgen receptor splice variants contribute to prostate cancer aggressiveness through induction of EMT and expression of stem cell marker genes[J].Prostate, 2015, 75(2): 161-74.
[2]Ansieau S. EMT in breast cancer stem cell generation[J].CancerLett, 2013, 338(1): 63-8.
[3]朱智杰, 阮君山, 李尧,等. Wnt信号通路诱导肿瘤细胞上皮间质转化的研究进展[J]. 中国药理学通报, 2012, 28(7): 904-7.
[3]Zhu Z J, Ruan J S, Li Y, et al. Research progress of Wnt signaling pathway induced EMT in tumor cells[J].ChinPharmacolBull, 2012, 28(7): 904-7.
[4]Weigel D, Jurgens G, Kuttner F, et al. The homeotic gene fork head encodes a nuclear protein and is expressed in the terminal regions of the Drosophila embryo[J].Cell, 1989, 57(4): 645-58.
[5]Kaestner K H, Knochel W, Martinez D E. Unified nomenclature for the winged helix/forkhead transcription factors[J].GenesDev, 2000, 14(2): 142-6.
[6]Carlsson P, Mahlapuu M. Forkhead transcription factors: key players in development and metabolism[J].DevBiol, 2002, 250(1): 1-23.
[7]Benayoun B A, Caburet S, Veitia R A. Forkhead transcription factors: key players in health and disease[J].TrendsGenet, 2011, 27(6): 224-32.
[8]Xia L, Huang W, Tian D, et al. Overexpression of forkhead box C1 promotes tumor metastasis and indicates poor prognosis in hepatocellular carcinoma[J].Hepatology, 2013, 57(2): 610-24.
[9]Xu Z Y, Ding S M, Zhou L, et al. FOXC1 contributes to microvascular invasion in primary hepatocellular carcinoma via regulating epithelial-mesenchymal transition[J].IntJBiolSci, 2012, 8(8): 1130-41.
[10]Huang W, Chen Z, Zhang L, et al. Interleukin-8 induces expression of FOXC1 to promote transactivation of CXCR1 and CCL2 in hepatocellular carcinoma cell lines and formation of metastases in mice[J].Gastroenterology, 2015, 149(4): 1053-67.
[11]Mani S A, Yang J, Brooks M, et al. Mesenchyme forkhead 1 (FOXC2) plays a key role in metastasis and is associated with aggressive basal-like breast cancers[J].ProcNatlAcadSciUSA, 2007, 104(24): 10069-74.
[12]Lim J C, Koh V C, Tan J S, et al. Prognostic significance of epithelial-mesenchymal transition proteins Twist and Foxc2 in phyllodes tumours of the breast[J].BreastCancerResTreat, 2015, 150(1): 19-29.
[13]Zhu J L, Song Y X, Wang Z N, et al. The clinical significance of mesenchyme forkhead 1(FoxC2) in gastric carcinoma[J].Histopathology, 2013, 62(7): 1038-48.
[14]Watanabe A, Suzuki H, Yokobori T, et al. Forkhead box protein C2 contributes to invasion and metastasis of extrahepatic cholangiocarcinoma, resulting in a poor prognosis[J].CancerSci, 2013, 104(11): 1427-32.
[15]Golden D, Cantley L G. Casein kinase 2 prevents mesenchymal transformation by maintaining Foxc2 in the cytoplasm[J].Oncogene, 2015, 34(36): 4702-12.
[16]Filhol O, Giacosa S, Wallez Y, et al. Protein kinase CK2 in breast cancer: the CK2beta regulatory subunit takes center stage in epithelial plasticity[J].CellMolLifeSci, 2015, 72(17): 3305-22.
[17]Kong F F, Qu Z Q, Yuan H H, et al. Overexpression of FOXM1 is associated with EMT and is a predictor of poor prognosis in non-small cell lung cancer[J].OncolRep, 2014, 31(6): 2660-8.
[18]Xu N, Jia D, Chen W, et al. FoxM1 is associated with poor prognosis of non-small cell lung cancer patients through promoting tumor metastasis[J].PLoSOne, 2013, 8(3): e59412.
[19]Bao B, Wang Z, Ali S, et al. Over-expression of FoxM1 leads to epithelial-mesenchymal transition and cancer stem cell phenotype in pancreatic cancer cells[J].JCellBiochem, 2011, 112(9): 2296-306.
[20]Huang C, Xie D, Cui J, et al. FOXM1c promotes pancreatic cancer epithelial-to-mesenchymal transition and metastasis via upregulation of expression of the urokinase plasminogen activator system[J].ClinCancerRes, 2014, 20(6): 1477-88.
[21]Park H J, Gusarova G, Wang Z, et al. Deregulation of FoxM1b leads to tumour metastasis[J].EMBOMolMed, 2011, 3(1): 21-34.
[22]Huang C, Qiu Z, Wang L, et al. A novel FoxM1-caveolin signaling pathway promotes pancreatic cancer invasion and metastasis[J].CancerRes, 2012, 72(3): 655-65.
[23]Christensen J, Bentz S, Sengstag T, et al. FOXQ1, a novel target of the Wnt pathway and a new marker for activation of Wnt signaling in solid tumors[J].PLoSOne, 2013, 8(3): e60051.
[24]Abba M, Patil N, Rasheed K, et al. Unraveling the role of FOXQ1 in colorectal cancer metastasis[J].MolCancerRes, 2013, 11(9): 1017-28.
[25]Huang W, Chen Z, Shang X, et al. Sox12, a direct target of FoxQ1, promotes hepatocellular carcinoma metastasis through up-regulating Twist1 and FGFBP1[J].Hepatology, 2015, 61(6): 1920-33.
[26]Xia L, Huang W, Tian D, et al. Forkhead box Q1 promotes hepatocellular carcinoma metastasis by transactivating ZEB2 and VersicanV1 expression[J].Hepatology, 2014, 59(3): 958-73.
[27]Feng J, Xu L, Ni S, et al. Involvement of FoxQ1 in NSCLC through regulating EMT and increasing chemosensitivity[J].Oncotarget, 2014, 5(20): 9689-702.
[28]Feng J, Zhang X, Zhu H, et al. FoxQ1 overexpression influences poor prognosis in non-small cell lung cancer, associates with the phenomenon of EMT[J].PLoSOne, 2012, 7(6): e39937.
[29]Meng F, Speyer C L, Zhang B, et al. PDGFRalpha and beta play critical roles in mediating Foxq1-driven breast cancer stemness and chemoresistance[J].CancerRes, 2015, 75(3): 584-93.
[30]Fan D M, Feng X S, Qi P W, et al. Forkhead factor FOXQ1 promotes TGF-beta1 expression and induces epithelial-mesenchymal transition[J].MolCellBiochem, 2014, 397(1-2): 179-86.
[31]Gao M, Wu R C, Herlinger A L, et al. Identification of the NAC1-regulated genes in ovarian cancer[J].AmJPathol, 2014, 184(1): 133-40.
[32]Gao M, Shih Ie M, Wang T L. The role of forkhead box Q1 transcription factor in ovarian epithelial carcinomas[J].IntJMolSci, 2012, 13(11): 13881-93.
[33]Zhu Z, Zhu Z, Pang Z, et al. Short hairpin RNA targeting FOXQ1 inhibits invasion and metastasis via the reversal of epithelial-mesenchymal transition in bladder cancer[J].IntJOncol, 2013, 42(4): 1271-8.
[34]Taube J H, Herschkowitz J I, Komurov K, et al. Core epithelial-to-mesenchymal transition interactome gene-expression signature is associated with claudin-low and metaplastic breast cancer subtypes[J].ProcNatlAcadSciUSA, 2010, 107(35): 15449-54.
[35]Sarkar T R, Battula V L, Werden S J, et al. GD3 synthase regulates epithelial-mesenchymal transition and metastasis in breast cancer[J].Oncogene,2015, 34(23): 2958-67.
[36]Sehrawat A, Kim S H, Vogt A, et al. Suppression of FOXQ1 in benzyl isothiocyanate-mediated inhibition of epithelial-mesenchymal transition in human breast cancer cells[J].Carcinogenesis, 2013, 34(4): 864-73.
[37]Katoh M, Igarashi M, Fukuda H, et al. Cancer genetics and genomics of human FOX family genes[J].CancerLett, 2013, 328(2): 198-206.
[38]Yang J, Li T, Gao C, et al. FOXO1 3′UTR functions as a ceRNA in repressing the metastases of breast cancer cells via regulating miRNA activity[J].FEBSLett, 2014, 588(17): 3218-24.
[39]Ni D, Ma X, Li H Z, et al. Downregulation of FOXO3a promotes tumor metastasis and is associated with metastasis-free survival of patients with clear cell renal cell carcinoma[J].ClinCancerRes, 2014, 20(7): 1779-90.
[40]Liu H, Yin J, Wang H, et al. FOXO3a modulates WNT/beta-catenin signaling and suppresses epithelial-to-mesenchymal transition in prostate cancer cells[J].CellSignal, 2015, 27(3): 510-8.
[41]Magnani L, Eeckhoute J, Lupien M. Pioneer factors: directing transcriptional regulators within the chromatin environment[J].TrendsGenet, 2011, 27(11): 465-74.
[42]Van Der Heul-Nieuwenhuijsen L, Dits N F, Jenster G. Gene expression of forkhead transcription factors in the normal and diseased human prostate[J].BJUInt, 2009, 103(11): 1574-80.
[43]Wang H, Meyer C A, Fei T, et al. A systematic approach identifies FOXA1 as a key factor in the loss of epithelial traits during the epithelial-to-mesenchymal transition in lung cancer[J].BMCGenomics, 2013, 14: 680.
[44]Zhang X L, Wang H S, Liu N, et al. Bisphenol A stimulates the epithelial mesenchymal transition of estrogen negative breast cancer cells via FOXA1 signals[J].ArchBiochemBiophys, 2015, 585: 10-6.
[45]Liu Y N, Abou-Kheir W, Yin J J, et al. Critical and reciprocal regulation of KLF4 and SLUG in transforming growth factor beta-initiated prostate cancer epithelial-mesenchymal transition[J].MolCellBiol, 2012, 32(5): 941-53.
[46]Jin H J, Zhao J C, Ogden I, et al. Androgen receptor-independent function of FoxA1 in prostate cancer metastasis[J].CancerRes, 2013, 73(12): 3725-36.
[47]Zhang C, Wang L, Wu D, et al. Definition of a FoxA1 Cistrome that is crucial for G1 to S-phase cell-cycle transit in castration-resistant prostate cancer[J].CancerRes, 2011, 71(21): 6738-48.
[48]Song Y, Washington M K, Crawford H C. Loss of FOXA1/2 is essential for the epithelial-to-mesenchymal transition in pancreatic cancer[J].CancerRes, 2010, 70(5): 2115-25.
[49]Zhang Z, Yang C, Gao W, et al. FOXA2 attenuates the epithelial to mesenchymal transition by regulating the transcription of E-cadherin and ZEB2 in human breast cancer[J].CancerLett, 2015, 361(2): 240-50.
[50]Wang J, Zhu C P, Hu P F, et al. FOXA2 suppresses the metastasis of hepatocellular carcinoma partially through matrix metalloproteinase-9 inhibition[J].Carcinogenesis, 2014, 35(11): 2576-83.
[51]Tang Y, Shu G, Yuan X, et al. FOXA2 functions as a suppressor of tumor metastasis by inhibition of epithelial-to-mesenchymal transition in human lung cancers[J].CellRes, 2011, 21(2): 316-26.
[52]Wang Q S, Kong P Z, Li X Q, et al. FOXF2 deficiency promotes epithelial-mesenchymal transition and metastasis of basal-like breast cancer[J].BreastCancerRes, 2015, 17: 30.
[53]Cai J, Tian A X, Wang Q S, et al. FOXF2 suppresses the FOXC2-mediated epithelial-mesenchymal transition and multidrug resistance of basal-like breast cancer[J].CancerLett, 2015, 367(2): 129-37.
[54]Tian H P, Lun S M, Huang H J, et al. DNA methylation affects the SP1-regulated transcription of FOXF2 in breast cancer cells[J].JBiolChem, 2015, 290(31): 19173-83.
[55]He G, Hu S, Zhang D, et al. Hypermethylation of FOXD3 suppresses cell proliferation, invasion and metastasis in hepatocellular carcinoma[J].ExpMolPathol, 2015, 99(2): 374-82.
[56]Chu T L, Zhao H M, Li Y, et al. FoxD3 deficiency promotes breast cancer progression by induction of epithelial-mesenchymal transition[J].Oncogene, 2014, 446(2): 580-4.
[57]Sun T, Wang H, Li Q, et al. Forkhead box protein k1 recruits TET1 to act as a tumor suppressor and is associated with MRI detection[J].JpnJClinOncol, 2016,46(3):209-21.
[58]Zhang G, He P, Gaedcke J, et al. FOXL1, a novel candidate tumor suppressor, inhibits tumor aggressiveness and predicts outcome in human pancreatic cancer[J].CancerRes, 2013, 73(17): 5416-25.
[59]田超, 江国荣, 周梁, 等. 间质干细胞与肿瘤的关系研究进展[J]. 中国药理学通报, 2013, 29(3): 303-6.
[59]Tian C, Jiang G R, Zhou L, et al. Mesenchymal stem cells and tumor[J].ChinPharmacolBull,2013,29(3): 303-6.
[60]Cuyas E, Corominas-Faja B, Menendez J A. The nutritional phenome of EMT-induced cancer stem-like cells[J].Oncotarget, 2014, 5(12): 3970-82.
[61]Scheel C, Eaton E N, Li S H, et al. Paracrine and autocrine signals induce and maintain mesenchymal and stem cell states in the breast[J].Cell, 2011, 145(6): 926-40.
[62]Hollier B G, Tinnirello A A, Werden S J, et al. FOXC2 expression links epithelial-mesenchymal transition and stem cell properties in breast cancer[J].CancerRes, 2013, 73(6): 1981-92.
[63]Qiao Y, Jiang X, Lee S T, et al. FOXQ1 regulates epithelial-mesenchymal transition in human cancers[J].CancerRes, 2011, 71(8): 3076-86.
[64]Chiu W T, Huang Y F, Tsai H Y, et al. FOXM1 confers to epithelial-mesenchymal transition, stemness and chemoresistance in epithelial ovarian carcinoma cells[J].Oncotarget, 2015, 6(4): 2349-65.
[65]刘晓霓, 谢立, 王延军, 等. 逆转肿瘤上皮间质化药理研究进展[J]. 中国药理学通报, 2013, 29(11): 1481-5.
[65]Liu X N, Xie L, Wang Y J, et al.Advance of pharmacological studies on reversing epithelial-mesenchymal transition of tumors[J].ChinPharmacolBull,2013,29(11): 1481-5.
[66]Zhou Z, Zhang L, Xie B, et al. FOXC2 promotes chemoresistance in nasopharyngeal carcinomas via induction of epithelial mesenchymal transition[J].CancerLett, 2015, 363(2): 137-45.
[67]Tkocz D, Crawford N T, Buckley N E, et al. BRCA1 and GATA3 corepress FOXC1 to inhibit the pathogenesis of basal-like breast cancers[J].Oncogene, 2012, 31(32): 3667-78.
[68]Yu Y H, Chen H A, Chen P S, et al. MiR-520h-mediated FOXC2 regulation is critical for inhibition of lung cancer progression by resveratrol[J].Oncogene, 2013, 32(4): 431-43.
[69]Yu C, Chen L, Yie L, et al. Targeting FoxM1 inhibits proliferation, invasion and migration of nasopharyngeal carcinoma through the epithelialto-mesenchymal transition pathway[J].OncolRep, 2015, 33(5): 2402-10.
[70]Wang Y, Yao B, Wang Y, et al. Increased FoxM1 expression is a target for metformin in the suppression of EMT in prostate cancer[J].IntJMolMed, 2014, 33(6): 1514-22.
[71]Zhu Y, Jiang Q, Lou X, et al. MicroRNAs up-regulated by CagA of Helicobacter pylori induce intestinal metaplasia of gastric epithelial cells[J].PLoSOne, 2012, 7(4): e35147.
[72]Li Z, Ying X, Chen H, et al. MicroRNA-194 inhibits the epithelial-mesenchymal transition in gastric cancer cells by targeting FoxM1[J].DigDisSci, 2014, 59(9): 2145-52.
[73]Li J, Wang Y, Luo J, et al. miR-134 inhibits epithelial to mesenchymal transition by targeting FOXM1 in non-small cell lung cancer cells[J].FEBSLett, 2012, 586(20): 3761-5.
[74]Lin Z, Sun L, Chen W, et al. miR-639 regulates transforming growth factor beta-induced epithelial-mesenchymal transition in human tongue cancer cells by targeting FOXC1[J].CancerSci, 2014, 105(10): 1288-98.
[75]Deng X G, Qiu R L, Wu Y H, et al. Overexpression of miR-122 promotes the hepatic differentiation and maturation of mouse ESCs through a miR-122/FoxA1/HNF4a-positive feedback loop[J].LiverInt, 2014, 34(2): 281-95.
Research progress of epithelial mesenchymal transition mediated by FOX family in tumor metastasis
JIANG Zong-sheng1,3,RUAN Jun-shan2,3,WANG Shao-ming2,3
(1.CollegeofPharmacy,FujianMedicalUniversity;2.FujianProvincialHospital,ClinicalCollegeofFujianMedicalUniversity;3.MolecularBiologyLaboratoryofTraditionalChineseMedicine,FujianProvincialHospital,Fuzhou350001,China)
Epithelial mesenchymal transition(EMT) is one of the important biological processes in tumor invasion and metastasis. However, due to the complexity of EMT signaling pathway and its unclear molecular mechanism, the treatment of EMT is still a worldwide problem. But many studies have proved that EMT is not an irreversible process. In recent years, the research of FOX gene family in EMT shows its important role in tumor metastasis. This review focuses on the FOX-mediated EMT process in many kinds of tumor, aiming to have a better understanding of EMT signaling network, and provide a new target for the effective prevention of EMT.
EMT; FOX; transcription; molecular target; cancer stem cells; drug resistance
2016-04-07,
2016-05-10
国家自然科学基金面上项目(No 81273647);福建省自然科学基金资助项目(No 2013J01365);福建省卫生系统中青年骨干人才重点项目(No 2015-ZQN-ZD-2);国家卫计委共建科学研究基金项目(No WKJ-FJ-19)
蒋宗胜(1992-),男,硕士生,研究方向:药物干预肿瘤转移分子机制,E-mail:296847770@qq.com;
王少明(1959-),男,主任药师,硕士生导师,研究方向:药物干预肿瘤转移分子机制、医院药学,通讯作者,E-mail:cnfjwsm@163.com
A
1001-1978(2016)08-1053-06
R-05;R329.24;R394.2;R73-37
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.010.html

