靶向CD123嵌合抗原受体T细胞治疗急性髓系白血病最新进展
张家奎,阮燕洁,王会平,翟志敏
(安徽医科大学第二附属医院血液科,生物医疗研究中心,安徽医科大学血液病研究中心,安徽 合肥 230601)
靶向CD123嵌合抗原受体T细胞治疗急性髓系白血病最新进展
张家奎,阮燕洁,王会平,翟志敏
(安徽医科大学第二附属医院血液科,生物医疗研究中心,安徽医科大学血液病研究中心,安徽 合肥230601)
doi:10.3969/j.issn.1001-1978.2016.08.004
急性髓系白血病(acute myeloid leukemia,AML)是最常见的、死亡率最高的一类白血病。在过去的40年里,尽管人们对于AML的认识更加深入,但是与其他血液肿瘤相比,AML的治疗并没有明显的变化。CD123是AML相关抗原,高表达于白血病干细胞,低或不表达于正常造血干细胞。作为治疗AML的潜在治疗靶点,近期靶向CD123+细胞免疫治疗技术已经有了新的进展,尤其是嵌合抗原受体(chimeric antigen receptor,CAR)T细胞治疗技术发展迅速。早期研究也已经证实CD123 CAR-T细胞具有抗白血病效应,而且对正常造血系统有不同程度的影响,这也为临床治疗复发/难治AML提供了新的思路。
急性髓系白血病;CD123;干细胞;免疫治疗;嵌合抗原受体;T细胞
随着肿瘤免疫学技术的发展, 细胞免疫治疗技术在急性白血病中的作用日益受到重视。近年来,表达某些肿瘤特异性嵌合抗原受体(chimeric antigen receptor,CAR)的T细胞治疗技术发展迅速,在体外和临床试验中已经显示出良好的靶向性、杀伤能力和持久性, 为过继性细胞免疫治疗恶性肿瘤提供了新的有效解决方案, 展示了巨大的应用潜力和发展前景。CD123是急性髓系白血病(acute myeloid leukemia,AML)相关抗原,高表达于白血病干细胞,低或不表达于正常造血干祖细胞,是AML的潜在治疗靶点。本文就目前靶向CD123的细胞免疫治疗技术治疗急性髓细胞白血病的最新进展做一综述。
1 AML治疗现状
急性白血病是一类造血干细胞的恶性克隆性疾病,因白血病细胞自我更新增强、增殖失控、分化障碍、凋亡受阻,而停滞在细胞发育的不同阶段,在骨髓和其他造血组织中,白血病细胞大量增生累积,使正常造血受抑制并浸润其他器官和组织。在成人急性白血病患者当中,AML是最常见的、死亡率最高的一类白血病。在过去的40年里,尽管人们对于AML的认识更加深入,但是与其他血液肿瘤相比,AML的治疗并没有明显的变化,目前60岁及60岁以下AML患者的治愈率为35% ~ 40%,而60岁以上老年AML患者治愈率仅5% ~ 15%[1]。无法接受强化疗老年AML患者的中位生存期仅为5~10个月。目前,成人初诊AML诱导治疗的完全缓解(complete remission,CR)率约为70%,而其中约43%的患者会最终复发,此外还有约18%的患者不能通过一线诱导化疗方案获得CR[2]。AML患者首次复发后的5年OS也仅为7%~12%[2-3]。
目前,异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,alloHSCT)仍然是难治/复发AML的主要治疗手段,也是AML患者获得二次缓解后的首选治疗方法。它可以将AML患者的5年无病生存率(disease-free survival,DFS)提升至40%~50%[2,4]。然而不幸的是,现有的治疗手段并不能使大多数AML患者获得二次CR,其中首次CR周期>6个月的患者复发后仅约50%能够获得二次CR,首次CR周期<6个月的患者复发后仅约20%的患者能够获得二次CR[5]。同时,复发后的挽救化疗方案常常为大剂量或非常规的化疗药物,如此会使患者的身体状况以及脏器功能严重恶化,同时也会降低alloHSCT的成功率。因此,对于难治/复发及诱导失败的AML患者,迫切需要寻找有效且副作用可控的全新治疗方法。
2 CD123与AML
近年来,随着对白血病细胞耐药机制研究的逐渐深入,已认识到传统化疗对于急性白血病效果不佳主要是因其无法有效针对白血病干细胞(leukemic stem cells,LSCs)。究其原因主要是由于LSCs基本上都是处于静止期,并可以随时增殖分化成为白血病细胞,同时他们还具有较强的自我修复能力。因此,AML患者若想取得能长期CR必须根除LSCs。对于LSCs表面特异性抗原的研究以及特异性细胞免疫治疗技术也都是目前的研究热点。
CD123是一种包含360个氨基酸的糖蛋白,它也是IL-3受体(interleukin-3 receptor, IL-3R)α链,与IL-3Rβ(CD131)一起构成高亲和力的IL-3R。CD131是IL-3R、IL-5R和GM-CSFR的共同β链,而CD123则仅存在于IL-3R,并表达于造血干/祖细胞、单核细胞、巨核细胞、B淋巴细胞和浆细胞样树突状细胞上。IL-3R特异性识别并结合IL-3后,能促进细胞的生长和增殖,与肿瘤、过敏性炎症、自身免疫性疾病的发生有关。CD123低或不表达于原始造血细胞和红系祖细胞上,而在髓系或B系祖细胞上是高表达的。随着这些细胞的成熟,CD123的表达强度也在逐渐减弱,并消失于成熟的粒细胞和淋巴细胞上[6]。
有研究已证实,CD123同样高表达于75%~89%的AML患者的白血病细胞和LSCs上[7]。有学者对CD123+细胞群的功能进行研究后发现,将CD34+/CD123+细胞亚群植入非肥胖糖尿病/重度联合免疫缺陷(nonobese diabetic /severe-combined immunodeficient,NOD/SCID)小鼠体内后可诱发小鼠AML[8]。此外,CD123通常也会高表达在浆细胞样树突状细胞、嗜碱性粒细胞,低表达在单核细胞、嗜酸性粒细胞、骨髓来源的树突状细胞上[9]。
CD123在AML中的表达与信号转导与转录激活因子5(signal transducer and activator of transcription 5, STAT5)密切相关。AML患者的白血病细胞能自发磷酸化激活STAT5,使细胞增殖分化并抵抗凋亡[10],因此,高表达CD123是AML预后不良因素之一。除了AML以外,CD123还会过表达于其他血液系统肿瘤,如急性B淋巴细胞白血病、慢性粒细胞白血病、浆细胞样树突细胞肿瘤和多毛细胞白血病等[11]。
3 CD123单抗治疗AML
SL-401是白喉毒素与IL-3作用过程中的一个催化和易位的片段,它是早期研究比较多的一种针对CD123的免疫治疗手段[7]。SL-401与白血病细胞上CD123相互作用以后,会内化并促使细胞产生新的蛋白,并抑制白血病细胞增殖。早期临床研究发现,SL-401的活性与IL-3β的表达程度相关。然而,与CD123不同,IL-3β并不常表达于AML细胞上。Frankel等[12]将SL-401应用在治疗9例AML患者的I期临床试验中,7例患者有较为明显的治疗反应,其中5例是CR,2例是部分缓解(partial remission,PR),但中位时间仅约5个月。Frankel等[13]将SL-401应用于40例难治性AML和骨髓异常增生综合征患者治疗的Ⅰ期临床试验中,1名患者获得CR(随访8个月),1例获得PR(随访3个月),提示 SL-401疗效不佳。究其原因,可能是与抗 CD123偶联的白喉毒素的治疗剂量与中毒剂量接近,且人群因预防免疫常携带有白喉毒素抗体, 故其临床应用有限。
CSL-360(7G3)为鼠源抗CD123单克隆抗体,7G3能与IL-3Rα链结合,抑制其与IL-3 结合,从而拮抗IL-3的功能。然而,在一项针对27例AML患者的I期临床试验中,仅1例患者获得长期CR,提示中和IL-3R在治疗AML中是无效的[14]。
CSL362是一种人源化的抗CD123单抗,是CSL360的衍生物。它是通过抗体工程技术使之与自然杀伤(natural killer,NK)细胞表面的CD16有较强的亲和力,通过提高NK细胞的抗体依赖性细胞毒(antibody dependent cell-mediated cytotoxicity,ADCC)作用来提高抗白血病效应。动物实验中已发现 CSL362 能明显抑制 AML 移植小鼠的白血病细胞增殖,同时,CSL-362也正在I期临床试验中[15]。
此外,还有一些针对CD123的双特异性抗体。MGD006可以同时针对CD123和CD3,早期临床研究中也证实其具有抗白血病效应,目前其也已经被用于试验性治疗难治/复发AML[16]。
XmAb14045同样是同时针对CD123和CD3,它也已经完成非人类的灵长类动物实验,研究结果也提示其可以清除骨髓和外周血中CD123+细胞[17]。
迄今为止,针对CD123的单克隆抗体治疗AML并未发生明显毒副反应,但目前还没有抗CD123抗体被正式应用于临床治疗,它们在人体内的抗白血病效应仍有待观察。
4 CD123 CAR-T治疗AML
4.1CAR-T简介CAR-T是一种高尖端免疫细胞基因工程技术,通过修饰自体杀伤肿瘤性T淋巴细胞,使其表达可靶向识别肿瘤细胞表面特定分子的受体并加以扩增激活。基于Ig和TCR结构的相似性,CAR是以单克隆抗体的单链可变区(single chain variable fragment,scFv)取代TCR的a、G链可变区,然后scFv直接以单一多肽链形式和T细胞信号传导区域CD3ζ连接,加或不加共刺激分子所组成(Fig 1)。scFv通过识别肿瘤特异性抗原,直接将信号向细胞内传导,使T细胞活化,分泌细胞因子,并杀伤肿瘤细胞[18]。CAR识别的是细胞表面完整的蛋白或糖脂分子,无需抗原处理和提呈,故为MHC非限制性。同时与传统化疗和单克隆抗体治疗不同,CAR-T细胞可能会长期存在于患者体内发挥持久免疫效应。
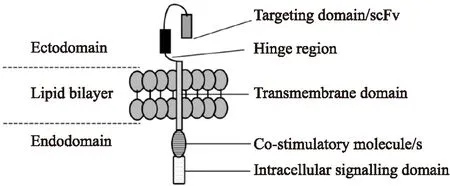
Fig 1 Chimeric antigen receptor(CAR) structure and design
The common elements of all CARs consist of:① A targeting domain, typically an scFv:a single-chain variable fragment derived from a monoclonal antibody;② A hinge region, both extends the binding domain away from the T-cell membrane and allows suitable freedom of orientation. This region is usually derived from IgG4, CD8α, or CD28 molecules;③ A transmembrane domain. This region is usually derived from CD8 or CD28 molecules;④ co-stimulatory molecule(s). Early first generation CARs had no co-stimulatory components,second or third generation CARs had two or more co-stimulatory molecules. This region is usually derived from CD27,CD28,4-1BB,OX40or ICOS molecules;⑤ An intracellular signalling domain, usually the TCRζ or FCRγ chain.
近年来,CAR-T细胞在部分肿瘤中已经取得了令人鼓舞的疗效。Porter等[19]利用CD19 CAR-T细胞治疗了3例慢性淋巴细胞白血病(CLL)患者,其中2例达到CR, 1例PR, 未发生明显不良反应,而且这2例CR患者随访2年后仍处于CR,疗效得到肯定。美国Memorial Sloan Kettering癌症中心利用CD19 CAR-T细胞治疗了16例B-ALL患者,其中88%的患者获得CR,而且CR的患者中大部分继续成功接受了造血干细胞移植术[20]。本研究中心也已在美国Clinicaltrials.gov注册了采用CAR-T细胞治疗难治/复发急性非T淋巴细胞白血病的临床研究(NCT02735291),截至目前有14例难治/复发B-ALL患者入组,除4名患者目前正在接受治疗,本研究组已对10名患者进行疗效评估,其中5例患者获得CR,1例获得PR,总反应率60%。相比国外报道的结果,本研究组反应率相对较低的原因可能与入组患者病情更加严重复杂有关:10例患者中9例患者复发次数≥2次,8例患者存在提示预后差的细胞遗传学异常和/或髓外复发(其中提示预后差的细胞遗传学异常的5例,髓外复发的6例)。因此,能够获得60%的总反应率也是很好的突破。今后随着病例数的增加,将对疗效和不良反应进行全面系统的分析。
4.2CD123 CAR-T的基础研究尽管CAR-T细胞是目前的研究热点,但关于CD123 CAR-T的研究才刚刚起步。目前CD123 CAR-T细胞的制备仍在努力探索中,比如使用的scFv类型、制备的T细胞亚群比例以及制备相关技术等。
Mardiros等[5]最早测试了二代CD123 CAR-T细胞,它是由1个CD123 CAR和CD28共刺激分子组成。这种CAR-T细胞在异基因小鼠体内表现出了有效的抗白血病效应,而且在体外实验中发现,利用AML患者T细胞制作成的CD123 CAR-T细胞能够重新杀伤患者自身的白血病细胞。他们还将CD123 CAR-T 细胞与脐血中的CD34+细胞共培养,仍然能培养出正常的细胞集落,提示CD123 CAR-T 细胞对脐血中CD34+细胞并没有杀伤作用。Tettamanti等[21]也在细胞因子诱导的杀伤(cytokine-induced killer,CIK)细胞上加上了一代CD123 CAR,即一代CD123 CAR CIK细胞,证实了CD123 CAR-T的抗白血病效应及靶向性。他们还测试了三代CD123-28OX40 CAR CIK细胞,即添加了共刺激分子CD28和OX40,同样展示出了更强的抗白血病效应,且共培养后对脐血细胞及人或动物的造血干祖细胞仅有很弱的杀伤作用。
然而,Gill等[22]用CD123-41BB CAR-T细胞治疗AML小鼠时,CAR-T细胞在展示出了抗白血病效应的同时却对小鼠自身造血系统造成严重损伤,这令他们对CD123 CAR-T的安全性产生质疑。然而后来检测发现,这是由于小鼠的造血祖细胞来源于CD34+胎肝细胞,而这种细胞是高表达CD123的,不同于骨髓和脐血来源的造血祖细胞。
4.3CD123 CAR-T的临床研究关于CD123 CAR-T的临床试验正在进行当中。而即使通过CD123 CAR-T细胞治疗使复发/难治AML患者获得二次CR,后续治疗仍需首选异基因造血干细胞移植术。CAR-T细胞能否取代alloHCT仍有待临床检验。
Mardiros等[5]利用慢病毒载体制备出CD123 CAR-T细胞,并成功通过美国FDA批准临床试验。他们正在开展CD123 CAR-T细胞针对难治/复发的AML患者的I期临床试验。该试验中,CD123 CAR-T细胞治疗作为一种挽救性治疗手段,目的是最大程度降低患者的肿瘤负荷,并为进行造血干细胞移植做准备。同时,为了应对治疗过程中可能发生的不良反应,他们采取了以下措施:① 为了解决CAR-T细胞可能引起的不可逆性血细胞减少,所有患者在接受CD123 CAR-T细胞输注前必须有合适的造血干细胞移植供者或者脐血供者;② 同其他CAR-T细胞一样,需要严格控制CD123 CAR-T细胞在体内的存活时间,以降低长期血细胞减少及后期移植过程中残留CAR-T细胞损伤造血干细胞的风险;③ 慢病毒载体的构成包括一段剪切的表皮生长因子受体(epidermal growth factor receptor,EGFR),它可以用于选择、追踪CAR-T细胞,同时在需要时可利用西妥昔单抗作用于EGFR以清除CAR-T细胞。
然而,目前尚无CD123 CAR-T成功治疗AML患者的报道,究其原因可能如下:① 最佳的CAR设计尚不清楚。例如如何选择共刺激分子及其数量、细胞膜外连接片段的长度等;② CAR-T细胞的制备技术尚不成熟,导致不同实验室制备的CAR-T细胞在CD4/CD8比例、调节性T细胞的比例、记忆细胞亚群比例等方面各不相同,也没有统一的最佳标准;③ CAR-T细胞在体内的存在时间尚无法合理控制。临床上输注的CAR-T细胞的数量与治疗效果并没有明显的联系,因为即使输注的CAR-T细胞数量很少,进入体内经过扩增以后仍然可能发挥良好的抗肿瘤效果。目前已知的提高CAR-T在体内存在时间的途径是应用二代及以上的CAR-T细胞,但更强的免疫应答也会引起更强的不良反应。因此,最佳的CAR的设计及CAR-T细胞的输注数量需要更多研究;④ 不良反应。目前临床上报道的不良反应主要有B淋巴细胞“再障”、细胞因子释放综合征及神经系统毒性。因此,还需要尽可能提高治疗效果并降低不良反应。值得一提的是,对于CAR-T治疗过程中出现严重的相关不良反应时,相对于清除CAR-T细胞的方式,若能实时精确控制体内CAR表达其实更为理想;⑤ 无法有效克服肿瘤微环境的抑制作用。因此,治疗过程需在有丰富免疫治疗经验的医生指导下进行,以降低治疗风险。
5 结语
综上所述,鉴于CD123在AML白血病干细胞和正常造血细胞上的表达差异,它已经成为特别关注的一个特殊的肿瘤抗原靶点。CD123的抗体治疗技术及CAR-T细胞技术的研究也已经证实存在抗白血病效应。相信在不久的将来,针对CD123的细胞治疗技术很可能会有效改善AML患者预后,甚至改变AML长久以来的标准治疗方案。
[1]Döhner H, Estey E H, Amadori S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European Leukemia Net[J].Blood, 2010, 115(3):453-74.
[2]Forman S J, Rowe J M. The myth of the second remission of acute leukemia in the adult[J].Blood,2013,121(7):1077-82.
[3]Breems D A, Van Putten W L, Huijgens P C, et al. Prognostic index for adult patients with acute myeloid leukemia in first relapse[J].JClinOncol,2005,23(9):1969-78.
[4]Stone R M. Acute myeloid leukemia in first remission: to choose transplantation or not[J]?JClinOncol,2013,31(10):1262-6.
[5]Mardiros A, Forman S J, Budde L E. T cells expressing CD123 chimeric antigen receptors for treatment of acute myeloid leukemia[J].CurrOpinHematol,2015,22(6):484-8.
[6]Liu K,Zhu M, Huang Y,et al. CD123 and its potential clinical application in leukemias[J].LifeSci,2015,122:59-64.
[7]Frankel A E, McCubrey J A, Miller M S, et al. Diphtheria toxin fused to human interleukin-3 is toxic to blasts from patients with myeloid leukemias[J].Leukemia,2000,14(4):576-85.
[8]Jin L,Lee E M,Ramshaw H S,et al.Monoclonal antibody-mediated targeting of CD123, IL-3 receptor alpha chain,eliminates human acute myeloidleukemic stem cells[J].CellStemCell,2009,5(1):31-42.
[9]Moretti S, Lanza F, Dabusti M, et al. CD123 (interleukin 3 receptor alpha chain)[J].JBiolRegulHomeostAgents,2001,15(1):98-100.
[10]魏伟. 炎症免疫反应软调节[J]. 中国药理学通报,2016,32(3):297-303.
[10]Wei W. Soft regulation of inflammatory immune responses[J].ChinPharmacolBull,2016,32(3):297-303.
[12]Frankel A E, Woo J H, Ahn C, et al. Activity of SL-401, a targeted therapy directed to interleukin-3 receptor, in blastic plasmacytoid dendritic cell neoplasm patients[J].Blood,2014,124(3):385-92.
[13]Frankel A,Liu J S,Rizzieri D,et al. Phase I clinical study of diphtheria toxin-interleukin 3 fusion protein in patients with acute myeloid leukemia and myelodysplasia[J].LeukLymphoma,2008,49(3):543-53.
[14]He S Z, Busfield S, Ritchie D S, et al. A phase 1 study of the safety, pharmacokinetics and antileukemic activity of the anti-CD123 monoclonal antibody CSL360 in relapsed, refractory or high-risk acute myeloid leukemia[J].LeukLymphoma,2015,56(5):1406-15.
[15]Busfield S J,Biondo M,Wong M, et al. Targeting of acute myeloid leukemiainvitroandinvivowith an anti-CD123 mAb engineered for optimal ADCC[J].Leukemia,2014,28(11):2213-21.
[16]Hussaini M A, Ritchey J, Retting M, et al. Targeting CD123 in leukemic stem cells using dual affinity re-targeting molecules (DARTs) [C]//Proceedingsofthe55thASHannualmeeting. New Orleans, 2013: 360.
[17]Chu S, Pong E, Chen H, et al. Immunotherapy with long-lived anti-CD123×anti-CD3 bispecific antibodies stimulates potent T cell-mediated killing of human AML cell lines and of CD123+ cells in monkeys: a potential therapy for acute myelogenous leukemia[C]//Proceedingsofthe56thASHannualmeeting. San Francisco, 2014: 2316.
[18]Colovos C,Villena-Vargas J, Adusumilli P S,et al. Safety and stability of retrovirally transduced chimeric antigen receptor T cells[J].Immunotherapy,2012,4(9):899-902.
[19]Porter D L, Levine B L, Kalos M, et al. Chimeric antigen receptor modified T cells in chronic lymphoid leukemia[J].NEnglJMed,2011,365(8):725-33.
[20]Davila M L, Riviere I, Wang X, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J].SciTranslMed,2014,6(224):224ra25.
[21]Tettamanti S, Marin V, Pizzitola I, et al. Targeting of acute myeloid leukemia by cytokine-induced killer cells redirected with a novel CD123-specific chimeric antigen receptor[J].BrJHaematol,2013,161(3):389-401.
[22]Gill S, Tasian S K, Ruella M, et al. Preclinical targeting of human acute myeloid leukemia and myeloablation using chimeric antigen receptor-modified T cells[J].Blood,2014,123(15):2343-54.
Research progress of T cells expressing CD123 chimeric antigen receptor for treatment of AML
ZHANG Jia-kui, RUAN Yan-jie, WANG Hui-ping, ZHAI Zhi-min
(DeptofHematologyandBio-medicalResearchCenteroftheSecondAffiliatedHospital,HematologicDiseasesResearchCenter,AnhuiMedicalUniversity,Hefei230601,China)
Acute myeloid leukemia(AML) is the most common acute leukemia in adults and has the highest death rate of all leukemias. Compared with other hematologic malignancies, there was only a small increment in the 5-year relative overall survival for patients with AML in the last 40 years, despite the advancement in our understanding of AML. CD123 is an AML-associated antigen that expresses at a high level in leukemic stem cells and leukemic blasts and a low level in normal hematopoietic stem cells. As an attractive surface target for AML therapies, immune-based therapies targeting CD123 are being developed recently, especially chimeric antigen receptor(CAR) T-cell-based immunotherapy. Preclinical data have demonstrated that CD123 CAR-T cells exhibit potent antileukemic activity and various impacts on normal hematopoiesis. This will probably be a promising treatment for patients with relapsed/refractory AML.
AML;CD123;stem cells;immune-based therapies;CAR;T cells
2016-03-26,
2016-04-25
国家自然科学基金资助项目(No 81401293);安徽高校省级自然科学研究重大项目(No KJ2014Z017)
张家奎(1988-),男,博士生,研究方向:血液肿瘤的免疫治疗,E-mail:6855585@sina.com;
翟志敏(1963-),女,博士,主任医师,博士生导师,研究方向:血液肿瘤的诊断与治疗,通讯作者, E-mail:zzzm889@163.com
A
1001-1978(2016)08-1049-04
R-05;R392.11;R392.12;R733.720.5
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.008.html

