组织蛋白酶B在SAHA诱导乳腺癌MCF-7细胞凋亡过程中的调控作用
李 静,周伟强
(沈阳医学院 1.基础医学2014级研究生1班、2.病原生物学教研室,辽宁 沈阳 110034)
组织蛋白酶B在SAHA诱导乳腺癌MCF-7细胞凋亡过程中的调控作用
李静1,周伟强2
(沈阳医学院 1.基础医学2014级研究生1班、2.病原生物学教研室,辽宁 沈阳110034)
doi:10.3969/j.issn.1001-1978.2016.08.011
目的阐明组织蛋白酶B(cathepsin B, Cat B) 在SAHA诱导的乳腺癌雌激素受体阳性细胞系MCF-7细胞凋亡中的调控作用。方法采用MTT法检测SAHA对乳腺癌MCF-7细胞生长状况的影响;应用ELISA方法测定SAHA作用于MCF-7细胞后相关蛋白表达变化的情况;通过BioStationIM活细胞工作站实时收集各种处理因素对乳腺癌MCF-7细胞增殖干预的形态学影响;并通过自动细胞分析仪Muse Cell Analyzer分析SAHA对MCF-7细胞活力和细胞凋亡的影响。结果SAHA能明显抑制乳腺癌MCF-7细胞的增殖,其最佳作用浓度为10 μmol·L-1,最佳作用时间为24 h。ELISA结果表明,SAHA能诱导乳腺癌MCF-7细胞中Cat B的表达。实时活细胞工作站成像实验从形态学上证明,Cat B抑制剂Cystatin C和SAHA联合应用可有效阻止SAHA对MCF-7细胞生长的抑制作用。细胞学实验结果表明,SAHA能使MCF-7细胞活力下降,细胞凋亡发生率明显增高;然而经过Cystatin C处理后的MCF-7细胞活力增加,细胞凋亡发生率下降。结论Cat B在SAHA诱导乳腺癌雌激素受体阳性细胞MCF-7凋亡过程中具有重要的调控作用。
乳腺癌;雌激素受体阳性细胞;MCF-7;组织蛋白酶B;SAHA;细胞凋亡
乳腺癌是一种严重影响女性身心健康的最常见恶性肿瘤之一,目前已成为全球第二大致死性癌症。在新增女性恶性肿瘤患者中,乳腺癌的发病率逐年上升,且呈年轻化趋势[1]。在乳腺癌患者中,70%~80%为雌激素受体(estrogen receptor, ER)阳性乳腺癌,因此针对ER+乳腺癌相关的研究显得尤为重要。组织蛋白酶B(cathepsin B,Cat B)基因定位于染色体 8p22,由13个外显子和11个内含子组成, 长度约2.7 kb,是溶酶体内一种半胱氨酸蛋白酶[2]。研究表明,当溶酶体内Cat B释放入细胞质后可激活Bid的表达,导致细胞色素C从线粒体中释放而诱导细胞凋亡的发生,这说明Cat B在细胞凋亡产生过程中起到重要的作用[3-5]。
随着分子生物学技术的迅猛发展,人们已经从分子水平上对乳腺癌有了更深的了解。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)可通过提高染色质特定区域组蛋白乙酰化水平从而影响靶基因的表达[6]。SAHA(suberoylanilide hydroxamic acid)作为一种广谱组蛋白去乙酰化酶抑制剂,研究发现其具有良好的抑瘤性。其可结合组蛋白去乙酰化酶HDAC1(histone deacetylase 1, HDAC1 )的催化位点,并抑制其活性以促进乙酰化组蛋白增加,导致癌细胞转录过程异常,诱导癌细胞分化,阻滞癌细胞周期进程和促进癌细胞凋亡的发生[7]。在本实验中,我们将观察Cat B在SAHA诱导ER+乳腺癌细胞MCF-7凋亡过程中的表达变化情况,阐明Cat B在SAHA诱导乳腺癌细胞凋亡过程中的调节作用。
1 材料与方法
1.1材料人乳腺癌细胞株MCF-7购自美国ATCC细胞库;RPMI 1640培养基、胎牛血清、BCA蛋白质定量试剂盒、青霉素及链霉素购自美国Thermo公司;SAHA和Cystatin C购自美国Sigma-Aldrich公司;ELISA试剂盒购自美国R&D公司;Muse Annexin & Dead Cell kit、Muse Count & Viability kit 试剂盒购自德国Merck Millipore 公司;其它化学试剂购自美国Sigma-Aldrich公司。
1.2方法
1.2.1细胞培养人乳腺癌MCF-7细胞,在10%胎牛血清的RPMI 1640培养液中(含100 mg·L-1青、链霉素)、37 ℃、5% CO2的条件下传代培养。
1.2.2MTT细胞增殖检测将5×106·L-1乳腺癌MCF-7细胞接种于96孔板各孔中,待细胞进行无血清同步化处理后,分别加入不同浓度的SAHA(0、0.5、1.0、2.0、5.0、10.0、20.0、50.0 μmol·L-1)进行孵育,以DMSO为对照组。应用MTT检测SAHA作用24、48 h后细胞的生长状况,了解SAHA对MCF-7细胞生长的影响。
1.2.3蛋白裂解将1.5×108·L-1乳腺癌MCF-7细胞接种于24孔板各孔中,无血清培养液同步化处理后,加入不同浓度Cat B特异性抑制剂Cystatin C(0、20、40、60、80、100 μg·L-1)和10 μmol·L-1SAHA孵育24 h。收集细胞团,PBS漂洗1次后,加入RIPA蛋白裂解液裂解蛋白。蛋白定量采用BCA方法测定。
1.2.4ELISA检测BCA蛋白定量后,按照ELISA试剂盒说明书配制相应试剂;将100 μL的Assay Diluent RD1-34加入ELISA专用微孔板各孔内,再分别加入50 μL工作标准品、对照组和处理组样品的蛋白,封膜后4 ℃摇床孵育2 h;每孔400 μL washing buffer清洗后,加入200 μL Human Pro-Cathepsin B Conjugate, 4 ℃摇床孵育2 h;每孔400 μL washing buffer清洗各孔后,加入200 μL Substrate Solution,室温下避光孵育30 min;多功能酶标分析仪450 nm检测各孔吸光度。
1.2.5实时活细胞工作站成像将5×107·L-1乳腺癌MCF-7细胞接种于BioStationIM活细胞工作站专用4孔板的各孔中,待细胞进行无血清同步化处理后,加入Cystatin C和SAHA共同孵育24 h 。设定BioStationIM活细胞工作站总拍摄时长为72 h,实时观测各孔中乳腺癌MCF-7细胞生长状况,并收集相应处理因素对乳腺癌MCF-7细胞增殖干扰的形态学证据。
1.2.6细胞凋亡荧光检测将5×107·L-1乳腺癌MCF-7细胞接种于4孔板各孔内,同步化处理后,加入Cystatin C、SAHA与MCF-7共同孵育24 h。将孵育后的细胞分别加入150 μL Annexin-V-FLUOS荧光试剂,室温避光静置15 min后,应用荧光共聚焦显微镜Leica DMI4000B进行荧光观察。
1.2.7细胞活力检测将4×108·L-1乳腺癌MCF-7细胞接种于12孔板各孔中,无血清培养液同步化处理后,加入100 μg·L-1Cystatin C和10 μmol·L-1SAHA与MCF-7细胞共同孵育24 h。细胞活力实验参照试剂盒程序进行。将与Cystatin C和SAHA孵育后的细胞经胰酶消化,收集约50 μL的细胞悬液,加入450 μL Count & Viability reagent,静置5 min后,应用自动细胞分析仪Muse Cell Analyzer(Millipore)进行检测。
1.2.8细胞凋亡检测将4×108·L-1乳腺癌MCF-7细胞接种于12孔板各孔中,无血清培养液同步化处理后,加入100 μg·L-1Cystatin C和10 μmol·L-1SAHA与MCF-7细胞共同孵育24 h。将与Cystatin C和SAHA孵育后的细胞经胰酶消化,收集约100 μL的细胞悬液,与100 μL Muse Annexin V & Dead Cell reagent室温下避光孵育20 min。应用自动细胞分析仪Muse Cell Analyzer检测各处理因素诱导MCF-7细胞凋亡发生的情况。
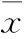
2 结果
2.1SAHA抑制乳腺癌MCF-7细胞增殖的MTT检测为了解SAHA对ER+乳腺癌细胞MCF-7的抑制作用,我们应用MTT的方法检测不同浓度SAHA对MCF-7细胞生长状态的影响。从Fig 1中可以看出,24 h时0.5 μmol·L-1浓度的SAHA组与Basal组相比表现出了对MCF-7细胞生长有抑制的趋势,2~50 μmol·L-1的SAHA与Basal相比则都表现出了较明显的抑制细胞生长的效应,并且数据经统计学处理后,差异具有统计学意义(P<0.01),其中,SAHA作用达24 h时有效的半抑制浓度(50% inhibiting concentration, IC50)为10 μmol·L-1。因此,在本实验中我们选定10 μmol·L-1浓度的SAHA、24 h的作用时间为抑制MCF-7细胞生长的最适浓度和处理时长。
2.2Cat B抑制剂Cystatin C和SAHA对乳腺癌MCF-7细胞相关Cat B表达的影响为了解Cat B在SAHA抑制乳腺癌细胞增殖中的作用,我们把不同浓度(0、20、40、60、80、100 μg·L-1)Cystatin C分别和10 μmol·L-1SAHA与MCF-7细胞共同孵育,并用 ELISA检测Cat B表达的变化。结果发现(Fig 2),相比较于Basal组,10 μmol·L-1SAHA作用后的细胞中Cat B高表达;相对于SAHA组,随着Cat B抑制剂Cystatin C量的增加,Cat B的表达量有不同程度的减少,且Cystatin C在100 μg·L-1时能有效地抑制Cat B的表达。数据经统计学分析,差异具有统计学意义(P<0.05)。
2.3Cat B抑制剂Cystatin C和SAHA对乳腺癌MCF-7细胞形态学的影响为了收集Cat B抑制剂Cystatin C、SAHA等处理因素对MCF-7细胞增殖影响的形态学证据,我们采用BioStationIM活细胞工作站及荧光共聚焦显微镜实时观察Cat B抑制剂Cystatin C和SAHA对乳腺癌MCF-7细胞生长状况的影响。结果如Fig 3所示,Basal组的细胞生长状况良好,形态正常,24 h时达到9层以上的铺满率;而单独使用SAHA处理后的乳腺癌细胞呈现不同于Basal组的形态学改变。单独SAHA处理后,24 h出现细胞变长,细胞质呈放射状向外突出,细胞生长受到抑制,荧光显微镜下出现一些形态完整、大圆型的凋亡荧光细胞。而单独Cystatin C处理对MCF-7细胞形态学影响与空白对照组相比变化不大。Cystatin C和SAHA联合作用24 h后,MCF-7即使发生一些形态学变化,细胞核固缩,梭形细胞变多,但是作用不如单独使用SAHA作用明显。
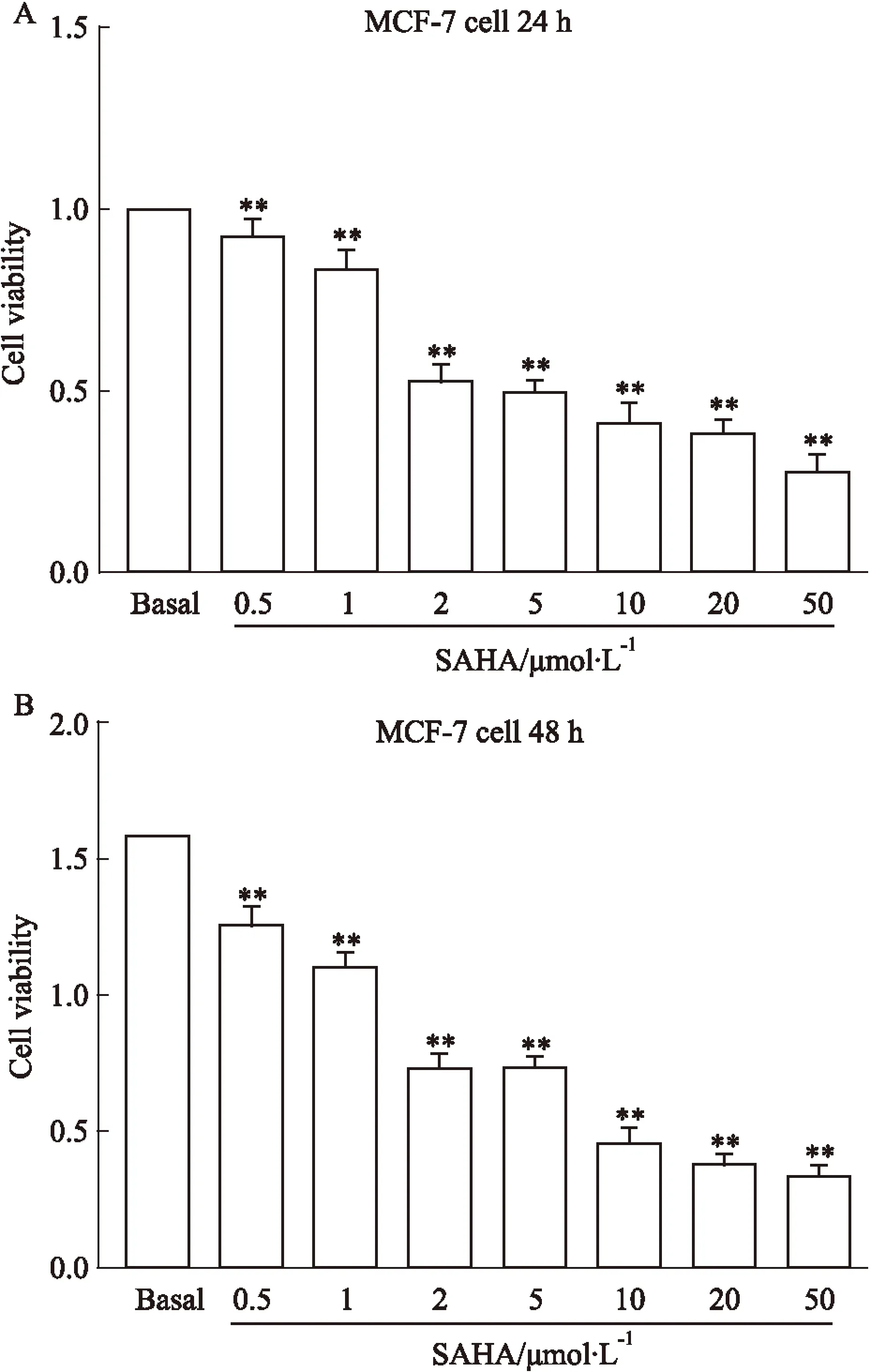
Fig 1 MTT cell proliferation assays on different concentrations of SAHA for MCF-7 breast cancer cells **P<0.01 vs basal
2.4Cat B抑制剂Cystatin C、SAHA对乳腺癌MCF-7细胞活力和细胞凋亡的影响为了更清晰地探究Cat B和SAHA对乳腺癌MCF-7细胞生长状态的影响,我们分别应用100 μg·L-1Cystatin C和10 μmol·L-1SAHA与MCF-7细胞孵育24 h后,测定细胞活力和细胞凋亡。细胞活力检测结果显示(Fig 4A):与Basal组相比,经SAHA单独处理后乳腺癌MCF-7细胞活力明显下降,活细胞比率从89.3%下降到71.3%,死细胞比率由10.7%上升到28.7%;经Cat B抑制剂Cystatin C单独处理后的MCF-7细胞,活细胞比率与Basal组差别不大,为87.7%;然而与单独使用SAHA组不同,经Cystatin C和SAHA共同处理后的乳腺癌MCF-7细胞活力上升,由SAHA组的71.3%上升到84.5%,表明SAHA诱导乳腺癌MCF-7细胞凋亡的途径中有Cat B的参与。细胞凋亡检测结果显示(Fig 4B):与Basal组相比,经SAHA处理后的MCF-7细胞出现明显的细胞凋亡,细胞的早、晚期凋亡诱导率分别达到15.68%和24.02%;而单独使用Cystatin C处理后的MCF-7细胞早、晚期凋亡诱导率与Basal组差别不大,为8.08%和10.04%;与单独使用SAHA组不同,经Cystatin C和SAHA共同处理后的乳腺癌MCF-7细胞凋亡诱导率则下降,这说明了Cat B在SAHA诱导乳腺癌MCF-7细胞凋亡的过程中有一定的调控作用。
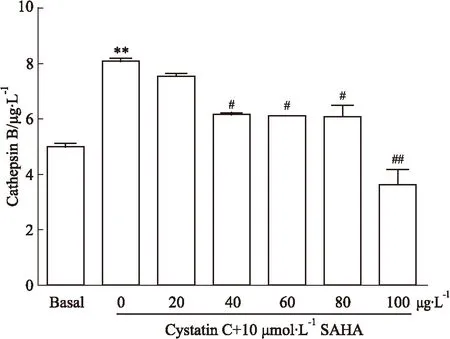
Fig 2 The Cat B changes induced by Cystatin C and SAHA treatment on MCF-7 breast cancer cell
**P<0.01vsbasal;#P<0.05,##P<0.01vsSAHA
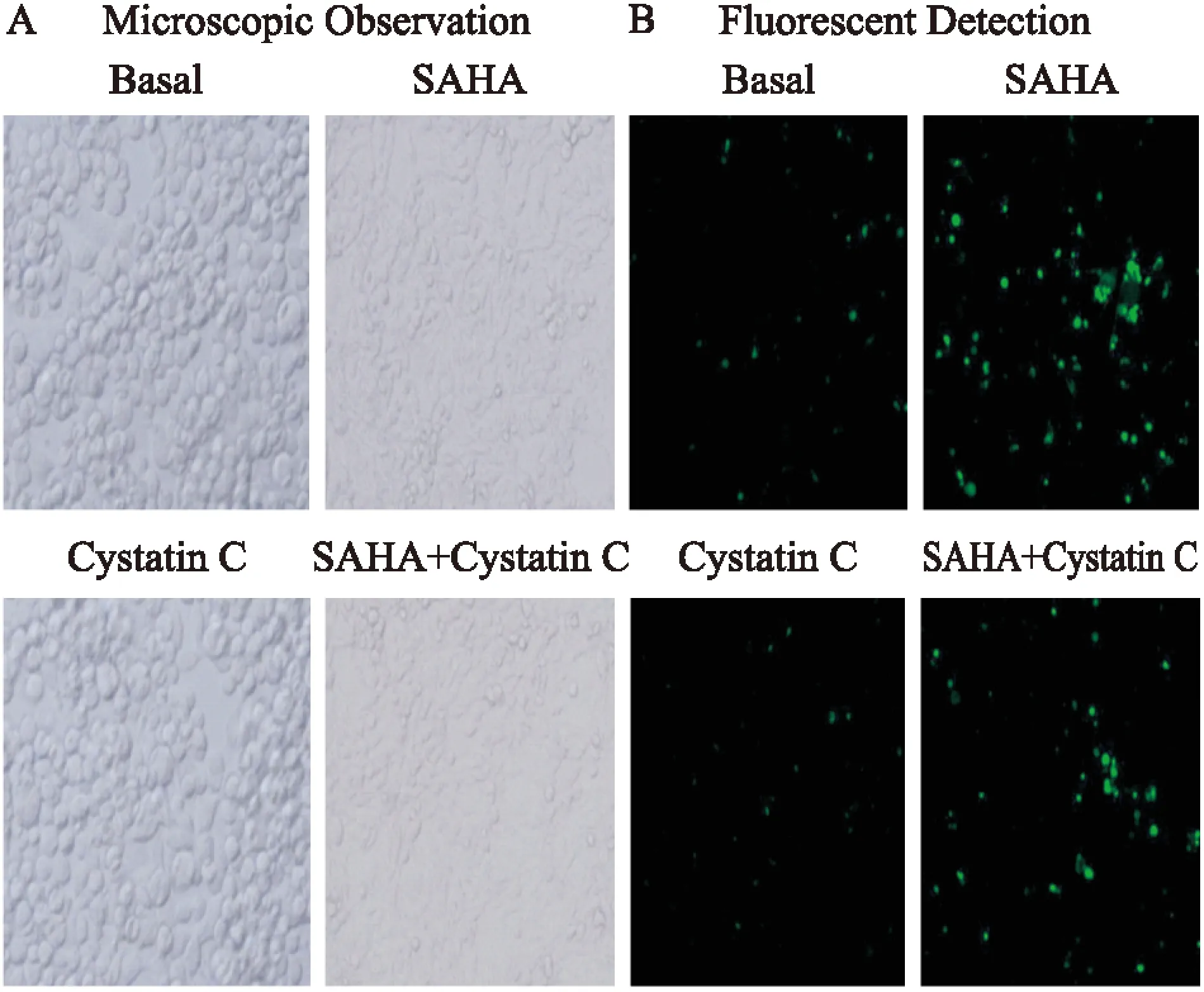
Fig 3 The morphological effect induced by Cystatin C and SAHA on MCF-7 breast cancer cell
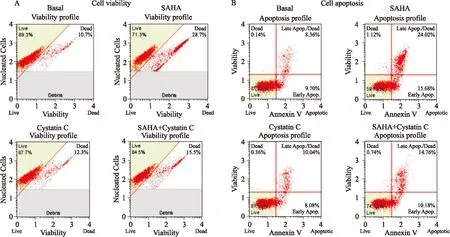
Fig 4 Effect of Cystatin C and SAHA treatment on cell viability (A) and apoptosis (B) of MCF-7 breast cancer cell
3 讨论
在真核生物中,组蛋白是构成核小体的重要成分,组蛋白的乙酰化与去乙酰化修饰在真核生物基因表达调控中起重要的作用。SAHA作为羟肟酸类的组蛋白去乙酰化酶抑制剂,具有良好的抑瘤性[8]。有研究表明,SAHA可抑制MCF-7、MDA-MB-231、MDA-MB-435、SKBr-3等乳腺癌细胞中Cyclin D1的表达,激活p21Waf1/Cip1的功能,导致乳腺癌细胞增殖周期停滞并诱导凋亡的产生[9-10]。在本实验中,我们将组蛋白去乙酰化酶抑制剂SAHA与MCF-7细胞培养,通过MTT的方法得出SAHA在10 μmol·L-1、24 h时能抑制乳腺癌ER+细胞MCF-7增殖。相关细胞学实验表明,SAHA能够使MCF-7细胞凋亡发生率明显增加,而细胞活力明显下降。
近年来的研究表明,Cat B作为一个半胱氨酸组织蛋白酶和肿瘤的发生发展密切相关。Ebert等[11]发现,Cat B在60%的胃癌患者中过表达。晚期癌症患者与健康人相比,Cat B血清水平明显高于健康对照组,呈高表达。蛋白组学研究结果也发现,乳腺癌、甲状腺癌和结肠癌中Cat B的表达同样也明显增高[12-14]。在本实验中,我们通过应用Cat B抑制剂Cystatin C来研究Cat B在SAHA促进乳腺癌MCF-7细胞凋亡过程中的表达情况及其在细胞凋亡过程中的调控作用。将Cystatin C、SAHA与MCF-7细胞共同培养,通过ELISA测定相关蛋白Cat B的表达情况。结果显示,与Basal组相比,单独使用SAHA组的Cat B蛋白高表达,而应用Cystatin C后的细胞中Cat B蛋白的表达与SAHA组相比有明显减少,当Cystatin C浓度达到100 μg·L-1时可有效抑制Cat B的表达。通过细胞活力和细胞凋亡实验得出,单独SAHA 能促进MCF-7细胞活力下降,早、晚期细胞凋亡发生率明显上升。而加入Cystatin C和SAHA的MCF-7与单独使用SAHA组相比,细胞活力则明显上升,早、晚期细胞凋亡发生率明显下降。这些数据从不同角度证实了SAHA在促进乳腺癌MCF-7细胞凋亡中有Cat B的参与,说明Cat B在SAHA促进乳腺癌MCF-7细胞凋亡过程中具有一定的调节作用。
综上所述,在本次实验中,我们系统地研究了Cat B在SAHA作用于ER+乳腺癌细胞系MCF-7细胞增殖过程中所产生的影响。通过ELISA和相关细胞学实验方法探讨了Cat B抑制剂Cystatin C、SAHA作用MCF-7细胞后对相关蛋白Cat B表达变化的情况,以及对细胞活力和细胞凋亡变化的影响,并通过形态学观察了Cystatin C、SAHA对MCF-7细胞增殖的作用。通过实验结果,我们得出了SAHA在促进乳腺癌MCF-7细胞凋亡的过程中,Cat B具有一定的调控作用。我们的研究工作为进一步明确Cat B在SAHA促进乳腺癌细胞凋亡过程中所起的作用提供了一定的理论和实验基础。
(致谢:衷心感谢沈阳医学院“辽宁省环境污染与微生态重点实验室”工作人员对于本实验给予的大力支持!)
[1]Chao Y L,Shepard C R,Wells A. Breast carcinoma cells re-express E-cadherin during mesenchymal to epithelial reverting transition[J].MolCancer,2010,9:179.
[2]Rawlings N D, Waller M, Barrett A J, et al. MEROPS: the database of proteolytic enzymes, their substrates and inhibitors[J].NucleicAcidsRes, 2014, 42:D503-9.
[3]Cirman T, Oresic K, Mazovec G D, et al. Selective disruption of lysosomes in Hela cells triggers apoptosis mediated by cleavage of Bid by multiple papain-like lysosomal cathepsins[J].JBiolChem, 2004, 279(5):3578-87.
[4]Cesen M H, Pegan K, Spes A, et al. Lysosomal pathways to cell death and their therapeutic applications[J].ExpCellRes, 2012, 318(11):1245-51.
[5]Kallunki T, Olsen O D, Jaattela M. Cancer-associated lysosomal changes: friends or foes[J].Oncogene, 2013, 32(16):1995-2004.
[6]冯秀艳, 韩翰, 周伟强. SAHA在Leptin诱导的乳腺癌MCF-7细胞增殖过程中的调控作用[J]. 中国药理学通报,2016,32(4):503-8.
[6]Feng X Y, Han H, Zhou W Q. Regulation of SAHA on cell proliferation induced by leptin in breast cancer cell line MCF-7[J].ChinPharmacolBull, 2016, 32(4):503-8.
[7]De Ruijter A J, van Gennip A H, Caron H N, et al. Histone deacetylases(HDACs): characterization of the classical HDAC family[J].BiochemJ, 2003, 370(Pt3):737-49.
[8]Al-Yacoub N, Fecker L F, Mobs M, et al. Apoptosis induction by SAHA in cutaneous T-cell lymphoma cells is related to downregulation of c-FLIP and enhanced TRAIL signaling[J].JInvestDermatol, 2012, 132(9):2263-74.
[9]Shankar S, Davis R, Singh K P, et al. Suberoylanilide hydroxamic acid(Zolinza/vorinostat) sensitizes TRAIL-resistant breast cancer cells orthotopically implanted in BALB/c nude mice[J].MolCancerTher, 2009, 8(6):1596-605.
[10]Munster P N, Troso-Sandoval T, Rosen N, et al. The histone deacetylase inhibitor suberoylanilide hydroxamic acid induces differentiation of human breast cancer cells[J].CancerRes, 2001, 61(23):8492-7.
[11]Ebert M P, Kruger S, Fogeron M L, et al. Overexpression of cathepsin B in gastric cancer identified by proteome analysis[J].Proteomics, 2005, 5(6):1693-704.
[12]McKerrow J H, Bhargava V, Hansell E, et al. A functional proteomics screen of proteases in colorectal carcinoma[J].MolMed, 2000, 6(5):450-60.
[13]Srisomsap C, Subhasitanont P, Otto A, et al. Detection of cathepsin B up-regulation in neoplastic thyroid tissues by proteomic analysis[J].Proteomics, 2002, 2(6):706-12.
[14]Wulfkuhle J D, Sgroi D C, Krutzsch H, et al. Proteomics of human breast ductal carcinoma in situ[J].CancerRes, 2002, 62(22):6740-9.
The regulation of Cathepsin B on cell apoptosis induced by SAHA in breast cancer cell line MCF-7
LI Jing1, ZHOU Wei-qiang2
(1.Class1Grade2014,ClinicalMedicine, 2.DeptofPathogenBiology,ShenyangMedicalCollege,Shenyang110034,China)
AimTo clarify the regulation role of cathepsin B (Cat B) in cell proliferation and apoptosis induced by SAHA in ER-positive breast cancer cell line MCF-7.MethodsMTT was used to screen the optimal concentration and treatment time of SAHA. The expression levels of related proteins were determined by ELISA, and the morphological changes were observed through time-lapse live cell imaging acquisition. Cell viability and apoptosis assay in MCF-7 cells were assessed by Muse Cell Analyzer with SAHA and/or Cystatin C treatment. ResultsMTT assay showed that the anti-tumor efficacy of SAHA was significant. The optimal concentration and treatment time were 10 μmol·L-1and 24 h respectively. ELISA assay showed that SAHA could induce expression of Cat B in MCF-7 cells. Real-time live-cell imaging experiments demonstrated that the combination treatment of Cystatin C and SAHA significantly resumed the inhibitory effect caused by SAHA alone. Cytology test showed that SAHA alone obviously depressed the cell viability and induced apoptosis. However, the effect was reversed with the combination of Cystatin C.ConclusionCat B plays an important role in apoptosis induced by SAHA in ER+breast cancer cells MCF-7.
breast cancer;estrogen receptor positive cell line;MCF-7;Cat B;SAHA;cell apoptosis
2016-03-21,
2016-04-25
国家自然科学基金资助项目(No 81172509); 辽宁省自然科学基金资助项目(No 2015020393)
李静(1989-),女,硕士生,研究方向:肿瘤调控,Tel:024-62216825,E-mail:815885270@qq.com;
周伟强(1970-),男,博士,教授,研究方向:乳腺癌发生与调控,通讯作者,Tel:024-62216825,E-mail:zhouwq@hotmail.com
A
1001-1978(2016)08-1086-05
R329.25;R392.11;R737.9;R977.3
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.022.html

