白藜芦醇调控Th1和Th2应答抑制小鼠日本血吸虫病肝脏纤维化的研究
张伟伟,朱继峰,王 任,高雅楠,张军峰,佟书娟
(1.南京中医药大学病原与免疫学教研室,江苏 南京 210023;2.江苏省现代病原生物学重点实验室,江苏 南京 211166)
白藜芦醇调控Th1和Th2应答抑制小鼠日本血吸虫病肝脏纤维化的研究
张伟伟1,朱继峰2,王任1,高雅楠1,张军峰1,佟书娟1
(1.南京中医药大学病原与免疫学教研室,江苏 南京210023;2.江苏省现代病原生物学重点实验室,江苏 南京211166)
doi:10.3969/j.issn.1001-1978.2016.08.012
目的探讨白藜芦醇对日本血吸虫病纤维化的作用,并分析其对Th1和Th2应答的影响。方法45只C57BL/6小鼠感染日本血吸虫3周后,随机分为A、B、C 3组,A组为感染组,B组为灌胃白藜芦醇治疗组,C组为灌胃吡喹酮治疗组,另取15只正常C57BL/6小鼠为健康对照D组。在感染第13周,取小鼠的肝脏,应用天狼猩红染色观察肝脏纤维化程度,并检测肝脏中IL-13、IFN-γ和TGF-β mRNA的表达情况。另取脾脏淋巴细胞,采用流式细胞术检测Th1和Th2细胞占总T淋巴细胞的比例。结果感染第13周,与A组相比,B组和C组小鼠肝脏纤维化程度明显减轻(P<0.01),B组小鼠的Th1细胞比例明显增高(P<0.05),Th2细胞比例明显降低(P<0.01),B组小鼠外周血清中的抗可溶性成虫抗原(SWA)的IgG2a明显增多(P<0.05),而抗可溶性虫卵抗原(SEA)的IgG1明显减少(P<0.01),B组小鼠肝脏中IFN-γ mRNA的表达量明显增高(P<0.05),而IL-13、TGF-β mRNA的表达水平明显降低(P<0.01)。结论白藜芦醇通过增强日本血吸虫感染小鼠的Th1应答,降低Th2应答,明显抑制日本血吸虫感染小鼠肝脏纤维化程度。
日本血吸虫;白藜芦醇;吡喹酮;纤维化;Th1;Th2
血吸虫病是一种严重危害全球多个地区人民健康的慢性感染性免疫疾病[1]。其最主要的病理损伤是由沉积在肝脏中的虫卵导致的肉芽肿及继发的纤维化,能够阻塞窦前静脉, 导致门脉高压, 从而引起肝、脾肿大,上消化道出血及腹水等症状, 严重者可危及生命[2]。现在的研究表明,CD4+T细胞应答在纤维化发生发展过程中发挥关键作用,尤其是Th1/Th2细胞的极化及其免疫调节与血吸虫肝脏纤维化的发生发展密切相关。Th1细胞通过产生INF-γ等细胞因子有效抑制肝星状细胞的增殖和活化,从而下调血吸虫病的纤维化程度, 而Th2细胞则能够产生大量的IL-13和TGF-β,促进成纤维细胞的形成和胶原蛋白的合成与沉积[3]。目前,探讨血吸虫病的免疫学基础,以期开发新的治疗方案和药物,对治疗血吸虫病人具有积极的意义。
白藜芦醇是广泛存在于葡萄、虎杖等多种药用植物中的一种天然多酚类化合物,具有抗氧化、抗肿瘤和抗炎作用[4-6]。已有研究报道,白藜芦醇对四氯化碳和酒精导致的肝脏纤维化具有明显的抑制作用。同时,有人也发现白藜芦醇伍用吡喹酮能够有效治疗血吸虫感染小鼠的纤维化[7-8]。这些研究均提示白藜芦醇本身同样也具有抗纤维化的作用,但相关研究尚未见报道,且其机制尚不清楚。同时有研究报道了白藜芦醇对人外周血T细胞的增殖、淋巴细胞母细胞化以及IL-2、INF-γ 产生的影响[9]。这就提示白藜芦醇可能通过调节血吸虫感染过程中的T细胞免疫应答,从而影响相应的病理。本研究采用白藜芦醇灌胃日本血吸虫感染小鼠,探讨白藜芦醇对日本血吸虫感染小鼠Th1/Th2细胞极化以及相应的肝脏纤维化的影响,为白藜芦醇治疗日本血吸虫病等感染性免疫疾病提供新的理论基础和治疗策略。
1 材料与方法
1.1实验动物与阳性钉螺清洁级6~8周龄♀ C57BL/6小鼠60只, 购自南京医科大学实验动物中心; 日本血吸虫感染钉螺购自江苏省血吸虫病防治研究所。
1.2试剂白藜芦醇(纯度为98%以上,批号为KA080CA14)购自上海源叶生物技术有限公司。吡喹酮购自南京制药厂有限公司(批号为20091202)。流式抗体仓鼠抗小鼠CD3e-APC、大鼠抗小鼠CD4-FITC、大鼠抗小鼠IFN-γ-PE、大鼠抗小鼠IL-4-PE均购自eBioscience公司。破膜固定剂试剂盒(Fix/Perm Cell Permeabilization Kit)购自BD公司。小鼠IL-13、INF-γ、TGF-β引物购自上海英骏生物技术有限公司。酶联吸附反应HRP结合的大鼠抗小鼠IgG1和IgG2a抗体购自BD公司,TMB底物购自BD公司。TRIzolTM购自上海英骏生物技术有限公司,逆转录试剂盒购自Fermantas公司,SYBR Green PCR Master Mix购自Roche公司。
1.3感染模型的建立和分组取6~8周龄♀ C57BL/6小鼠45只,每鼠经腹部皮肤感染日本血吸虫尾蚴(12±2)条。感染3周后,感染小鼠随机均分为3组,每组15只。实验共设立4组: A组小鼠为感染组,B组小鼠为灌胃白藜芦醇治疗组,感染6周后连续6周灌胃给予白藜芦醇20 mg·kg-1·d-1,C组小鼠为灌胃吡喹酮治疗组,在感染后第3、6周灌胃给予吡喹酮500 mg·kg-1·d-1×3 d, D组小鼠为健康对照组。
1.4病理学检查在感染第13周取各组小鼠肝组织固定,石蜡包埋,切片,天狼猩红染色,于低倍镜(×100)下分别观察肝组织中的纤维化程度,采用Image-Pro Plus 图像处理分析软件分析天狼猩红染色的平均光密度。
1.5流式细胞术检测脾淋巴组织中Th1和Th2细胞比例在感染第13周,取各组小鼠的脾脏淋巴结组织研磨制备成单细胞悬液,并以完全RPMI 1640培养液调节浓度至1×109·L-1。在反应体系中加入1 mg·L-1佛波酯(PMA)、50 mg·L-1离子霉素及0.7 mL·L-1Golgistop,置于37 ℃、体积分数为0.05的CO2培养箱中培养6 h。将细胞用PBS缓冲液洗1遍并重悬于100 μL PBS缓冲液中,加入CD3e-APC(0.2 g·L-1)和CD4-FITC(0.5 g·L-1)抗体,充分混匀后于4 ℃避光孵育20 min。以缓冲液洗1遍,加入Fixation/Permeabilization Solution 1 mL,并于4 ℃避光孵育40 min。1 500 r·min-1离心后弃去上清,以100 μL Perm/Wash Buffer 重悬细胞后,分别加入抗IFN-γ-PE (0.2 g·L-1)或抗IL-4-PE(0.2 g·L-1)抗体,置4 ℃避光孵育20 min。PBS缓冲液洗1遍后,以500 μL PBS缓冲液重悬细胞,用流式细胞仪(FACS Calibur,Becton Dickinson公司)检测。
1.6ELISA检测血清中IgG1和IgG2a在感染第13周对各组小鼠进行内眦取血,10 000 r·min-1离心后取上清即为血清。预先用血吸虫成虫抗原(SWA)和血吸虫虫卵抗原(SEA)以4 mg·L-1的最佳浓度包被酶标板,40 g·L-1脱脂奶粉封闭。加入稀释度为1 ∶100血清孵育,洗脱后分别在包被SWA和SEA的酶标板中加入稀释度为1 ∶1 000 HRP标记的anti-mouse IgG2a和anti-mouse Ig G1孵育,洗脱后TMB显色,终止显色后,立即在酶标读数仪450 nm的波长下检测吸光度。
1.7实时定量RT-PCR检测肝组织中的INF-γ、IL-13、TGF-β mRNA在感染第13周每组小鼠肝组织取50 mg,用TRIzolTM提取肝组织总RNA,按M-MLV转录cDNA。IL-4、INF-γ、TGF-β的反应体系都为SYBR Green PCR Master Mix 10 μL,反转录cDNA 5 μL,上游引物1 μL,下游引物1 μL,ddH2O 3 μL,总体积20 μL。进行实时荧光定量PCR,反应条件为:95℃ 10 min, 40个循环:60℃ 60 s,95℃ 15 s,溶解曲线60℃~90℃保证扩增为单一产物。以Ct值进行结果分析,采用相对量法与内参GAPDH比较。计算公式为:2-ΔCT,ΔCt=Ct gene-Ct control。
1.8统计学分析统计作图用GraphPad Prism 4.0软件,采用SPSS 15.0软件进行统计分析。两组间差异比较采用Student′st检验。
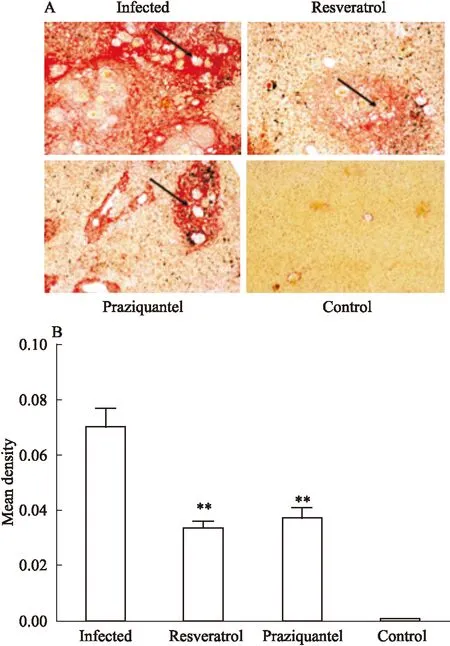
Fig 1 The hepatic fibrosis in different groups
A: The degree of hepatic fibrosis; B: The mean density of hepatic fibrosis.**P<0.01vsinfected group
2 结果
2.1不同处理组小鼠肝脏的纤维化程度日本血吸虫感染后第13周,光镜下健康对照组小鼠的肝脏未见任何病理改变,而感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠的肝脏中都可见胶原纤维沉积(Fig 1A)。在纤维化程度和范围上,感染组最严重,白藜芦醇治疗组和吡喹酮治疗组较感染组明显减轻(P<0.01),而白藜芦醇治疗组和吡喹酮治疗组之间差异没有统计学意义(P>0.05)( Fig 1B )。结果提示白藜芦醇与吡喹酮一样都能明显抑制肝脏纤维化程度。
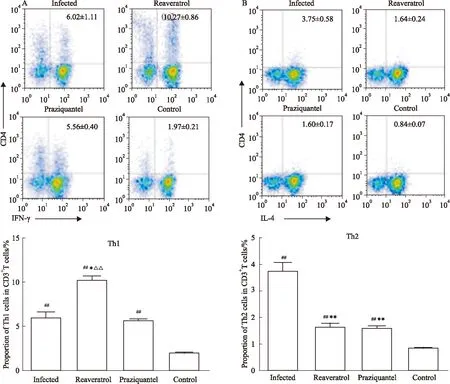
Fig 2 Proportions of Th1 (A), Th2 (B) cells in different groups
*P<0.05,**P<0.01vsinfected group;##P<0.01vscontrol group;△△P<0.01vspraziquantel group
2.2不同处理组小鼠的Th1、Th2细胞比例与健康对照组比较,日本血吸虫感染13周的感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠脾脏淋巴细胞中Th1细胞(CD3+CD4+IFN-γ+)占总T细胞的比例明显增加(P<0.01),并且白藜芦醇治疗组的Th1细胞比例明显高于感染组(P<0.05)和吡喹酮治疗组(P<0.01),而感染组和吡喹酮治疗组的Th1细胞比例并无差异(P>0.05)(Fig 2A)。同时,感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠脾脏淋巴细胞中Th2细胞(CD3+CD4+IL-4+T细胞)占总T细胞的比例也明显高于健康对照组小鼠(P<0.01),并且白藜芦醇治疗组和吡喹酮治疗组的Th2细胞比例均明显低于感染组(P<0.01),但是白藜芦醇治疗组和吡喹酮治疗组之间差异没有统计学意义(P>0.05)(Fig 2B)。
2.3不同处理组小鼠血清中的抗SWA-IgG2a和抗SEA-IgG1表达水平为了进一步验证Th1和Th2细胞应答情况,检测了各组小鼠血清中的抗SWA-IgG2a和抗SEA-IgG1表达水平。与健康对照组比较,感染13周后,感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠血清中的抗SWA-IgG2a的表达水平都明显增加(P<0.01),并且白藜芦醇治疗组抗SWA-IgG2a的表达水平明显高于感染组(P<0.05)和吡喹酮治疗组(P<0.05),而感染组和吡喹酮治疗组则没有差异(P>0.05)(Fig 3A)。抗SEA-IgG1的检测结果发现,感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠血清中的表达水平较健康对照组也都明显增加(P<0.01),并且白藜芦醇治疗组(P<0.01)和吡喹酮治疗组(P<0.05)的抗SEA-IgG1表达水平明显低于感染组,而白藜芦醇治疗组和吡喹酮治疗组之间差异没有统计学意义(P>0.05)(Fig 3B)。
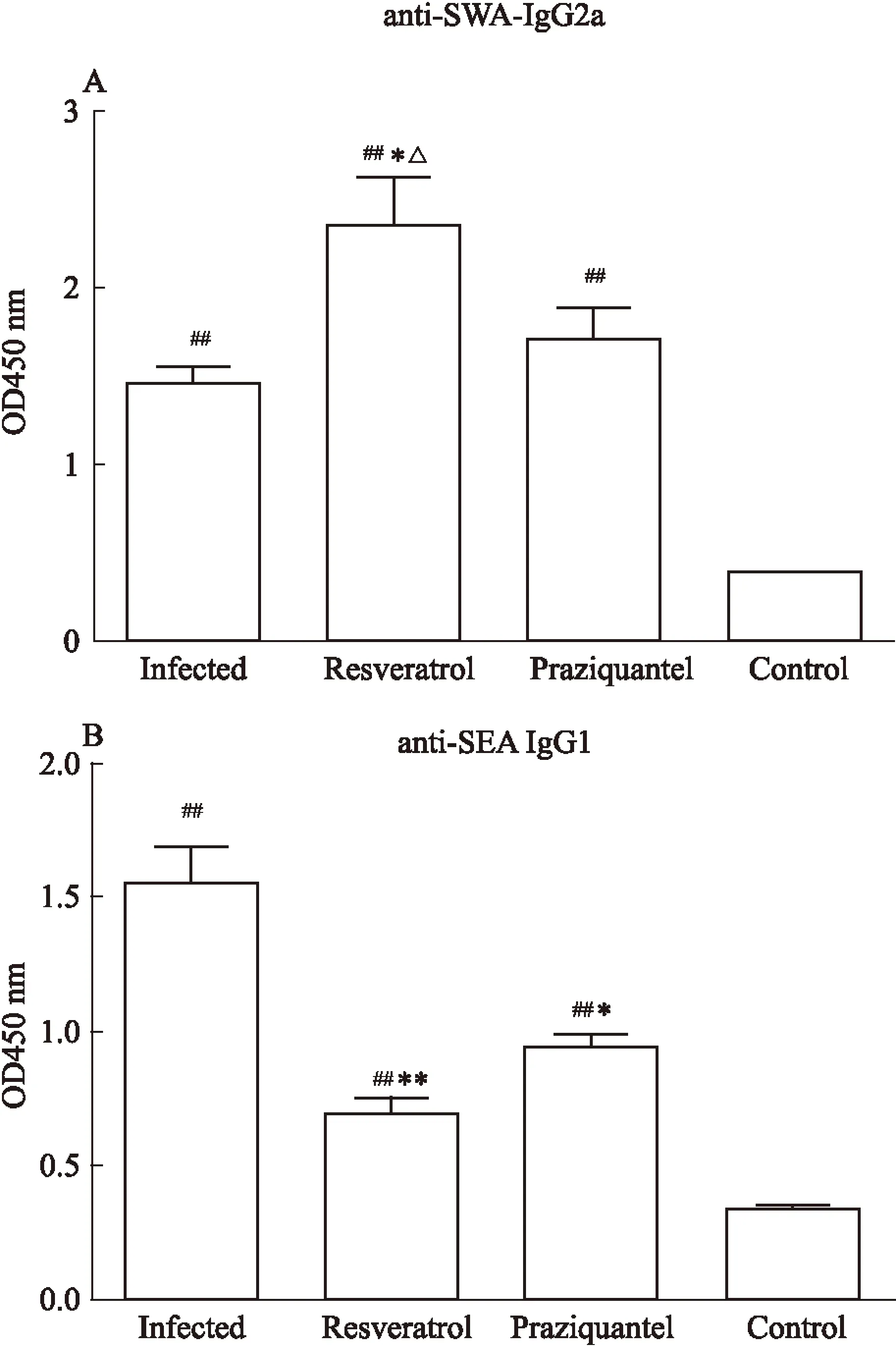
Fig 3 Production of anti-SWA IgG2a (A) and anti-SEA IgG1 (B)
*P<0.05,**P<0.01vsinfected group;##P<0.01vscontrol group;△P<0.05vspraziquantel group
2.4不同处理组小鼠肝脏中INF-γ、IL-13、TGF-β的表达水平为了进一步阐明白藜芦醇抗日本血吸虫病肝脏纤维化的机制,又检测了与Th1/Th2免疫反应相关,同时又是参与肝脏纤维化发生发展的重要细胞因子INF-γ、IL-13、TGF-β的表达情况。结果如Fig 4所示,感染13周后,感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠肝脏中的INF-γ、IL-13、TGF-β的mRNA表达水平都明显高于健康对照组小鼠(P<0.01)。并且白藜芦醇治疗组肝脏中的INF-γ mRNA表达水平较感染组和吡喹酮治疗组明显增高(P<0.05),但白藜芦醇治疗组肝脏中IL-13、TGF-β的mRNA表达水平明显低于感染组(P<0.01)。另外发现,白藜芦醇治疗组和吡喹酮治疗组小鼠肝脏IL-13、TGF-β的mRNA表达水平之间差异都没有统计学意义(P>0.05)。
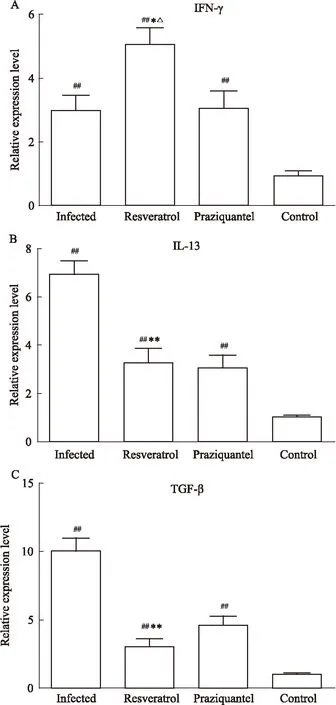
Fig 4 Expression of INF-γ (A),IL-13 (B), TGF-β (C) in livers from different groups
*P<0.05,**P<0.01vsinfected group;##P<0.01vscontrol group;△P<0.05vspraziquantel group
3 讨论
血吸虫病是一种严重危害人类健康的寄生虫病。目前,全世界有78个国家和地区流行血吸虫病,感染者超过2亿[10]。我国主要流行日本血吸虫病,至2014年底全国仍有血吸虫病人11.5万余例[11]。迄今的研究表明,血吸虫病是一种“免疫性”疾病。在血吸虫感染过程中, 虫体的各个发育阶段, 如童虫、成虫和虫卵的抗原成分能够刺激机体, 诱发机体一系列免疫应答及产生相应的病理损害, 这涉及到体液免疫和细胞免疫等诸多因素复杂的反应及调节,其中T淋巴细胞(尤其是Th1和Th2细胞)发挥了极其重要的作用,如Th1细胞通过分泌INF-γ抑制,Th2细胞通过产生IL-13、TGF-β促进肝脏纤维化的形成发展[3]。因此,寻找通过调节免疫应答减轻血吸虫病病理的治疗药物是十分必要的。
目前的常用抗血吸虫药吡喹酮主要是通过有效杀虫和直接对肝脏作用减轻纤维化程度,对CD4+T细胞应答影响不大,因此仍然不能改变纤维化的进程[12]。而近几年的研究发现一种中药化合物白藜芦醇,同样可以明显抑制肺部和酒精性肝纤维化,其机制可能是通过抑制Th17细胞应答发挥抗纤维化的作用[7,13]。白藜芦醇是否同样可以通过调节Th1和Th2细胞应答,从而对血吸虫病发挥抗肝脏纤维化作用?与设想一致,本研究首先发现经白藜芦醇治疗的感染小鼠肝脏的纤维化程度明显减轻,并且效果与吡喹酮没有统计学差异。这提示白藜芦醇也同样具有治疗血吸虫病纤维化的潜能。进一步的免疫细胞检测发现经白藜芦醇治疗后,Th1细胞比例明显増高,而Th2细胞比例则明显下降,可以提示白藜芦醇可以通过上调Th1细胞应答和下调Th2细胞应答,从而有效抑制肝脏纤维化程度。文献报道血吸虫感染过程中,机体内抗SWA- IgG2a和抗SEA-IgG1的水平可以分别反映Th1细胞和Th2细胞的应答情况[14]。检测结果发现,白藜芦醇同样可以上调抗SWA- IgG2a和下调抗SEA-IgG1的表达水平,这个实验表明血吸虫感染过程中白藜芦醇的确是与增强的Th1细胞、减弱的Th2细胞反应存在联系,也进一步佐证我们的推测。
肝脏纤维化的形成主要是由于相关的免疫细胞因子和炎症因子,如INF-γ、IL-13、TGF-β等在肝脏中持续激活肝星状细胞,产生大量细胞外基质沉积在肝脏中[12]。因此,又进一步检测了白藜芦醇治疗后Th1细胞因子INF-γ和Th2细胞因子IL-13、TGF-β在肝脏中的表达情况,结果发现在肝脏中检测到的INF-γ和IL-13、TGF-β的表达水平变化趋势与检测到的Th1细胞和Th2细胞比例变化是相一致的。这个结果充分表明白藜芦醇治疗通过增强Th1细胞应答,上调INF-γ表达,同时通过减弱Th2细胞应答,下调IL-13、TGF-β表达,共同抑制肝脏纤维化程度。研究已经明确在血吸虫感染过程中,血吸虫的成虫抗原(SWA)可诱导巨噬细胞向M1型转化,继而可以有效地增强Th1细胞应答。而在虫卵产生以后,其分泌的可溶性虫卵抗原(SEA)促使巨噬细胞又向M2型巨噬细胞极化,从而上调Th2细胞应答[15-16]。因此,巨噬细胞血吸虫感染不同阶段向M1/M2的极化决定了Th1和Th2细胞的分化。而有课题组也发现,白藜芦醇可以促进LPS刺激的RAW264.7巨噬细胞向M2型极化改变[17],说明白藜芦醇对巨噬细胞的极化有调控作用。这些研究结果提示在血吸虫感染过程中,白藜芦醇可能在巨噬细胞向M1/M2的极化的过程中发挥作用,进而调控了Th1和Th2免疫应答的发生发展,值得今后更深入的研究。在实验中,同样发现吡喹酮治疗后对Th2细胞应答也有所调节,也提示了吡喹酮可能不仅是通过杀虫和直接对肝脏作用发挥抗纤维化作用,也可能是通过调节T细胞免疫应答造成,这也值得进一步的探究。
综上所述,白藜芦醇作为一种重要的中药单体,在临床上已经被证明具有良好的抗氧化和抗炎等作用,本研究发现白藜芦醇还具有免疫调节作用,其通过上调Th1细胞应答,下调Th2细胞应答,从而有效抑制血吸虫病肝脏纤维化程度,但具体的机制还未有深入研究,有待于继续探寻,从而为白藜芦醇的进一步研究和开发利用提供实验依据。
(致谢:本文实验主要是在江苏省现代病原生物学重点实验室和南京中医药大学基础医学院实验室分部完成,在此诚挚感谢对本实验提供帮助的老师和同学!)
[1]Pearce E J, MacDonald A S. The immunobiology of schistosomiasis[J].NatRevImmunol,2002,2(7):499-511.
[2]Wynn T A, Thompson R W, Cheever A W, et al.Immunopathogenesis of schistosomiasis[J].ImmunolRev,2004,2(1):156-67.
[3]王瑜,夏超明. Th1/Th2极化相关因子在血吸虫病肝纤维化发生发展中的作用[J]. 中国血吸虫病防治杂志,2010,22(4):384-7.
[3]Wang Y,Xia C M.Effect of polarization of Th1/Th2 related factors in process of schistosomiasis hepatic fibrosis[J].ChinJSchistoControl,2010,22(4):384-7.
[4]袁霜雪,王东旭,伍秋香,等.白藜芦醇抑制 HCT116 结肠癌细胞增殖与Wnt/β-catenin的关系研究[J].中国药理学通报,2015,31(4):537-41.
[4]Yuan S X,Wang D X,Wu Q X,et al. Study on the relationship between anti-proliferation effect of resveratrol on HCT116 colon cancer cells and Wnt/β-catenin[J].ChinPharmacolBull,2015,31(4):537-41.
[5]邓祖跃,匡荣,朱社敏,等.白藜芦醇对高脂血症大鼠多种抗氧化系统的影响[J]. 中国药理学通报,2013,29(1):147-8.
[5]Deng Z Y,Kuang R,Zhu S M,et al. Effects of resveratrol on multiple anti-oxidant systems in hyperlipidemia rats[J].ChinPharmacolBull,2013,29(1):147-8.
[6]刘顺,李赫宇,赵玲. 白藜芦醇降血尿酸、抗炎作用研究进展[J]. 药物评价研究,2016,39(2):304-7.
[6]Liu S,Li H Y,Zhao L. Research progress on lowering uric acid and anti-inflammation effect of resveratrol[J].DrugEvalRes,2016,39(2):304-7.
[7]黄丙清,邱香,王林枝,等. ALDH2在白藜芦醇改善大鼠慢性酒精性肝损伤中的机制[J]. 华中科技大学学报(医学版),2015,44(1):37-41.
[7]Huang B Q,Qiu X,Wang L Z,et al.Resveratrol protects against chronic alcoholic liver injury by regulating hepatic ALDH2 expression in rats[J].ActaMedUnivSciTechnolHuazhong,2015,44(1):37-41.
[8]陈艳,肖政. 白藜芦醇及其伍用吡喹酮对小鼠日本血吸虫肝纤维化的治疗作用[J]. 中国寄生虫学与寄生虫病杂志,2013,31(5):337-41.
[8]Chen Y, Xiao Z. Therapeutic effect of resveratrol as well as resveratrol combined with praziquantel on the liver fibrosis due to schistosoma japonicum infection in mice[J].ChinJParasitolParasitDis,2013,31(5):337-41.
[9]王冲,华子春. 白藜芦醇的免疫调节作用研究进展[J]. 中国生化药物杂志,2012,33(1):84-7.
[9]Wang C, Hua Z C. Research advances of the immunomodulatory effect of resveratrol[J].ChinJBiochemPharm,2012,33(1):84-7.
[10]Steinauer M L, Blouin M S, Criscione C D. Applying evolutionary genetics to schistosome epidemiology[J].InfectGenetEvol,2010,10(4): 433-43.
[11]雷正龙,张利娟,徐志敏,等. 2014年全国血吸虫病疫情通报[J]. 中国血吸虫病防治杂志,2015,27(6):563-9.
[11]Lei Z L,Zhang L J,Xu Z M,et al. Endemic status of schistosomiasis in People′s Republic of China in 2014[J].ChinJSchistoControl,2015,27(6):563-9.
[12]杨振坤,汪伟,梁幼生. 吡喹酮抗血吸虫的免疫机制研究进展[J]. 中国热带医学,2013,13(2):240-4.
[12]Yang Z K,Wang W,Liang Y S. Advances in research of immune mechanism of praziquantel against schistosomes[J].ChinaTropMed,2013,13(2):240-4.
[13]刘理静,于小华,张平. 白藜芦醇通过TGF-β1/ADAMTS-1信号通路抑制肺纤维化[J]. 中国药理学通报,2013,29(3):425-31.
[13]Liu L J,Yu X H,Zhang P. Resveratrol inhibits pulmonary fibrosis through TGF-β1 /ADAMTS-1 signaling pathway[J].ChinPharmacolBull,2013,29(3):425-31.
[14]Mountford A P, Fisher A, Wilson R A.The profile of IgG1 and IgG2a antibody responses in mice exposed to Schistosoma mansoni[J].ParasiteImmunol,1994,16(10): 521-7.
[15]Xu J, Zhang H, Chen L, et al. Schistosoma japonicum infection induces macrophage polarization[J].JBiomedRes,2014,28(4):299-308.
[16]Zhu J, Xu Z, Chen X, et al. Parasitic antigens alter macrophage polarization during Schistosoma japonicum infection in mice[J].ParasitVectors,2014,7:122.
[17]雷宇鹏,曾振国,胡德泉. 白藜芦醇对脂多糖诱导的巨噬细胞极化改变的影响[J]. 重庆医学,2015,44(19):2593-5.
[17]Lei Y P,Zeng Z G,Hu D Q. Effect of resveratrol on macrophage polarizing phenotype induced by lipopolysaccharide[J].ChongqingMed,2015,44(19):2593-5.
Resveratrol inhibited hepatic fibrosis in mice with schistosomiasis japonica by modulating Th1 and Th2 responses
ZHANG Wei-wei1, ZHU Ji-feng2, WANG Ren1, GAO Ya-nan1, ZHANG Jun-feng1, TONG Shu-juan1
(1.DeptofPathogenandImmunology,NanjingUniversityofTraditionalChineseMedicine,Nanjing210023,China;2.JiangsuKeyLaboratoryofPathogenBiology,NanjingMedicalUniversity,Nanjing211166,China)
AimTo observe the antifibrogenic effect of resveratrol on mice with schistosomiasis japonica and its effect on Th1 and Th2 responses.MethodsForty-five mice infected withS.japonicumcercariae for 3 weeks were randomly divided into three groups named as infection group(A), resveratrol group(B)and praziquantel group(C). Fifteen normal mice were taken as normal control group(D). In the 13th week post-infection, all mice were sacrificed and the liver tissues were removed. Histopathological changes were observed in the liver of all groups. Splenocytes were prepared from spleens of mice withS.japonicuminfection and the proportions of Th1 and Th2 cells in T cells were determined by FACS respectively. RT-PCR was used to detect the relative IFN-γ,IL-13,TGF-β mRNA levels in liver tissue.ResultsAfter treatment, the degrees of liver fibrosis in groups B and C decreased in the 13th week post-infection(P<0.01). Compared to group A, the proportions of Th1 cells in group B significantly increased(P<0.05) and the proportions of Th2 cells in group B decreased significantly(P<0.01). The level of anti-SWA IgG2a in group B was significantly higher(P<0.05), while the anti-SEA IgG1 level in group B was lower(P<0.01) than that in group A. The hepatic expression of IFN-γ mRNA level in group B was higher than that in group A(P<0.05), and IL-13,TGF-β mRNA levels in group B were lower than in group A(P<0.01).ConclusionResveratrol has an antifibrogenic effect through upregulating Th1 cell response and downregulating Th2 cell response in mice infected withSchistosomajaponicum.
Schistosomajaponicum; resveratrol; praziquantel; fibrosis; Th1; Th2
2016-04-17;
2016-05-12
南京中医药大学基础医学院青年科技创新基金项目(No 14JCQN04)
张伟伟(1987-),女,博士,讲师,研究方向:中医药抗感染与免疫机制,E-mail:allien242@126.com;
佟书娟(1966-),女,硕士,教授,硕士生导师,研究方向:中医药抗感染与免疫机制,通讯作者,E-mail: tongshujuan6@sina.com
A
1001-1978(2016)08-1091-07
R-332;R284.1;R322.47;R392.11;R392.12;R532.21;R575.2
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.024.html
——以江苏省为例

