miRNA-143在同型半胱氨酸致血管平滑肌细胞增殖中作用的研究
杨晓玲,郭凤英,马胜超,杨安宁,曹成建,贾月霞,李桂忠,姜怡邓
(1.宁夏医科大学基础医学院,宁夏 银川 750004;2.宁夏医学科学研究所,宁夏 银川 750004)
miRNA-143在同型半胱氨酸致血管平滑肌细胞增殖中作用的研究
杨晓玲1,2,郭凤英1,马胜超1,杨安宁1,曹成建1,贾月霞1,李桂忠1,姜怡邓1
(1.宁夏医科大学基础医学院,宁夏 银川750004;2.宁夏医学科学研究所,宁夏 银川750004)
doi:10.3969/j.issn.1001-1978.2016.08.013
目的探讨miRNA-143在同型半胱氨酸(homocysteine, Hcy)致血管平滑肌细胞增殖中的作用。方法原代培养血管平滑肌细胞(vascular smooth muscle cells, VSMCs),用不同浓度的Hcy和叶酸干预,MTT法检测VSMCs增殖情况,qRT-PCR法检测miR-143的表达,巢式降落式特异性甲基化PCR法分析miR-143启动子区的甲基化状态,分别用miR-143的前体和抑制物转染细胞检测细胞增殖。结果不同浓度的Hcy均可以引起VSMCs增殖活性增强,miR-143的mRNA表达降低,miR-143启动子区甲基化程度升高,以100 μmol·L-1Hcy最为明显(P<0.01),miR-143前体作用VSMCs后,细胞的增殖活性减弱(P<0.01),细胞转染miR-143的抑制物后细胞增殖活性明显增强(P<0.01)。结论miR-143可以抑制VSMCs增殖,其机制可能与miR-143启动子区高甲基化有关。
miRNA-143;同型半胱氨酸;血管平滑肌细胞;增殖;甲基化;表达
同型半胱氨酸(homocysteine, Hcy)是体内甲硫氨酸循环的中间代谢产物,DNA甲基化是Hcy致血管平滑肌细胞(vascular smooth muscle cells, VSMCs)增殖的重要机制[1]。miRNAs作为表观遗传学的组成部分,也参与了VSMCs的增殖过程[2]。VSMCs中含有大量miRNA-143(miR-143),且miR-143在VSMCs由分化表型向增殖表型转化中具有重要的调节作用[3]。但在Hcy导致VSMCs增殖的过程中是否是通过miR-143进行调节的,其机制是什么,尚不清楚。因此,本文拟探讨miR-143在VSMCs增殖中的作用及机制,为临床VSMCs增殖相关疾病的研究提供理论依据。
1 材料与方法
1.1试剂与仪器RPMI 1640培养基、胎牛血清购自Gibco公司;DNA与RNA提取试剂盒、逆转录试剂盒均购自TaKaRa公司;荧光定量PCR试剂盒购自Fermentas公司;DNA甲基化修饰试剂盒购自美国ZYMORESEARCH公司;叶酸和维生素B12购自Sigma公司。引物由上海生工生物工程公司合成。荧光定量PCR仪、电泳仪及凝胶成像系统均是美国Bio-Rad公司产品,酶标仪为美国Thermo公司产品,CO2培养箱是德国Heraeus公司产品。
1.2方法
1.2.1细胞培养与分组参考文献[4]方法原代培养人脐静脉血管平滑肌细胞,实验用第3~8代细胞。将细胞分为对照组、Hcy组(在培养液中加入Hcy,使其终浓度为100 μmol·L-1)、叶酸组(培养液中加入Hcy和叶酸、维生素B12,使Hcy终浓度为100 μmol·L-1,叶酸和维生素B12的终浓度为30 μmol·L-1)。置于37℃、5% CO2培养箱中。
1.2.2MTT法检测VSMCs增殖细胞用0.25%胰蛋白酶消化,再用含15%胎牛血清的RPMI 1640培养液重悬,并按照1×104每孔接种于96孔板中。培养48 h后,加入MTT继续培养4 h,吸去上清,每孔加入150 μL DMSO震荡15 min,用全自动酶标仪于490 nm处检测OD值。
1.2.3荧光定量PCR按照试剂盒说明书提取细胞的总RNA,并将RNA逆转录为cDNA。在NCBI查询各基因的编码序列,采用Premier 5.0设计相关引物。miR-143:5’-GGGTGAGATGAAGCACTGTAGCTC-3’(上游),5’-GCTGTCAACATACGCTACGTAACG-3’(下游);PCR反应条件: 95 ℃预变性5 min,94 ℃变性 20 s,58 ℃退火30 s、72 ℃延伸40 s,共45个循环。目的基因的相对变化结果用2-△△CT法分析。
1.2.4巢式降落式甲基化特异性PCR(nMS-PCR)按DNA提取试剂盒说明书提取各组细胞全基因组DNA,检测OD260/OD280值,分析全基因组DNA 样品纯度和浓度。亚硫酸盐修饰法对全基因组DNA 进行甲基化修饰。nMS-PCR法检测miR-143启动子区DNA 甲基化改变。
分别设计miR-143外引物、甲基化引物(M)及非甲基化引物(U),miR-143外引物上游:5’-AGGAGTTTTAGATTAGTTTGGGTAA-3’, 下游:5’-TTTTAAAACAAAATCTCCCTCTATC-3’;M上游:5’-ATTAGTTAGGTATGGTGGTGTACGT-3’,下游:5’- TTTAAAACAAAATCTCCCTCTATCG-3’;U上游:5’-ATTAGTTAGGTATGGTGGTGTATGT-3’, 下游:5’-TTAAAACAAAATCTCCCTCTATCAC-3’。外引物扩增的反应条件为: 94℃预变性5 min,94℃变性30 s,64℃退火30 s,72℃延伸30 s,20个循环,每个循环降0.5℃ 至56℃,最后72℃继续延伸7 min。然后以外引物的扩增产物为模板,进行内引物扩增。反应条件同外引物。甲基化产物与非甲基化产物均为120 bp,取5μL终产物于2% 的琼脂糖凝胶电泳,分析甲基化条带及非甲基化条带的光密度,按公式计算:甲基化/%=甲基化OD值/(甲基化OD值+非甲基化OD 值)×100%。
1.2.5miRNA转染将VSMCs接种于6孔板,按照脂质体转染试剂说明书的操作步骤,分别将miR-143前体和抑制物转染入VSMCs。48 h后收集细胞,提取细胞的总RNA以及全基因组DNA,检测基因的mRNA表达。
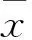
2 结果
2.1Hcy对VSMCs增殖的影响用不同浓度Hcy刺激VSMCs 48 h后,VSMCs的增殖活性分别是对照组的1.21、1.39、1.17、1.03倍,以100 μmol·L-1Hcy组增加最为明显,差异具有显著性(P<0.05);叶酸组中VSMCs的增殖活性与100 μmol·L-1Hcy组相比下降了27%,差异具有显著性(P<0.01),见Fig 1。
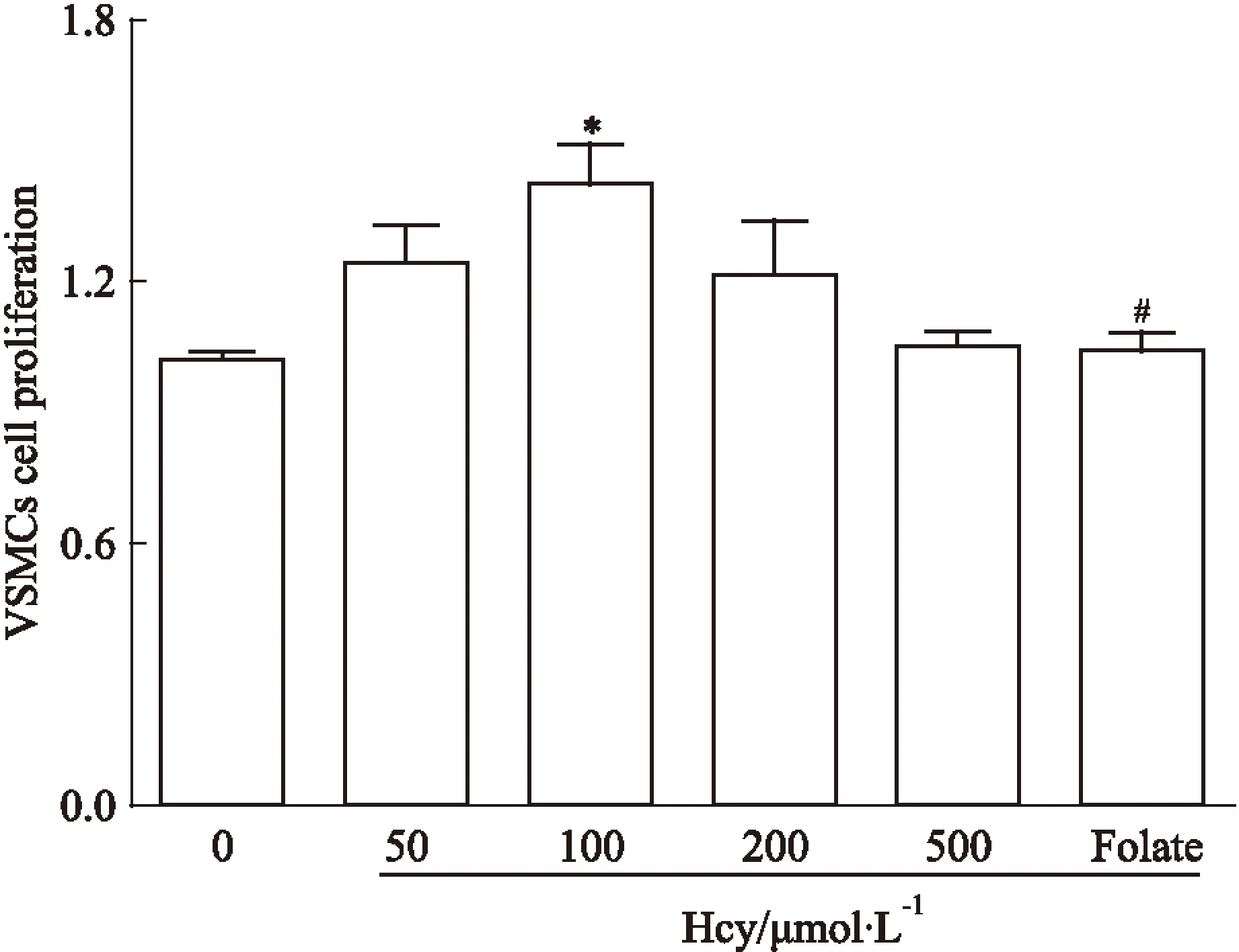
Fig 1 Effect of Hcy on proliferation of vascular smooth muscle cells
*P<0.05vs0 μmol·L-1Hcy;#P<0.05vs100 μmol·L-1Hcy
2.2Hcy对miR-143表达的影响qRT-PCR法检测各组细胞中miR-143的表达,与对照组相比,不同浓度Hcy 刺激VSMCs后,miR-143 表达分别降低了64%、77%、48%、50%,差异具有显著性(P<0.05,P<0.01),其中,以100 μmol·L-1Hcy组浓度降低最为明显。叶酸组miR-143的表达是100 μmol·L-1Hcy组的2.07倍,差异具有显著性(P<0.05),见Fig 2。

Fig 2 Effect of Hcy on miR-143 expression
*P<0.05,**P<0.01vs0 μmol·L-1Hcy;#P<0.05vs100 μmol·L-1Hcy
2.3Hcy对miR-143启动子区甲基化的影响用巢式降落式PCR方法检测miR-143启动子区的甲基化状态。结果显示,不同浓度Hcy 刺激VSMCs后,miR-143启动子区DNA 甲基化水平均升高。100 μmol·L-1Hcy组和200 μmol·L-1Hcy组miR-143甲基化分别是对照组的5.53倍和2.50倍,差异具有显著性(P<0.05,P<0.01)。而叶酸组中miR-143甲基化水平与100 μmol·L-1Hcy比较则下降了61%,差异具有显著性(P<0.05),见Fig 3。
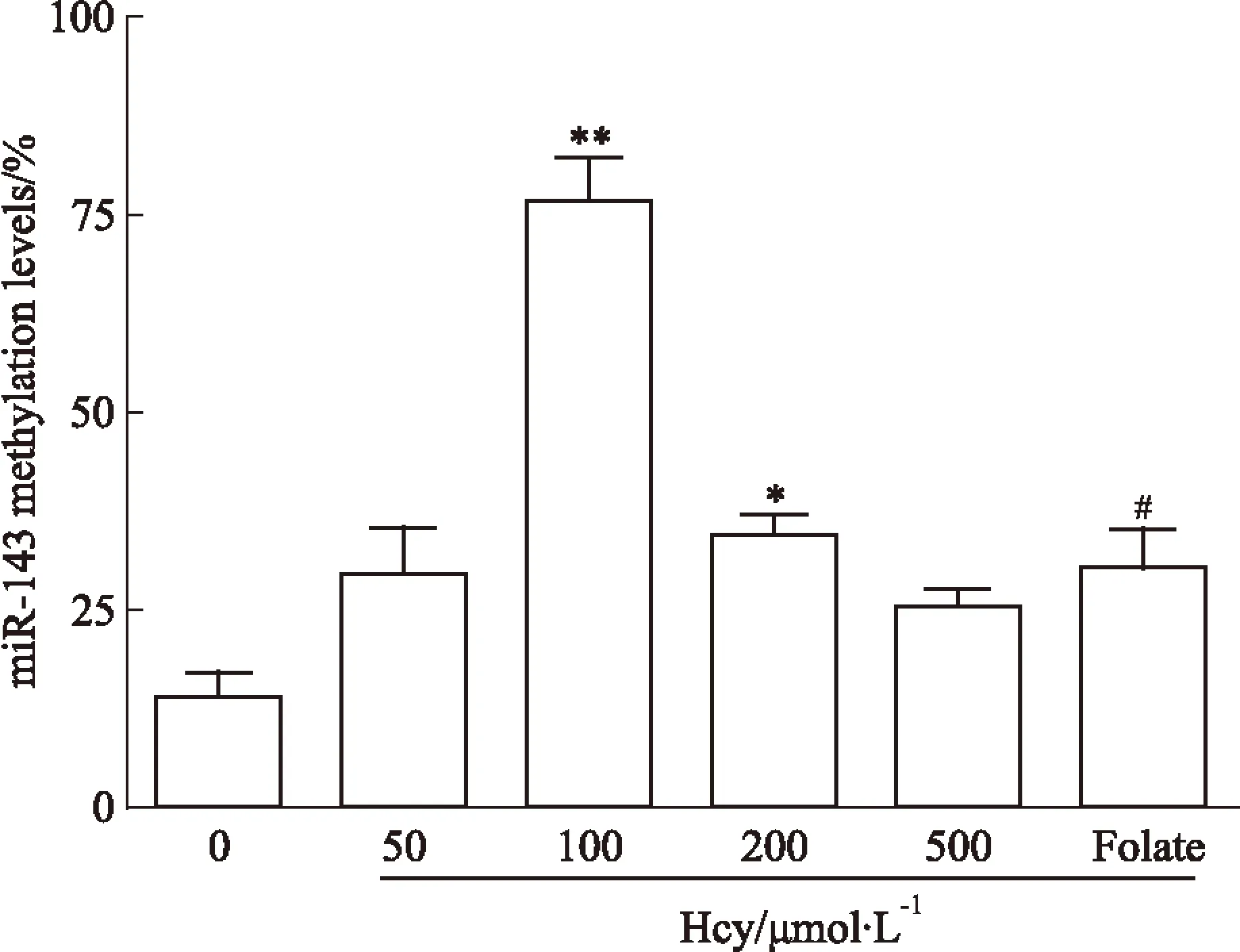
Fig 3 Promoter DNA methylation of miR-143 in VSMCs stimulated with Hcy
*P<0.05,**P<0.01vs0 μmol·L-1Hcy;#P<0.05vs100 μmol·L-1Hcy
2.4miR-143对VSMCs增殖的影响为了确定miR-143在VSMCs增殖中的作用,我们分别将miR-143前体(Pre-miR-143)和miR-143抑制物(miR-143-inhibitor)转染VSMCs。结果显示,Pre-miR-143组miR-143表达明显升高,而miR-143抑制剂组miR-143表达明显降低(P<0.01),见Fig 4A。用MTT法检测了细胞的增殖活性,与对照组相比,过表达miR-143后VSMCs的增殖率降低了46%,而在miR-143 抑制物组中VSMCs的增殖率较正常对照组相比增加了1.29倍,差异均具有显著性(P<0.05),见Fig 4B。当用Hcy与Pre-miR-143共培养VSMCs后,细胞增殖较Hcy组下降了38%,而用miR-143抑制物后,细胞增殖较Hcy组升高了40%(P<0.05)。
3 讨论
高同型半胱氨酸血症(hyperhomocysteinemia, HHcy)是动脉粥样硬化性心血管疾病的危险因素[5-6],其致动脉粥样硬化的机制涉及内皮细胞损伤、VSMCs增殖以及泡沫细胞的形成等[7-9]。本研究用不同浓度的Hcy作用VSMCs后,均可引起VSMCs增殖,以100 μmol·L-1Hcy浓度组最为明显,而用叶酸干预后,VSMCs增殖受到抑制,表明Hcy能够促进VSMCs增殖,与文献报道一致[4],但Hcy导致VSMCs增殖的机制目前尚未完全阐明。
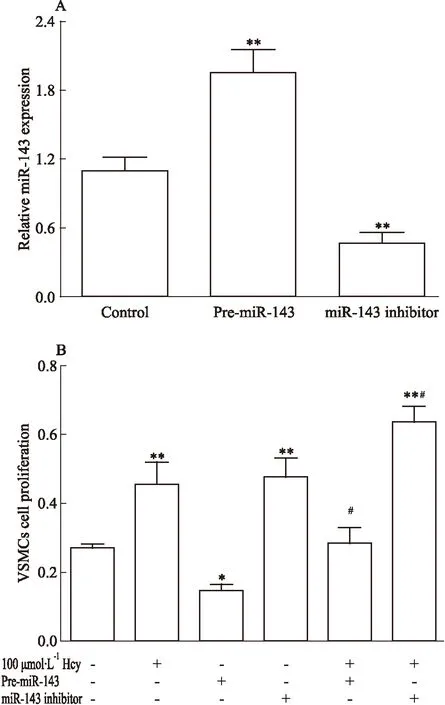
Fig 4 Effect of miR-143 on VSMCs proliferation
*P<0.05,**P<0.01vscontrol;#P<0.05vs100 μmol·L-1Hcy
microRNAs属于非编码RNA,是近年新发现的长度约为21nt的内源性小分子的单链RNA,能够与靶基因mRNA的3’非编码区结合,抑制或降解靶mRNA,导致基因的沉默,可以调控机体的生长、发育及分化等[10]。miRNA在体内的表达具有组织和细胞特异性,血管组织富含多种miRNAs, 其中,miR-143主要表达于血管壁平滑肌细胞层,在维持VSMCs收缩表型,调节VSMCs分化中具有关键作用[3,11]。本研究显示,用不同浓度的Hcy干预VSMCs后,miR-143表达明显降低,以100 μmol·L-1Hcy浓度组最为明显,而用叶酸干预后,miR-143表达有所升高,表明Hcy在促进VSMCs增殖的同时伴有miR-143表达改变,提示miR-143参与了Hcy导致的VSMCs增殖过程。
Hcy是一种含硫的非必需氨基酸,其代谢途径包括转硫过程和转甲基过程[1,12]。轻度的HHcy或低浓度的Hcy作用于细胞后,Hcy的转甲基作用较强,而高浓度的Hcy则主要引起转硫效应。在体内,Hcy参与了甲硫氨酸的循环过程,将甲基转移至DNA、蛋白质等物质发挥生物学效应[13]。DNA甲基化属于表观遗传学的重要内容,也是调控基因表达的重要方式,是指在DNA甲基化转移酶的作用下,影响了体内某些基因的甲基修饰状态而导致基因表达改变,一般而言,DNA甲基化使基因沉默,去甲基化使基因表达激活[14]。本研究结果显示,用不同浓度的Hcy干预VSMCs后,miR-143启动子区的甲基化程度明显升高,用叶酸干预后,miR-143启动子区甲基化程度降低,表明在Hcy导致VSMCs增殖的过程中,miR-143启动子区的甲基化变化程度升高是导致miR-143表达改变的重要机制。为了明确miR-143在Hcy致VSMCs增殖中的作用,我们分别用miR-143的前体和抑制物与Hcy共孵育VSMCs。结果显示,miR-143前体能够抑制VSMCs增殖,而miR-143抑制物能够促进VSMCs增殖。我们的结果提示miR-143是Hcy致VSMCs增殖过程中的关键miRNA,本研究将为VSMCs增殖相关疾病的研究提供新的理论基础。但miR-143启动子区甲基化是受那些因子的调控,需要进一步研究。
(致谢:本实验在宁夏医科大学心脑血管疾病基础研究重点实验室和宁夏医学科学研究所公共实验平台完成。感谢宁夏医学科学研究所赵巍老师给予的指导与帮助。)
[1]Han X B, Zhang H P, Cao C J, et al. Aberrant DNA methylation of the PDGF gene in homocysteine mediated VSMC proliferation and its underlying mechanism[J].MolMedRep, 2014,10(2): 947-54.
[2]刘现梅,曹成建,田珏,等. miR-125b甲基化在同型半胱氨酸促进血管平滑肌细胞增殖中的作用[J].中国药理学通报,2015, 31(7): 1023-7.
[2]Liu X M, Cao C J, Tian J, et al. Role of homocysteine to promoter the vascular smooth muscle cell proliferation by miR-125b methylation[J].ChinPharmacolBull,2015, 31(7): 1023-7.
[3]Liu X, Cheng Y, Yang J, et al. Flank sequences of miR-145/143 and their aberrant expression in vascular disease: mechanism and therapeutic application[J].JAmHeartAssoc,2013,2(6): e000407.
[4]于海娇,马琳娜,徐支芳,等. 同型半胱氨酸对血管平滑肌细胞周期及P27和CyclinA表达的影响[J].中国现代医学杂志,2011, 21(36): 4487-92.
[4]Yu H J, Ma L N, Xu Z F, et al. Effects of homocysteine on cell cycle of vascular smooth muscle cells and the expression of P27 and CyclinA[J].ChinaJModMed,2011, 21(36): 4487-92.
[5]McCully K S. Homocysteine and the pathogenesis of atherosclerosis[J].ExpertRevClinPharmacol,2015, 8(2): 211-9.
[6]Guo H Y, Xu F K, Lyu H T, et al. Hyperhomocysteinemia independently causes and promotes atherosclerosis in LDL receptor-deficient mice[J].JGeriatrCardiol,2014, 11(1): 74-8.
[7]Pushpakumar S, Kundu S, Sen U. Endothelial dysfunction: the link between homocysteine and hydrogen sulfide[J].CurrMedChem,2014, 21(32): 3662-72.
[8]Baszczuk A, Kopczyński Z, Thielemann A. Endothelial dysfunction in patients with primary hypertension and hyperhomocysteinemia[J].PostepyHigMedDosw(Online),2014, 30(68): 91-100.
[9]Zhang D, Chen Y, Xie X, et al. Homocysteine activates vascular smooth muscle cells by DNA demethylation of platelet-derived growth factor in endothelial cells[J].JMolCellCardiol,2012, 53(4): 487-96.
[10]Huang J, Lyu H, Wang J, et al. MicroRNA regulation and therapeutic targeting of survivin in cancer[J].AmJCancerRes,2014, 5(1): 20-31.
[11]Climent M, Quintavalle M, Miragoli M, et al. TGFβ triggers miR-143/145 transfer from smooth muscle cells to endothelial cells, thereby modulating vessel stabilization[J].CircRes,2015, 116(11): 1753-64.
[12]Stam F, Smulders Y M, van Guldener C, et al. Folic acid treatment increases homocysteine remethylation and methionine transmethylation in healthy subjects[J].ClinSci(Lond),2005, 108(5): 449-56.
[13]Yang X, Xu H, Hao Y, et al. Endoplasmic reticulum oxidoreductin 1α mediates hepatic endoplasmic reticulum stress in homocysteine-induced atherosclerosis[J].ActaBiochimBiophysSin(Shanghai),2014, 46(10): 902-10.
[14]赵丽, 焦运, 杨安宁, 等. miR-124及其启动子区DNA甲基化在同型半胱氨酸致动脉粥样硬化中的作用[J]. 生理学报, 2015, 67 (2): 207-13.
[14]Zhao L, Jiao Y, Yang A N, et al. The effect of miR-124 on homocysteine-induced atherosclerosis via promoter region DNA methylation in ApoE(-/-) mice[J].ActaPhysiolSin, 2015, 67(2): 207-13.
Effect of miRNA-143 on homocysteine induced vascular smooth muscle cell proliferation
YANG Xiao-ling1,2,GUO Feng-ying1,MA Sheng-chao1,YANG An-ning1,CAO Cheng-jian1,JIA Yue-xia1,LI Gui-zhong1,JIANG Yi-deng1
(1.BasicMedicalCollegeofNingxiaMedicalUniversity, 2.InstituteofMedicalSciencesofNingxia,Yinchuan750004,China)
AimTo explore the effect of miRNA-143(miR-143) on homocysteine (Hcy) induced-vascular smooth muscle cells(VSMCs) proliferation and the mechanism.MethodsVSMCs were cultured and incubated with Hcy by using primary cultured method. Then, cells were treated with different concentrations of Hcy and folate. VSMCs proliferation was determined with MTT assay, miR-143 was measured by qRT-PCR, and methylation of miR-143 was determined with methylated PCR.ResultsAfter cells were treated with different concentrations of Hcy, the proliferation of VSMCs was significantly increased, mRNA expression of miR-143 was decreased and methylation of miR-143 was increased. The proliferation of VSMCs was significantly decreased when transfected VSMCs with miR-143 precursor, and cell proliferation was increased by using miR-143 inhibitor transfection.ConclusionHypomethylation of miR-143 may inhibit VSMCs proliferation.
miRNA-143; homocysteine; vascular smooth muscle cells; proliferation; methylation; expression
2016-03-24,修回稿日期:2016-04-26
宁夏自然科学基金资助项目(No NZ15209);国家自然科学基金资助项目(No 81360027,81360052,81360053)
杨晓玲(1975-),女,博士,副教授,研究方向:动脉粥样硬化分子机制,E-mail:yangwj04@126.com;
姜怡邓(1974-),男,博士,教授,博士生导师,研究方向:动脉粥样硬化分子机制,通讯作者,E-mail:jwcjyd@163.com
A
1001-1978(2016)08-1097-05
R322.74;R329.24;R342.2;R977.4
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.026.html

