白花前胡有效成分Pd-Ia对急性肺损伤的作用及机制研究
周晓霞,张建情,刘春晓,常 贺,邹 军,薛茂强
(厦门大学基础医学系,福建 厦门 361102)
白花前胡有效成分Pd-Ia对急性肺损伤的作用及机制研究
周晓霞,张建情,刘春晓,常贺,邹军,薛茂强
(厦门大学基础医学系,福建 厦门361102)
doi:10.3969/j.issn.1001-1978.2016.08.026
目的探讨白花前胡甲素(dl-praeruptorin,Pd-Ia)对脂多糖(lipopolysaccharide, LPS)诱导急性肺损伤的作用及其机制。方法气管滴注LPS建立小鼠急性肺损伤模型,Pd-Ia腹腔注射进行干预治疗,应用组织细胞染色及定量PCR、ELISA等方法评估Pd-Ia对急性肺损伤的作用。结果病理形态学显示,Pd-Ia治疗组炎性细胞浸润明显减轻,细胞染色也显示BALF中炎性细胞数量明显减少,定量PCR及ELISA结果显示,Pd-Ia治疗组抑制了肺组织中细胞因子IL-6、TNF-α、IL-1β、趋化因子MIP-1α、MIP-2的表达。结论Pd-Ia治疗可以明显减轻肺部的炎症反应,从而改善肺损伤。
急性呼吸窘迫综合征; 急性肺损伤;脂多糖; 白花前胡甲素;炎症; 细胞因子
急性肺损伤(ALI)是由于肺内外的多种因素如感染、创伤、休克及手术等引起的肺毛细血管炎症损伤,通透性增加,并导致肺水肿和肺不张为病理特性的疾病,进一步发展可以形成急性呼吸窘迫综合征(ARDS)[1-2]。迄今为止,急性肺损伤的治疗中仍无有效的临床药物,高发病率以及高死亡率一直是临床研究的难点。
白花前胡是伞形科植物中药前胡的一种,在临床主要用于止咳平喘、缓解肺动脉高压等[3]。白花前胡甲素(dl-praeruptorin,Pd-Ia)是白花前胡根中提取出来的吡喃香豆素成分,我们课题组前期研究发现,Pd-Ia在内皮细胞中能够有效抑制脂多糖(lipopolysaccharide, LPS)诱导的炎症反应[4]。本研究采用LPS诱导建立小鼠急性肺损伤模型,探讨Pd-Ia对小鼠急性肺损伤的作用[5-10],为急性肺损伤的临床研究与治疗提供新的思路与途径。
1 材料
1.1动物健康的SPF级♂ 129品系小鼠30只,6~8周龄,体质量18~20 g, 购自北京维通利华实验动物技术有限公司,实验动物许可证号为SCXK(京)2002-003,饲养于厦门大学实验动物中心,符合伦理学标准。
1.2药品与试剂LPS 0111:B4(美国Sigma),白花前胡甲素Pd-Ia(日本明治大学奥山辙教授惠赠),TRIzol(美国 Invitrogen 公司),逆转录试剂盒(德国Fermentas公司),SYBR Green PCR混液(日本TaKaRa公司),ELISA试剂盒(中国欣博盛生物科技有限公司),PCR引物(大连宝生物工程公司合成)。
2 方法
2.1急性肺损伤模型制作经过参考多种急性肺损伤模型制作方法[11-14],以及结合本课题实际情况,模型具体制作方法如下:实验动物随机分为3组,每组10只,分别为:对照组、LPS组、LPS+Pd-Ia组,异氟烷麻醉小鼠后鼻腔滴注LPS(1 g·L-1)诱导急性肺损伤,40 μg·g-1,每只50 μL,体积用生理盐水补足,对照组滴注50 μL生理盐水。1 h后根据预实验结果,选取最佳剂量给予Pd-Ia 10 μg·g-1腹腔注射, 对照组注射同等体积生理盐水,24 h后处死小鼠,采集标本进行相关指标检测。
2.2小鼠血液采集灭菌弯镊摘取小鼠眼球后靠近EP管,待血液缓慢滴下500 μL,室温静置30 min后,常温3 000 r·min-1离心20 min, 收集血清用于ELISA检测。
2.3肺泡灌洗液小鼠处死后,仰卧于操作台上,暴露气管,酒精棉球消毒,灌洗分为单侧和双侧,若为单侧灌洗则还需要解剖胸部,结扎一侧气管。滞留针缓慢插入颈部气管1/3处,预冷生理盐水灌洗每次0.5 mL,灌洗2次。生理盐水注入后可停留1 min,之后缓慢回吸2~3次,使灌洗更为充分,回收率>90%。灌洗液转入EP管后立即置于冰上,BALF 1 000 r·min-1、4℃离心10 min,将所得上清12 000 r·min-1再次离心30 min,收集上清-80℃保存用于ELISA检测。第1次离心所得细胞沉淀重悬后制作细胞涂片,吉姆萨染色后显微镜下观察,对BALF中细胞进行分类计数。
2.4病理形态学采集采集小鼠双侧肺叶后,取右肺中叶,放入40 g·L-1多聚甲醛磷酸盐缓冲液中,固定48 h,组织脱水,石蜡包埋后切片,通过HE染色观察肺组织病理学改变。
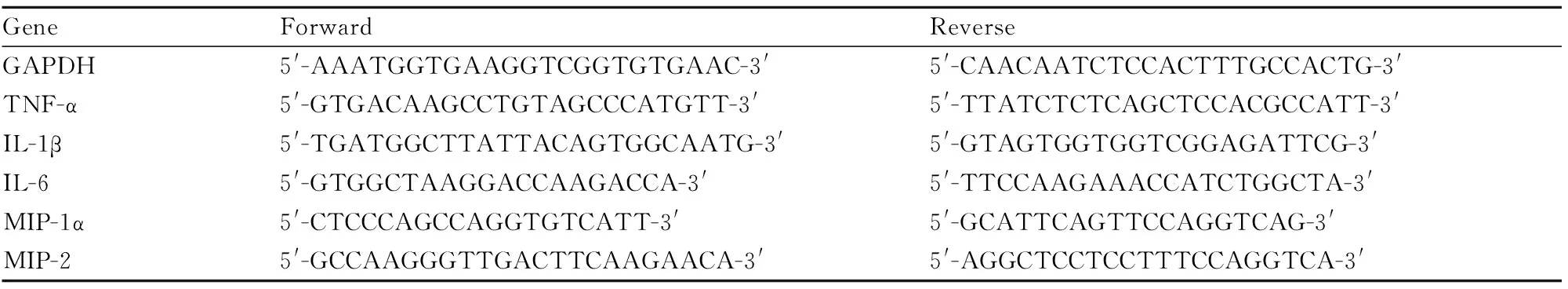
Tab 1 Primer sequence for Real time PCR
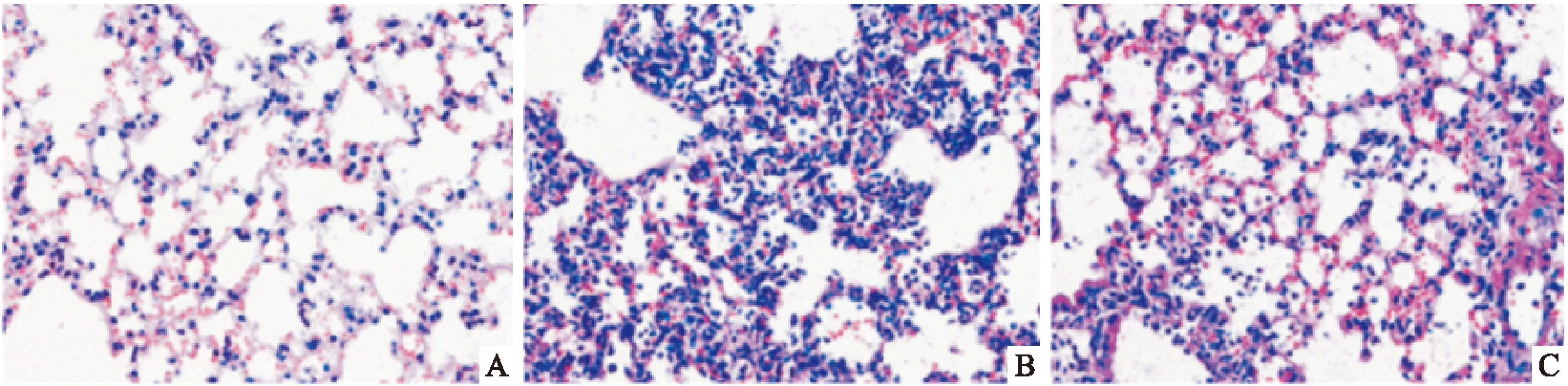
Fig 1 Effects of Pd-Ia on histopathological of lung tissue in different groups
A:Control;B:LPS;C:LPS+Pd-Ia
2.5肺组织中炎性因子检测取左肺叶用DEPC水处理的剪刀剪碎后,取适量组织TRIzol法提取总RNA,取2 μg加1 μL primer-oligo(dT),DEPC水补足12 μL, 65 ℃ 5 min预变性,结束后立即取出促冷,之后依次加入5×Reaction buffer 4 μL; RiboLock RNase Inhibitor 1 μL; 10 mmol·L-1dNTP Mix 2 μL; Revert Aid Reverse Transcriptase 1 μL,进行逆转录合成cDNA, 反应条件为: 42 ℃ 60 min;70℃ 5 min;95 ℃ 5 min;4 ℃保存。
取逆转录产物cDNA,进行Real time PCR,20 μL反应体系:cDNA 1 μL; SYBR Taq酶混合物10 μL; ROX 0.4 μL; Primer F 0.5 μL; Primer R 0.5 μL,灭菌水补足20 μL。反应条件为95 ℃ 1 min预变性;95 ℃ 15 s变性; 60 ℃ 31 s退火,共40个循环, 收集结果后,以GAPDH作为内参,采用相对定量ΔΔCt法分析结果,检测肺组织中炎性因子IL-6、TNF-α、IL-1β及趋化因子MIP-1α、MIP-2表达变化。引物由大连宝生物工程公司合成,具体序列见Tab 1。2.6血清及BALF中细胞因子检测ELSIA试剂盒检测血清及BALF中IL-6、TNF-α含量,按照ELISA说明书操作,测定OD值,计算各细胞因子含量变化。
3 结果
3.1肺组织病理学HE染色对照组肺泡结构清晰,肺泡内未见渗出物,无出血、炎性细胞浸润及水肿,肺泡间隔未出现增厚现象; LPS诱导组可见肺泡结构被严重破坏,出现大面积肺泡融合,并且可见大量的炎性细胞浸润,肺泡间隔明显增宽;与LPS诱导组相比,Pd-Ia组肺泡结构恢复完整,炎性细胞浸润明显减少,肺泡壁未见明显增厚(Fig 1)。
3.2BALF中细胞数目的变化LPS诱导肺部炎症爆发后,肺泡中的细胞种类以及数量出现明显改变,可见对照组的细胞数量较少,大部分为巨噬细胞,LPS组炎性细胞数量明显增加,且大多为中性粒细胞,Pd-Ia治疗后炎性细胞总数明显减少,中性粒细胞及巨噬细胞数量也明显减少(Fig 2)。
3.3肺组织中炎性因子的基因表达变化Real time PCR的结果显示,LPS诱导后,肺组织中细胞因子IL-1β、IL-6、TNF-α以及趋化因子MIP-1α、MIP-2的表达明显增高;而Pd-Ia治疗组明显降低了这些细胞因子的表达,提示Pd-Ia对小鼠肺部炎症损伤有保护作用(Fig 3)。
3.4血浆及BALF中细胞因子的蛋白表达变化ELISA的结果显示,LPS组诱导了血浆以及 BALF 中炎性因子IL-6、TNF-α的表达;Pd-Ia治疗组降低了IL-6与TNF-α的表达,显示了Pd-Ia可以有效抑制LPS诱导的炎症反应(Fig 4)。
4 讨论
ARDS在临床中是急性呼吸衰竭的主要因素,它的主要特点是爆发性的肺部炎症,ALI属于ARDS的早期阶段[1-2]。LPS是革兰阴性菌细胞壁中的一种成分,是造成急性肺损伤的重要因素之一。LPS进入肺组织后可以诱导炎症反应,引起大量的免疫细胞聚集,分泌多种细胞因子,引起肺组织的损伤[15-16]。目前,急性肺损伤尚无有效的药物治疗方案,大多数研究都停留在体外以及动物实验阶段,因此寻找新的药物治疗肺损伤是当前急需解决的问题之一[17-18]。
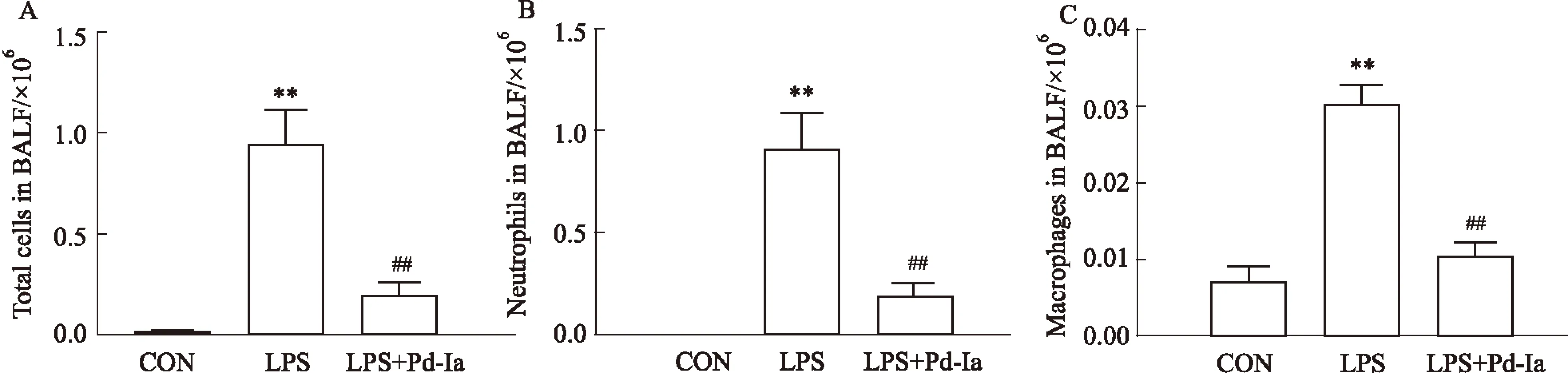
Fig 2 Effects of Pd-Ia on inflammatory cell changes in BALF
A:Effects of Pd-Ia on total cells in BALF; B: Effects of Pd-Ia on neutrophils cells in BALF; C: Effects of Pd-Ia on macrophages cells in BALF.**P<0.01vscontrol;##P<0.01vsLPS
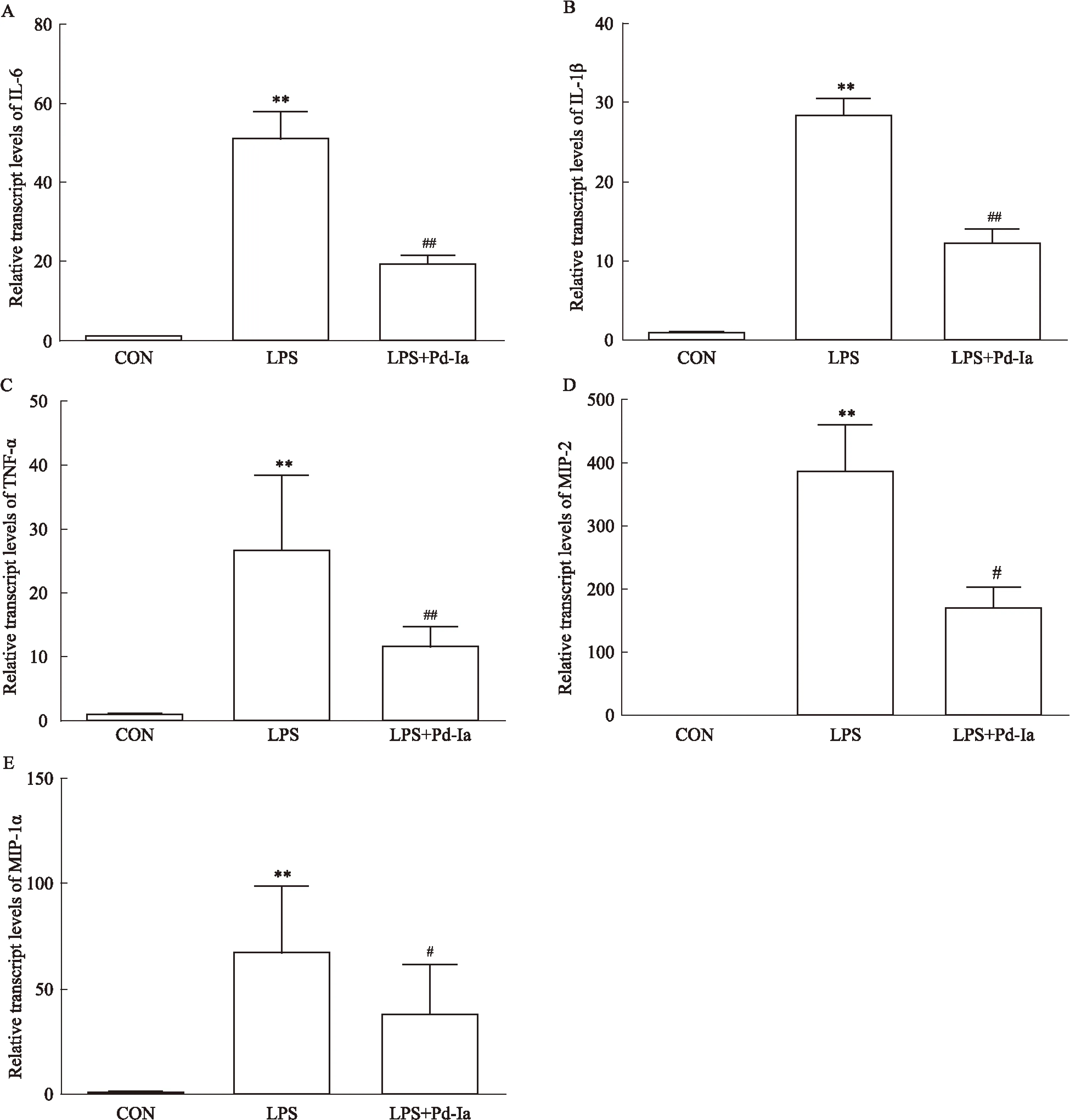
Fig 3Effects of Pd-Ia on mRNA expression of inflammatory cytokines in lung tissue
A:Effect of Pd-Ia on IL-6 mRNA expression;B: Effect of Pd-Ia on IL-1β mRNA expression;C:Effect of Pd-Ia on TNF-α mRNA expression; D:Effect of Pd-Ia on MIP-2 mRNA expression;E:Effect of Pd-Ia on MIP-1α mRNA expression.**P<0.01vscontrol;#P<0.05,##P<0.01vsLPS.
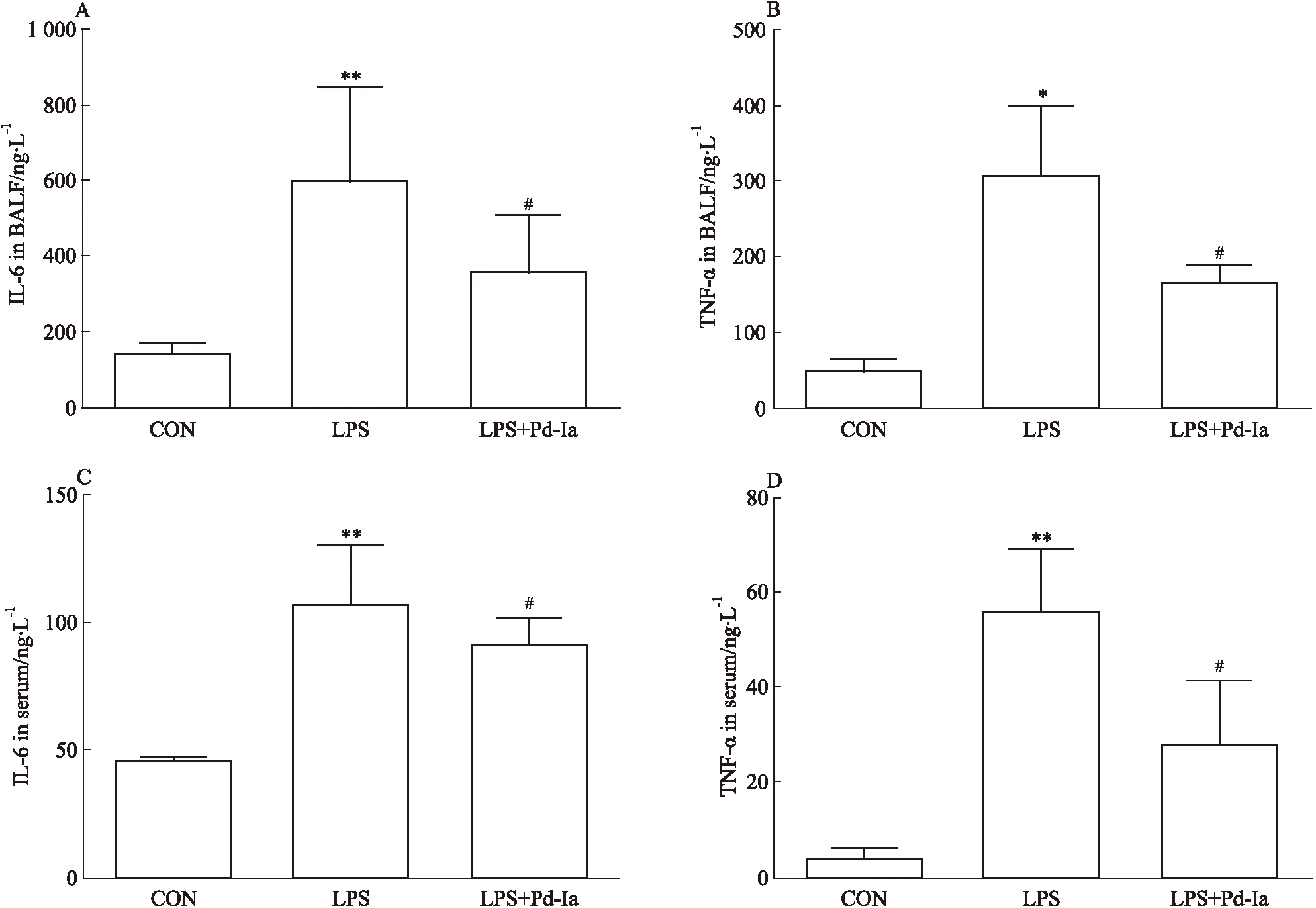
Fig 4 Effect of Pd-Ia on inflammatory cytokine changes in BALF and serum
A: Effect of Pd-Ia on IL-6 expression in BALF; B: Effect of Pd-Ia on TNF-α expression in BALF; C: Effect of Pd-Ia on IL-6 expression in serum; D: Effect of Pd-Ia on TNF-α expression in serum.*P<0.05,**P<0.01vscontrol;#P<0.05vsLPS
白花前胡是伞形科植物,可用于清肺止咳、散风清热、缓解肺动脉高压等,在肺损伤的中医药治疗中具有重要作用[19]。研究发现,在缺血/再灌注心肌损伤以及内皮细胞炎症反应中均发挥较好的抗炎作用[4,20]。目前,Pd-Ia在急性肺损伤中的相关研究较少,作用尚不清楚。本研究通过LPS诱导小鼠急性肺损伤模型,探讨Pd-Ia对急性肺损伤的作用及其机制。
急性肺损伤的发病机制涉及到多种炎性细胞以及炎性反应介质的释放与调节[15-16]。肺部或者外周血中以及其他组织中的中性粒细胞、巨噬细胞的活化是炎症反应的起始[21-23],活化后引起TNF-α以及IL-1β的释放,从而启动炎症的级联反应。这两种细胞因子具有多种功能,活化后不仅可以刺激中性粒细胞及单核巨噬细胞产生多种趋化因子以及其他的炎性介质,如IL-6、MIP-1α、MIP-2等,炎症损伤部位血管内皮细胞中黏附分子表达上调,可以使更多的中性粒细胞黏附聚集在损伤部位,从而加重损伤。因此在本研究中,我们检测了在急性肺损伤模型中Pd-Ia对相关炎性因子表达的影响,结果显示,Pd-Ia能够明显降低IL-6、MIP-2等炎性因子的表达,从而发挥对肺损伤的改善作用。
综上所述,我们发现Pd-Ia对于LPS诱导的急性肺损伤具有一定的治疗作用,其机制可能与抑制相关炎性因子的表达及分泌有关。本文对Pd-Ia在急性肺损伤中的作用只做了初步探讨,进一步探究Pd-Ia对急性肺损伤的作用机制,对于急性肺损伤的临床治疗将具有深远意义。
(致谢:本研究在厦门大学医学院成智楼102实验室完成,感谢邹军副教授指导。)
[1]Caironi P, Langer T, Gattinoni L. Acute lung injury/acute respiratory distress syndrome pathophysiology: what we have learned from computed tomography scanning[J].CurrOpinCritCare, 2008, 14(1): 64-9.
[2]Ware L B. Pathophysiology of acute lung injury and the acute respiratory distress syndrome[J].SeminRespirCritCareMed,2006, 27(4): 337-49.
[3]刘瑛,韩恩凤. 白花前胡对心肺功能的药理作用[J].毒理学杂志,2007,21(4): 328.
[3]Liu Y, Han E F. The pharmacological effects of Bai hua qian hu for cardio-pulmonary function[J] .JToxicol,2007, 21(4): 328.
[4]王焱,杨翠,常贺,等.前胡甲素通过PPARα抑制LPS诱导的内皮细胞的炎症反应[J].中国药理学通报,2012,28(11): 1594-7.
[4]Wang Y, Yang C, Chang H, et al.Effects of Pd-Ia on LPS-induced inflammation in endotheliocyte via PPAR-α[J] .ChinPharmacolBull,2012, 28(11): 1594-7.
[5]Jiang W, Luo F, Lu Q, et al. The protective effect of Trillin LPS-induced acute lung injury by the regulations of inflammation and oxidative state[J].ChemBiolInteract,2016, 243:127-34.
[6]Kim J, Jeong S W, Quan H, et al. Effect of curcumin(Curcuma longa extract) on LPS-induced acute lung injury is mediated by the activation of AMPK[J].JAnesth,2016, 30(1): 100-8.
[7]刘丹丹,曹纲, 张琦,等. 三叶青黄酮经p38MAPK和NF-κB途径抑制老年小鼠急性肺损伤[J].中国药理学通报,2015,31(12): 1725-30.
[7]Liu D D, Cao G, Zhang Q, et al.Tetrastigma hemsleyanum Diels et Gilg flavone inhibits lung linjury in aged mice through p38MAPK and NF-κB pathway[J] .ChinPharmacolBull,2015, 31(12): 1725-30.
[8]刘焕龙,朱忠宁,江平,等. Apelin/APJ系统在脂多糖诱导大鼠肺微血管内皮细胞损伤中的变化及其作用研究[J].中国药理学通报,2015,31(8):1152-8.
[8]Liu H L, Zhu Z N, Jiang P, et al.The changes and effects of Apelin/APJ system in rat pulmonary microvascular endothelial cells injury induced by LPS[J] .ChinPharmacolBull,2015, 31(8): 1152-8.
[9]王宏,刘刚,符炜,等. Nrf2在丙泊酚抑制内毒素性急性肺损伤中的作用[J].中国药理学通报,2013, 29(9):1286-90.
[9]Wang H, Liu G, Fu W,et al. The role of Nrf2 on propofol inhibits acute lung linjury induced by endotoxin[J] .ChinPharmacolBull,2013, 29(9):1286-90.
[10]徐秀娟,孙耕耘,尤青海,等. cAMP反应元件结合蛋白在LPS致肺微血管内皮细胞损伤过程中的作用[J].中国药理学通报,2014,30(7):965-9.
[10]Xu X J, Sun G Y, You Q H, et al. Effects of cAMP responsive element binding protein in pulmonary microvascular endothelial cells injury induced by LPS[J] .ChinPharmacolBull,2014, 30(7):965-9.
[11]Niu N, Li B, Hu Y, et al. Protective effects of scoparone against lipopolysaccharide-induced acute lung injury[J].IntImmunopharmacol,2014, 23(1): 127-33.
[12]Tang Y, Chen Y, Chu Z, et al. Protective effect of cryptotanshinone on lipopolysaccharide-induced acute lung injury in mice[J].EurJPharmacol,2014, 723: 494-500.
[13]Yang H, Li Y, Huo P, et al. Protective effect of Jolkinolide B on LPS-induced mouse acute lung injury[J].IntImmunopharmacol,2015, 26(1): 119-24.
[14]黄建华, 李理,袁伟锋,等. 脂多糖经不同给药方式致急性肺损伤小鼠模型的比较研究[J].中国呼吸与危重监护杂志,2013, 12(3): 264-8.
[14]Huang J H, Li L, Yuan W F, et al. The comparative study on different method of dosing lipopolysaccharide to induce acute lung injury model in mice[J] .ChinJResCritCareMed,2013, 12(3): 264-8.
[15]Deng J C, Standiford T J. Growth factors and cytokines in acute lung injury[J].ComprPhysiol,2011, 1(1): 81-104.
[16]张青, 李 琦,毛宝龄, 等. 内毒素致伤大鼠肺组织促炎与抗炎细胞因子mRNA表达的时相性研究[J]. 中国危重病急救医学, 2004, 16(10):585-8.
[16]Zhang Q, Li Q, Mao B L, et al. Studies on the expression of mRNA of anti-and pro-inflammatory cytokines in acute lung injury induced by lipopolysaccharide in rat[J].ChinCritCareMed,2004, 16(10): 585-8.
[17]Fang C L, Wen C J, Aljuffali I A, et al. Passive targeting of phosphatiosomes increases rolipram delivery to the lungs for treatment of acute lung injury: an animal study[J].JControlRelease,2015, 213: 69-78.
[18]Yang C, Jiang J, Yang X, et al. Stem/progenitor cells in endogenous repairing responses: new toolbox for the treatment of acute lung injury[J].JTranslatMed,2016, 14(1): 47.
[19]林冬杰. 白花前胡甲素的药理作用研究进展[J].中国中医药现代远程教育,2008, 6(7): 797-8.
[19]Lin D J.Progress in stuy onpharmacological effects of Pd-Ia[J] .ChinMedModDistanceEducChina,2008,6(7): 797-8.
[20]常天辉,章新华,邢军,等. 白花前胡及前胡甲素对心肌缺血/再灌注大鼠IL-6水平及Fas、bax、bcl-2蛋白表达的影响[J].中国医科大学学报,2003, 32(1): 1-6.
[20]Chang T H, Zhang X H, Xing J, et al. Effects of Pd-Ia on interleukin-6 level and Fas, bax, bcl-2 protein expression in ischemia-reperfusion myocardium[J] .JChinMedUniv,2003, 32(1):1-6.
[21]Bao S, Zou Y, Wang B, et al. Ginsenoside Rg1 improves lipopolysaccharide-induced acute lung injury by inhibiting inflammatory responses and modulating infiltration of M2 macrophages[J].IntImmunopharmacol,2015, 28(1): 429-34.
[22]Hu R, Chen Z F, Yan J, et al. Endoplasmic reticulum stress of neutrophils is required for ischemia/reperfusion-induced acute lung injury[J].JImmunol,2015, 195(10): 4802-9.
[23]Park D W, Jiang S, Liu Y, et al. GSK3beta-dependent inhibition of AMPK potentiates activation of neutrophils and macrophages and enhances severity of acute lung injury[J].AmJPhysiolLungCellMolPhysiol,2014, 307(10): L735-45.
Protective effect of Pd-Ia on LPS-induced mouse acute lung injury and its mechanism
ZHOU Xiao-xia, ZHANG Jian-qing,LIU Chun-xiao, CHANG He,ZOU Jun,XUE Mao-qiang
(DeptofBasicMedicalCollege,XiamenUniversity,XiamenFujian361102,China)
AimTo explore the protective effects of dl-praeruptorin(Pd-Ia) against acute lung injury induced by lipopolysaccharide(LPS).MethodsAcute lung injury model was induced by intranasal instillation LPS, and Pd-Ia was administered by intraperitoneal injection after 1 h of LPS exposure. Lung tissue samples were collected after 24 h of LPS administration to investigate the role of Pd-Ia in acute lung injury.ResultsPathomorpholoy showed a marked improvement of inflammatory cell infiltration in Pd-Ia treated group, cellular staining also indicated a marked decrease of inflammatory cells in BALF, and quantitative PCR and ELISA revealed a significant inhibition of cytokine IL-6,TNF-α,IL-1β, and chemokine MIP-1α,MIP-2 expression. Pd-Ia attenuated LPS-induced histological severities and TNF-α, IL-6, IL-1β,MIP-1α and MIP-2 production. ConclusionPd-Ia can alleviate the lung injury by ameliorating inflammation in lung.
ARDS; ALI; LPS; Pd-Ia; inflammation; cytokines
2016-03-01,
2016-04-07
国家自然科学基金资助项目(No 81270294);福建省高校省级自然科学基金项目(No 2013J01357)
周晓霞(1990-),女,硕士,研究方向:药理学,E-mail:zxx9012@sina.cn;
邹军(1971-),男,博士,副教授,研究方向:药理学,通讯作者,E-mail:zoujun@xmu.edu.cn;
A
1001-1978(2016)08-1165-06
R-332;R284.1;R322.35;R392.12;R563.022;R563.053.1
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.052.html
薛茂强(1964-),男,博士,教授,研究方向:药理学,通讯作者,E-mail:xmq8887@xmu.edu.cn

