慢病毒介导的GHSR1a shRNA对结直肠癌细胞生长的影响*
刘 岸, 黄成钢, 徐 佳
(岳阳市第一人民医院胃肠外科,湖南岳阳414000)
慢病毒介导的GHSR1a shRNA对结直肠癌细胞生长的影响*
刘 岸△, 黄成钢, 徐 佳
(岳阳市第一人民医院胃肠外科,湖南岳阳414000)
目的:构建生长激素促泌素受体1a(growth hormone secretagogue receptor 1a,GHSR1a)基因短发夹干扰RNA(short hairpin RNA,shRNA)慢病毒载体,感染人结直肠癌细胞系SW480,观察沉默GHSR1a基因对SW480细胞生长的影响,并探讨其作用机制。方法:构建特异性靶向GHSR1a基因的shRNA慢病毒表达载体和阴性对照序列慢病毒载体;建立稳定表达GHSR1a shRNA的SW480细胞、阴性对照细胞(NC)及空白对照细胞(BC),RTPCR检测GHSR1a的mRNA在细胞中的表达;通过Western blot技术检测细胞中GHSR1a、ghrelin、PTEN、p-AKT及p53蛋白的水平;CCK-8法测定GHSR1a shRNA对SW480细胞活力的影响;建立裸鼠结直肠癌皮下移植瘤模型,实验结束后处死裸鼠并测量各组裸鼠肿瘤重量;免疫组织化学法检测肿瘤组织中Ki-67和PTEN的阳性表达。结果:在体外实验中,GHSR1a在人结直肠癌细胞株Caco-2及SW480中的表达明显高于人正常结肠上皮细胞株NCM460的表达;成功建立了稳定表达GHSR1a shRNA的SW480细胞;GHSR1a shRNA能明显抑制SW480细胞GHSR1a mRNA及蛋白的表达;沉默GHSR1a基因后SW480细胞活力明显减弱;与NC组相比较,GHSR1a shRNA组细胞中PTEN mRNA及蛋白水平上调,AKT磷酸化被抑制,p53的表达明显增加;在体内实验中,与NC组相比较,GHSR1a shRNA组裸鼠结直肠癌皮下移植瘤重量明显减轻,同时Ki-67表达下调,PTEN表达上调。结论:慢病毒介导的GHSR1a shRNA对体内、外人结肠癌细胞的生长有明显抑制作用,该作用可能通过上调PTEN及其下游PI3K/AKT通路实现。
结直肠癌;Ghrelin;生长激素促泌素受体1a;PTEN
Ghrelin作为一种主要由胃肠道黏膜细胞分泌的生长激素促泌剂受体的内源性配体,其在控制胃酸分泌、进食和新陈代谢等生理和病理生理活动中发挥重要调控作用[1-2]。研究表明,ghrelin基于生长激素促泌素受体(growth hormone secretagogue receptors,GHSRs)而发挥调控作用,目前已知的GHSRs有GHSR1a和GHSR1b两个亚型,GHSR1a主要分布在血管内皮细胞、心肌细胞和单核细胞中[3-4]。近年来报道称ghrelin/GHSRs生物学轴不仅调控正常细胞生长和分化,同时与食管癌[5]、胃癌[6]和肺癌[7]等多种恶性肿瘤细胞生长和转移等恶性生物学行为关系密切。Waseem等[8]报道使用GHSR1a拮抗剂可明显抑制结肠癌细胞侵袭,但GHSR1a在结直肠癌中的作用机制仍待进一步研究。为此,本研究应用RNA干扰技术,构建靶向GHSR1a基因的shRNA慢病毒表达载体,感染至人结直肠癌SW480细胞中,观察沉默GHSR1a基因对体内外结肠癌细胞生长的作用,并进一步探讨其作用机制。
材料和方法
1 试剂
胎牛血清(fetal bovine serum,FBS)、含EDTA胰酶和高糖DMEM培养基购自Gibco;TRIzol试剂、Lipofectamine 2000、Opti-MEM培养基和抗生素杀稻瘟菌素S购自Invitrogen;逆转录试剂盒和细胞蛋白提取试剂盒购自Fermentas;RT-PCR试剂盒购自TaKa-Ra;慢病毒载体系统pLenR-GPH vector由上海吉凯基因技术有限公司提供;限制性内切酶、T4DNA连接酶购自NEB;质粒提取试剂盒和DNA凝胶回收试剂盒购自Qiagen;GHSR1a、PTEN和GAPDH的上、下游引物由上海生工生物工程技术服务有限公司合成;聚凝胺购自Sigma;CCK-8试剂盒购自Dojindo;细胞周期检测试剂盒、Annexin V/PI凋亡检测试剂盒、HRP标记的山羊抗兔和山羊抗小鼠IgG及ABC免疫组化检测试剂盒购自南京凯基生物科技发展有限公司;化学发光试剂和Ki-67鼠抗人单克隆抗体购自碧云天生物技术研究所;GHSR1a兔抗人多克隆抗体、ghrelin小鼠抗人单克隆抗体、PTEN兔抗人多克隆抗体、p-AKT兔抗人多克隆抗体、p53兔抗人单克隆抗体和β-actin小鼠抗人单克隆抗体购自Epitomics。
2 细胞培养和实验动物
人胚肾细胞株HEK-293T、人直肠癌高分化腺癌细胞株Caco-2、低分化腺癌细胞株SW480和人正常结肠上皮细胞株NCM460均购自ATCC,所有细胞均培育于含10%胎牛血清的DMEM培养基中,培养液含1×105U/L青霉素、100 mg/L链霉素和1%谷氨酸盐,置于含5%CO2、37℃培养箱内常规培养,当细胞融合成80%~90%时以胰蛋白酶消化并传代,取对数生长期细胞为实验对象。24只4~5周龄雌性BALB/c-nu/nu品系裸鼠购自北京维通利华公司,体重(18.4±0.7)g,生产许可证编号为SCXK(京) 2012-0001,饲养于湘雅医学院动物实验中心无特定病原体级实验室。
3 实验方法
3.1 设计干扰序列及阴性对照序列 针对已经公布的GHSR1a基因序列(NM-198407),设计针对人GHSR1a基因的干扰 RNA序列(GHSR1a shRNA),正义链序列为 5'-TGAGAAAGCTCTCCACTCTGTTCAAGAGACAGAGTGGAGAGCTTTCTCTTTTTTC-3',反义链序列为5'-ACTCTTTCGAGAGGTGAGACAAGTTCTCTGTCTCACCTCTCGAAAGAGAAAAAAGAGCT-3'。同时设计1条阴性对照(negative control,NC)序列(NC shRNA),正义链序列为5'-TAACTAGTAACGGCTGCTCCTTCAAGAGAGGAGCAGCCGTTACTAGTTTTTTTTC-3',反义链序列为 5'-ATTGATCATTGCCGACGAGGAAGTTCTCTCCTCGTCGGCAATGATCAAAAAAAAGAGCT-3',并通过BLAST检索验证该序列不对任何基因起干扰效应。所有shRNA由上海英骏生物技术有限公司合成。
3.2 构建和鉴定慢病毒表达载体 在干扰RNA序列正义链及反义链的5'端分别加上AgeⅠ和EcoRⅠ的酶切位点,应用限制性内切酶AgeⅠ和EcoRⅠ双酶切空载体PLLU2G与稀释和退火(退火反应条件为95℃10 min,75℃10 min,55℃10 min,35℃10 min,15℃ 10 min)后的 GHSR1a shRNA及 NC shRNA在T4 DNA连接酶作用下进行连接反应,转染新鲜大肠杆菌感受态细胞DH5α并挑选阳性重组克隆,经北京华大基因研究中心测序检测证实与GHSR1a cDNA序列一致。
3.3 HEK-293T细胞感染 取对数生长期的HEK-293T细胞,将5×106个细胞接种于培养皿中,放置培养箱培养24 h后去除培养液,加入5 mL Opti-MEM培养液。在一支离心管中加入20 μg重组干扰质粒pLenR-GPH(表达绿色荧光蛋白)或20 μg阴性对照质粒,分别加入Opti-MEM培养液中并混匀,调整溶液体积为2.5 mL。在另一支离心管中加入100μL Lipofectamine 2000,加入2.4 mL Opti-MEM培养液混匀,将上述质粒溶液和Lipofectamine 2000稀释液混合并制备成质粒脂质体复合物,置室温20 min。将3 mL质粒脂质体复合物转移至HEK-293T细胞的培养皿培养8 h,更换含10%胎牛血清的DMEM培养液后继续培养48 h,收集上清液,离心并过滤后分装,使用逐孔稀释滴度测定法测定病毒滴度后保存于-80℃。
3.4 慢病毒感染SW480细胞 将SW480细胞接种于6孔板内,每孔5×104个细胞,放置培养箱培养24 h后将细胞分为空白对照(blank control,BC)组、阴性对照(negative control,NC)组和GHSR1a shRNA感染组,NC组和GHSR1a shRNA感染组细胞中分别加入含8 mg/L聚凝胺的2种稀释后病毒液1 mL,病毒液感染复数(multiplicity of infection,MOI)为5,将病毒液感染细胞12 h后弃去培养基,并加入含有10%胎牛血清的DMEM培养基,在荧光显微镜下观察绿色荧光蛋白荧光的慢病毒感染细胞,流式细胞仪检测感染效率。将感染后SW480细胞加入含杀稻瘟菌素(8 μg/L)的选择性培养基进行筛选,2周后可见抗性克隆长出,取单细胞克隆转入6孔板中继续培养,1个月后可获得稳定抑制GHSR1a表达的SW480细胞。
3.5 CCK-8法检测细胞活力 将感染后培养24 h 的SW480细胞,用含10%胎牛血清的DMEM培养基制备单细胞悬液,以每孔5×103个细胞接种于96孔培养板中。细胞贴壁添加或不添加ghrelin(1 000 nmol/L)后放置培养箱培养72 h,每组设5个复孔,同时设置空白调零组(不加细胞,加入等量的PBS)。培养结束前1 h,各孔加入CCK-8溶液0.01 mL后继续培养1 h,选择酶标仪波长为490 nm,测量吸光度值(A490)。细胞存活率 (%)=(实验组A490值-空白调零组A490值)/(空白对照组A490值-空白调零组A490值)×100%。
3.6 Western blot检测细胞中GHSR1a蛋白的表达依照细胞蛋白提取试剂盒的操作说明书提取对数生长期Caco-2、SW480和NCM460细胞蛋白质。经Bradford法测量蛋白浓度后取30 μg样品,加入上样缓冲液混匀后置于100℃水浴中孵育8 min。以8%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,用半干电转移法将分离的蛋白转移到PVDF膜上,加入5%脱脂奶粉于4℃下孵育过夜,洗膜后加入相应I抗,于4℃下孵育过夜,取出洗膜后,再分别加入用封闭液稀释为1∶2 000的 II抗(HRP标记的山羊抗兔或山羊抗小鼠IgG)室温孵育1 h,加入化学发光试剂后经X线胶片曝光、显影和定影。使用Quantity One 4.6.2(Bio-Rad)软件扫描胶片,分析各蛋白条带灰度值,以GHSR1a蛋白条带灰度值与内参β-actin蛋白条带灰度值的比值表示GHSR1a蛋白的相对表达水平。
3.7 RT-PCR检测SW480细胞中GHSR1a和PTEN 的mRNA表达 用TRIzol试剂提取总RNA,按说明书操作。总RNA经紫外分光光度计测定260 nm与280 nm处光密度比值(A260/A280)为1.9~2.1。每份样品中取3 μg RNA进行逆转录合成cDNA,然后取1 μL cDNA进行PCR扩增。用引物设计软件primer3设计特异性引物。GHSR1a的上游引物为5'-GGAGTTCATTCAGATGGGAAGAC-3',下游引物为5'-TTCACCGCATCGAAGACCGA-3'(产物为287 bp); PTEN的上游引物为5'-CGCCCGAATTCAGATGGGAGCAA-3',下 游 引 物 为 5'-TCGACCGCATC GAAAGACCA-3'(产物为235 bp);GAPDH的上游引物为5'-GTGGC ATCCACGAAACTAC-3',下游引物为5'-GGACTCGTCATACTCCTGCT-3'(产物为123 bp)。反应在25 μL体系中进行,反应条件为50℃ 30 min;94℃ 1 min;57℃ 1 min,72℃ 7 min。扩增产物在1.5%琼脂糖凝胶上电泳,用Bio-Rad Gel凝胶图像分析系统扫描分析,以GAPDH作为内参照,分析目的基因mRNA的相对表达水平。
3.8 制备裸鼠结直肠癌皮下移植瘤模型及分组
取对数生长期的空白对照组、阴性对照组和感染组SW480细胞,用不含血清的DMEM培养基调整密度为5×109/L,裸鼠皮肤消毒后,将100 μL上述细胞悬液注射至裸鼠左腋窝皮下,每组8只,接种肿瘤后裸鼠置于SPF环境下饲养。实验第40天时处死裸鼠,剥离裸鼠皮下肿瘤标本后称重。
3.9 免疫组织化学法(immunohistochemistry,IHC)检测Ki-67和PTEN的表达 所有标本经甲醛固定、石蜡包埋、5 μm切片后采用SP染色法,阴性对照以PBS代替I抗,表达阴性。Ki-67表达结果判定参考Kunnumakkara等[9]的方法,在低倍镜(×100)下随机选择20个视野,计数染色阳性细胞所占比例。同时在低倍镜下随机选择20个视野,用Image-Pro Plus 6.0图像处理软件进行分析PTEN的表达强度。
4 统计学处理
采用SPSS 13.0统计软件进行统计分析,数据均以均数±标准差(mean±SD)表示,总体及总体中两样本均数之间比较采用单因素方差分析,各组均数间的两两比较用SNK-q法,以P<0.05为差异有统计学意义。
结果
1 GHSR1a在正常结肠上皮细胞及结直肠癌细胞系中的表达
如图1所示,ghrelin和GHSR1a在人正常结肠上皮细胞系NCM460中的表达量极低,而在人结直肠癌细胞系Caco-2和SW480中表达明显升高,差异有统计学显著性(P<0.05);另外,SW480细胞中的ghrelin和GHSR1a的表达量显著高于Caco-2细胞(P<0.05),于是选择ghrelin和GHSR1a表达量较高的SW480细胞进行后续实验。
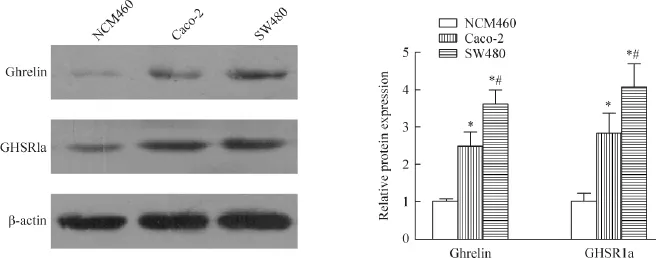
Figure 1.The levels of ghrelin and GHSR1a were significantly higher in malignant Caco-2 and SW480 cells than those in normal human colonocytes.Mean±SD.n=3.*P<0.05 vs NCM460 group;#P<0.05 vs Caco-2 group.图1 Western blot检测ghrelin和GHSR1a在人正常结肠上皮NCM460细胞和人结直肠癌Caco-2和SW480细胞中的表达
2 建立稳定表达GHSR1a shRNA的SW480细胞株
沉默GHSR1a基因的SW480细胞GHSR1a蛋白及mRNA表达较BC组和NC组明显下调,差异均有统计学显著性(P<0.05),其中GHSR1a mRNA的抑制率达71.5%,蛋白抑制率达83.2%,见图2。
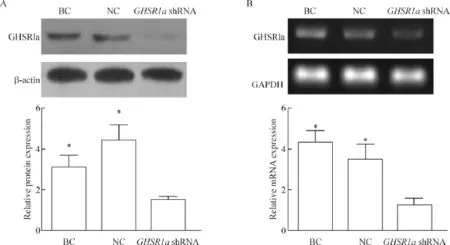
Figure 2.The production of stable GHSR1a knockdown cells.A:GHSR1a protein was assayed by Western blot analysis;B:GHSR1a mRNA level in SW480 cells was detected by RT-PCR.BC:blank control;NC:negative control.Mean±SD.n=3.*P<0.05 vs GHSR1a shRNA group.图2 用Western blot和RT-PCR分别检测SW480细胞中GHSR1a的蛋白和mRNA的表达水平
3 沉默GHSR1a基因对SW480细胞增殖的影响
如图3所示,细胞经培养72 h后,GHSR1a shRNA组细胞增殖率为(161.6±20.8)%,与BC组或NC组比较,差异均有统计学显著性(P<0.05);各组细胞经外源性ghrelin(1 μmol/L)作用72 h后,BC组和NC组的细胞存活率分别为(128.6±17.2)%和(133.5±15.4)%,与GHSR1a shRNA组相比较,差异有统计学显著性(P<0.05)。
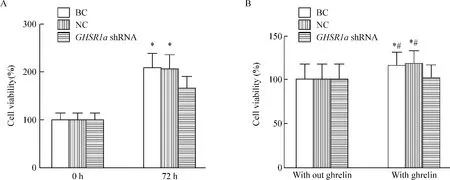
Figure 3.The effect of GHSR1a shRNA on the viability of SW480 cells.A:SW480 cells were treated with culture medium(BC group),negative control(NC group)and GHSR1a shRNA were monitored for 72 h,and the cell viability was measured by CCK-8 assay;B:the effect of exogenous ghrelin on SW480 cell viability.Mean±SD.n=3.*P<0.05 vs GHSR1a shRNA group;#P<0.05 vs the same group without ghrelin.图3 CCK-8法检测GHSR1a shRNA对SW480细胞活力的影响
4 GHSR1a shRNA上调 PTEN蛋白同时抑制PI3K/AKT通路
Western blot检测结果表明,感染GHSR1a shRNA对SW480细胞中ghrelin蛋白的表达无明显影响,但PTEN和p53蛋白的表达明显上调,同时AKT的磷酸化水平显著下调,与BC组或NC组相比较,差异均有统计学显著性(P<0.05);另外,应用RTPCR检测PTEN的mRNA水平结果显示,与NC组相比较,GHSR1a shRNA组中PTEN的mRNA水平上调约1.8倍,差异有统计学显著性(P<0.05),见图4。
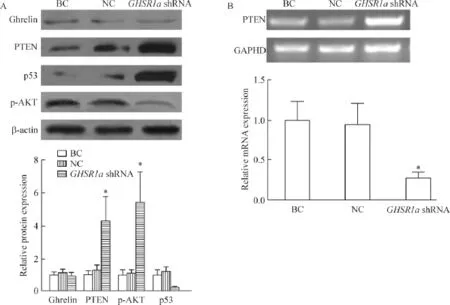
Figure 4.GHSR1a shRNA up-regulated PTEN and inhibited the PI3K/AKT pathway in the SW480 cells.A:the protein levels of PTEN,p-AKT and p53 were detected by Western blot analysis in the SW480 cells after treated with culture medium(BC group),negative control(NC group)and GHSR1a shRNA;B:the PTEN mRNA was detected by RT-PCR.Mean±SD.n=3.*P<0.05 vs NC group.图4 GHSR1a shRNA后对SW480细胞中PTEN、p-AKT和p53蛋白水平和PTEN mRNA表达的影响
5 GHSR1a shRNA抑制结直肠癌皮下移植瘤生长
肿瘤细胞接种裸鼠皮下15 d后即可在皮下触及肿瘤,成瘤率为100%,饲养至第40天实验结束时,实验动物均未出现死亡。实验结束后剥离裸鼠皮下移植瘤组织后称重,BC组、NC组和GHSR1a shRNA组肿瘤平均重量分别为(1.22±0.34)g、(1.09± 0.28)g和(0.63±0.17)g,GHSR1a shRNA组裸鼠肿瘤重量明显低于BC组或NC组,差异有统计学显著性(P<0.05),而BC组与NC组相比较差异无统计学显著性(P>0.05),见图5。
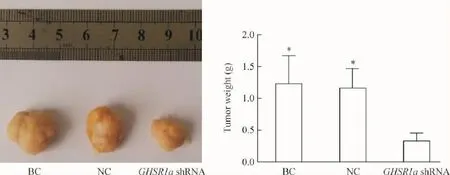
Figure 5.The effect of GHSR1a knockdown on in vivo growth of tumor xenograft.Mean±SD.n=8.*P<0.05 vs GHSR1a shRNA group.图5 沉默GHSR1a基因在SW480细胞中的表达对裸鼠皮下移植瘤生长的影响
6 感染GHSR1a shRNA对裸鼠皮下移植瘤组织中Ki-67和PTEN表达的影响
如图6所示,免疫组化染色结果表明,Ki-67染色阳性细胞表现为仅胞核染成棕褐色,PTEN阳性细胞表现为胞浆为棕褐色。BC组和NC组中Ki-67阳性表达强度较高,但PTEN阳性表达强度较低;而GHSR1a shRNA组肿瘤细胞中Ki-67阳性表达强度均明显低于BC组和NC组,另外PTEN的阳性表达强度显著增加,差异有统计学显著性(P<0.05)。
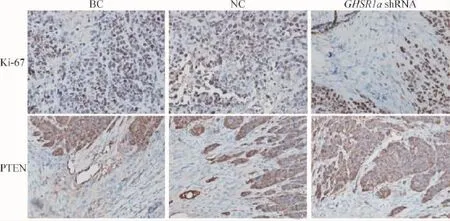
Figure 6.Ki-67 and PTEN in tumor tissue sections determined by immunohistochemistry(×400).图6 免疫组化检测感染GHSR1a shRNA后对裸鼠结直肠癌皮下移植瘤细胞中Ki-67和PTEN表达的影响
讨论
结直肠癌作为我国最常见的消化道肿瘤之一,近年来发病率和病死率呈明显上升趋势,位居我国恶性肿瘤病死率的第3位。目前结直肠癌的治疗方法主要是手术治疗,而外科手术对早期实体瘤的患者较为有效,对复发和晚期的患者往往达不到根治的目的,因此,目前临床上需要一种新的结直肠癌早期诊断和治疗的分子标志物,以期改善患者预后[10]。目前已有多项研究报道表明ghrelin在包括结直肠癌在内多种恶性肿瘤细胞的恶性生物学行为中发挥了巨大作用[5-8],同时GHSR的亚型之一GHSR1a在调控HEK-293细胞增殖和凋亡过程中发挥了一定作用[11],表明GHSR1a可能与恶性肿瘤细胞增殖相关,但GHSR1a在人结直肠癌中的表达及作用机制尚未见报道。为此,本研究首先比较了 ghrelin及 GHSR1a在人正常结肠上皮细胞和结肠癌细胞中的表达差异,结果表明ghrelin和GHSR1a在结肠癌细胞中的表达明显升高,同时ghrelin及GHSR1a在结直肠高分化腺癌细胞系Caco-2中的表达显著低于结直肠低分化腺癌细胞系SW480。既往研究表明非恶性细胞表达极少量内源性ghrelin,在缺乏胎牛血清的培养基中无法增殖,而恶性肿瘤细胞表达大量内源性ghrelin,并且可以在不含胎牛血清的培养基中增殖[9],这种ghrelin及其受体GHSR1a在良恶性细胞中的表达差异表明ghrelin/GHSR1a生物学轴与结直肠癌细胞的恶性生物学行为有一定联系,与文献报道相仿,为此,本研究将进一步探讨ghrelin/GHSR1a生物学轴与体内外结肠癌生长的关系及其可能作用机制。
RNA干扰技术已成为当前研究基因功能的重要工具,小干扰RNA(small interfering RNA,siRNA)存在感染效率低、半衰期短、维持时间较短等缺点,近年来发展的慢病毒介导的shRNA技术可高效抑制靶基因表达,成为基因沉默的最常用选择[12]。在本研究中,我们通过RNA干扰技术设计了特异性靶向GHSR1a基因的shRNA,并通过慢病毒的介导感染至人结直肠癌SW480细胞,从而首次获得稳定沉默GHSR1a基因表达的结直肠癌细胞株,结果表明,感染GHSR1a shRNA慢病毒表达载体后可明显下调GHSR1a蛋白及mRNA在SW480细胞中的表达。在体外实验中,感染GHSR1a shRNA的结直肠癌细胞增殖能力明显被抑制,从而进一步表明GHSR1a与肿瘤细胞增殖关系密切;既往研究表明外源性ghrelin可明显促进肿瘤细胞增殖并抑制细胞凋亡[13],在本实验中,一定浓度外源性ghrelin(1 μmol/L)可促进空白对照组和阴性对照组SW480细胞增殖,而对沉默GHSR1a基因表达的SW480细胞增殖无明显影响,从而表明外源性ghrelin需通过其受体GHSR1a才能发挥促细胞增殖作用。但抑制 GHSR1a在SW480细胞中的表达可抑制细胞增殖,这种作用是因为GHSR1a shRNA可抑制内源性ghrelin在SW480细胞中的表达还是GHSR1a本身具有一定促进肿瘤细胞增殖的活性?为进一步明确疑问,在随后的实验中,本研究验证了感染GHSR1a shRNA对SW480细胞中内源性ghrelin表达无明显影响,从而表明GHSR1a在促进体外结直肠癌细胞增殖作用中具有一定活性,抑制GHSR1a的表达,可抑制体外肿瘤细胞增殖。
为进一步验证沉默GHSR1a基因在结直肠癌细胞中的表达对体内肿瘤细胞是否同样具有增殖抑制作用。为此,本研究通过建立裸鼠结直肠癌皮下移植瘤模型。体内实验结果首次表明GHSR1a shRNA可抑制增殖因子Ki-67在皮下移植瘤组织中的表达,从而抑制皮下移植瘤生长,表明沉默GHSR1a基因的表达可在体内抑制人结直肠癌细胞生长,体内实验结果与体外实验结果相仿,从而表明抑制GHSR1a在结直肠癌细胞中的表达可有效抑制体内外肿瘤细胞生长,进而表明GHSR1a有望成为新的结直肠癌治疗的作用靶点。当前,已有GHSR拮抗剂和反向激动剂安全地用于人体实验和啮齿动物中,并取得了良好的疗效[14-15]。
PTEN作为一种易变异的抑癌基因,其在人体正常组织中呈高表达,在维持机体内环境稳定中发挥着关键的调控作用,但PTEN基因的突变或缺失可促进细胞增殖和阻断细胞凋亡,从而在恶性肿瘤的发生、发展和转移等多种恶性生物学行为中有着密不可分的关系[16]。在结直肠癌中,PTEN的低表达与结直肠癌的病理分级呈负相关,同时PTEN的缺失和低表达与结直肠癌淋巴结转移关系密切[17]。在体外实验中,Western blot和RT-PCR结果表明,GHSR1a shRNA不仅可促进体外结直肠癌SW480细胞中PTEN蛋白和mRNA的表达;另外在体内实验中,沉默GHSR1a在SW480细胞中的表达可上调PTEN蛋白在裸鼠结直肠癌皮下移植瘤中的表达,从而表明抑制GHSR1a在结直肠癌细胞中的表达可在转录和翻译水平调控PTEN基因的表达。既往研究表明肿瘤细胞中抑癌基因PTEN的缺失或表达下调可引起PIP3催化亚基的表达放大,并激活PI3K/AKT通路的磷酸化,而活化的 AKT可以磷酸化下游的mTOR,从而在细胞生长、增殖、蛋白合成和转移等多种生物学行为中发挥中枢作用[18],而通过 PTEN/ PI3K/AKT通路即可有效抑制结直肠癌细胞增殖和转移[11]。在本研究中,GHSR1a shRNA可分别上调和下调p53和p-AKT在SW480细胞中的蛋白水平,从而表明PTEN/PI3K/AKT通路可能在GHSR1a促进结直肠癌细胞生长中发挥着一定作用。
综上所述,本研究提示感染GHSR1a shRNA至结直肠癌SW480细胞后可抑制体内外结直肠细胞的生长,PTEN及其下游调控因子在GHSR1a调控体内外结直肠癌细胞生长过程中起到重要的调控作用。从而为临床结直肠癌基因治疗提供一个新的作用靶点,但仍需进一步深入研究GHSR1a是否影响结直肠癌的其它恶性生物学行为。
致谢:感谢南方医科大学动物实验中心对本研究顺利实施给予的帮助!
[1] Mora M,Adam V,Palomera E,et al.Ghrelin gene variants influence on metabolic syndrome components in aged spanish population[J].PLoS One,2015,10(9): e0136931.
[2] Eren M,olak,I爧ksoy S,et al.Effect of H.pylori infection on gastrin,ghrelin,motilin,and gastroesophageal reflux[J].Turk J Gastroenterol,2015,26(5):367-372.
[3] Kurashina T,Dezaki K,Yoshida M,et al.The β-cell GHSR and downstream cAMP/TRPM2 signaling account for insulinostatic and glycemic effects of ghrelin[J].Sci Rep,2015,5:14041.
[4] Whirledge SD,Garcia JM,Smith RG,et al.Ghrelin partially protects against cisplatin-induced male murine gonadal toxicity in a GHSR-1a-dependent manner[J].Biol Reprod,2015,92(3):76.
[5] Hiura Y,Takiguchi S,Yamamoto K,et al.Effects of ghrelin administration during chemotherapy with advanced esophageal cancer patients:a prospective,randomized,placebo-controlled phase 2 study[J].Cancer,2012,118 (19):4785-4794.
[6] Tian C,Zhang L,Hu D,et al.Ghrelin induces gastric cancer cell proliferation,migration,and invasion through GHS-R/NF-κB signaling pathway[J].Mol Cell Biochem,2013,382(1-2):163-172.
[7] Northrup R,Kuroda K,Duus EM,et al.Effect of ghrelin and anamorelin(ONO-7643),a selective ghrelin receptor agonist,on tumor growth in a lung cancer mouse xenograft model[J].Support Care Cancer,2013,21(9):2409-2415.
[8] Waseem T,Javaid-Ur-Rehman,Ahmad F,et al.Role of ghrelin axis in colorectal cancer:a novel association[J].Peptides,2008,29(8):1369-1376.
[9]Kunnumakkara AB,Guha S,Krishnan S,et al.Curcumin potentiates antitumor activity of gemcitabine in an orthotopic model of pancreatic cancer through suppression of proliferation,angiogenesis,and inhibition of nuclear factor-κB-regulated gene products[J].Cancer Res,2007,67(8):3853-3861.
[10]胡俊杰,周志祥,梁建伟,等.左、右半结肠癌患者临床病理特点及预后差异分析[J].中华医学杂志,2015,95(28):2268-2271.
[11]Lau PN,Chow KB,Chan CB,et al.The constitutive activity of the ghrelin receptor attenuates apoptosis via a protein kinase C-dependent pathway[J].Mol Cell Endocrinol,2009,299(2):232-239.
[12]叶钿均,王绮雯,张继民,等.慢病毒感染胸苷磷酸化酶基因增强5’-脱氧氟尿苷抗结肠癌细胞活性[J].中华肿瘤杂志,2015,37(1):18-24.
[13]Zhang Y,Ying B,Shi L,et al.Ghrelin inhibit cell apoptosis in pancreatic beta cell line HIT-T15 via mitogen-activated protein kinase/phosphoinositide 3-kinase pathways [J].Toxicology,2007,237(1-3):194-202.
[14]Wlotzka B,Tschp MH,Rosewicz S,et al.Inhibition of ghrelin action in vitro and in vivo by an RNA-Spiegelmer [J].Proc Natl Acad Sci U S A,2004,101(36):13174-13179.
[15]Shearman LP,Wang SP,Helmling S,et al.Ghrelin neutralization by a ribonucleic acid-SPM ameliorates obesity in diet-induced obese mice[J].Endocrinology,2006,147 (3):1517-1526.
[16]Wu H,Wang K,Liu W,et al.Recombinant adenovirusmediated overexpression of PTEN and KRT10 improves cisplatin resistance of ovarian cancer in vitro and in vivo [J].Genet Mol Res,2015,14(2):6591-6597.
[17]Zheng L,Zhang Y,Liu Y,et al.MiR-106b induces cell radioresistance via the PTEN/PI3K/AKT pathways and p21 in colorectal cancer[J].J Transl Med,2015,13: 252.
(责任编辑:陈妙玲,罗 森)
Lentivirus-mediated shRNA interferenceofghrelin receptorblocks growth of colorectal cancer cells
LIU An,HUANG Cheng-gang,XU Jia
(Department of Gastrointestinal Surgery,The First People’s Hospital of Yueyang,Yueyang 414000,China.E-mail: 325905634@qq.com)
AIM:To investigate the therapeutic effects of lentivirus-mediated shRNA targeting growth hormone secretagogue receptor 1a(GHSR1a)on colorectal cancer cell line SW480 both in vitro and in vivo.METHODS:Human GHSR1a sequence was used for the design of shRNA targeting GHSR1a,which was introduced to lentivirus,followed by transfection into SW480 cells.CCK-8 assay was performed to detect cell viability.The mRNA expression of GHSR1a and PTEN in colorectal cancer cells was detected by RT-PCR.The protein levels of GHSR1a,ghrelin,PTEN,p-AKT and p53 were determined by Western blot.Stable GHSR1a silencing in SW480 xenografts in nude mice was established.After the mice were sacrificed and weighted,immunohistochemistry was used to detect the positive expression of Ki-67 and PTEN in the tumors.RESULTS:GHSR1a was over-expressed in the malignant cells in comparison with the normal cells in vitro.The tumor specific lentivirus-mediated shRNA targeting GHSR1a gene and GHSR1a knockdown SW480 cells were successfully constructed.After transfection with GHSR1a shRNA,the expression of GHSR1a at mRNA and protein levels was markedly inhibited in the SW480 cells.Furthermore,GHSR1a silencing by specific shRNA showed increased PTEN,inhibition of AKT phosphorylation and promotion of p53 release in the SW480 cells.In vivo results demonstrated that down-regulation of GHSR1a in the SW480 cells significantly decreased the expression of Ki-67 and increased the expression of PTEN in the tumor tissues,leading to a marked reduction in tumor weight in comparison to blank control or negative controltumors.CONCLUSION:Down-regulation of GHSR1a by shRNA technique inhibits the growth of colorectal cancer cell line and xenograft tumor through activation of the PTEN/PI3K/AKT signaling pathways.
Colorectal cancer;Ghrelin;Growth hormone secretagogue receptor 1a;PTEN
R730.23
A
10.3969/j.issn.1000-4718.2016.07.012
1000-4718(2016)07-1227-08
2016-01-06
2016-04-21
岳阳市2014年第三批科技资助项目
△Tel:0730-8256328;E-mail:325905634@qq.com

