乳腺大汗腺病变48例临床病理分析
周珏,王红卫,陈洁,王华(宁波市临床病理诊断中心,浙江 宁波315000)
乳腺大汗腺病变48例临床病理分析
周珏,王红卫,陈洁,王华
(宁波市临床病理诊断中心,浙江 宁波315000)
目的探讨乳腺大汗腺病变的临床病理特点及预后。方法回顾性分析48例乳腺大汗腺病变的临床资料并进行随访。免疫组化采用Envision二步法进行免疫表型检测,抗体包括AR、CK5/6、HER-2、CD34、ER、PR、ECadherin、GCDFP-15、P63、Ki-67。结果48例均为女性,中位年龄54岁;左乳17例,右乳24例,双侧7例;最常见临床表现为单侧乳腺无痛性肿块。本组病例大汗腺增生5例,不典型大汗腺增生3例,大汗腺腺病4例,不典型大汗腺腺病8例,大汗腺型导管原位癌17例,浸润性大汗腺癌11例;48例中37例行免疫组化检测,37例均恒定表达AR,28例表达GCDFP-15,20例表达E-Cadherin。良性及非典型病例一致表达P63;恶性病例28例中12例强表达HER-2,4例弱表达ER、PR。42例获随访资料,40例均存活,2例死亡,生存时间为18个月及26个月。结论乳腺大汗腺病变为一组具特征性组织学形态的乳腺疾病,具有特殊免疫表型,可能具有自身的起源细胞。
乳腺;大汗腺病变;免疫表型;诊断;预后
乳腺大汗腺病变是乳腺疾病中较少见的一类疾病,它在形态学中形成一个连续的病变谱系,从普通的大汗腺增生到浸润性大汗腺癌,共同特征是均具有细胞质丰富、嗜酸性、颗粒状,细胞核增大,染色质淡染、块状,核膜增厚,核仁显著等大汗腺细胞特征[1]。本文收集中心2011年7月~2015 年10月收治诊断的48例乳腺大汗腺病变病例,结合文献,探讨其临床病理学特征、诊断及鉴别诊断。
1 临床资料
48例乳腺大汗腺病变患者,均为女性,年龄31~78岁,中位年龄54岁。病程3天~24个月,中位病程10个月。左侧17例,右侧24例,双侧7例。发现乳腺肿块就诊39例,其中8例伴乳腺肿痛,4例伴乳腺外观异常(乳头内陷、橘皮样等),1例伴皮肤红肿;单纯乳腺经前期胀痛6例,单纯乳头溢液3例。影像学检查:B超提示乳腺肿块30例,乳腺不规则致密结节影9例,乳腺结构紊乱9例,其中4例可见明确钙化灶,其中影像学诊断评分BIRADS 4级以上者25例。12例行粗针穿刺活检,21例曾行冰冻检查。48例中20例为良性及非典型性病例,临床采用病灶切除或乳腺区段切除手术,其余28例恶性病例中11例行乳腺癌改良根治术,14例行保乳术+前哨淋巴结活检术,3例经粗针穿刺活检确诊后赴外地手术治疗。术后8例行曲妥珠单抗靶向治疗1~2个疗程,2例行内分泌治疗 (他莫昔芬等),4例行CHOP等化疗方案治疗3~6个疗程。48例中42例获随访资料,随访时间3~36个月,40例均存活,2例死亡,生存时间为18个月及26个月,1例死于病情恶化,1例死于远处脏器的转移(肺转移)。
2 方法
手术标本经10%中性福尔马林固定液固定,常规石蜡包埋,4μm切片,HE染色。复诊所有48例病理切片,病变分类参照乳腺病理诊断难点中大汗腺细胞增生性病变一章(2011版)[2],并对比粗针穿刺活检结果及冰冻诊断结果。免疫组化采用Envision二步法,VETANA机染,选用的抗体为AR、CK5/6、HER-2、CD34、ER、PR、E-Cadherin、GCDFP-15、P63、Ki-67(各抗体均按要求稀释浓度比例)。所选试剂购自于罗氏公司(ER、PR、HER-2)、福州迈新生物技术开发有限公司(AR、CK5/6、P63、Ki-67)及北京中杉生物技术开发有限公司(CD34、E-Cadherin、GCDFP-15),并严格按照试剂说明书进行操作。染色结果判断:细胞质、细胞膜、细胞核等出现棕黄色反应为阳性,HER-2染色结果参照《乳腺癌HER-2检测指南》标准及方法进行判读,Ki-67按阳性细胞的百分比计数。
3 结果
3.1病理特征除3例为穿刺活检组织外,45例为手术切除标本。本组大汗腺增生5例,不典型大汗腺增生3例,大汗腺腺病4例,不典型大汗腺腺病8例,大汗腺型导管原位癌17例,浸润性大汗腺癌11例,其中伴发纤维腺瘤者13例。20例良性及非典型病变中,巨检8例乳腺组织增生,未见明确肿块,有明确病灶但界限不清者12例,镜下细胞单层或复层排列,部分形成微乳头细胞簇或导管内部不规则腔隙,胞浆丰富,嗜酸颗粒状,不典型病例核具有轻度异型性,核仁易见,部分可见细胞质内空泡;28例恶性病变中巨检肿块大小1.0cm×0.7cm× 0.5cm~5.5cm×2.5cm×2.0cm,病变多为界清、实性肿块,切面灰白灰红,质地中等,其中5例病灶较弥漫,无明确边界。镜下导管上皮细胞多呈明显复层排列,组织结构复杂,细胞具有较为显著的异型性,部分病例可见坏死,核分裂像多见,但仍保留明显的大汗腺细胞的特征(胞浆嗜酸,核仁明显等),浸润性病灶可见明确的浸润区域,侵犯周围正常乳腺组织。见图1~4。
3.2免疫表型48例中37例行免疫组化检测,37例均恒定表达AR,28例表达GCDFP-15,20例表达E-Cadherin。良性及非典型病例一致表达P63,提示肌上皮细胞完整;恶性病例28例中12例强表达HER-2,4例弱表达ER、PR,不表达CK5/6,CD34标记血管阳性,Ki-67表达指数5%~40%。见图5~8。

图1 大汗腺型导管原位癌,肿瘤细胞含丰富的嗜酸性胞质,在管腔周围排列成实性、微乳头结构,管腔内可见多量坏死。

图2 大汗腺化生,扩张的腺泡内可乳头状结构,被覆单层、稍拥挤的高柱状大汗腺细胞,核位于基底部。

图3 浸润性大汗腺癌,肿瘤细胞浸润间质,团巢状排列,细胞嗜酸,伴有显著异型。

图4 不典型大汗腺腺病,上皮细胞胞质颗粒状、嗜酸,核有多形性,核仁明显。

图5 浸润性大汗腺癌GCDFP-15(+)
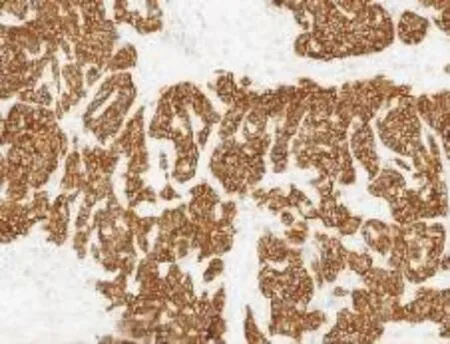
图6 浸润性大汗腺癌HER-2(+++)
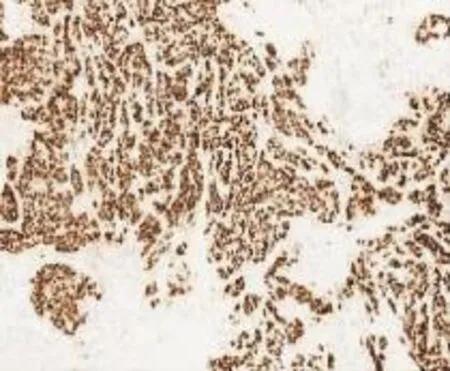
图7 浸润性大汗腺癌AR(+)

图8 不典型大汗腺腺病,P63(+),提示肌上皮细胞完整。
4 讨论
乳腺大汗腺病变是一类少见的,诊断上尚缺乏统一标准的病理变化,普遍存在认识模糊、诊断经验缺乏的现象[3]。从大汗腺增生-不典型增生-导管原位癌-浸润性癌的序列病变,形成了一个连续的形态学谱系。一般而言,对于大汗腺增生性病变并无独特的临床病理学特征,可累及各年龄段女性,常无特殊症状和体征,部分病例可见钙盐沉积,本组8例大汗腺增生病例中有4例大汗腺增生性病变影像学上显示明显的钙化灶。其病理学评估标准与一般的导管细胞相似,如细胞复层增生、增生细胞充满管腔并使导管腔膨胀扩大,但与之不同的是,良性大汗腺增生性病变并不像普通型导管增生细胞那样有明显的黏附性,因此并不形成典型的流水状排列和梭形细胞桥,而当出现细胞的异型性(细胞质淡染、细胞核不再位于基底、细胞核的多形性、核仁明显及具有多形性)以及结构的异型性(细胞拥挤复层排列、形成微乳头、腺样腔隙和梁状结构)时,将考虑为不典型的大汗腺病变。如何区分大汗腺导管原位癌和大汗腺型不典型导管增生则是多数病理医生感到困惑不解的难点。本组病例中有3例在冰冻诊断时出现判断困难,未能明确诊断。而目前文献尚无较多指导意见,且无公认的、恰当的诊断标准[4-5],病理医生只能借助最基本的诊断原则分析此类病变,主要从组织结构、细胞学和病变范围三方面进行详细的对比及阐述,组织结构上低级别大汗腺型导管原位癌更倾向于复杂的细胞桥、筛孔状结构,细胞学形态在不典型大汗腺型导管增生与低级别大汗腺导管原位癌的区别上并不明显,主要均表现为细胞及细胞核的增大(3倍或以上),核仁增大,核膜不规则、染色质粗糙,胞质空泡化,而病变范围对区别两者有一定参考价值[6],不典型大汗腺型导管增生范围通常局限(<2~4mm),累及1个小叶单位,而低级别大汗腺型导管原位癌范围通常较大(>4mm),累及2个及以上小叶单位,并累及导管。根据Schnitt[7]和Collins等[8]的报道,如果大汗腺型导管内增生性病变中大汗腺细胞核轻度异常于良性大汗腺细胞,且存在1个或多个足以诊断导管原位癌的结构特征,则应将该种病变诊断为大汗腺型导管原位癌。可见当肿瘤细胞为轻度细胞异型且无坏死时,其结构的异型性对明确诊断可能会起关键作用。如果大汗腺导管内病变出现高度细胞异型性,即使没有发现大范围增生和结构异型性,确诊大汗腺型导管原位癌亦无异议。
大汗腺增生性病变中,大汗腺腺病和非典型性大汗腺腺病在诊断中极易误诊,尤其是在冰冻切片诊断中。本组有12例该类病变,该类病变主要是指那些具有硬化性腺病的结构特征,且其中的上皮显示大汗腺化生的特征的病变。当硬化性腺病中出现大汗腺上皮时,上皮细胞核增大、核仁明显,腺体扭曲,形成类似于浸润性癌的结构,而大汗腺细胞出现非典型性(细胞核的大小至少相差3倍并且核仁增大)时尤其如此。此类病变并不适于在冰冻报告中直接诊断,免疫组化学标记肌上皮细胞将有助于该类疾病与浸润性癌的区分。
许多浸润性乳腺癌显示大汗腺分化的一些特征,但仅有极少数被证实为具有纯大汗腺特征,该类肿瘤被归为特殊类型的乳腺癌,即浸润性大汗腺癌,或称为伴大汗腺分化的癌[9]。该类肿瘤患者的发病年龄和临床表现与非特殊性浸润性癌无差别,影像学检查上与其他类型的乳腺癌亦无法区分[10]。组织学形态上均可见大汗腺特征,表现为细胞胞质丰富,泡沫状(B型细胞)到嗜酸性颗粒状(A型细胞),核圆形,核仁明显,生物学标记ER和PR表达阴性,AR和GCDFP-15表达阳性,但晚期肿瘤可能GCDFP-15表达缺失,约有50%的病例可有HER-2的过度表达和基因扩增,本组病例HER-2阳性所占比例为42.9%(12/28)。浸润性大汗腺癌的临床治疗一般以手术治疗为主(改良根治术或保乳术),术后可辅以靶向治疗或化疗。现阶段的研究表明,浸润性大汗腺癌与传统类型的非特殊性浸润性癌的腋窝淋巴结转移率及预后均无明显差异[11],通过对微阵列产生的两组预后基因的数据进行生物信息学分析显示,具有“大汗腺分子特征”的伴大汗腺分化的癌,拥有21-基因复发高评分和70-基因不良预后特征,而肿瘤的雄激素受体信号可能对未来的肿瘤治疗提供新的措施[12]。
本组病例的临床病理特征归纳如下:(1)48例患者均为女性,中位年龄54岁,病程较长(中位病程10个月);(2)48例中41例为单侧乳腺发病,7例为双侧乳腺发病,组织学类型均为大汗腺病变,其中28例为大汗腺恶性病变;(3)免疫组化检测37例均表达AR,28例表达GCDFP-15,20例表达E-Cadherin。良性及非典型病例一致表达P63,提示肌上皮细胞完整;恶性病例28例中12例强表达HER-2,4例弱表达ER、PR。
总之,乳腺大汗腺病变从大汗腺细胞增生到浸润性大汗腺癌形成一个连续的病变谱系[13],其特殊形态学特征已经得到病理医师的广泛认同,生物学性质尚未得到充分理解[14],虽然大汗腺细胞增生性病变属于导管上皮增生性病变的类型之一,但似乎不是起源于已经充分发育成形的一般导管上皮增生性病变,也并非一般导管上皮增生性病变形成之后的继发性改变,它可出现于非增生性大汗腺化生病灶内,也可直接发生于一般导管上皮,提示其很可能有自身的起源细胞[2,15]。系统复习并提高对其细胞异型性和结构异型性的认识,有助于对该类疾病的理解。
[1]Mazoujian G,Pinkus G S,Davis S,et al.Immunohistochemistry of a gross cystic disease fluid protein(GCDFP-15)of the breast.A maker of apocrine epithelium and breast carcinomas with apocrine features.Am J Pathol,1983,110(2):105
[2]Frederick C.Koerner.乳腺病理诊断难点.薛德彬,黄文斌,译.北京:人民卫生出版社,2011:86
[3]Shim H S,Jung W H,Kim H,et al.Expression of androgen receptors and inhibin/activin alpha and beta A subuntis in breast apocrine lesion.APMIS,2006,114(5):352
[4]Celis J E,Gromova I,Gromov P,et al.Molecular pathology of breast apocrine carcinomas:a protein expression signature specific for benign apocrine metaplasia.FEBS Lett,2006,580 (12):2930
[5]Simpson PT,Reis-Filho JS,Gale T,et al.Molecular evolution of breast cancer.J Pathol,2005,205:248
[6]丁华野.不典型大汗腺增生性病变.临床与实验病理学杂志,2014,30(3):237
[7]Schnitt SJ.Benign breast disease and breast cancer risk: morphology and beyond.Am J Surg Pathol,2003,27(6):836
[8]Collins LC,Baer HJ,Tamimi RM,et al.The influence of family history on breast cancer risk in women with biopsyconfirmed benign breast disease:results from the Nurses' Health Study.Cancer,2006,107(6):1240
[9]Kimihiro Tanaka,Shigeru Imoto,Noriaki Wada,et al.Invasive Apocrine Carcinoma of the Breast:Clinicopathologic features of 57 Patients.Breast,2008,14(2):164
[10]Kopans DB.Breast Imaging.2nd ed.Philadelphia:Lippincott-Ranen Publishers,1997:1
[11]O'Malley F P,Bane A.An update on apocrine lesions of the breast.Histopathology,2008,52(1):3
[12]Tavassoli FA,Devilee P.World Health Organization cassification of tumours.Pathology and genetics,tumours of the breast and female genital organs.Lyon:IARC Press,2003:36
[13]Well CA,El-Ayat GA.Non-operative breast pathology:Apocrine lesions.J Clin Pathol,2007,60:1313
[14]Zagorianakou P,Zagorianakou N,Stefanou D,et al.The enigmatic nature of apocrine breast lesions.Virchows Arch,2006,448:525
[15]Celise JE,Gromova L,Gromov P,et al.Molecular pathology of breast apocrine carcinomas:A protein expression signature specificforbenignapocrinemetaplasia.FEBSLett,2006,580:2933

