阿霉素诱导大鼠心力衰竭模型中血浆NGF表达的初步研究*
梁 政,王怀龙,李 晓,李 波,岑永艺,刘珍君,黄石安,陈建英,陈 灿,陈文江
(1.广东医科大学附属医院心血管内科,广东湛江 524001;2.中国海洋石油南海西部医院,广东湛江 524000)
·论著·
阿霉素诱导大鼠心力衰竭模型中血浆NGF表达的初步研究*
梁政1,王怀龙1,李晓1,李波1,岑永艺2,刘珍君1,黄石安1,陈建英1,陈灿1,陈文江1
(1.广东医科大学附属医院心血管内科,广东湛江 524001;2.中国海洋石油南海西部医院,广东湛江 524000)
目的探讨阿霉素诱导的大鼠心力衰竭模型中血浆神经生长因子(NGF)的表达情况。方法25只Wistar大鼠随机分为心力衰竭组(CHF组,n=15,阿霉素4 mg/kg,腹腔注射,6周)和正常对照组(NC组,n=10),待造模成功后继续观察6周,在6周和12周测定心功能;每2周测定体质量和通过尾静脉采血测定大鼠血浆NGF表达。结果6周后,CHF组大鼠体质量较NC组明显减轻,差异有统计学意义(P<0.05),LVEDV和LVESV明显升高,LVEF明显下降,NGF表达量也较对照组明显下降,差异有统计学意义(P<0.05);NGF表达量随着病程时间延长而逐渐降低(P<0.05)。结论Wistar大鼠腹腔注射阿霉素可以成功诱导HF,而且NGF可能与HF密切相关。
心力衰竭;神经生长因子;阿霉素;Wistar大鼠
心力衰竭(HF)是一组常见临床综合征,其患病率为0.9%(男性0.7%,女性1.0%),而且住院患者 30 d病死率为5.4%,我国目前HF患者有大约450 万[1],由此可见其危害性。HF发病机制仍未完全清楚,目前研究主要认为与心脏重构有关[2],而近年来研究显示交感神经重构与HF发生密切相关,具体机制主要涉及交感神经激活、神经萌芽和一些神经生长相关因子[3-5]。神经生长因子(NGF)是心血管系统和神经系统非常重要的生物活性因子之一,对维持人体正常神经细胞营养起重要作用,而且可维持交感神经活性、促进神经细胞的分化等功能[5-8]。近年来有研究显示NGF与HF关系密切[9-10]。因此,本研究拟采用Wistar大鼠腹腔注射阿霉素制备HF模型,从而探讨NGF与HF的关系。
1 材料与方法
1.1动物模型与标本采集25只成年雄性清洁级Wistar大鼠,体质量为(200±20)g,由广东省实验动物中心提供,随机分为心力衰竭组(CHF组,n=15)和正常对照组(NC组,n=10)。CHF组给予阿霉素4 mg/kg,腹腔注射,每周1次,共6周,累积总量24 mg/kg,而NC组应用生理盐水以CHF组相同的方法、剂量和时间进行注射。确定造模成功后,继续喂养6周,以观察自然病程和其他指标变化情况。实验期间每2周通过尾静脉采血以乙二胺四乙酸(EDTA)抗凝管收集两组大鼠0.5 mL静脉血和测定体质量,同时观察大鼠一般情况,并在6周和12周进行超声测定存活大鼠的心功能。
1.2方法
1.2.1HE染色于实验周期结束时,留取大鼠心脏组织,进行苏木素-伊红(HE)染色,HE试剂盒(C0105)由碧云天生物科技有限公司提供,详细操作步骤按照试剂盒说明书进行。
1.2.2心脏超声测定常规麻醉各组大鼠,固定四肢并采用仰卧位,以彩色超声诊断仪(SONOS 5500,Hewlett Packard)和HP小动物超声探头(15 MHz)在大鼠胸骨旁以二维超声进行心脏形态和功能检测,测量指标主要有左室舒张末期内径(LVEDV)、左室收缩末期内径(LVESV)、左室射血分数(LVEF),LVEF =(LVEDV-LVESV)/LVEDV×100%。
1.2.3ELISA将所获取的各组大鼠全血进行离心(3 000 r/min,24 ℃,10 min)分离血浆,取各组大鼠的血浆,按照ELISA试剂盒说明书(ELISA试剂盒由深圳柏万森生物有限公司提供)对血浆NGF进行检测,观察其变化情况,具体步骤按照试剂盒说明书进行,最后用酶标仪(EPOCH,美国)在 450 nm 波长下测定吸光度(OD 值),并通过制备的标准曲线计算大鼠血浆中 NGF 的浓度。

2 结 果
2.1大鼠基本情况CHF组在实验观察期间,尤其是阿霉素腹腔注射4周以后,大鼠出现食欲下降、活动减少、体质量减轻和死亡,体质量变化情况见表1。CHF组在造模期间死亡4只,在随后的观察期间死亡5只,经解剖,基本都可见心脏变大、肝脏肿大等现象;而NC组未见老鼠有明显异常和死亡。

表1 两组大鼠造模前后体质量变化情况
注:与NC组比较,*P<0.05。
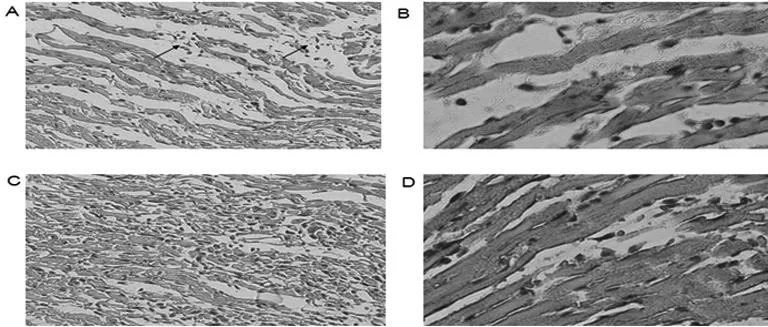
注:A、B为阿霉素造模组,C、D为正常对照组。
图1大鼠HE染色情况
2.2HE染色结果对造模后大鼠进行HE染色发现,CHF组大鼠心肌细胞排列紊乱、间隙增宽(图1A、B),有的心肌细胞已经坏死、溶解(图1A箭头所示);而对照组心肌细胞排列基本正常(如图1C、D)。该结果符合HF的病理表现。
2.3大鼠心功能测定情况CHF组15只Wistar大鼠经过6周阿霉素腹腔注射造模后,存活11只,而NC组10只大鼠全部存活,进行心功能测定发现:CHF组大鼠LVEDV和LVESV 都比NC组明显升高,差异有统计学意义(P<0.01),而CHF组LVEF(73.95%)则较NC组(92.52%)明显降低(P<0.01);在12周时,CHF组大鼠仅存活6只,LVEDV和LVESV 都较6周时未见明显升高(P>0.05),然而LVEF则较6周时明显降低(P<0.01),而CHF组与NC组比较,心功能明显下降,LVEF仅为62.60%(P<0.01),见表2。该结果结合上述HE染色表明阿霉素腹腔注射可以成功建立Wistar大鼠心力衰竭模型,而且心功能衰竭会随着生存时间的延长而加重。
2.4NGF表达变化情况经过尾静脉采血,然后采用ELISA检测血浆NGF发现:CHF组NGF表达量逐渐降低,在8周时升高,然后又逐渐下降,而NC组整个过程未见明显升高或者下降;在4周以后,CHF组NGF表达量明显较NC组降低(P<0.01),详见表3。

表2 两组大鼠心功能情况
注:与NC组比较,*P<0.05;与6周比较,#P<0.05。

表3 两组大鼠NGF表达情况
注:与NC组比较,*P<0.05;与6周和10周比较,#P<0.05。
3 讨 论
HF已经成为严重危害人类健康的重大疾病之一,给人类和社会带来严重负担,其防治刻不容缓[1]。对于其防治,目前已经有较好的临床措施(如强心、利尿、扩管等),但目前多局限于HF后的组织结构重构和电重构(如β受体阻滞剂、血管紧张素转化酶抑制剂等的治疗)[3-4]。现有研究表明HF后神经重构也是HF治疗和预后的关键因素,目前主要发现NGF、酪氨酸羟化酶、生长相关蛋白43等可能与神经重构有关[6-7]。NGF目前在临床已经有人或鼠重组型运用于滋养神经、营养神经细胞等,主要用于外伤或者卒中后康复治疗[11]。国内已经有研究者在临床发现HF患者血浆NGF表达会下降,而血管紧张素转换酶抑制剂、α1受体阻断剂和β受体阻滞剂等可能会改善NGF的表达[9-10,12],不过都还是一些小样本观察性研究,还需要更深层次研究。另有研究者发现有氧运动可以改善HF后NGF的表达[13]。也有研究者通过建立急性心肌梗死模型探讨NGF与交感神经重构的关系,发现心肌梗死后NGF表达也下调[14-18]。然而关于HF与NGF具体关系的研究较少。
本研究通过腹腔注射阿霉素成功建立HF模型,发现阿霉素腹腔注射4周以后,CHF组大鼠相比于NC组出现食欲下降、活动减少、体质量减轻和死亡等情况;并通过HE染色发现CHF组大鼠心肌细胞排列紊乱、间隙增宽,并出现心肌细胞坏死、溶解等情况;通过超声测定基本心功能发现CHF组大鼠LVEDV和LVESV 都比NC组明显升高,而CHF组LVEF则较NC组明显降低,同时发现CHF组大鼠心功能衰竭会随着生存时间的延长而加重;通过对大鼠血浆NGF检测发现在HF后大鼠NGF的表达明显下降,而且随着病程延长和病情加重而持续下降,而在8周时呈现上升趋势,可能与机体代偿等有关,当失代偿后NGF继续下降,说明NGF与HF密切有关,而其具体机制可能与交感神经重构等有关,还有待进一步研究。本研究只是从动物层面发现HF后NGF表达下降,未进行干预和治疗,有一定局限性,还有待后续研究确定具体机制和关系。
综上所述,本研究通过采用Wistar大鼠腹腔注射阿霉素可以成功诱导慢性HF动物模型,NGF在阿霉素诱导的HF模型中呈现低表达,可能与阿霉素诱导的HF发病机制密切相关。
[1]陈伟伟,高润霖,刘力生,等.《中国心血管病报告2014》概要[J].中国循环杂志,2015,30(7):617-622.
[2]张敏,孟照辉.心力衰竭发病机制及药物治疗进展[J].临床医学,2015,35(5):118-121.
[3]钱方毅.重视心力衰竭发病机制中的神经内分泌细胞因子系统的研究[J].中国循环杂志,2001,16(4):243-245.
[4]Rogers C,Bush N.Heart failure:pathophysiology,diagnosis,medical treatment guidelines,and nursing management[J].Nurs Clin North Am,2015,50(4):787-799.
[5]Hasan W,Smith PG.Decreased adrenoceptor stimulation in heart failure rats reduces NGF expression by cardiac parasympathetic neurons[J].Auton Neurosci,2014,181(181):13-20.
[6]Xing J,Lu J,Li J.Nerve growth factor decreases in sympathetic and sensory nerves of rats with chronic heart failure[J].Neurochem Res,2014,39(8):1564-1570.
[7]D′elia E,Pascale A,Marchesi N,et al.Novel approaches to the post-myocardial infarction/heart failure neural remodeling[J].Heart Fail Rev,2014,19(5):611-619.
[8]Singh S,Sayers S,Walter JS,et al.Hypertrophy of neurons within cardiac ganglia in human,canine,and rat heart failure:the potential role of nerve growth factor[J].J Am Heart Assoc,2013,2(4):e000210.
[9]李书国,毛小波,郭张强,等.α1受体阻断剂对慢性心力衰竭大鼠心肌神经生长因子表达的影响[J].中国现代医学杂志,2007,17(17):2110-2113.
[10]焦蓉,朱小燕.心力衰竭患儿血浆神经生长因子水平及卡托普利的干预研究[J].医药导报,2011,30(8):1013-1015.
[11]唐中力,李浪.神经调节蛋白1治疗慢性心力衰竭的新进展[J].中华老年心脑血管病杂志,2015,17(2):209-211.
[12]李书国,杨俊,丁家望,等.慢性心力衰竭大鼠心肌神经生长因子表达及卡维地洛治疗的影响[J].中国医师杂志,2009,11(6):846-849.
[13]甄洁,李晓霞.有氧运动抑制心梗后心力衰竭大鼠左室重塑及交感神经重塑[J].中国病理生理杂志,2015,31(6):973-979.
[14]Kimura K,Kanazawa H,Ieda M,et al.Norepinephrine-induced nerve growth factor depletion causes cardiac sympathetic denervation in severe heart failure[J].Auton Neurosci,2010,156(1/2):27-35.
[15]Lam NT,Currie PD,Lieschke GJ,et al.Nerve growth factor stimulates cardiac regeneration via cardiomyocyte proliferation in experimental heart failure[J].PLoS One,2012,7(12):e53210.
[16]Qin F,Vulapalli RS,Stevens SY,et al.Loss of cardiac sympathetic neurotransmitters in heart failure and NE infusion is associated with reduced NGF[J].Am J Physiol Heart Circ Physiol,2002,282(1):H363-H371.
[17]Kaye DM,Vaddadi G,Gruskin SL,et al.Reduced myocardial nerve growth factor expression in human and experimental heart failure[J].Circ Res,2000,86(7):E80-E84.
[18]Govoni S,Pascale A,Amadio M,et al.NGF and heart:Is there a role in heart disease?[J].Pharmacol Res,2011,63(4):266-277.
Preliminary study on plasma NGF expression in adriamycin induced rat heart failure model*
LIANG Zheng1,WANG Huailong1,LI Xiao1,LI Bo,1CEN Yongyi2,LIU Zhenjun1,HUANG Shian1,CHENJianying1,CHENCan1,CHENWenjiang1
(1.DepartmentofCardiovascularInternalMedicine,AffiliatedHospitalofGuangdongMedicalUniversity,Zhanjiang,Guangdong524001,China;2.NanhaiWestHospitalofChinaOffshoreOil,Zhanjiang,Guangdong524000,China)
ObjectiveTo investigate plasma NGF expression in adriamycin induced rat heart failure(HF) model.MethodsTwenty-five Wistar rats were randomly divided into the CHF group(n=15,adriamycin 4 mg/kg,by intraperitoneal injection,for 6 weeks) and normal control group (NC group,n=10),after successful model construction,the 6-week observation was continuously conducted.The body mass and plasma NGF expression were detected once per 2 weeks.ResultsAfter 6 weeks later,the body mass in the CHF group was significantly reduced,the difference was statistically significant (P<0.05),LVEDV and LVESV were significantly increased,while LVEF was declined obviously (P<0.05),the NGF expression amount was significantly decreased compared with the control group,the differences were statistically significant (P<0.05);the NGF expression amount was gradually reduced with the time extension of disease course(P<0.05).ConclusionIntraperitoneal injection of adriamycin can successfully induce heart failure model in Wistar rats,moreover NGF may be closely associated with HF.
heart failure;nerve growth factor;adriamycin;Wistar rats
2016-01-29修回日期:2016-05-17)
广东省湛江市科技计划资助项目(2014B01082)。
梁政,男,副主任医师,主要研究心力衰竭发病机制及其防治。
10.3969/j.issn.1673-4130.2016.15.014
A
1673-4130(2016)15-2086-03

