胰岛自身抗体和生化指标在糖尿病分型诊断中的应用价值*
周 晖,李正康,徐晓明,江楚文,严永智,裴剑浩
(1.广东省医学科学院/广东省人民医院检验科,广州 510080;2.广东省广州市妇女儿童医疗中心 510623;3.广东省医学科学院/广东省人民医院省临床检验中心,广州510120;4.广东省医学科学院/广东省人民医院内分泌科,广州 510080)
胰岛自身抗体和生化指标在糖尿病分型诊断中的应用价值*
周晖1,李正康1,徐晓明2,江楚文3,严永智1,裴剑浩4△
(1.广东省医学科学院/广东省人民医院检验科,广州 510080;2.广东省广州市妇女儿童医疗中心510623;3.广东省医学科学院/广东省人民医院省临床检验中心,广州510120;4.广东省医学科学院/广东省人民医院内分泌科,广州 510080)
目的探讨胰岛自身抗体与生化指标在1型糖尿病(T1DM)和2型糖尿病(T2DM)临床分型诊断中的应用价值。方法回顾性分析99例T1DM患者(T1DM组)与577例T2DM患者(T2DM)的临床资料及实验室检测结果,比较两组胰岛自身抗体及各项生化指标水平,并分析其特征。结果T1DM组患者血清谷氨酸脱羧酶抗体(GADA)、胰岛细胞瘤相关蛋白-2自身抗体(IA-2A)、抗胰岛细胞抗体(ICA)及锌转运体8自身抗体(ZnT8A)单项及联合检测的阳性率均高于T2DM组,差异均有统计学意义(P<0.05)。T1DM组患者起病年龄、空腹C肽(CP)、餐后2 h CP、空腹胰岛素(INS)、餐后2 h INS、三酰甘油(TG)和体质量指数(BMI)均低于T2DM组,空腹血糖、餐后2 h血糖、糖化血红蛋白(HbA1c)及高密度脂蛋白胆固醇(HDL-C)水平均高于T2DM组,差异均有统计学意义(P<0.05);而两组总胆固醇、低密度脂蛋白胆固醇水平比较,差异均无统计学意义(P>0.05)。空腹CP及餐后2 h CP水平在T1DM组均随着病程延长呈下降趋势,且不同病程间比较,差异均有统计学意义(P<0.05);而在T2DM组无明显的下降趋势。病程小于2年的患者空腹CP、餐后2 h CP鉴别诊断T1DM与T2DM的受试者工作曲线下面积及其95%置信区间分别为0.902(0.850~0.954)、0.905(0.852~0.958)。当空腹CP诊断界点为0.283 nmol/L时,其灵敏度和特异度分别为82.6%、89.2%;餐后2 h CP诊断界点为0.421 nmol/L时,其灵敏度和特异度分别为84.8%、89.2%。结论T1DM、T2DM患者的起病年龄、BMI值及血清GADA、IA-2A、ICA、ZnT8A、INS、CP、葡萄糖、HbA1c、TG 、HDL-C水平等指标存在差异,可辅助临床对其进行分型诊断。
C肽;自身抗体;血液化学分析;糖尿病,1型;糖尿病,2型
糖尿病可分为1型糖尿病(type 1 diabetes mellitus,T1DM)、2型糖尿病(type 2 diabetes mellitus,T2DM)、其他特殊类型糖尿病、妊娠糖尿病等类型[1],以T2DM最为多见,约占所有糖尿病的90%~95%,其次为T1DM,约占5%~10%,其他特殊类型糖尿病约占3%,其中妊娠糖尿病需产后重新分型。T1DM是由于胰岛β细胞的自身免疫性破坏或功能缺失导致胰岛素(insulin,INS)分泌绝对缺乏所引起的糖尿病,具有酮症倾向,患者需要终身依赖INS维持生命。T2DM则是由于胰岛素抵抗为主伴INS分泌相对不足,或INS分泌缺陷为主伴胰岛素抵抗所致的糖尿病,患者通常不需要依赖INS维持生命。虽然国内外公认起病年龄、体质量指数(BMI)、胰岛自身抗体等是T1DM、T2DM分型的重要依据[1-2],但随着生活方式的改变、发病人群的复杂化和研究的深入,发现许多糖尿病患者的表现有重叠,导致分型困难[3]。除上述指标外,这两型糖尿病患者血清INS、C-肽(C-peptide,CP)、葡萄糖和脂类等实验室指标也有所不同,为给临床分型诊断与治疗提供更多依据,本研究回顾分析了676例T1DM、T2DM住院患者的实验室指标特点,现报道如下。
1 资料与方法
1.1一般资料回顾性分析2013年4月至2014年8月在广东省人民医院住院的T1DM与T2DM患者的实验室指标。所有患者均依据1999年WHO糖尿病诊断标准进行分型诊断,重复住院患者仅取第1次住院资料。其中2013年4月至2014年8月T1DM住院患者99例(T1DM组),男53例,女46例;住院年龄31.0(22.0~49.0)岁 ;病程3.0(0.1~10.3)年。2013年4月至2013年12月T2DM住院患者577例(T2DM组),男309例,女268例;住院年龄62.0(52.5~73.0)岁;病程6.0(0.8~11.0)年。
1.2方法
1.2.1胰岛自身抗体检测采用深圳伯劳特公司免疫印迹法试剂盒检测血清谷氨酸脱羧酶抗体(glutamic acid decarboxylase autoantibodies,GADA)、胰岛细胞瘤相关蛋白-2自身抗体(insulinoma-associated antigen-2 autoantibodies,IA-2A)、抗胰岛细胞抗体(islet cell antibodies,ICA)和锌转运体8自身抗体(zinc transporter 8 autoantibodies,ZnT8A)。
1.2.2生化指标检测血清葡萄糖包括空腹血糖(fasting blood glucose,FBG)与餐后2 h血糖(postprandial 2 h blood glucose,2 h PG)检测使用美国Beckman公司试剂,总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)检测使用上海科华生物工程股份有限公司试剂,高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)检测使用四川迈克生物科技股份有限公司试剂,均在美国Beckman公司UniCel®DxC 800全自动生化分析仪上检测。采用高压液相色谱法(HPLC)检测糖化血红蛋白(glycosylated hemoglobin,HbA1c),使用美国伯乐公司D-10TM糖化血红蛋白检测仪及原装配套试剂。
1.2.3激素检测利用电化学发光法检测血清CP与INS水平,使用瑞士罗氏公司Cobas e601电化学发光免疫分析仪及原装配套试剂。99例T1DM患者中共97例检测血清CP水平,病程0.0~<2.0、2.0~5.0、>5.0年者分别为48、9、40例;共95例检测2 h CP水平,病程0.0~<2.0、2.0~5.0、>5.0年者分别为46、9、40例。577例T2DM患者中共566例检测血清CP水平,病程0.0~<2.0、2.0~5.0、>5.0年者分别为210、74、282例;共562例检测2 h CP水平,病程0.0~<2.0、2.0~5.0、>5.0年者分别为209、74、279例。
1.3统计学处理采用SPSS 17.0统计软件进行数据处理与统计分析,各组计量资料不呈正态分布,以中位数、第25百分位数和第75百分位数[M(P25~P75)]表示,多组间比较采用非参数完全随机多组独立样本的秩和检验(Krusdal-Wallis法),两组间比较采用非参数完全随机两独立样本的秩和检验(Mann-Whitney法);计数资料以例数或百分率表示,采用χ2检验进行比较分析。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,评价CP对糖尿病的分型诊断价值,计算ROC曲线下面积(area under the curve,AUC)及其95%置信区间(CI),AUC=0.5时无诊断价值;AUC为0.5~<0.7时表示诊断准确性较低;AUC为0.7~<0.9时表示诊断准确性中等;AUC≥0.9时表示诊断准确性较高。以P<0.05为差异有统计学意义。
2 结 果
2.1两组胰岛自身抗体检测阳性率比较T1DM组4种抗体单独检测及联合检测(至少1种抗体阳性)的阳性率均高于T2DM组,差异均有统计学意义(P<0.05)。见表1。

表1 两组4种胰岛自身抗体单独及联合检测阳性率比较[n(%)]
2.2两组起病年龄、BMI及各项生化指标水平比较T1DM组空腹CP、餐后2 h CP、空腹INS、餐后2 h INS、TG水平及起病年龄、BMI值均低于T2DM组,FBG、2 h PG、HbA1c及HDL-C水平均高于T2DM组,差异均有统计学意义(P<0.05);而两组TC及LDL-C水平比较,差异均无统计学意义(P>0.05)。见表2。

表2 两组起病年龄、BMI及各项生化指标水平比较[M(P25~P75)]

表3 两组不同病程患者空腹CP水平比较[M(P25~P75),nmol/L]

表4 两组不同病程患者餐后2 h CP水平比较[M(P25~P75),nmol/L]
2.3两组不同病程患者CP水平比较为进一步研究CP在T1DM、T2DM组的差异,将两组患者按病程分为3个亚组。T1DM组不同病程患者空腹CP、餐后2 h CP水平均低于T2DM组,差异均有统计学意义(P<0.05),见表3、4;而且随着T1DM组患者病程的延长,下降趋势、幅度明显,以2年内病程水平为基数,2.0~<5.0年病程患者空腹CP、餐后2 h CP水平的M值分别下降88.7%、79.2%,病程大于5.0年的患者空腹CP、餐后2 h CP水平的M值均降至检测低限(0.003 nmol/L),不同病程T1DM组患者空腹CP及餐后2 h CP水平比较,差异均有统计学意义(χ2=32.509,P=0.000;χ2=26.184,P=0.000)。而T2DM组患者随着病程延长空腹CP、餐后2 h CP均无明显下降趋势;不同病程T2DM组患者餐后2 h CP水平比较,差异有统计学意义(χ2=8.243,P=0.016);而空腹CP水平比较,差异无统计学意义(χ2=3.197,P=0.202)。
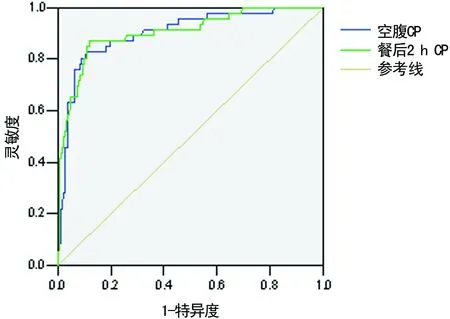
图1 空腹CP及餐后2 h CP鉴别诊断T1DM与T2DM的ROC曲线
2.4CP的诊断价值考虑到早期诊断的重要性,以病程0.0~<2.0年的T1DM、T2DM患者空腹CP、餐后2 h CP水平为检验变量,绘制ROC曲线以分析CP对T1DM、T2DM的鉴别诊断价值。空腹CP、餐后2 h CP的AUC均大于0.9(P<0.05),诊断准确度较高。CP水平越低,T1DM的可能性越大;越高,T2DM的可能性越大。见图1、表5。

表5 空腹CP及餐后2 h CP对T1DM与T2DM的鉴别诊断价值
*:P<0.05,与AUC=0.5比较。
3 讨 论
T1DM起病年龄常为6月龄至成年,而T2DM则于青春期后起病。本研究T1DM组患者起病年龄明显低于T2DM组,差异有统计学意义(P<0.05)。本研究T1DM多发生在40岁以下,其中小于20岁者20例,而T2DM则多发生在40岁以上的中、老年,与相关研究报道相符[1-3]。
T1DM常有自身细胞免疫和体液免疫的共同参与,患者血清中可检出多种针对胰岛细胞及其细胞成分的自身抗体,目前应用广泛的有GADA、IA-2A、ICA、抗胰岛素抗体(insulin autoantibodies,IAA)及近年发现的ZnT8A抗体。由于目前常规检测方法不能区分针对自身抗原还是外源性INS产生的抗体,本研究中绝大多数患者已使用INS超过2周,因此未将IAA纳入观察指标。
本研究结果显示,T1DM组患者4种自身抗体单独及联合检测阳性率均明显高于T2DM组。谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)是合成抑制性神经递质γ-氨基丁酸的关键酶,人类GAD有两种非等位基因异构体GAD 67(相对分子质量67×103)和GAD 65(相对分子质量65×103),前者主要分布在神经元,后者主要分布在胰岛β细胞。多数T1DM患者血清只能识别GAD 65的构象表位,只有10%~30%的患者血清能与GAD67结合。GAD 65是诱发遗传易感个体胰岛β细胞特异性自身免疫最强的抗原之一[4],相应的GADA是阳性率最高的胰岛自身抗体。本研究T1DM组患者GADA抗体阳性率明显高于T2DM组(46.46%vs. 5.03%,P<0.05),与文献[5-9]报道的38.00%~52.94%接近。人胰岛细胞瘤相关蛋白-2(IA-2)是参与调节INS分泌的受体型蛋白酪氨酸磷酸酶家族中的一员,主要在脑和胰岛组织神经内分泌细胞中表达,是T1DM的一个主要靶抗原。相应IA-2A的阳性率与年龄、病程有关,韩国Kong等[10]报道诊断后1年内,小于20岁、大于或等于20岁的T1DM患者IA-2A阳性率分别为66.67%、16.67%。日本Kawasaki等[11]研究发现,病程小于1年、1~<4年、4~10年和10年以上的T1DM患者IA-2A阳性率分别为61.3%、40.7%、28.6%和20.5%。本研究T1DM患者IA-2A阳性率为19.19%,接近对类似研究人群的检测结果(19.38%~24.65%)[5,7,9]。ICA是一组针对胰岛细胞(α、β、δ和PP)内多种抗原的混合抗体,在儿童和青少年的灵敏度达70%~90%,但以后随着发病年龄的增加而降低。ICA存在时间非常短,仅出现在胰岛炎发生前的无高血糖阶段及T1DM初期,其阳性率随着病程的延长而逐渐降低。本研究结果显示,T1DM组患者ICA阳性率为14.14%,与国内赵玲等[12]、越南Ly等[13]报道的10.8%、11.11%接近。胰岛β细胞特异性锌转运体8(ZnT8)是近年新发现的T1DM自身靶抗原[14],位于胰岛素分泌颗粒,属于锌转运体蛋白质(SLC30)家族,负责将细胞内的锌离子转运到细胞外基质或细胞内囊泡中,通过影响锌离子浓度在INS合成与分泌中发挥重要作用。ZnT8A在中国人群的阳性率少有报道。本研究T1DM组患者ZnT8A阳性率为15.15%,ZnT8A阳性标本均同时伴有GADA、IA-2A、ICA阳性;且ZnT8A抗体阳性的T1DM患者其发病年龄明显小于其他自身抗体阳性患者,且患者空腹CP水平更低,与疾病严重程度高度相关。提示ZnT8A的检测对起病后胰岛功能破坏的监测与评估可能具有重要意义。总之,这4种自身抗体可以辅助T1DM、T2DM的诊断分型,其中以GADA诊断价值较高。
本研究结果还显示,T1DM组患者FBG、2 h PG及HbA1c水平控制较差,均明显高于T2DM组(P<0.05)。T2DM患者多肥胖,本研究中T2DM组患者血清TG、LDL-C水平及BMI值均明显高于T1DM组(P<0.05),与文献[14-15]报道相符。HDL-C具有抗动脉粥样硬化(atherosclerosis,AS)作用,本研究中T2DM组患者血清HDL-C水平明显低于T1DM组(P<0.05)。高血脂是引起AS的三大主要因素之一,T2DM患者高TG、TC、LDL-C和低HDL-C水平的特点可能与T2DM患者发生心血管疾病的风险较高有关。
血清INS是由胰岛β细胞分泌的降血糖的重要激素,当患者应用INS治疗后,血清INS不能完全反映体内INS的分泌状况。而CP与INS等物质的量分泌入血,且不与IAA反应,外源性INS不含CP,因而CP可以真实地反映体内INS的合成与分泌状态。本研究中,尽管多数患者应用了INS,但T1DM组患者空腹CP、餐后2 h CP、INS均明显低于T2DM组;CP的ROC曲线也显示其鉴别诊断T1DM、T2DM的准确度较高。随着病程延长,T1DM的空腹CP、餐后2 h CP比T2DM下降更快、降幅更大。病程小于2.0年的T1DM组与T2DM组患者中,分别有79.17%(38/48)与16.19%(34/210)患者空腹CP低于参考范围下限(0.370 nmol/L)。病程大于5.0年的T1DM组患者中,95.00%(38/40)空腹CP水平低于0.370 nmol/L,其中60.00%(24/40)为检测低限值(0.003 nmol/L),提示胰岛β细胞功能衰竭;而在T2DM组仅21.63%(61/282)患者空腹CP水平低于0.370 nmol/L,且仅0.35%(1/282)为0.003 nmol/L。结果提示,CP水平越低,下降越快,T1DM的可能性越大;越高,下降趋势不明显或很慢,T2DM的可能性越大,与相关研究报道相符[15-17]。目前,国内外尚无公认的CP诊断界点,多数研究认为空腹CP小于0.2 nmol/L时,T1DM的可能性大。本研究中,当空腹CP以0.200 nmol/L为诊断界点时,灵敏度和特异度分别为63.0%、94.3%,可能与患者的构成及检测方法有关,还需扩大样本量,采取分层研究来确定合适的诊断界点。
综上所述,T1DM、T2DM患者的起病年龄、BMI值,以及血清GADA、IA-2A、ICA、ZnT8A、INS、CP、葡萄糖、HbA1c、TG 、HDL-C水平等指标均有明显差异,可辅助临床对两种糖尿病类型进行分型诊断和治疗。
[1]American Diabetes Association.Diagnosis and classification of diabetes mellitus[J].Diabetes Care,2012,35(Suppl 1):S64-71.
[2]Atkinson M,Eisenbarth GS,Michels AW.Type 1 diabetes[J].Lancet,2014,383(9911):69-82.
[3]Tuomi T,Santoro N,Caprio S,et al.The many faces of diabetes: a disease with increasing heterogeneity[J].Lancet,2014,383(9922):1084-1094.
[4]Shoenfeld Y,Gershwin ME,Meroni PL,et al.自身抗体[M].邹和建,译.2版.北京:人民卫生出版社,2009:287-294.
[5]Wilmot-Roussel H,Lévy DJ,Carette C,et al.Factors associated with the presence of glutamic acid decarboxylase and islet antigen-2 autoantibodies in patients with long-standing type 1 diabetes[J].Diabetes Metab,2013,39(3):244-249.
[6]顾愹,王知笑,杨慧,等.我国汉族1型糖尿病HLA基因与4种胰岛自身抗体关系的研究[J].中国糖尿病杂志,2012,20(12):881-888.
[7]王建平,张弛,林健,等.1型糖尿病患者胰岛自身抗体与人类白细胞抗原-DQ基因型的关系[J].中华医学杂志,2007,87(34):2380-2384.
[8]Siraj ES,Rogers DG,Gupta MK,et al.A simple screening method for individuals at risk of developing type 1 diabetes measurement of islet cell autoantibodies[J].Horm Metab Res,2012,44(11):855-860.
[9]周薇,杜静,陆红,等.胰岛细胞自身抗体对1型糖尿病诊断价值的研究[J].国际检验医学杂志,2012,33(14):1690-1691.
[10]Kong YH,Kim MS,Lee DY.Comparison of the prevalence of islet autoantibodies according to age and disease duration in patients with type 1 diabetes mellitus[J].Ann Pediatr Endocrinol Metab,2013,18(2):65-70.
[11]Kawasaki E,Kuriya G,Satoh T,et al.Humoral immune response to islet autoantigens in Japanese patients with type 1 diabetes[J].Ann N Y Acad Sci,2008(1150):248-251.
[12]赵玲,吕朝晖,杨国庆,等.成年起病的1型糖尿病临床分析[J].中华糖尿病杂志,2014,6(2):86-90.
[13]Ly LD,Twigg SM,Tran DT,et al.Most type 1 diabetes presenting as diabetic ketoacidosis in Vietnamese People is negative for pancreatic islet cell autoantibodies[J].Diabetes Res Clin Pract,2012,96(3):e63-e65.
[14]Wenzlau JM,Juhl K,Yu LP,et al.The cation efflux transporter ZnT8 (Slc30A8) is a major autoantigen in human type 1 diabetes[J].Proc Natl Acad Sci U S A,2007,104(43):17040-17045.
[15]陶文玉,李奕平,徐凡.92例青壮年糖尿病临床分析[J].重庆医学,2013,42(6):642-644.
[16]吴艺捷,胡远峰,赵立,等.糖尿病患者胰岛自身抗体与β细胞功能的关系[J].中华内分泌代谢杂志,2003,19(1):17-20.
[17]Jones AG,Hattersley AT.The clinical utility of C-peptide measurement in the care of patients with diabetes[J].Diabet Med,2013,30(7):803-817.
Application value of serum pancreatic isled autoantibodies and biochemical indicators in classification diagnosis of diabetes mellitus*
ZhouHui1,LiZhengkang1,XuXiaoming2,JiangChuwen3,YanYongzhi1,PeiJianhao4△
(1.DepartmentofClinicalLaboratory,GuangdongAcademyofMedicalSciences/GuangdongGeneralHospital,Guangzhou,Guangdong510080,China;2.GuangzhouMunicipalWomenandChildren′sMedicalCenter,Guangzhou,Guangdong510623,China;3.GuangdongCenterforClinicalLaboratory,GuangdongAcademyofMedicalSciences/GuangdongGeneralHospital,Guangzhou,Guangdong510120,China;4.DepartmentofEndocrinology,GuangdongAcademyofMedicalSciences/GuangdongGeneralHospital,Guangzhou,Guangdong510080,China)
ObjectiveTo investigate the application value of serum pancreatic isled autoantibodies and biochemical indicators in classification diagnosis of type 1 diabetes mellitus (T1DM) and type 2 diabetes mellitus (T2DM).MethodsThe clinical data and laboratory detection results in 99 cases of T1DM and 577 cases of T2DM were retrospectively analyzed.The levels of pancreatic isled autoantibodies and biochemical indicators were compared between the two groups and their characteristics were analyzed.ResultsThe positive rates of single detection and combine detection of glutamic acid decarboxylase autoantibodies(GADA),insulinoma-associated antigen-2 autoantibodies(IA-2A),islet cell autoantibodies (ICA) and ZnT8 autoantibodies(ZnT8A) in the T1DM group were higher than those in the T2DM group,the differences were statistically significant(P<0.05).The onset age,fasting and postprandial 2 h CP,fasting and postprandial 2 h insulin(2 h INS),triglyceride(TG) and body mass index (BMI) in the T1DM group were lower than those in the T2DM group,while the levels of fasting and postprandial 2h blood glucose,glycosylated hemoglobin(HbA1c) and high-density lipoprotein cholesterol(HDL-C) were higher than those in the T2DM group,the differences were statistically significant (P<0.05); however total cholesterol and low-density lipoprotein cholesterol levels had no statistical difference between the T1DM group and T2DM group (P>0.05).Moreover,the fasting and postprandial 2 h CP levels in the T1DM group showed decreasing trend as the T1DM course extending,and the difference had statistical difference among different disease courses; but the fasting and postprandial 2 h CP levels in the T2DM group had no obvious decreasing trend.The areas under the receiver operating characteristic(ROC) curve of fasting and postprandial 2 h CP for differential diagnosis of T1DM and T2DM in the patients with the disease course < 2 year were 0.902(95%CI: 0.850-0.954) and 0.905(95%CI: 0.852-0.958) respectively.The suitable threshold value of fasting CP was 0.283 nmol/L,its sensitivity and specificity were 82.6% and 89.2%,respectively,which of postprandial 2 h CP was 0.421 nmol/L,its sensitivity and specificity were 84.8% and 89.2% respectively.ConclusionT1DM and T2DM are different in onset age,BMI value,serum GADA,IA-2A,ICA,ZnT8A,insulin,CP,glucose,HbA1c,TG and HDL-C levels,which may assist clinic in their classification diagnosis.
C-peptide;autoantibodies;blood chemical analysis;diabetes mellitus,type 1;diabetes mellitus,type 2
中华医学会临床医学科研专项资金项目(13040430428);广东省药学会科学研究基金项目(2012C14)。作者简介:周晖(1969-),主任技师,硕士,主要从事临床免疫学研究。△
,E-mail:jianhaopei@163.com。
R587.1
A
1671-8348(2016)21-2909-05
2016-01-20
2016-04-07)
论著·临床研究doi:10.3969/j.issn.1671-8348.2016.21.009

