经导管主动脉瓣膜置换术后房室传导阻滞的预警
于海波 综述 梁延春 审校
(沈阳军区总医院心内科,辽宁 沈阳110016)
经导管主动脉瓣膜置换术后房室传导阻滞的预警
于海波综述梁延春审校
(沈阳军区总医院心内科,辽宁 沈阳110016)
经导管主动脉瓣置换术是外科手术高危的主动脉瓣狭窄患者的有效替代治疗方式,但术后发生房室传导阻滞并需要植入起搏器的患者比例增高。术后的希氏束与心室之间间期、术后与术前希氏束与心室之间间期之差、术前合并完全性右束支传导阻滞、术后新发的左束支传导阻滞等均为经导管主动脉瓣置换术相关房室传导阻滞的预警因素。
主动脉瓣狭窄;经导管主动脉瓣置换术;传导阻滞
主动脉瓣狭窄是老年人中最常见的瓣膜病,随着年龄的增长,患病率逐年升高。年龄超过65岁的老年人患病率为2%~7%,主要原因可能是在动脉硬化的形成过程中发生慢性退行性钙化及隐匿性炎症反应。一旦严重的主动脉瓣狭窄患者出现临床症状或进展到左室收缩功能障碍期,远期寿命将明显减少。外科主动脉瓣置换术一直是症状性主动脉瓣狭窄的主要治疗方式;但许多老年人由于伴发疾病多,常常无法耐受外科手术。近10年来,经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)取得了较大的进步,为那些有较高的手术风险、高龄、左室收缩功能减退和存在手术禁忌证的患者提供了一种全新的疗法。
1 TAVR概述
TAVR是一种微创的治疗方式,不需要心脏停跳及心肺分流术,经股动脉逆行途径或经心尖逆行途径将人工主动脉瓣经导管植入在病变的主动脉瓣位置,并通过机械挤压将原瓣膜挤向周围。目前临床应用比较成熟的瓣膜产品主要有两种:由球囊扩张展开的Edwards-SAPIEN瓣膜支架系统和自膨式支架展开的CoreValve瓣膜系统。上述两种瓣膜支架均在2008年获得欧盟认证并投入使用。在欧洲完成的多中心SOURCE注册研究中,463例SAPIEN瓣膜支架经股动脉TAVR手术成功率为95.2%,575例经心尖TAVR成功率为92.7%[1];CoreValve的手术成功率超过92%。
2012年美国心脏病学会基金会、美国胸外科学会、美国心血管造影和介入学会和美国胸外科医师学会联合发布了“TAVR专家共识”[2]。该共识提出TAVR主要适合于外科手术禁忌和外科手术高危的患者,其依据来源于PARTENER研究的结论。PARTNER-A研究证实,对于外科手术高危的重度主动脉瓣狭窄患者,TAVR与外科手术效果相当[3],PARTNER-B研究证实,对于外科手术禁忌的重度主动脉瓣狭窄患者,TAVR优于传统保守治疗。PARTNER研究为TAVR的安全性及有效性提供令人信服的证据,具有里程碑意义。
2 TAVR术后发生房室传导阻滞的可能机制
TAVR早期的并发症包括脑卒中、冠状动脉闭塞、植入永久心脏起搏器(PPM)、血管并发症、肾功能衰竭、心脏破裂、心包压塞、出血、主动脉夹层和死亡。与传统的外科开胸进行主动脉瓣置换相比,TAVR术后发生房室传导阻滞(AVB)并需植入PPM的比例增高[4]。应用SAPIEN瓣膜TAVR术后需植入PPM患者比例为7%~22%;应用CoreValve瓣膜为19.2%~42.5%[5-7]。
希氏束在无冠状动脉窦和右冠状动脉窦交界的下方室间隔膜部穿越,并在室间隔肌部上方分为左右束支,分别走形于左右心室心内膜下。因此TAVR术后植入的人工瓣膜在高位对房室结或希氏束压迫导致其炎症水肿可能为高度AVB发生的机制。植入的人工瓣膜更容易压迫走行在左室心内膜下的左束支,表现为TAVR术后出现左束支传导阻滞(LBBB)。CoreValve瓣膜支架较长,安放时支架压迫所致的传导束损伤更广泛,导致CoreValve瓣膜术后发生传导阻滞较SAPIEN瓣膜增多[8]。
3 TAVR相关的AVB的预警指标
目前TAVR所应用的手术器械及手术方式决定了TAVR术后可能有较高的AVB发生率和需植入PPM比例,因此针对AVB可能发生的一些预警指标进行研究十分必要。
3.1心腔内电图指标预警TAVR相关的AVB
通过电生理检查方法获得心腔内心电图可明确观察到AVB的发生及发生部位。心腔内心电图可定位AVB阻滞发生的部位,心房-希氏束之间(AH)传导延迟提示心房至希氏束传导障碍,而希氏束与心室之间(HV)延迟提示希氏束内或希氏束以下传导障碍。既往临床研究表明,心腔内电图中术前的AH间期、HV间期、术前术后HV间期之差(Δ-HV间期)、术后HV间期的长度可能是TAVR相关AVB的预警因素[9-11]。
新近发表的加拿大蒙特利尔心脏中心的研究[12],是目前较大规模且经过长期随访的关于TAVR手术后发生AVB及需植入PPM的预警方法研究。该研究中前瞻性观察了75例老年患者TAVR术前及术后的电生理检查结果,平均年龄82岁,术前无起搏器的适应证,64例(88%)使用CoreValve瓣膜,11例使用SAPIEN瓣膜,平均住院日10 d,随访观察1.4年。14例发生了完全性AVB,均为植入CoreValve瓣膜的患者,11例发生在住院期间,3例发生在出院后。患者的发病特点如下:术前存在右束支传导阻滞(RBBB)的6例患者5例发生了AVB(83.3%),30例新发LBBB中8例发生了AVB(26.7%),7例术前LBBB中1例发生了AVB(14.3%),在单因素分析中,术前存在RBBB、新发LBBB,TAVR术后的QRS间期、术后QRS时程与术前QRS时程之差(Δ-QRS)、TAVR术后HV间期、Δ-HV间期均与完全性AVB的发生有明显的相关性。而在多因素分析中,Δ-HV间期是唯一与AVB相关的独立预测因素,在新发LBBB的亚组,术后HV间期与AVB密切相关。Δ-HV间期预测AVB的敏感性为100%、特异性为84.4%。术后HV间期>65 ms预测AVB敏感性为83.3%、特异性为81.6%。在多因素分析中,TAVR术后HV间期是全因死亡的独立预测因素。此研究结果发现,TAVR术后延长的HV间期(Δ-HV≥13 ms)与完全性AVB的发生密切相关,在术后新发LBBB的患者人群,术后HV间期≥65 ms是发生AVB的预测因素。
笔者认为,由于人工主动脉瓣膜的类型和主动脉瓣其所在的特殊结构,TAVR术后发生AVB不易完全避免,故对于术后AVB的预警尤其重要,心腔内心电图预测TAVR术后是否出现AVB有明确的优势,虽然电生理检查会增加TAVR手术的时间,但可减少术后患者的危险,做到及时预警,并可提供围手术期的临时起搏保障,故推荐TAVR围术期根据电生理检查结果指导AVB的处理。蒙特利尔心脏中心[12]建议的电生理预警流程值得推荐(图1)。
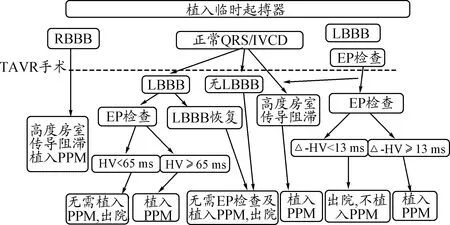
注:EP:电生理;IVCD:室内传导延迟[12]
图1TAVR术后临床管理流程建议图
3.2术前体表心电图指标预警TAVR相关的AVB
在术前体表心电图中,明确预测AVB的指标为RBBB。
许多的临床研究表明,术前RBBB与TAVR术后发生AVB有明确的相关性,一项在822例人群匹配后的老年患者中进行的TAVR(SAPIEN)或外科主动脉瓣置换术的研究中,共44例患者发生了AVB,其中TAVR组占30例,而外科主动脉瓣置换术组只有14例,所以TAVR术后比外科主动脉瓣置换术后需要植入PPM的比例高(7.3% vs 3.4%,P=0.014)。更重要的是在TAVR组发现,术前存在RBBB的患者35%发生了AVB且需要PPM植入,而在术前不存在RBBB的患者只有5.9%发生了AVB,提示术前存在RBBB是TAVR术后需要植入PPM的唯一相关因素[4]。Calvi等[8]对181例进行CoreValve瓣膜置换的主动脉瓣病变患者进行4年的随访,其中52例发生了永久AVB并需要植入PPM,研究发现虽然LBBB是术后常见的心电图表现,出院前发生率为50.3%,其长期存在的可能性及临床意义并不确定;但可明确的是,术前RBBB是预测术后植入PPM的重要指标。
在Rivard等[12]的研究中,术前存在RBBB的6例患者中5例发生了AVB,术前存在RBBB患者在TAVR术后发生AVB的比例达83.3%,较Bagur等[4]研究中观察到的35%明显增高,可能与Rivard等研究的基数偏小,以及两个研究所主要使用的瓣膜类型不同有关(Rivard等的研究为CoreValve瓣膜,Bagur等的研究为SAPIEN瓣膜);但两者得出的结论都是一致的,术前存在RBBB的患者TAVR术后并发AVB的可能性明显增高,故临床医生可通过这一指标在术前充分评估术后风险。
心电图中可能还有其他一些指标与TAVR术后AVB相关,如术前的PR间期、QRS宽度、心电轴偏移程度等;但由于循证医学的证据有限,故目前针对这些指标还没有确定的研究结论。
4 TAVR术后发生AVB的其他预测因子
TAVR术后发生AVB的其他预测因素还包括植入瓣膜的类型、深度、自身主动脉瓣环的大小、室间隔的厚度、左心室流出道内径等。Bleiziffer等[13]的研究入选了159例TAVR患者,其中22%需要植入PPM,患者的主动脉瓣环小而植入的人工瓣膜大则其发生AVB的危险增加2倍;置入CoreValve瓣膜发生AVB的风险是SAPIEN瓣膜的4倍,该研究认为大的人工瓣膜对相对小的瓣环产生的机械压迫和CoreValve瓣膜相对大的压迫覆盖面积是AVB风险度增加的因素。Jilaihawi等[14]对30例应用CoreValve瓣膜进行TAVR患者的研究提示,1/3患者TAVR术后需植入PPM,如果基线资料存在LBBB伴电轴左偏、室间隔厚度>17 mm和无冠状动脉瓣厚度>8 mm,则预测TAVR术后需植入PPM的灵敏度为75%、特异度100%。Baan等[15]研究了34例应用CoreValve瓣膜进行TAVR的患者,7例需植入PPM,分析7例患者的临床资料发现,其左室流出道直径相对较小、二尖瓣环钙化严重且心电向量轴更加偏左。多项研究提示人工瓣膜植入的深度是新发LBBB[16]、需要植入PPM[17]和发生AVB[18]的预测因子;与SAPIEN瓣膜植入相比,自膨式CoreValve瓣膜植入后需进行PPM治疗的比例明显增高[7,13,19-21]。
5 结语
随着主动脉瓣膜支架设计技术的改进及TAVR手术在临床上的熟练开展,TAVR术后相关的AVB发生比例有望进一步减少,目前比较确定的是TAVB术后相关AVB发生的预警因素主要包括瓣膜支架类型、术前存在RBBB、术后新发LBBB、术后HV间期及Δ-HV间期。
[1]Thomas M, Schymik G, Walther T, et al. Thirty-day results of the SAPIEN aortic Bioprosthesis European Outcome (SOURCE) Registry: a European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve[J]. Circulation,2010,122(1):62-69.
[2]Holmes DR Jr, Mack MJ, Kaul S, et al. 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement[J]. J Am Coll Cardiol,2012,59(13):1200-1254.
[3]Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients[J]. N Engl J Med,2011,364(23):2187-2198.
[4]Bagur R, Rodés-Cabau J, Gurvitch R, et al. Need for permanent pacemaker as a complication of transcatheter aortic valve implantation and surgical aortic valve replacement in elderly patients with severe aortic stenosis and similar baseline electrocardiographic findings[J]. JACC Cardiovasc Interv,2012,5(5):540-551.
[5]Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients[J]. N Engl J Med,2011,36(4):2187-2198.
[6]Zahn R, Gerckens U, Grube E, et al.Transcatheter aortic valve implantation: first results from a multi-centre real-world registry[J]. Eur Heart J,2011,32:198-204 .
[7]Thomas M, Schymik G, Walther T, et al. Thirty-day results of the Sapien Aortic Bioprosthesis European outcome (SOURCE) registry: a European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve[J]. Circulation,2010,122:62-69.
[8]Calvi V, Conti S, Pruiti GP, et al. Incidence rate and predictors of permanent pacemaker implantation after transcatheter aortic valve implantation with self-expanding CoreValve prosthesis[J].J Interv Card Electrophysiol, 2012,34(2):189-195.
[9]Akin I, Kische S, Paranskaya L, et al. Predictive factors for pacemaker requirement after transcatheter aortic valve implantation[J]. BMC Cardiovasc Disord,2012,12:87.
[10]Akin I, Kische S, Schneider H, et al. Surface and intracardiac ECG for discriminating conduction disorders after CoreValve implantation[J]. Clin Res Cardiol,2012,101:357-364.
[11]Eksik A, Gul M, Uyarel H, et al. Electrophysiological evaluation of atrioventricular conduction disturbances in transcatheter aortic valve implantation with Edwards SAPIEN prosthesis[J]. J Invasive Cardiol,2013,25(6):305-309.
[12]Rivard L, Schram G, Asgar A, et al. Electrocardiographic and electrophysiological predictors of atrioventricular block after transcatheter aortic valve replacement[J]. Heart Rhythm,2015,12(2):321-329.
[13]Bleiziffer S, Ruge H, Horer J,et al. Predictors for new-onset complete heart block after transcatheter aortic valve implantation[J]. JACC Cardiovasc Interv,2010,3: 524-530.
[14]Jilaihawi H, Chin D, Vasa-Nicotera M, et al. Predictors for permanent pacemaker requirement after transcatheter aortic valve implantation with the CoreValve bioprosthesis[J]. Am Heart J,2009,157:860-866.
[15]Baan J Jr, Yong ZY, Koch KT, et al. Factors associated with cardiac conduction disorders and permanent pacemaker implantation after percutaneous aortic valve implantation with the CoreValve prosthesis[J]. Am Heart J,2010,159:497-503.
[16]Piazza N, Onuma Y, Jesserun E, et al. Early and persistent intraventricular conduction abnormalities and requirements for pacemaking after percutaneous replacement of the aortic valve[J]. JACC Cardiovasc Interv,2008,1:310-316.
[17]Fraccaro C, Buja G, Tarantini G, et al. Incidence, predictors, and outcome of conduction disorders after transcatheter self-expandable aortic valve implantation[J]. Am J Cardiol,2011,107:747-754.
[18]Urena M, Mok M, Serra V, et al. Predictive factors and long-term clinical consequences of persistent left bundle branch block following transcatheter aortic valve implantation with a balloon-expandable valve[J]. J Am Coll Cardiol,2012,60: 1743-1752.
[19]Dawkins S, Hobson AR, Kalra PR, et al. Permanent pacemaker implantation after isolated aortic valve replacemen incidence, indications, and predictors[J]. Ann Thorac Surg,2008,85:108-112.
[20]Limongelli G, Ducceschi V, D’Andrea A, et al. Risk factors for pacemaker implantation following aortic valve replacement: a single centre experience[J]. Heart,2003,89:901-904.
[21]Houthuizen P, van Garsse LA, Poels TT, et al. Left bundle-branch block induced by transcatheter aortic valve implantation increases risk of death[J].Circulation,2012,126:720-728.
Predicting Factors of Atrioventricular Block after Transcatheter Aortic Valve Replacement
YU Haibo,LIANG Yanchun
(DepartmentofCardiology,TheGeneralHospitalofShenyangMilitaryRegion,Shenyang110016,Liaoning,China)
Transcatheter aortic valve replacement(TAVR) is an effective therapy method for aortic stenosis patients intolerable surgical aortic valve replacement. While it is known that the requirement for permanent pacing is higher because of subsequent atrioventricular block. The postprocedural HV interval,a prolonged delta-HV interval,RBBB before TAVR and a new-onset LBBB after TAVR are strongly associated with atrioventricular block.
Aortic valve stenosis;Transcatheter aortic valve replacement;Conduction disturbances
2016-04-22修回日期:2016-05-25
于海波(1974—),副主任医师,博士,主要从事心脏起搏与心电生理研究。Email:yuhaibo-74@126.com
梁延春(1966—),主任医师,博士,主要从事心脏起搏与心电生理研究。Email:liangyanchun@sina.com
R654.2
A【DOI】10.16806/j.cnki.issn.1004-3934.2016.04.024

