舒芬太尼对大鼠胚胎神经干细胞增殖、凋亡及分化的影响
赵 方 银 瑞
(郑州大学附属南阳中心医院麻醉科,河南 南阳 473000)
舒芬太尼对大鼠胚胎神经干细胞增殖、凋亡及分化的影响
赵方银瑞1
(郑州大学附属南阳中心医院麻醉科,河南南阳473000)
目的研究不同浓度舒芬太尼对大鼠胚胎神经干细胞增殖、凋亡和分化的影响。方法从孕14 d的Wistar大鼠中分离胚胎神经干细胞并培养,采用神经干细胞标记蛋白Nestin免疫荧光染色对胚胎神经干细胞进行鉴定;BrdU渗入法检测不同浓度舒芬太尼对胚胎神经干细胞增殖的影响;采用流式细胞仪检测不同浓度舒芬太尼对胚胎干细胞凋亡的影响;NeuN/DAPI、GFAP/DAPI双染标记神经元细胞和星形胶质细胞以检测不同浓度苏芬太尼对胚胎干细胞分化的影响。结果从孕14 d的Wistar大鼠中分离得到大鼠胚胎神经干细胞,经过不同浓度的舒芬太尼处理后,发现低浓度(0.5 nmol/L)的舒芬太尼对胚胎神经干细胞的增殖、凋亡和分化没有明显影响,而随着剂量增大至中浓度(5 nmol/L)时可以引起细胞的凋亡和分化,增加至高浓度(50 nmol/L)时可以抑制胚胎神经干细胞的增殖。结论高剂量的舒芬太尼可能通过影响中枢神经系统发育过程中神经干细胞的增殖、凋亡和分化,进而影响神经系统发育。
舒芬太尼;神经干细胞;胚胎神经干细胞;增殖;凋亡;分化
在所有阿片类制剂中,舒芬太尼的镇痛效果最强〔1〕,但是,目前舒芬太尼对神经干细胞的影响尚未见报道。神经干细胞具有多向分化的潜能,还具有很强的跨系或跨胚层分化潜能,能够转化为造血细胞并重建造血系统,还能够分化为肌细胞。因此,神经干细胞也被称为神经多潜能干细胞〔2~5〕。另外,神经干细胞具有自我维持和更新能力,通过对称分裂和不对称分裂,能够在某一确定部位维持稳定的数量,并在必要时进行增殖〔6〕。本研究旨在研究不同浓度舒芬太尼对胚胎神经干细胞增殖、凋亡及分化的影响。
1 材料和方法
1.1材料实验于2014年6月至2015年8月在郑州大学附属南阳中心医院病理实验室完成。舒芬太尼(枸橼酸舒芬太尼注射液)购买自宜昌人福药业有限公司,使用磷酸盐缓冲液(PBS)配成母液(100 nmol/L),-20℃的冰箱保存备用。Wistar大鼠20只购自中国科学院上海实验动物中心。分为对照组(等体积PBS缓冲液),低浓度组(0.5 nmol/L),中浓度组(5 nmol/L)及高浓度组(50 nmol/L)。BrdU(美国Sigma-Aldrich),DMEM/F12细胞培养液(美国Hyclone),B27添加剂、N2添加剂、BFGF、EGF(美国Sigma-Aldrich),Nestin单克隆抗体、NeuN单克隆抗体、GFAP单克隆抗体、BrdU单克隆抗体(美国Chemicon),FITC荧光标记二抗(北京中杉公司),Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司),流式细胞仪(美国BD公司),免疫荧光分析仪(美国perkin Elmer)。
1.2方法
1.2.1胚胎神经干细胞的分离及培养将孕14 d的Wistar大鼠颈椎脱臼处死,常规分离出胚胎大脑,PBS冲洗,无菌条件下去除头皮及脑膜,分离出脑组织。将分离出的脑组织剪切成细小组织块,胰蛋白酶消化,吹打,过滤后,离心。细胞沉淀用无血清培养液(DMEM/F12 1∶1)洗涤2次,加入神经干细胞培养液〔DMEM/F12,含2%B27,1% N2添加剂,20 ng/ml表皮生长因子(EGF),20 ng/ml碱性成纤维细胞生长因子(bFGF),青霉素200 U/L及链霉素100 U/L,pH7.4〕。将细胞吹打成单细胞悬液后,台盼蓝染色进行细胞计数,培养瓶中接种密度为4×109/L。原代克隆形成后,6~9 d克隆传代1次,每2~3 d半量换液,培养条件为37℃、5%CO2、饱和湿度的培养箱。
1.2.2胚胎神经干细胞鉴定取传代2次的细胞悬液滴入多聚赖氨酸包被的玻片上,待细胞贴壁后,4%多聚甲醛室温固定30 min,PBS清洗3次,加入0.25%的Triton-100孵育5 min,再以山羊血清封闭30 min。封闭结束后,加入抗Nestin单克隆抗体4℃过夜,PBS清洗3次后,加入异硫氰基荧光素(FITC)标记的二抗,室温孵育60 min,PBS清洗3次,封片,荧光显微镜下观察。
1.2.3细胞增殖检测将细胞以5×104个/孔接种于多聚赖氨酸包被过得48孔板中。待细胞贴壁后,药物处理组加入舒芬太尼,使终浓度为0.5、5、50 nmol/L,对照组加入等体积的PBS,继续培养24 h,每孔5 μmol/L BrdU,继续培养24 h,PBS清洗后95%乙醇固定30 min,BrdU和4′-6-二脒基-二苯基吲哚(DAPI)双染,荧光显微镜下观察,记录阳性细胞数。
1.2.4细胞凋亡检测取传代2次的神经干细胞球,吹打成单细胞悬液,并将计数后的细胞悬液加入6孔板中,每孔约5×105个。待细胞完全贴壁后,加入舒芬太尼,使终浓度为0.5、5、50 nmol/L,对照组加入等体积的PBS,继续培养48 h。孵育完成后,胰蛋白酶消化并收集每孔的细胞,预冷的PBS清洗3次。70%的乙醇固定,4℃过夜,离心弃去固定液,PBS清洗2次,再用Binding Buffer重悬,每孔加入各5 μl的Annexin V-FITC和PI,室温避光反应后,流式细胞仪进行分析,计算细胞凋亡率。
1.2.5胚胎神经干细胞分化检测将传代2~3次生长良好的神经球吹打成单细胞悬液,以1×105/孔的密度接种于多聚赖氨酸包被过的48孔板中,待细胞贴壁后,更换培养液为含10%胎牛血清的神经干细胞培养液,并在培养液中加入工作浓度为0.5、5、50 nmol/L的舒芬太尼,空白对照加入等体积的PBS缓冲液。继续培养48 h后,更换培养液为不含药物的干细胞培养液,72 h后固定细胞,分别进行NeuN/DAPI、GFAP/DAPI双染标记神经元细胞和星形胶质细胞,观察细胞并计数。
1.3主要观察指标大鼠胚胎神经干细胞的分离及鉴定,不同浓度的舒芬太尼对大鼠胚胎神经干细胞增殖、凋亡及分化的影响。
1.4统计学方法应用SPSS14.0软件进行t检验或单因素方差分析。
2 结 果
2.1大鼠胚胎神经干细胞分离培养及鉴定结果在分离出的胚胎干细胞原代培养2~3 d后可见由单个细胞形成的神经球或数个细胞聚集形成的神经球悬浮于培养液中,在培养5~7 d后可见悬浮的神经球数目明显增多,经过几代培养后,只有具备自我更新能力的神经干细胞能够存活并增殖成悬浮生长的神经干细胞球。利用Nestin免疫荧光染色观察结果显示,神经干细胞增殖形成的细胞团有显著的荧光这色现象,证明了神经干细胞呈现Nestin阳性,神经球主要是由神经干细胞组成的。见图1。
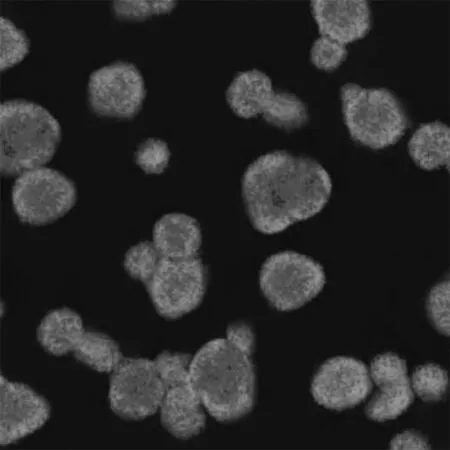
图1 Nestin免疫荧光染色结果(×100)
2.2舒芬太尼对胚胎神经干细胞增殖的影响对照组的阳性细胞比例为(45.68±6.98)%,舒芬太尼低浓度剂量组为(42.95±3.96)%,与对照组相比无显著差异(P>0.05);中浓度剂量组为(39.95±4.56)%,与对照组相比无显著性差异(P>0.05);高浓度剂量组为(32.26±3.25)%,与对照组相比差异显著(P<0.05)。
2.3舒芬太尼对胚胎神经干细胞凋亡的影响不同浓度的舒芬太尼处理大鼠胚胎干细胞48 h后,对照组细胞的凋亡率为(21.92.26±2.98)%,低浓度处理组为(24.56±2.59)%,与对照组相比无统计学差异(P>0.05);中浓度处理组为(31.65±3.36)%,与对照组相比有统计学差异(P<0.05);高浓度组为(38.86±4.26)%,与对照组相比,差异极显著(P<0.01)。
2.4舒芬太尼对胚胎神经干细胞分化的影响使用NeuN/DAPI、胶质纤维酸性蛋白(GFAP)/DAPI双染标记神经元细胞及星形胶质细胞,荧光显微镜观察结果显示,对照组中神经元细胞的比例为(15.16±1.87)%,星形胶质细胞的比例为(14.89±1.68)%;舒芬太尼低剂量组分别为(18.59±1.36)%,(16.20±1.68)%,与对照组相比无显著差异(P>0.05);中剂量组分别为(21.56±3.69)%,(25.56±2.45)%,与对照组相比差异显著(P<0.05);高剂量组分别为(26.23±2.35)%和(28.26±2.65)%,与对照组相比差异显著(P<0.05)。
3 讨 论
随着对舒芬太尼研究的不断深入,其应用范围也在不断地扩大。杨金凤等〔7〕报道,舒芬太尼在临床常用剂量范围内对肝癌细胞的增殖和凋亡无明显影响,但随着浓度的增加,舒芬太尼可以抑制肝癌细胞的增殖、诱导细胞的凋亡、并将细胞周期阻滞在G1期。高巍等〔8〕报道,不同浓度的舒芬太尼处理肝癌(Hep3B)细胞可以降低细胞活性、使细胞周期阻滞在G0/G1期,诱导细胞凋亡、降低survivin蛋白的表达量,提高(caspase-3)蛋白的表达量。还有研究显示,不同浓度的舒芬太尼可以抑制H9C2细胞缺氧复氧后损伤,提高细胞的活力,说明舒芬太尼可以浓度依赖性的增强细胞抗缺氧复氧损伤能力〔9〕。
神经干细胞的分离主要是利用培养基筛选出能够在该条件下存活并增殖的神经干细胞群(神经球),而成熟的神经细胞则无法较长时间的存活。首先将神经组织通过机械方法制备成单细胞并培养与含有特殊营养添加剂和促增殖因子的无血清培养基中,经过一段时间的培养,即可获得呈神经球状生长的神经干细胞群体〔10〕。本实验神经干细胞呈神经球状生长,将神经球吹打分散成单细胞后,单个细胞即可增殖成神经球,也可由数个细胞聚集形成小神经球结构,这种小的神经球再增殖成较大的神经球。
BrdU是胸腺嘧啶核苷类似物,可以取代可代替胸腺嘧啶核苷插入正在复制的DNA双链中并进入子代细胞中,通过检测DNA中BrdU的含量来特异性的显示增殖状态的细胞,实验动物体内无内源性的BrdU存在〔11〕。本研究提示高剂量的舒芬太尼可能干扰中枢神经系统发育过程中神经干细胞的增殖,从而对神经系统发育产生影响。
Bovill等〔12〕报道,临床上有效靶控舒芬太尼的低、中剂量浓度为0.4~0.8 ng/ml,大剂量浓度为4~6 ng/ml,可单位换算为0.01~0.016 μmol/L。本研究结果提示,高剂量的舒芬太尼可能通过影响中枢神经系统发育过程中神经干细胞的增殖、凋亡和分化,进而影响神经系统发育。
1Hakkim A,Kirubahar R,Kanna V,etal.Comparative study of 0.5% hyperbaric bupivacaine with sufentanil(5 μg)and 0.5% hyperbaric bupivacaine for spinal anesthesia〔J〕.Int J,2015;20151193.
2Song J,Zhong C,Bonaguidi MA,etal.Neuronal circuitry mechanism regulating adult quiescent neural stem-cell fate decision〔J〕.Nature,2012;489:150-4.
3Streckfuss-Bömeke K,Wolf F,Azizian A,etal.Comparative study of human-induced pluripotent stem cells derived from bone marrow cells,hair keratinocytes,and skin fibroblasts〔J〕.Eur Heart J,2013;34(33):2618-29.
4Azim K,Fischer B,Hurtado-Chong A,etal.Persistent wnt/β-catenin signaling determines dorsalization of the postnatal subventricular zone and neural stem cell specification into oligodendrocytes and glutamatergic neurons〔J〕.Stem Cells,2014;32(5):1301-12.
5Jiang Y,Habibollah S,Tilgner K,etal.An induced pluripotent stem cell model of hypoplastic left heart syndrome(HLHS)reveals multiple expression and functional differences in hlhs-derived cardiac myocytes〔J〕.Stem Cells Transl Med,2014;3(4):416-23.
6Azevedo-Pereira RL,Daadi MM.Isolation and purification of self-renewable human neural stem cells for cell therapy in experimental model of ischemic stroke〔J〕.Methods Mol Biol,2013;1059:157-67.
7杨金凤,孙瑛玮,孙辉平,等.舒芬太尼对体外培养hepg2细胞增殖及细胞凋亡的影响〔J〕.肿瘤药学,2011;1(2):121-4.
8高巍,张晓琪,景桂霞,等.舒芬太尼抑制肝癌HepGb细胞活性及促进凋亡作用〔J〕.西安交通大学学报:医学版,2015;36(3):479-82.
9王婕,屠伟峰,余杰,等.舒芬太尼预处理对h9c2细胞缺氧复氧损伤后细胞活力和乳酸脱氢酶活性的影响〔J〕.广东医学,2010;31(8):948-50.
10申茉函,王全才,颜炜群,等.人胚胎神经干细胞的分离培养及鉴定〔J〕.解剖科学进展,2015;21(2):188-91.
11Duque A,Rakic P.Identification of proliferating and migrating cells by brdu and other thymidine analogs:benefits and limitations〔J〕.Immunocytochem Relat Techniq,2015;(101):123-39.
12Bovill JG,Sebel PS,Blackburn CL,etal.The pharmacokinetics of sufentanil in surgical patients〔J〕.Anesthesiology,1984;61(5):502-6.
〔2015-10-26修回〕
(编辑袁左鸣)
10.3969/j.issn.1005-9202.2016.14.022
赵方(1981-),女,主治医师,主要从事麻醉学基础研究。
R614
A
1005-9202(2016)14-3402-03;
1郑州大学附属南阳中心医院胸外科

