TS-1催化转化乙烯制备乙二醇
张嘉霖, 孙培永, 张胜红, 姚志龙
(1.北京石油化工学院 化学工程学院, 恩泽生物质精细化工北京市重点实验室, 北京 102617;2.北京化工大学 生命科学与技术学院, 北京 100029)
TS-1催化转化乙烯制备乙二醇
张嘉霖1,2, 孙培永1, 张胜红1, 姚志龙1
(1.北京石油化工学院 化学工程学院, 恩泽生物质精细化工北京市重点实验室, 北京 102617;2.北京化工大学 生命科学与技术学院, 北京 100029)
摘要:以钛硅分子筛TS-1为催化剂,以H2O2为氧化剂,详细考察了间歇式反应釜中催化剂 n(Si)/n(Ti)、反应温度、压力、H2O2浓度等参数对乙烯催化转化制备乙二醇反应的影响。结果表明,分子筛骨架钛物种含量的增加有利于提高H2O2的有效利用率和产物乙二醇的选择性,反应过程中催化剂的部分失活可能源于其表面吸附有机物种而导致的骨架钛位点可及度的降低。在反应温度60℃、乙烯压力0.5 MPa、H2O2浓度0.83 mol/L的条件下,采用n(Si)/n(Ti)为50的TS-1催化剂催化乙烯转化制备乙二醇,H2O2的有效利用率和乙二醇的选择性可以分别达到85.63%和95.57%。
关键词:乙烯; 乙二醇; 双氧水; 钛硅分子筛; 催化转化
乙二醇(EG)是一种重要的化工原料,广泛应用于生产聚酯薄膜、纤维和聚对苯二甲酸乙二醇酯(PET)树脂,以及用作防冻剂的主要成分[1]。据TechNavio公司的市场分析报告[2],在未来几年全球乙二醇的市场需求仍将以每年4.7%的速率递增。目前,乙二醇的工业化生产主要经由乙烯环氧化制备环氧乙烷(EO)和环氧乙烷水解制备乙二醇两个步骤。银基催化剂催化乙烯的环氧化反应是一个已经工业化的工艺。但为了保持反应气氛中环氧乙烷的浓度在可燃范围之外,乙烯环氧化反应的单程收率通常介于4%~8%,总的环氧乙烷的选择性大约为85%,CO2的选择性则高达15%。环氧乙烷水解制备乙二醇过程中,由于二聚乙二醇(DEG)和三聚乙二醇(TEG)的生成,乙二醇的选择性通常不超过95%[3-4]。 考虑到乙烯的有效利用率以及低的投资成本和产物分离所需能耗,直接催化转化乙烯制备乙二醇具有非常重要的应用价值。
Wu等[5]在1980年首先申请了乙烯直接催化转化制备乙二醇的专利。在该专利中,他们分别以四氧化锇和叔丁基过氧化氢为催化剂和氧化剂,在含有水相和有机相的两相反应体系中实现了乙烯向乙二醇的催化转化。高爽等[6-7]在后续工作中改进了上述反应体系,以具有反应控制相转移特点的磷钨杂多酸季铵盐为催化剂,在双氧水和有机溶剂的混合溶液中实现了乙烯向乙二醇的催化转化。由于TS-1分子筛在温和的反应条件下具有优异的选择氧化烯烃的反应性能[8-16],其在乙烯选择氧化中也得以应用。张小明等[8-9]研究了在甲醇和水的混合溶液中TS-1催化双氧水氧化乙烯制备乙二醇及其单加醚的反应性能,总的产物的选择性接近100%,而双氧水的转化率和利用率则可以分别达到95%和90%。几乎在同一时间,中国石油化工股份有限公司公开了一项由钛硅分子筛、酸性分子筛和树脂组成的复合催化剂催化乙烯转化制备乙二醇的发明专利[10]。该专利实现了固定床内乙烯直接向乙二醇的催化转化,避免了传统两步法工艺的繁琐步骤,并提高了反应效率,乙二醇的选择性可达95%。但TS-1催化剂的n(Si)/n(Ti) 以及反应温度、乙烯压力和双氧水浓度对乙二醇选择性、产物收率以及双氧水有效利用率的影响却很少提及。
在本研究中,笔者以TS-1分子筛为模型催化剂,以双氧水为氧化剂,详细研究了间歇式反应釜中乙烯向乙二醇的催化转化工艺,逐一考察TS-1分子筛的n(Si)/n(Ti)以及反应温度、压力和双氧水浓度对乙二醇选择性和双氧水有效利用率的影响,优化了相应的工艺参数,并加深对TS-1分子筛催化双氧水氧化乙烯制备乙二醇反应过程的认识。
1 实验部分
1.1原料和试剂
硅酸四乙酯(TEOS)、钛酸四丁酯(TBOT)和乙二醇,均为分析纯试剂,国药集团化学试剂有限公司产品;四丙基氢氧化铵(TPAOH),分析纯,阿拉丁试剂(上海)有限公司产品;乙烯(>99.9%),北京氦普北分气体工业有限公司产品;35% H2O2水溶液(双氧水),西陇化工有限公司产品。
1.2催化剂制备
采用Deng等[17]报道的方法制备TS-1催化剂。在室温和强烈搅拌条件下,将一定量的TEOS和TBOT的混合溶液滴加到TPAOH的水溶液中,在50℃水解1 h后继续在80℃蒸发1 h,以移除水解产生的乙醇。将得到的淡黄色透明凝胶转移到具有聚四氟乙烯内杯的不锈钢反应釜中,在170℃水热处理48 h。将得到的沉淀过滤、洗涤、干燥,并在550℃焙烧10 h。n(TEOS)∶n(TBOT)∶n(TPAOH)∶n(H2O)控制为1∶x∶0.15∶18,改变x的数值分别制备得到n(Si)/n(Ti)为30、40、50、60和80的TS-1分子筛,相应记为TS-1-y,y代表分子筛中的n(Si)/n(Ti)比。
1.3催化剂表征
采用美国麦克仪器公司ASAP 2020比表面积及孔径分析仪测定催化剂的比表面积、总孔容和孔径分布,样品在110℃和300℃分别进行真空处理后降温至-196℃进行N2的物理吸附。采用日本岛津公司7000型X-射线衍射仪分析样品的晶相结构(XRD),CuKα, λ=0.1542 nm,40 kV,40 mA,2θ扫描速率为4 °/min。采用PANalytical公司Axiosmax型X-射线荧光光谱仪测定催化剂的组成(XRF),操作电压和电流分别为30 kV和133 mA,所得样品的相对结晶度以TS-1-80为基准。采用Nicolet-6700 FT-IR光谱仪在室温下记录样品的红外光谱(FT-IR)。采用普析公司TU-1950型紫外可见分光光度计记录紫外-可见光谱(UV-vis),以BaSO4为参比。
1.4催化剂活性评价
采用Parr-5100系列低压玻璃反应釜进行TS-1催化转化乙烯制备乙二醇的反应。反应釜内径10.16 cm、高20.32 cm、容量1.5 L。在反应釜中放入一定量的催化剂,并加入600 mL的双氧水,用N2置换3次以排除空气的干扰,然后将乙烯接入开始反应。通过反应釜夹套中的循环水浴控制反应温度,通过和高压乙烯罐(耐压2.5 MPa,容量2.5 L)相连的精密气体减压器控制乙烯压力,通过天平测量得到的高压乙烯罐及其内装乙烯总质量的减少计算转化的乙烯的质量。催化剂的用量、H2O2的浓度、乙烯压力和反应温度分别控制在0.5%~4%(相比于双氧水质量),0.41~1.66 mol/L、0.2~0.6 MPa和40~80℃范围内。待天平测得的乙烯罐及其内乙烯的总质量不再持续减少时终止反应。采用碘量法测定反应后溶液中残留H2O2的浓度,采用配有氢火焰检测器和Supelco-Wax毛细管色谱柱(30 m×0.53 mm×1 μm)的Agilent-7890A气相色谱仪分析其中的有机物。
H2O2的转化率x(H2O2),H2O2的利用率u(H2O2)和乙二醇的选择性s(EG)分别采用式(1)~式(3)计算。
x(H2O2)=[n0(H2O2)-n(H2O2)]/
n0(H2O2)×100%
(1)
u(H2O2)=[n(EG)+2n(DEG)]/
[n0(H2O2)×x(H2O2)]×100%
(2)
s(EG)=n(EG)/[n(EG)+2n(DEG)]×100%
(3)
式(1)~式(3)中,n0(H2O2)和n(H2O2)分别为反应前后H2O2的物质的量,mol;n(EG)和n(DEG)分别为生成的乙二醇和二聚乙二醇的物质的量,mol。
2 结果与讨论
2.1TS-1催化剂的结构
焙烧后的TS-1分子筛的物理化学性质列于表1。从表1可见,随着n(Si)/n(Ti) 从30提高到50,分子筛的比表面积增加,孔体积也相应增加;n(Si)/n(Ti) 进一步从50提高到80,比表面积变化不大,但孔体积却降低了。

表1 不同n(Si)/n(Ti)的TS-1催化剂的物理化学性质
1) Measured by XRF
TS-1分子筛的XRD谱如图1所示。TS-1分子筛的XRD谱中,在2θ为7.8°、8.8°、23.2°、23.8°和24.3°等处出现明显的衍射峰,对应于典型的MFI拓扑结构[17]。尽管n(Si)/n(Ti) 对分子筛的晶型结构没有影响,但其XRD谱在7.8°和8.8°衍射峰的强度随n(Si)/n(Ti) 的提高而明显增强,分子筛的相对结晶度也相应提高(见表1),表明较低的Ti含量有利于Ti物种在分子筛骨架中的分散,获得髙结晶度的TS-1分子筛。

图1 不同n(Si)/n(Ti)的TS-1催化剂的XRD谱Fig.1 XRD patterns of TS-1 catalysts with different n(Si)/n(Ti)
TS-1分子筛中Ti物种的结构进一步采用FT-IR 和UV-vis光谱表征,结果示于图2。从图2可见TS-1分子筛的FT-IR谱在962 cm-1处出现Ti—O—SiO3结构中Si—O键的典型振动峰,表明TS-1分子筛中有骨架Ti物种存在[18]。TS-1分子筛的UV-vis谱在215 nm有1个强吸收峰,在340 nm处有一宽吸收峰,前者对应于分子筛骨架中四面体配位的Ti和相邻O原子之间的p-d电荷跃迁,而后者归属于分子筛骨架外锐钛矿相TiO2物种的出现[19]。随着n(Si)/n(Ti)的提高,215 nm处的吸收峰强度稍稍降低,但340 nm处的吸收峰强度迅速减弱,表明骨架外TiO2的比例随n(Si)/n(Ti)的提高明显降低。
2.2TS-1的n(Si)/n(Ti) 对其催化乙烯转化反应性能的影响
H2O2溶液中乙烯在TS-1催化下的转化可能经历两个过程,即乙烯在活性Ti位点上的环氧化以及环氧化反应中间体水解生成乙二醇[8-9]。在实验过程中,气相产物中只检测到O2的生成,这源于反应条件下H2O2的自发分解;液相产物中出现乙二醇和二聚乙二醇,这可能源于反应体系中乙二醇的聚合。无论是气相还是液相产物中均没有检测到环氧类物质,表明在反应体系中即使能够生成环氧中间体,其也会快速发生水解生成乙二醇。
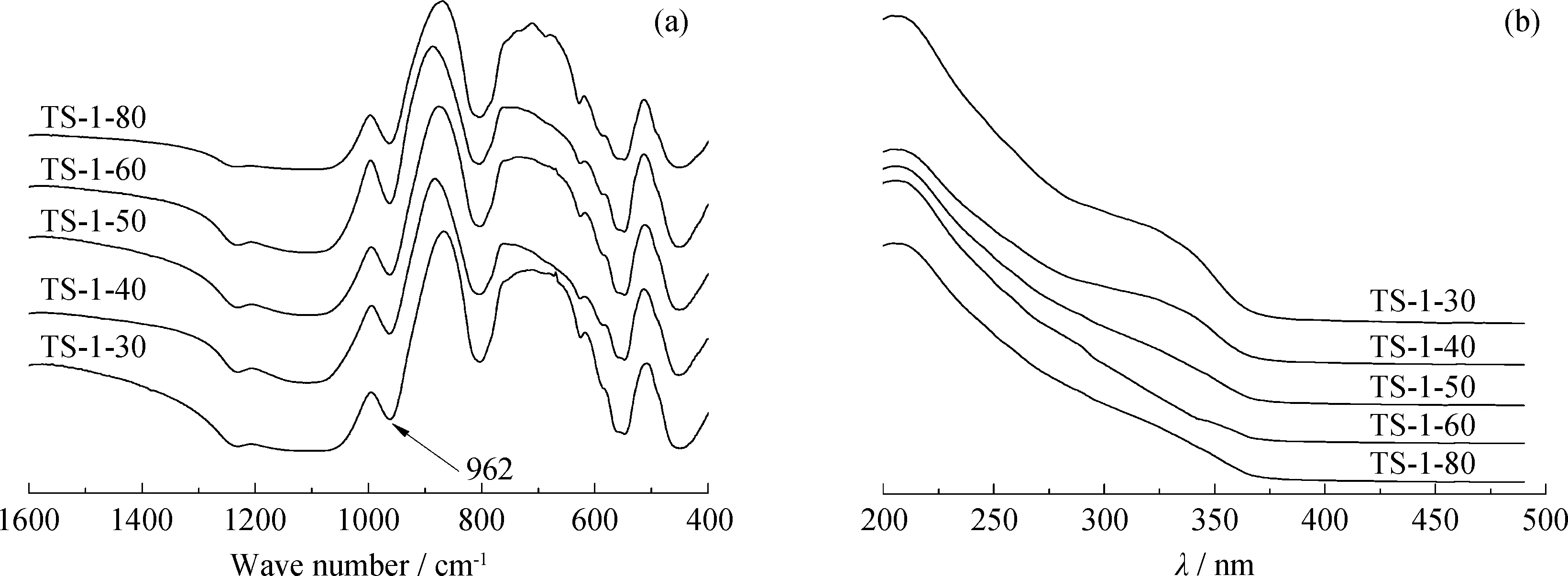
图2 不同n(Si)/n(Ti) 的TS-1催化剂的红外光谱和紫外-可见光谱Fig.2 FT-IR and UV-vis spectra of TS-1 catalysts with different n(Si)/n(Ti) (a) FT-IR; (b) UV-vis
表2列出了TS-1分子筛的n(Si)/n(Ti) 对其催化转化乙烯制备乙二醇反应性能的影响。从表2可见,随着n(Si)/n(Ti) 从30提高到50,H2O2有效利用率增加, 乙二醇选择性增加,产物中乙二醇的质量分数也相应增加;进一步提高分子筛的n(Si)/n(Ti) 到80, H2O2有效利用率、产物选择性和收率无明显变化。这种变化趋势和TS-1分子筛中Ti物种结构的演化密切相关(见图2),随着n(Si)/n(Ti)的提高,骨架外TiO2的比例相应降低。这表明分子筛骨架Ti物种是乙烯催化转化的活性位点,骨架外TiO2物种倾向于H2O2的直接分解,并导致其有效利用率的降低,和TS-1分子筛催化丙烯环氧化反应中得到的结论一致[12]。

表2 不同n(Si)/n(Ti)的TS-1催化乙烯转化制备乙二醇的性能
Reaction condition:T=60℃;p(C2H4)=0.5 MPa;w(Catalyst)=1%;c(H2O2)=0.83 mol/L
2.3反应条件对TS-1催化乙烯转化反应的影响
以n(Si)/n(Ti) 为50的TS-1-50分子筛为催化剂,分别考察了催化剂用量(w(Catalyst))、H2O2浓度(c(H2O2))、乙烯压力(p)和反应温度(T)对H2O2有效利用率(u(H2O2))和乙二醇选择性(s(EG))的影响,结果示于图3。
从图3可见,随着w(Catalyst)从0.5%增加到4%,乙二醇的选择性基本稳定在93%,而u(H2O2)却总体上呈现持续下降趋势,从75.3%降低到63.8%。TS-1分子筛自身能够催化H2O2分解,反应体系中过多的催化剂用量势必导致u(H2O2)的下降[20]。另一方面,随着c(H2O2)从0.41 mol/L提高到1.66 mol/L,s(EG)从94.9%略微降低到92.2%,而u(H2O2)却从96.2%迅速降低到66.9%。s(EG)的轻微下降源于高浓度的H2O2带来的产物中乙二醇浓度的上升,进而导致其二聚产物选择性的提高,而u(H2O2)的迅速下降则是高浓度时H2O2自身急剧的分解反应所导致。H2O2在TS-1分子筛表面的催化分解以自由基反应机理进行[20-22],对H2O2的浓度尤其敏感;反应过程中高浓度的H2O2势必引起其自身分解反应的加剧而降低其利用率。
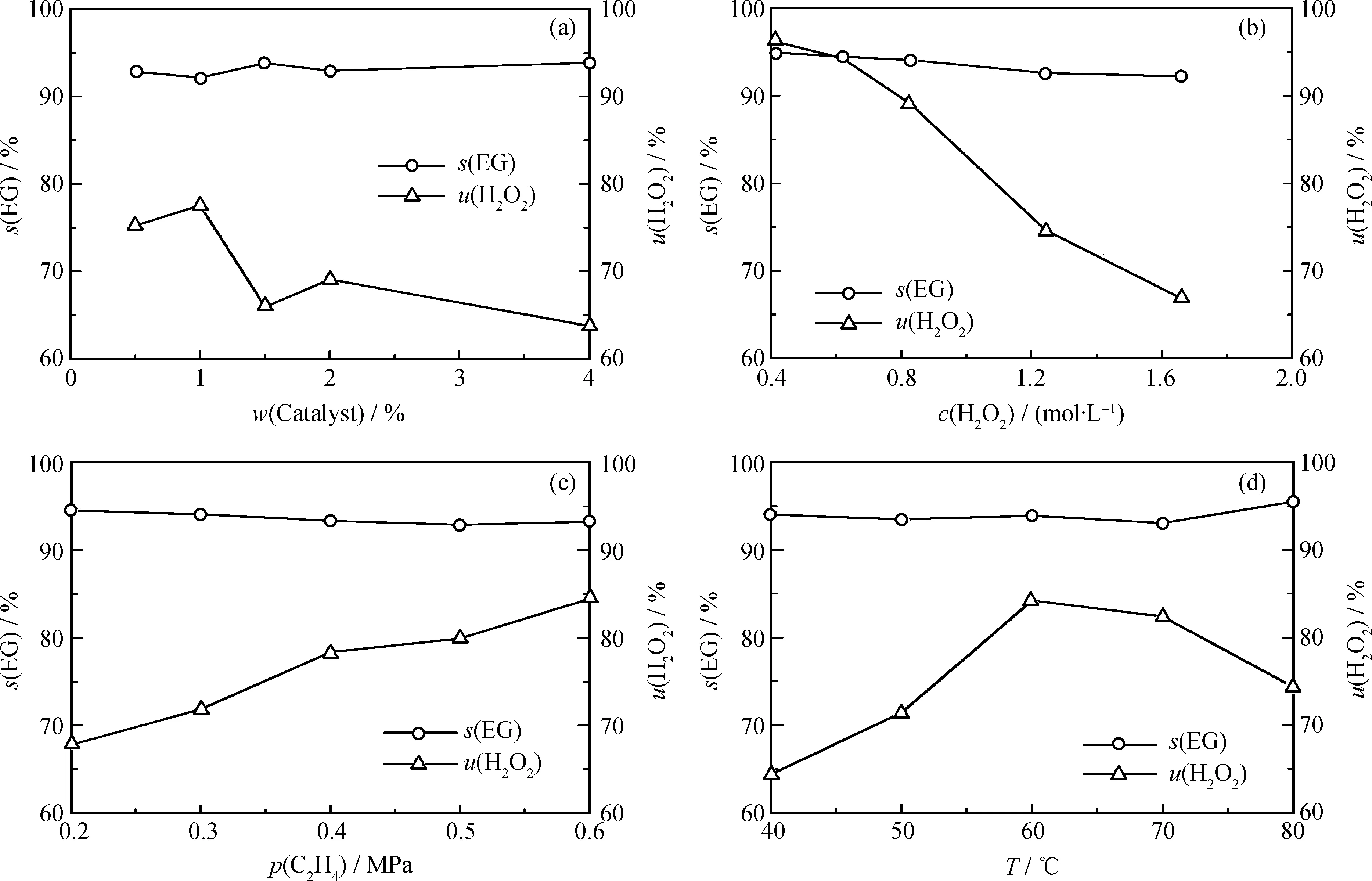
图3 w(Catalyst)、c(H2O2)、p和T对TS-1-50催化乙烯转化反应u(H2O2)和s(EG)的影响Fig.3 Effects of w(Catalyst), c(H2O2), p and T on u(H2O2) and s(EG) in catalytic conversion of ethylene to EG over TS-1-50 (a) T=55℃, p(C2H4)=0.3 MPa, c(H2O2)=1.04 mol/L; (b) T=55℃, p(C2H4)=0.3 MPa, w(Catalyst)=1%; (c) T=55℃, c(H2O2)=1.04 mol/L, w(Catalyst)=1%; (d) c(H2O2)=0.83 mol/L, p(C2H4)=0.3 MPa, w(Catalyst)=1%
提高乙烯压力理论上对H2O2的分解速率没有影响,但其可以增加乙烯在水相中的溶解度和相应的扩散性能,进而提高单位活性位点上乙烯的可及度,即高的反应压力有利于乙烯的环氧化过程。随着乙烯压力从0.2 MPa增至0.6 MPa,确实观察到u(H2O2)从67.8%提高到84.5%,而s(EG)则由于高浓度时乙二醇的聚合而略微降低。与别的反应条件不同,温度对乙烯的催化转化具有双重影响。提高温度不仅能够提高乙烯的环氧化速率,也能够加速H2O2的分解。随着反应温度从40℃提升到60℃,u(H2O2)从64.4%提高到84.2%,但随温度进一步升高而降低,在80℃时,u(H2O2)降低为74.3%。正如以上所讨论的,u(H2O2)取决于乙烯环氧化和H2O2自身分解这两个过程的竞争平衡。在低于60℃时,升高温度对乙烯的环氧化过程有利;而在高于60℃时,升高温度似乎对H2O2的分解影响更大。
2.4催化乙烯转化反应中TS-1催化剂的稳定性
采用同批次的TS-1-50催化剂在反应釜中连续5次反应考察TS-1催化剂的稳定性,得到的乙烯转化量随反应时间的变化曲线以及u(H2O2)和s(EG),结果示于图4。从图4可见,相比于初次反应,第2次和第3次反应的乙烯转化量在初始转化阶段明显下降,表明催化剂的活性有所降低;但在第3次及以后的反应过程中,催化剂的活性趋于稳定。尽管催化剂的活性随着循环次数的增加有所降低,但u(H2O2)和s(EG)基本保持恒定,意味着活性的降低可能与反应中可及的分子筛骨架Ti位点数目的减少有关[23],而不是骨架Ti结构的改变。因为骨架Ti物种向TiO2的转变将引起u(H2O2)和s(EG)的明显变化。
为探讨TS-1-50催化剂在循环反应中失活的原因,对反应后的催化剂进行了热重分析,结果如图5 所示。从图5可见,初次反应和5次连续反应后的催化剂在140~250℃区间内明显质量损失,并在280℃左右出现急剧的质量损失。前者对应于反应后催化剂表面吸附的有机物种(可能为高沸点的乙二醇聚合物)的脱附,而后者对应于催化剂表面难脱附有机物种的燃烧[23-24]。和初次反应后的催化剂相比,连续5次反应后催化剂表面吸附的有机物种含量有所增加,其总量从初次反应后催化剂的12.6%增加到5次反应后的15.9%。这些吸附的有机物种可能是引起TS-1催化剂表面活性位可及度下降的主要原因,并进而导致催化剂在反应中的活性降低。

图4 TS-1-50催化乙烯转化5次连续反应的乙烯转化量随反应时间的变化和u(H2O2)及 s(EG)Fig.4 Converted ethylene vs stream time in five consecutive reaction cycles of ethylene over TS-1-50 and u(H2O2), s(EG) (a) m(Converted C2H4); (b) u(H2O2) and s(EG) Reaction condition: T=60℃; p(C2H4)=0.5 MPa; c(H2O2)=1.04 mol/L; w(Catalyst)=1%

图5 催化乙烯转化循环反应后的TS-1-50催化剂的热重曲线Fig.5 TGA curves of the used TS-1-50 after the first (grey line) and the fifth (black line) run in recycling catalytic conversion of ethylene to EG Reaction condition: T=60℃; p(C2H4)=0.5 MPa;c(H2O2)=1.04 mol/L; w(Catalyst)=1%
3 结 论
(1)TS-1分子筛在温和的反应条件下能够催化H2O2氧化乙烯制备乙二醇。TS-1分子筛骨架Ti物种有利于提高H2O2的利用率和产物乙二醇的选择性,骨架外TiO2含量的增加则降低H2O2的有效利用率。在反应过程中,TS-1分子筛表面吸附有机物种而引起骨架Ti位点可及度的降低可能是分子筛部分失活的主要因素。
(2)TS-1分子筛中高的n(Si)/n(Ti) 和乙烯转化反应体系中低的H2O2浓度有利于乙二醇选择性的提高,而高的反应压力和适宜的反应温度有利于提高H2O2的有效利用率。以n(Si)/n(Ti)为50的TS-1分子筛为催化剂,以0.83mol/L的H2O2为氧化剂,在60℃、反应压力0.5 MPa的条件下,H2O2的有效利用率和产物乙二醇的选择性可以分别达到85.63%和95.57%。
参考文献
[1] YUE H R, ZHAO Y J, MA X B, GONG J L. Ethylene glycol: Properties, synthesis, and applications[J].Chemical Society Reviews, 2012, 41(11): 4218-4244.
[2] TECHNAVIO. Global ethylene glycol market 2014-2018[EB/OL]. www.researchandmarkets.com/research/ n77csn/global_ethylene, 2015-03-24.
[3] GHANTA M, RUDDY T, FAHEY D, et al. Is the liquid-phase H2O2-based ethylene oxide process more economical and greener than the gas-phase O2-based silver-catalyzed process?[J].Industrial & Engineering Chemistry Research, 2013, 52(1): 18-29.
[4] 庞纪峰,郑明远,姜宇,等.乙二醇生产和精制技术研究进展[J].化工进展,2013,32(9):2006-2014.(PANG Jifeng, ZHENG Mingyuan, JIANG Yu, et al. Progress in ethylene glycol production and purification[J].Chemical Industry and Engineering Progress, 2013, 32(9): 2006-2014.)
[5] WU C Y, THADDEUS P K. Converting ethylene and propylene to the glycol usingtert-butyl hydroperoxide in a two-phase liquid reactant: US, 4229601[P].1980-10-21.
[6] 高爽,李军,吕迎,等.一种直接氧化乙烯制备乙二醇的方法:中国,103172495A[P].2013-06-26.
[7] 张恒耘,吕迎,李军.反应控制相转移催化原位过氧化氢环氧化丙烯反应[J].催化学报,2010,31(10):1253-1256.(ZHANG Hengyun, LÜ Ying, LI Jun. Epoxidation of propylene catalyzed by reaction-controlled phase transfer[J].Chinese Journal of Catalysis, 2010, 31(10): 1253-1256.)
[8] LI H, LEI Q, ZHANG X M, et al. One-pot synthesis of ethylene glycol and its mono-methylether from ethylene using Al-TS-1 catalyst[J].Catalysis Communications, 2009, 10(14): 1936-1939.
[9] 李颢,雷骞,张小明,等.双功能钛硅分子筛的合成、表征及催化性能[J].催化学报,2013, 34(7): 1363-1372.(LI Hao, LEI Qian, ZHANG Xiaoming, et al. Synthesis, characterization, and catalytic performance of bifunctional titanium silicalite-1[J].Chinese Journal of Catalysis, 2013, 34(7): 1363-1372.)
[10] 李鹏.一种乙烯一步法制备乙二醇的方法:中国,102951998A[P]. 2013-03-06.
[11] 王海波,孙万付,勾连科,等.一种由乙烯制取乙二醇的方法:中国,102452900A[P].2012-05-16.
[12] CHENG W G, WANG X S, LI G, et al. Highly efficient epoxidation of propylene to propylene oxide over TS-1 using urea + hydrogen peroxide as oxidizing agent[J].Journal of Catalysis, 2008, 255(2): 343-346.
[13] CHEN Y, WU Y L, ZHANG Y R, et al. Epoxidation of propylene to propylene oxide catalyzed by large-grain TS-1 in supercritical CO2[J].Journal of Molecular Catalysis A: Chemical, 2012, 352: 102-109.
[14] LIU C, HUANG J L, SUN D H, et al. Anatase type extra-framework titanium in TS-1: A vital factor influencing the catalytic activity toward styrene epoxidation[J].Applied Catalysis A: General, 2013, 459: 1-7.
[15] RUSSO V, TESSER R, SANTACESARIA E, et al. Kinetics of propene oxide production via hydrogen peroxide with TS-1[J].Industrial & Engineering Chemistry Research, 2014, 53(15): 6274-6287.
[16] WANG L N, WANG Y Q, WU G Q, et al. Epoxidation of propylene over titanosilicate-1 in fixed-bed reactor: Experiments and kinetics[J].Asian Journal of Chemistry, 2014, 26(4): 943-950.
[17] DENG X J, WANG Y N, SHEN L, et al. Low-cost synthesis of titanium silicalite-1 (TS-1) with highly catalytic oxidation performance through a controlled hydrolysis process[J].Industrial & Engineering Chemistry Research, 2013, 52(3): 1190-1196.
[18] SCARANO D, ZECCHINA A, BORDIGA S, et al. Fourier-transform infrared and Raman spectra of pure and Al-, B-, Ti- and Fe-substituted silicalites: Stretching-mode region[J].Journal of the Chemical Society, Faraday Trans, 1993, 89(22): 4123-4130.
[19] LI C, XIONG G, LIU J K, et al. Identifying framework titanium in TS-1 zeolite by UV Resonance Raman spectroscopy[J].The Journal of Physical Chemistry B, 2001, 105(15): 2993-2997.
[20] YOON C W, HIRSEKORN K F, NEIDIG M L, et al. Mechanism of the decomposition of aqueous hydrogen peroxide over heterogeneous TiSBA15 and TS-1 selective oxidation catalysts: Insights from spectroscopic and density functional theory studies[J].ACS Catalysis, 2011, 1(12): 1665-1678.
[21] ANTONOVA N S, CARBJ J, KORTZ U, et al. Mechanistic insights into alkene epoxidation with H2O2by Ti- and other TM-Containing polyoxometalates: Role of the metal nature and coordination environment[J].Journal of the American Chemical Society, 2010, 132(21): 7488-7497.
[22] LOUSADA C M, JOHANSSON A J, BRINCK T, et al. Mechanism of H2O2decomposition on transition metal oxide surfaces[J].Journal of Physical Chemistry C, 2012, 116(17): 9533-9543.
[23] WANG Q F, WANG L, CHEN J X, et al. Deactivation and regeneration of titanium silicalite catalyst for epoxidation of propylene[J].Journal of Molecular Catalysis A: Chemical, 2007, 273(1-2): 73-80.
[24] 金国杰,高焕新,杨洪云.用于丙烯环氧化的 Ti/HMS 催化剂的失活与再生[J].催化学报,2009, 30(12): 1238-1242.(JIN Guojie, GAO Huanxin, YANG Hongyun. Deactivation and regeneration of Ti/HMS catalyst[J].Chinese Journal of Catalysis, 2009, 30(12): 1238-1242.)
收稿日期:2015-04-17
基金项目:北京市属高等学校高层次人才引进与培养计划项目(长城学者: CIT&TCD 20150316)资助
文章编号:1001-8719(2016)04-0793-07
中图分类号:O643.3
文献标识码:A
doi:10.3969/j.issn.1001-8719.2016.04.020
Catalytic Conversion of Ethylene to Ethylene Glycol Over TS-1
ZHANG Jialin1,2, SUN Peiyong1, ZHANG Shenghong1, YAO Zhilong1
(1.BeijingKeyLaboratoryofEnzeBiomassFineChemical,CollegeofChemicalEngineering,BeijingInstituteofPetrochemicalTechnology,Beijing102617,China;2.CollegeofLifeScienceandTechnology,BeijingUniversityofChemicalTechnology,Beijing100029,China)
Abstract:Oxidation of ethylene by H2O2 over titanium silicate-1 (TS-1) catalyst was carried out in detail to investigate the effects of n(Si)/n(Ti) of TS-1, reaction temperature, ethylene pressure and the H2O2 concentration on the conversion of ethylene to ethylene glycol (EG). The results indicated that an increase in the amount of framework titanium species was beneficial to both the H2O2 utilization efficiency and EG selectivity. The observed slight deactivation of TS-1 in the reaction could be attributed to the loss in the accessibility of Ti sites caused by the formation of organic oligomers on the catalyst surface. Under the optimized conditions of 60℃, 0.5 MPa ethylene pressure and 0.83 mol/L H2O2, the H2O2 utilization efficiency and EG selectivity over TS-1 catalyst with the n(Si)/n(Ti) of 50 were as high as 85.63% and 95.57%, respectively.
Key words:ethylene; ethylene glycol; hydrogen peroxide; titanium silicate; catalytic conversion
第一作者: 张嘉霖,男,硕士研究生,从事乙烯的选择氧化研究;Tel:010-81292304;E-mail:zhangjialin1989@163.com
通讯联系人: 张胜红,男,博士,讲师,主要从事低碳小分子的选择氧化研究;Tel:010-81292304;E-mail:zshong@bipt.edu.cn

