迈瑞BC-6800测定MCV、MCH及MCHC参考区间的调查*
马 骥,卢德志,陈 林,吴新忠,彭玉莲,徐建华△
(1.广东省中医院检验科,广州 510120;2.广东省东莞市东坑医院检验科 523443)
迈瑞BC-6800测定MCV、MCH及MCHC参考区间的调查*
马骥1,卢德志2,陈林1,吴新忠1,彭玉莲1,徐建华1△
(1.广东省中医院检验科,广州 510120;2.广东省东莞市东坑医院检验科523443)
目的调查迈瑞BC-6800测定健康成年人静脉血红细胞平均体积(MCV)、平均红细胞血红蛋白含量(MCH)及平均红细胞血红蛋白浓度(MCHC)的参考区间,以建立适合广东省中医院检验科的参考区间。方法参照美国临床实验室标准化委员会(NCCLS)C28-A3文件推荐方法,选取600例健康成年人作为参考个体,采用迈瑞BC6800进行MCV、MCH及MCHC测定,构建参考区间;另选取150例健康体检者,收集MCV、MCH、MCHC检测值,对所建立的参考区间进行验证。结果健康成人MCV、MCH及MCHC检测结果均呈正态分布。各年龄段MCV比较,差异有统计学意义(P<0.05);参考区间:青年82.278~94.242 fL、中年83.032~94.608 fL、老年83.137~96.343 fL。不同性别及各年龄段MCH比较,差异均有统计学意义(P<0.05);参考区间:男性青年27.785~32.415 pg、男性中年28.324~32.456 pg、男性老年28.274~32.966 pg,女性青年27.367~31.973 pg、女性中年27.445~32.215 pg、女性老年27.532~32.468 pg。不同性别MCHC比较,差异有统计学意义(P<0.05);参考区间:男328.611~352.810 g/L、女323.771~348.750 g/L。150例健康体检者中,位于参考区间外者所占百分比均小于10.0%,新建立的参考区间适用于该实验室。结论MCV、MCH和MCHC在成年人群存在性别或(和)年龄差异,按照实际情况分别建立了参考区间,且经验证均适用于该实验室。
红细胞;红细胞平均体积;平均红细胞血红蛋白含量;平均红细胞血红蛋白浓度;参考区间
作为检验结果解释、检验信息分析的基本尺度和依据,生物参考区间非常重要,其结果直接关系着临床对患者健康情况的判断及对应的治疗[1]。为了保证临床对患者及健康体检者的诊疗有明确的指引,检验报告必须提供一个准确可靠的生物参考区间[2]。而临床检验对象来源于动态生物体,生物属性的差异会带来生物参考区间的差异,主要是由年龄、性别、民族、居住地等原因引起的差异;另外,许多实验室往往同一检测项目同时使用两套或以上的检测系统,由于检验方法的差异,同一项目采用不同的检测方法也会导致结果不一致;而同一检测方法,仪器试剂来源不同,检验结果也会产生系统误差[3]。因此,建立一个适合本地区本实验室的生物参考区间既是临床诊断治疗的强有力保证,也是临床辅助实验室的重要任务。本研究根据《医学实验室质量和能力认可准则(ISO 15189:2003)》,参照美国临床实验室标准化委员会(national committee for clinical laboratory standards,NCCLS)C28-A3文件提供的建立生物参考区间的具体操作程序,对广州地区600例健康成年人全血细胞分析中的红细胞平均体积(mean corpuscular volume,MCV)、平均红细胞血红蛋白含量(mean corpuscular hemoglobin,MCH)及平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)的生物参考区间进行了调查,从而建立上述指标适合本地区本实验室的生物参考区间。
1 资料与方法
1.1一般资料参考个体均来自2014年6月至2014年10月在广东省中医院体检健康的成年人,不包含未成年人群体。健康人群的选择根据C28-A3文件,参考个体需符合以下条件:(1)年龄、性别等各种基本信息完整;(2)无异常体征及症状,大小便常规、血常规等检查结果均在正常参考范围内;(3)血糖、血脂、血压均正常;(4)妇女处于非妊娠期和非月经期。同时应考虑可能的排除标准:饮酒、近期患病、献血、哺乳期、血压异常、肥胖、吸毒、特定职业、正在服用处方药物或自购药物、口服避孕药、近期手术、吸烟、遗传因素、近期接受输血、正在或近期住院治疗、滥用维生素、环境因素等。共纳入600例参考个体,男280例,女320例。
1.2仪器与试剂Mindray BC-6800全自动血细胞分析仪及9种原装配套试剂,分别是M-68DS稀释液(批号2014061902)、M-68DR稀释液(批号2014051501)、M-68LD溶血剂(批号2014031501)、M-68LB溶血剂(批号2014061301)、M-68LN溶血剂(批号2014061701),M-68LH溶血剂(批号2014050701)、M-68FN染色液(批号2014050701)、M-68FR染色液(批号2014030201)、M-68FD染色液(批号2014061101)。质控品为Mindray公司生产,低值质控品批号BC60914L,中值质控品批号BC60914N,高值质控品批号BC60914H。静脉真空采血管为广州阳普医疗科技股份有限公司生产的乙二胺四乙酸二钾(EDTA-K2)抗凝管。试验前对检测系统的分析性能进行有效性验证、评价,确保总不精密度以变异系数(CV)小于原卫生部临床检验中心室间质评允许误差的1/3。分析系统由厂家校准后,用配套在线质控品做质控,确保检测系统在控。
1.3方法纳入的所有参考个体均在上午安静状态下空腹采集外周静脉血2 mL,EDTA-K2抗凝,常温运送至实验室,并在采血后2 h内于Mindray BC-6800全自动血细胞分析仪上完成测定,记录结果。
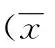
2 结 果
2.1离群值的处理分别对600例参考个体的MCV、MCH及MCHC检测结果进行探索性分析,判断有无离群值和极端值,结果显示:MCV、MCH及MCHC均有离群值,见图1。去除离群值,再用同样的统计方法进行分析,处理前后各指标参考值比较,差异均无统计学意义(P>0.05),则数据可以保留不作处理,见表1。

表1 MCV、MCH及MCHC参考值数据处理前后比较
2.2频数分布所有标本来源于健康成人,均在健康生理指标范围内,而且标本量足够大(大于120例)。将600例参考个体MCV、MCH及MCHC检测数据作频数分布,均呈正态分布,见图2。进一步采用百分位数图图示法进行正态性检验,散点呈直线分布,见图3,说明参考个体MCV、MCH及MCHC检测数据均服从正态分布。
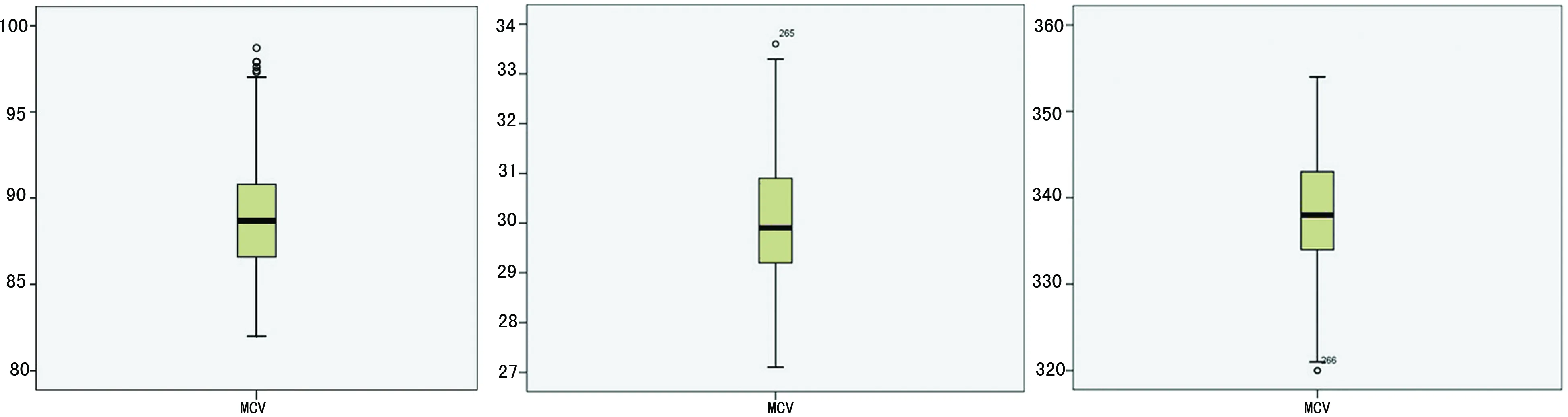
图1 MCV、MCH及MCHC参考值离群值箱图
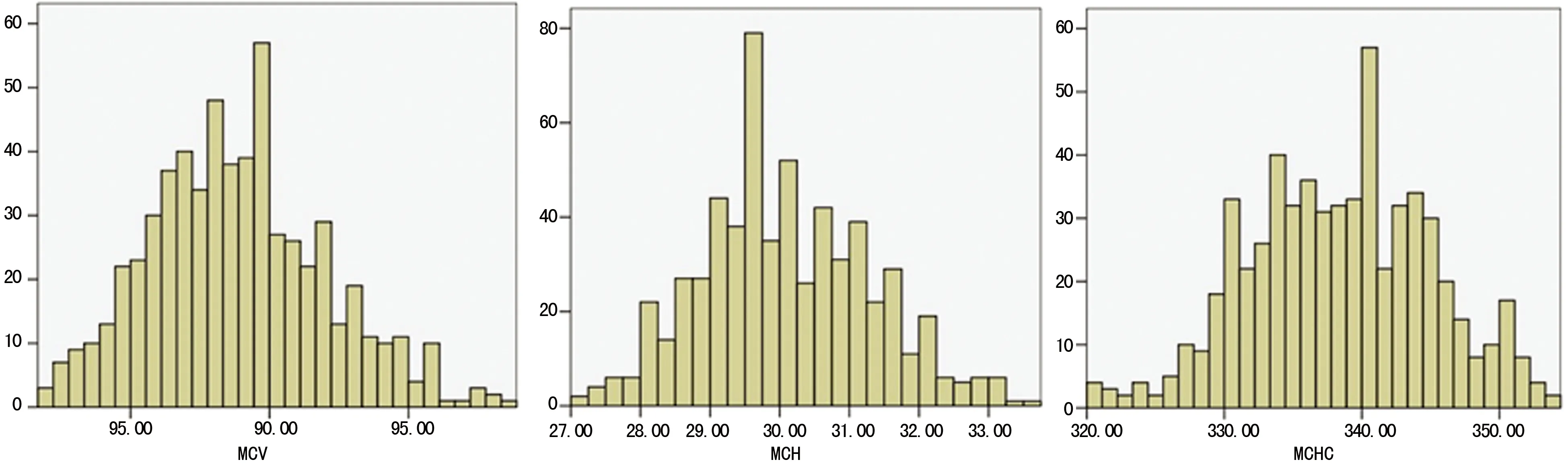
图2 MCV、MCH及MCHC参考值频数分布图

图3 MCV、MCH、MCHC参考值正态分布Q-Q图
2.3组间均值比较
2.3.1不同性别各指标检测结果比较MCV、MCH及MCHC检测数据经方差齐性检验显示,均方差齐(F=1.229,P=0.268;F=0.100,P=0.919;F=0.011,P=0.918);采用两独立样本t检验分别比较男、女两组各指标,男、女两组MCV比较,差异无统计学意义(t=1.705,P=0.089);而男、女两组MCH及MCHC比较,差异均有统计学意义(t=5.589,P=0.000;t=8.668,P=0.000)。说明MCH和MCHC需要分别设立男性与女性参考区间,而MCV则不需要。

表2 MCV、MCH及MCHC检测结果及参考区间
2.3.2不同年龄段各指标检测结果比较方差分析显示:各年龄组MCV及MCH比较,差异均有统计学意义(F=10.780,P=0.000;F=7.715,P=0.000);而各年龄组MCHC比较,差异无统计学意义(F=0.198,P=0.821)。说明MCV和MCH在各年龄段需要分别设立参考区间,而MCHC则不需要。
2.4新参考区间的建立与验证
2.4.2新建立参考区间的验证随机抽取150例健康体检者的MCV、MCH及MCHC检测结果进行验证,位于参考区间外的体检者所占百分比均小于10.0%,见表3。根据C28-A3文件,说明新建立的参考区间适用于本实验室。

表3 150例健康体检者的检测结果
3 讨 论
生物参考区间对临床诊断至关重要,临床实验室必须保证给临床提供的生物参考区间是正确可靠的,才能保证临床的诊疗质量,因此建立一个适合的生物参考区间意义重大[4]。而近年来随着血细胞分析仪的普及,各个厂家、各种型别的血细胞分析仪开始广泛使用,即使每个厂家都会对每个参数提供了一个生物参考区间,但是受地域、环境、民族、实验条件、操作人员和技术熟练度等各种因素影响,不同地区之间各个参数的差异也较大[3]。同时,经过查阅文献,笔者发现人群的生理因素如饮酒[5]、妊娠[6]等,病理性因素如红细胞冷凝集[7]、高白细胞[8]、乳糜血等及外界因素如仪器温度[9]、湿度、电压等,均会影响血细胞分析仪对MCV、MCH、MCHC等结果的测定。此外,何法霖等[10]研究指出,大部分实验室MCV项目的上下项均高于行业标准,使用较为混乱。因此,建立一个适合本地区本实验室的生物参考区间非常重要。因此,笔者首先根据NCCLS C28-A3文件中的筛选标准与排除指标,建立好参考个体的入选标准,并从体检中心数据库中选出600例符合标准的参考个体,然后记录好相关的结果信息。其中,要求该部分参考个体的检测过程与日常检测程序保持完全一致,即使用Mindray BC-6800全自动血细胞分析仪及原装配套试剂和在线质控品,并且在试验前对检测系统的分析性能进行有效性验证、评价,确保总不精密度低于原卫生部临床检验中心室间质评允许误差的1/3。分析系统由厂家校准后,用配套在线质控品做质控,确保检测系统在控。
本研究参照国际上公认的关于参考区间建立的NCCLS C28-A3文件,对MCV、MCHC、MCHC的参考区间进行调查。结果显示,MCV、MCH及MCHC参考值在健康成年人中呈正态分布,与熊火梅等[11]研究中MCHC呈偏态分布的结果并不一致,可能是由于检测仪器不同或纳入的参考个体地域分布不同。本研究采取的是回顾性分析法,通过资料收集统计得出结果。而且本次所收集的数据中,所有标本来源于健康成人,均在健康生理指标范围内,而且标本量足够大(大于120例),所以将600例参考值数据进行频数分布及采用百分位数图图示法进行正态性检验时,均显示呈正态分布。另外,在对数据进行正态分布分析及检验后,也根据NCCLS C28-A3中的分组标准进行了性别及年龄的分组分析。结果显示,男、女两组MCV检测结果比较,差异无统计学意义(P>0.05),参考区间可以合并;但男、女两组MCH及MCHC检测结果比较,差异均有统计学意义(P<0.05),其参考区间必须分别建立。而在年龄分组上,根据中国成人年龄分段原则分为青年组(18~<40岁)、中年组(40~60岁)、老年组(>60岁)[11],并对不同年龄组MCV、MCH、MCHC检测结果进行方差分析。结果显示,各年龄组MCHC检测结果比较,差异无统计学意义(P>0.05),参考区间可以合并;但各年龄组MCV及MCH检测结果比较,差异均有统计学意义(P<0.05),其参考区间必须分别建立。这可能与纳入研究的人群或使用的检测设备不同有关。MCV、MCH及MCHC不能忽略性别与年龄因素而片面的设置单一参考区间,由于性别、年龄等因素而导致的某些生理指标的变化是值得关注和研究的。Wu等[12]研究表明,MCV、MCH及MCHC的参考区间在不同性别、年龄段无明显差异,MCHC的参考区间研究与本研究一致,MCV、MCH存在部分差异。张云等[13]研究认为,男性的MCHC参考区间明显高于女性,差异有统计学意义(P<0.05);并且男性不同年龄段MCHC检测结果比较,差异有统计学意义(P<0.05);而女性不同年龄段比较,差异无统计学意义(P>0.05)。MCHC男性参考区间明显高于女性,与本研究结果一致,但是男性不同年龄段MCHC有明显差异,与本次调查结果并不一致,说明还有待深入研究,可能也是地区、人群、仪器类型等不同而导致的差异。最后随机抽取150例健康体检者的MCV、MCH、MCHC检测结果,对新建立的参考区间进行了验证。结果显示,在150例健康体检者中,位于参考区间外者所占百分比均低于10.0%,参照C28-A3文件说明新建立的参考区间可以接受。
MCV、MCH及MCHC是3项重要的临床诊断和治疗指标,对于正常细胞性贫血、大细胞性贫血、小细胞低色素性贫血、单纯小细胞性贫血等各类型贫血的鉴别诊断有着重要意义。其中,刘平方等[14]研究表明,珠蛋白生成障碍性贫血和缺铁性贫血的MCV值明显低于正常水平,另外MCHC对于缺铁性贫血和巨幼红细胞性贫血的鉴别诊断,以及珠蛋白生成障碍性贫血、溶血性贫血等的早期筛选也有着重要作用[15-16]。目前,国内一般将MCV、MCH及MCHC作为浮动均数的参数[17],应用于血细胞分析仪的室内质控,其靶值为每个实验室的参考范围的均值。本次调查发现,检测结果会受到检测系统、仪器、环境、地域、人群、标本等因素的影响,如米玛央宗等[18]研究表明,在高原地区,除MCV外,成年男性的MCH和MCHC均高于女性,且差异有统计学意义(P<0.05),而且高原地区MCV及MCHC的检测范围上下限均高于平原地区,如果只是照搬其他地区或仪器的参考区间,并不能准确地反映出本地区患者和体检人群的真实健康情况,而且容易给临床造成误诊、漏诊的风险。所以,建立一个准确的、适用于本地区本实验的参考区间不仅是临床辅助诊断实验室的任务,更是临床科室对于疾病诊断的一个迫切要求,具有非常重要的意义。本研究参照NCCLS C28-A3文件,建立了MCV、MCHC及MCHC的参考区间,并且通过验证适合本地区本实验室使用。
[1]魏有仁.参考值的几个基本问题[J].中国实验诊断学,1997,1(1):44-46.
[2]冯仁丰.临床检验质量管理技术基础[M].上海:上海科学技术文献出版社,2003:136.
[3]Fuentes-Arderiu X,Mas-Serra R,Alumà-Trullàs A,et al.Guideline for the production of multicentre physiological reference values using the same measurement system.A proposal of the Catalan Association for Clinical Laboratory Sciences[J].Clin Chem Lab Med,2004,42(7):778-782.
[4]陈桂山,杨志钊,何秀娴,等.血细胞分析指标生物参考区间适用性验证探讨[J].实验与检验医学,2009,27(2):151-152,173.
[5]郭永炼,吴统健,孙林渥,等.急性酒精中毒者血液红细胞参数的研究[J].预防医学文献信息,2004,10(1):28-29.
[6]左大鹏.贫血的实验室检查程序和诊断[J].中华检验医学杂志,2004,27(2):127-128.
[7]张德庆,文汇,李玉臣.冷凝集干扰全血细胞分析仪测定的探讨[J].社区医学杂志,2007,5(3):84-84.
[8]陈中新,徐云侠,王月华,等.高白细胞血对血红蛋白测定结果的影响[J].临床输血与检验,2006,8(4):334-335.
[9]陈瑛,李彩霞,王伟,等.仪器环境温度对MCHC室内质控的影响[J].浙江检验医学,2007,5(3):41-42.
[10]何法霖,周文宾,王薇,等.我国血细胞分析参考区间现状与行业标准分析和比较[J].中华检验医学杂志,2014,37(7):539-543.
[11]熊火梅,王小中,李静,等.Sysmex XE-2100测定红细胞平均血红蛋白浓度参考区间的调查[J].重庆医学,2011,40(22):2246-2248.
[12]Wu X,Zhao M,Pan B,et al.Complete blood count reference intervals for healthy Han Chinese adults[J].PLoS One,2015,10(3):e0119669.
[13]张云,马骢,郭建巍,等.北京地区健康成年人静脉全血细胞分析参考区间的调查[J].山东医药,2009,49(16):94-95.
[14]刘平方,王艳梅.红细胞分布宽度在小细胞低色素性贫血中的意义[J].中国现代医生,2013,51(33):110-112.
[15]康云平,孙宝云.平均红细胞血红蛋白浓度对溶血性贫血的诊断价值[J].疾病监测,2008,23(6):368-369.
[16]李军,殷和.转白生成障碍性贫血的诊断技术及进展[J].重庆医学,2009,38(7):864-866.
[17]朱翔,周正文.用浮动均值法建立MCH、MCHC质量控制探讨[J].安徽医学,2007,28(3):239-240.
[18]米玛央宗,赵旭宏,侯军林,等.建立高原地区成年人红细胞相关参数参考区间的研究[J].实用检验医师杂志,2015,7(1):32-35.
Investigation on reference intervals of MCV,MCH and MCHC levels determined by Mindray BC-6800 hematology analyzer*
MaJi1,LuDezhi2,ChenLin1,WuXinzong1,PengYulian1,XuJianhua1△
(1.DepartmentofClinicalLaboratory,GuangdongProvincialHospitalofTraditionalChineseMedicine,Guangzhou,Guangdong510120,China;2.DepartmentofClinicalLaboratory,DongguanDongkengHospital,Dongguan,Guangdong523443,China)
ObjectiveTo investigate the reference intervals of mean corpuscular volume(MCV),mean corpuscular hemoglobin(MCH) and mean corpuscular hemoglobin concentration(MCHC) examined by the MindrayBC-6800 hematological analyzer to establish the reference intervals suitable for our laboratory.MethodsAccording to the method recommended by the NCCLS C28-A3,600 healthy adult individuals were selected as the reference individuals.MCV,MCH and MCHC levels were determined by the MindrayBC-6800 hematological analyzer for constructing the reference intervals;other 150 healthy persons undergoing the physical examination were selected and their MCH,MCV and MCHC detection results were collected for verifying the established reference intervals.ResultsThe detection results of MCV,MCH and MCHC in healthy adults showed a normal distribution,MCV had statistical difference among different age periods(P<0.05);the reference intervals:82.278-94.242 fL for young adults,83.032-94.608 fL for the middle-aged persons and 83.137-96.343 fL for the elderly.MCH had statistical differences between different sexes and among different age periods;the reference intervals:27.785-32.415 pg for male young adults,28.324-32.456 pg for male middle-aged persons and 28.274-32.966 pg for male elderly;27.367-31.973 pg for female young adults,27.445-32.215 pg for female middle-aged persons and 27.532-32.468 pg for female elderly.MCHC had statistical difference between different sexes (P<0.05) ;the reference intervals:328.611-352.810 g/L for male and 323.771-348.750 g/L for female.In 150 individuals undergoing the physical examination,the proportion of individuals locating at the outside of reference interval was less than 10.0%,therefore the newly established intervals were suitable for this laboratory.ConclusionThe sex difference or/and age differences of MCV,MCH and MCHC exist among adult populations.So the reference intervals are respectively established according to the practical situation,which are suitable for this laboratory by verification.
erythrocyte;mean corpuscular volume;mean corpuscular hemoglobin;mean corpuscular hemoglobin concentration;reference intervals
国家中医药行业科研专项项目(201007005)。作者简介:马骥(1978-),副主任技师,硕士,主要从事临床血液学与临床生物化学检验方面的研究。△
,E-mail:jhxu1976@126.com。
R446
A
1671-8348(2016)20-2814-04
2016-01-02
2016-02-26)
·调查报告·doi:10.3969/j.issn.1671-8348.2016.20.025

