脑源性神经营养因子原核表达载体的构建及其生物学活性分析*
李健春,王 丽,姜 宁,王 琼△
(1.西南医科大学药学院,四川泸州 646000;2.中西医结合防治器官纤维化实验室/中西医结合研究中心/西南医科大学附属中医医院,四川泸州 646000)
脑源性神经营养因子原核表达载体的构建及其生物学活性分析*
李健春1,2,王丽2,姜宁1,王琼1△
(1.西南医科大学药学院,四川泸州 646000;2.中西医结合防治器官纤维化实验室/中西医结合研究中心/西南医科大学附属中医医院,四川泸州 646000)
目的构建含有脑源性神经营养因子(BDNF)的原核表达质粒pET28a(+)/BDNF及相应的原核表达菌,经异丙基硫代半乳糖苷(IPTG)诱导表达后研究其生物学活性。方法按照大肠杆菌BL21(DE3)的密码子偏好性进行密码子优化,人工合成大鼠BDNF的基因序列并构建原核表达质粒pET28a(+)/BDNF。经限制性内切酶(Bam HI,Hind Ⅲ)酶切鉴定及DNA测序鉴定后导入大肠杆菌BL21(DE3),经IPTG诱导表达后,用SDS-PAGE检测重组蛋白的表达情况,以BDNF特异性抗体采用Western blot法鉴定BDNF蛋白抗原性,四甲基偶氮唑蓝(MTT)法检测BDNF蛋白对PC12细胞活力的影响。结果构建的pET28a(+)/BDNF经双酶切和测序鉴定与设计序列100%一致;工程菌经IPTG诱导后在相对分子质量17×103左右有1条明显蛋白条带,Western blot显示目的蛋白能够与特异性BDNF抗体反应;不同浓度BDNF蛋白处理组与对照组比较细胞活力均有不同程度的增加,其中50 ng/mL BDNF处理组效果最优。结论成功构建原核表达质粒pET28a(+)/BDNF及相应的原核表达菌,该工程菌表达的BDNF蛋白具有良好的生物学活性。
脑源性神经营养因子;原核表达;生物学活性
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)最初是由Brade从猪脑中分离、纯化的一种碱性蛋白质[1]。BDNF作为神经营养因子的一员,其主要功能是调节神经元的可塑性,生长、生存及长期记忆[2]。此外,BDNF与神经退行性疾病发生高度相关,在治疗阿尔茨海默病[3]、精神分裂症[4]、抑郁症[5]、多发性硬化症[6]等中枢神经疾病中具有广阔的应用前景。然而,组织中BDNF含量极低,从3 kg脑组织中仅能提取2 μg BDNF蛋白[1],对其临床运用和分析鉴定都带来较大的挑战。近年来神经生长因子家族一些成员被用于中枢神经系统疾病的防治,然而,BDNF用于此类系统疾病的防治却罕见报道。本实验旨在通过现代分子生物学方法建立一种制备BDNF操作简单、稳定性高的方法,为下一步BDNF在中枢神经疾病的治疗中的应用和功能研究奠定基础。
1 材料与方法
1.1材料大肠杆菌BL21(DE3)购于北京全式金公司;原核表达载体pET28a(+)、PC12细胞为本实验室保存。
1.2仪器与试剂HiTrap SP Sepharose FF层析柱购自GE公司;HRP标记羊抗兔多克隆抗体购自中杉金桥生物公司;兔抗BDNF多克隆抗体购自Santa Cruz公司;胎牛血清购自杭州四季青公司;DMEM细胞培养基购自Gibco公司;质粒抽提试剂盒购自Omega公司;高灵敏度化学发光检测试剂盒购自康为世纪(北京)公司;Bam HI、Hind Ⅲ酶购自Takara公司;其他试剂均为进口或国产分析纯;蛋白电泳仪、多功能酶标仪购自BIO-RAD公司。
1.3方法
1.3.1重组BDNF序列设计与合成根据GenBank公布的大鼠BDNF 氨基酸序列(登录号NP_001257559.1),利用在线密码子优化工具JCAT优化密码子,优化后序列5′端引入Bam HI酶切位点,3′端引入Hind Ⅲ酶切位点,全长序列由金唯智生物科技(苏州)有限公司合成。
1.3.2BDNF工程菌的构建与鉴定将合成的基因序列通过Bam HI、Hind Ⅲ酶切位点亚克隆至pET28a(+)载体中,热激法转化至大肠杆菌BL21(DE3)感受态细胞中,转化后涂布于LB固体培养基(卡那霉素,50 μg/mL)中,倒置培养12 h,挑取阳性克隆,按说明书方法抽提质粒进行酶切鉴定。酶切鉴定正确后送金唯智生物科技(苏州)有限公司测序。
1.3.3BDNF工程菌诱导表达与BDNF蛋白可溶性分析将经酶切和测序鉴定正确的阳性克隆接种于5 mL LB固体培养基中,37 ℃,220 r/min震荡培养过夜。次日,以1%比例(v/v)接种到相同抗生素终浓度的LB 培养基中,37 ℃,220 r/min震荡培养3 h,加入异丙基硫代半乳糖苷至终浓度为0.5 mmol/L,继续培养4 h,4 ℃、 8 000 r/min离心5 min,弃上清液收集沉淀,沉淀经PBS洗涤后,以5 g/mL比例充分重悬于裂解液(20 mmol/L Tris·Hcl,2 mmol/L乙二胺四乙酸,pH=8.0),置冰上超声破碎(250 W,超2 s,停4 s;作用30 min),革兰染色检测破碎程度,4 ℃、 12 000 r/min离心20 min收集沉淀和上清液,沉淀用缓冲液[20 mmol/L羟乙基哌嗪乙硫磺酸(HEPES),8 mol/L尿素,pH=8.0]溶解,SDS-PAGE电泳检测上清液和沉淀中BDNF的含量。
1.3.4重组BDNF蛋白的纯化利用BDNF高等电点特性(pI=9.99),在HEPES缓冲液中带正电荷,选择阳离子交换层析进行纯化。将步骤1.3.3的沉淀样品依次用含2.0 mol/L尿素、4.0 mol/L尿素的PBS(pH=7.5)缓冲液洗涤。4 ℃、 15 000 r/min离心30 min收集沉淀,沉淀溶解于缓冲液(20 mmol/L HEPES,8 mol/L尿素,pH=8.0),4 ℃搅拌过夜。次日,4 ℃、 15 000 r/min离心30 min收集上清液,0.22 μm滤膜过滤后进行纯化。纯化条件为:采用1 mL HiTrap SP Sepharose FF层析柱,流速0.75 mL/min;上样完成后,先使用缓冲液(20 mmol/L HEPES,8.0 mol/L尿素,pH=8.0)平衡至基线后,再用缓冲液(20 mmol/L HEPES,8.0 mol/L尿素,0.5 mol/L Nacl,pH=8.0)线性洗脱。收集洗脱液,采用BCA法测定蛋白浓度,SDS-PAGE电泳检测纯化后样品纯度。
1.3.5Western blot鉴定BDNF蛋白抗原性取纯化后BDNF蛋白进行SDS-PAGE电泳,用湿转系统(转膜条件:200 mA,50 min)转移至PVDF膜进行Western blot分析:5%脱脂牛奶室温封闭1 h;加入兔抗鼠BDNF多克隆抗体(1∶1 000稀释)4 ℃孵育过夜;TBST洗涤5次(每次5 min)后用HRP标记羊抗兔IgG(1∶10 000稀释)室温孵育1 h;TBST洗涤5次(每次5 min)后ECL系统显影,拍照,记录结果。
1.3.6四甲基偶氮唑蓝(MTT)法检测BDNF蛋白对PC12细胞活力的影响取对数生长期PC12细胞,以1.0×104/孔接种于96孔板,每孔100 μL,于37 ℃,5% CO2培养箱中孵育24 h;吸出培养基,加入终浓度为20~400 ng/mL的BDNF蛋白,每个浓度设5个复孔;培养24 h后,MTT法检测细胞活力,利用酶标仪在490 nm处测定各组细胞吸光度(A)值。细胞存活率=A处理组/A对照组×100%。
1.4统计学处理采用SPSS19.0统计软件处理数据,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1重组BDNF基因序列密码子优化大鼠成熟BDNF基因序列全长357 bp,利用在线密码子优化工具JCAT优化后密码子适应指数(CAI)为96.00%,GC含量为50.14%。
2.2BDNF工程菌的构建与鉴定重组质粒经Bam HI、Hind Ⅲ双酶切后,琼脂糖电泳显示在约360 bp处出现1条条带,与目的基因片段大小相符(图1)。DNA测序结果显示与目的序列100%一致,重组质粒pET28a(+)/BDNF构建正确。
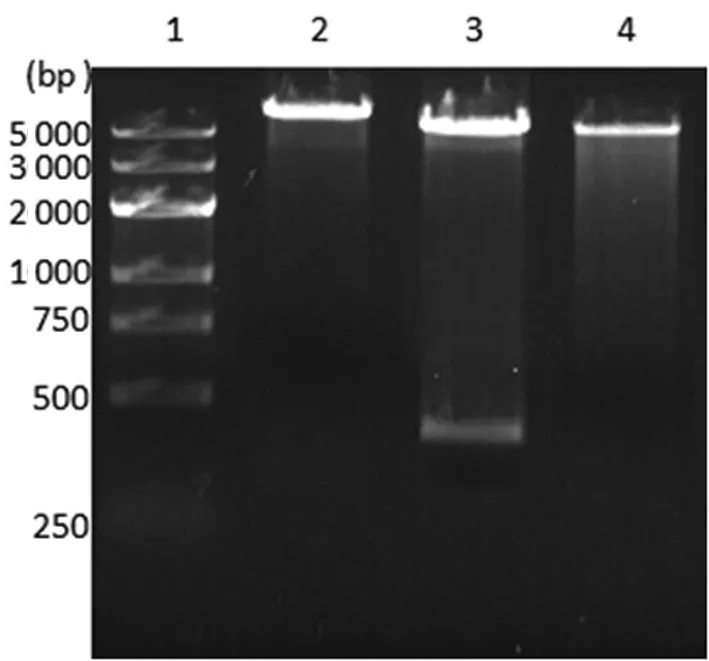
1:DNA Ladder;2:重组pET28a(+)/BDNF质粒经Bam HI单酶切;3:pET28a(+)/BDNF质粒经Bam HI和Hind Ⅲ双酶切;4:pET28a(+)质粒经Bam HI单酶切。
图1重组质粒pET28a(+)/BDNF酶切鉴定
2.3BDNF工程菌诱导表达与BDNF蛋白可溶性分析工程菌经IPTG诱导后,SDS-PAGE电泳在相对分子质量17×103左右有1条明显特异性蛋白条带,与理论预测值相符,见图2。表明该工程菌可表达BDNF蛋白,其表达量占菌体总蛋白的15%。培养基上清液(图片中未列出)和诱导后的细菌裂解液在上清液中均未出现目的蛋白,而在沉淀中具有明显蛋白条带,故认为BDNF蛋白主要以包涵体形式存在。
2.4重组BDNF蛋白的纯化重组BDNF蛋白经阳离子层析纯化后,样品纯度为85.6%,见图3。
2.5BDNF蛋白抗原性分析用兔抗鼠BDNF抗体作用后出现阳性条带,说明该工程菌表达的BDNF蛋白能与相应的特异性抗体结合,具有良好的抗原性。
2.6MTT法检测BDNF蛋白对PC12细胞活力的影响结果显示BDNF蛋白处理组与对照组比较均有不同程度的增加;20、50、100、400 ng/mL处理组与对照组相比差异有统计学意义(P<0.05);其中,50 ng/mL处理组效果最优,见图4。
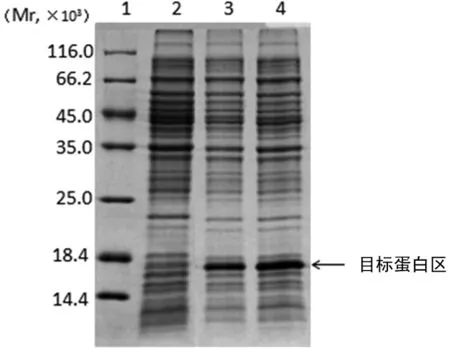
1:蛋白Marker;2:工程菌诱导后超破裂解上清液;3:工程菌诱导后总蛋白;4:工程菌诱导后超破裂解沉淀。
图2重组BDNF蛋白可溶性分析
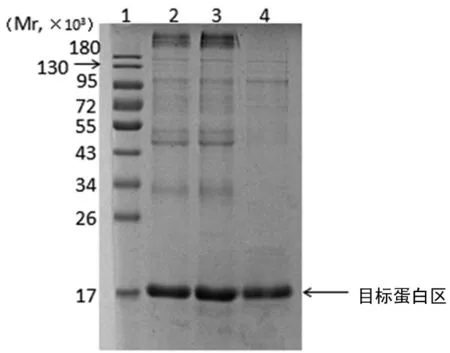
1:蛋白Marker;2、3:洗涤后涵体总蛋白;4:SP阳离子柱纯化后样品。
图3纯化BDNF的SDS-PAGE检测
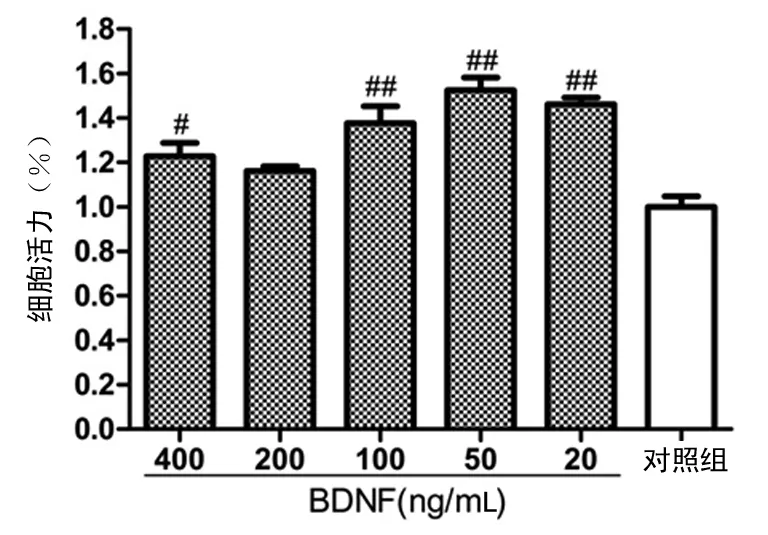
#:P<0.05;##:P<0.01,与对照组比较。
图4BDNF蛋白对PC12细胞活力的影响
3 讨 论
BDNF生物学功能十分广泛,参与调节神经元的可塑性、生长、生存及长期记忆。近几年来有学者研究发现,前体BDNF蛋白与其裂解产物共同参与神经元的多种调控,但发挥出与其裂解产物相反的作用[7]。陈甲等[8]学者研究发现前体BDNF蛋白能够促进神经元的凋亡。前体BDNF 蛋白单体含有 247 个氨基酸残基,经加工剪切后形成 119 个氨基酸残基、相对分子质量为14×103的成熟碱性蛋白,等电点为 9.99[9]。BDNF通过与受体(TrkB,p75NTR and sortilin)结合而发挥生物学功能[10]。
本实验通过基因重组的方法将大鼠成熟BDNF的基因克隆至pET28a(+)载体中,并在大肠杆菌中获得了表达,该质粒在N端携带有编码6个组氨酸的融合标签序列,有利于亲和层析纯化。然而,实验前期研究发现用镍螯合亲和层析(变性条件下)纯化,目的蛋白不挂柱,可能原因是组氨酸融合标签没有暴露,后改用阳离子交换层析纯化方法获得了目的蛋白,SDS-PAGE和Western blot方法鉴别为目的蛋白。目的蛋白在大肠杆菌中经诱导表达后其表达量占菌体总蛋白的15%,以包涵体形式表达,直接在变性条件下利用阳离子交换层析纯化获得了高纯重组BDNF 蛋白,经复性后获得了具有高生物学活性BDNF 蛋白。该方法利用BDNF高等电点特性,直接在变性条件下进行离子交换层析纯化,建立了一种操作简单,稳定性高的制备BDNF的方法。此外,由于BDNF基因序列高度保守,因而本研究制备的BDNF蛋白可以用于不同物种之间的研究。总之,本研究通过基因技术获得了重组BDNF 蛋白,为进一步探讨BDNF 蛋白抗原性、作用机制和临床治疗运用奠定了基础。
[1]Wozniak W.Brain-derived neurotrophic factor(BDNF):role in neuronal development and survival[J].Folia Morphol (Warsz),1993,52(4):173-181.
[2]Allen SJ,Watson JJ,Shoemark DK,et al.GDNF,NGF and BDNF as therapeutic options for neurodegeneration[J].Pharmacol Ther,2013,138(2):155-175.
[3]Nagahara AH,Merrill DA,Coppola GA,et al.Neuroprotective effects of brain-derived neurotrophic factor in rodent and primate models of Alzheimer′s disease[J].Nat Med,2009,15(3):331-337.
[4]Koeva YA,Sivkov ST,Akabaliev VH,et al.Brain-derived neurotrophic factor and its serum levels in schizophrenic patients[J].Folia Med (Plovdiv),2014,56(1):20-23.
[5]Hoshaw BA,Malberg JE,Lucki I.Central administration of IGF-I and BDNF leads to long-lasting antidepressant-like effects[J].Brain Res,2005,1037(1/2):204-208.
[6]Makar TK,Bever CT,Singh IS,et al.Brain-derived neurotrophic factor gene delivery in an animal model of multiple sclerosis using bone marrow stem cells as a vehicle[J].J Neuroimmunol,2009,210(1/2):40-51.
[7]Teng HK,Teng KK,Lee R,et al.ProBDNF induces neuronal apoptosis via activation of a receptor complex of p75NTR and sortilin[J].J Neurosci,2005,25(22):5455-5463.
[8]陈甲,梁小敏,许志强.脑源性神经营养因子前体基因重组蛋白的原核表达和活性鉴定[J].中华医学杂志,2014,94(31):2460-2463.
[9]Negro A,Tavella A,Grandi C,et al.Production and characterization of recombinant rat brain-derived neurotrophic factor and neurotrophin-3 from insect cells[J].J Neurochem,1994,62(2):471-478.
[10]Khalin I,Alyautdin R,Kocherga G,et al.Targeted delivery of brain-derived neurotrophic factor for the treatment of blindness and deafness[J].Int J Nanomed,2015(10):3245-3267.
Research on construction of prokaryotic expression vector of brain-derived neurotrophic factor and its biologic activity*
LiJianchun1,2,WangLi2,JiangNing1,WangQiong1Δ
(1.CollegeofPharmacology,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China;2.LaboratoryofOrganFibrosisProphylaxisandTreatmentbyIntegratedTraditionalChineseandWesternMedicine/ResearchCenterofIntegratedTraditionalChineseandWesternMedicine/AffiliatedHospitalofTraditionalChineseMedicine,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China)
ObjectiveTo construct the prokaryotic expression plasmid pET28a(+)/BDNF and corresponding prokaryotic expression bacterium containing brain-derived neurotrophic factor(BDNF),and to research its biologic activity after IPTG induction expression.MethodsThe codon optimization was done according to Escherichia coli(E.coli) BL21(DE3) bias.The rat BDNF gen sequence was then artificially synthesized and the prokaryotic expression plasmid pET28a(+)was constructed.After identification by the restriction enzyme digestion (Bam HI,Hind Ⅲ)and DNA sequencing,E.coli BL21(DE3) was introduced.After IPTG induction expression,the recombinant protein expression was detected by SDS-PAGE,the BDNF protein antigenicity was indentified by Western blot with anti-BDNF specific antibody.MTT assay was used to evaluate the influence of BDNF protein on the PC12 cell viability.ResultsThe constructed plasmid of pET28a(+)/BDNF was 100% consistent with the designing sequence confirmed by restriction enzyme digestion and DNA sequencing identification;the engineering bacterium had a clear protein band at the relative molecular mass about 17×103after IPTG induction,Western blot displayed that the target protein could react with specific BDNF antibody;compared with the normal control group,the cell viability in the different concentrations of BDNF protein treatment groups was increased to some extent compared with the control group,in which 50 ng/mL BDNF treatment group showed the best effect.ConclusionThe prokaryotic expressing plasmid pET28a(+)/BDNF and corresponding prokaryotic expressing bacterium are constructed successfully and the BDNF protein expressed by this engineering bacterium has a good biologic activity.
brain-derived neurotrophic factor; prokaryotic expression; biologic activity
人因工程重点实验室开放基金资助项目(HF2012-K-06);四川省科技厅-泸州市人民政府-泸州医学院联合科研资金项目(14JC01323-LH50);国家科技重大专项(2012ZX09J12201)。作者简介:李健春(1990-),在读硕士,主要从事中药神经、精神药理与航天医学研究。△
,E-mail:wqimplad@126.com。
R346
A
1671-8348(2016)20-2737-03
2015-12-11
2016-04-28)
·论著·doi:10.3969/j.issn.1671-8348.2016.20.001

