葡萄叶片上冰核细菌的分离鉴定
孙鲁龙,宋伟,翟衡*(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
葡萄叶片上冰核细菌的分离鉴定
孙鲁龙,宋伟,翟衡*
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
摘 要:为了检测葡萄上冰核活性细菌的分布情况,并探究其对葡萄叶片霜冻害的影响,本试验对葡萄叶片上的冰核活性细菌进行了分离、鉴定和冰核活性的测定,并检验了活性较高的菌株对叶片冻害的效果。试验通过分离共获得10株冰核活性细菌,活性较高的1、2号菌株都是假单孢菌属(Pseudomonas)。用1、2号菌处理葡萄叶片,进行霜冻胁迫,叶片的霜冻指数分别达到83.67%和90.42%,而对照组为66.13%;活性最好的2号菌可以提高叶片过冷点2.3 ℃。
关键词:葡萄;冰核活性细菌;分离;鉴定;霜冻
近年来国内葡萄酒市场的繁荣态势,带动了酿酒葡萄种植业的迅速发展。酿酒葡萄种植面积不断扩大,分布区域逐渐北移。我国属于典型的大陆性季风气候,多数葡萄种植区春季气温并不像欧洲海洋性气候那样稳定,这使得葡萄在萌芽期极易遭受晚霜冻的伤害。研究霜冻发生的影响要素,探索霜冻发生规律,开发高效防霜技术成为葡萄生产中的重要措施。一般认为,霜冻害的发生情况与植物的耐寒能力和低温程度有关,霜冻被认为是一种气象灾害。近年的研究发现,某些微生物能加重植物的霜冻害。这些微生物能分泌特定的蛋白质,为冰晶的形成提供必要的凝结核(冰核),使组织中的水在较高的低温条件下发生胞内或胞外结冰,从而加重低温伤害。这类具有冰核活性的微生物被称为冰核微生物,根据其种类不同分为冰核细菌和冰核真菌[1-2],其中以冰核细菌的分布最为广泛,对植物的影响也最显著[3]。目前已经在香蕉、草莓、杏、茶树、小麦、枇杷等[4-9]多种作物上分离到了冰核细菌,但葡萄上冰核活性细菌的存在情况未见报道,冰核细菌对葡萄霜冻害的影响也是未知数。本研究旨在探明葡萄上冰核细菌的种类,并研究其对葡萄嫩叶霜冻害的影响,为防治霜冻提供理论支持。
1 材料与方法
1.1 冰核细菌的分离
从2012-2014年,每年春季于葡萄萌芽期采集嫩叶作为分离冰核细菌的样品。采样时间为清晨,采样地点为本学院实验站葡萄园、蓬莱国宾酒庄葡萄园。采样时戴上一次性无菌乳胶手套,将阳光未照射到的叶片摘下[10],收集到洁净的自封袋中,放入冰盒带回实验室。
嫩叶样品立即采用平板涂布法[11]分离细菌,若不能立即分离,暂时保存在4 ℃冰箱里,并在1~3 d内完成分离工作。在超净工作台上用无菌剪刀将样品剪碎混匀,随机称取1 g放入无菌研钵中,加入少量灭菌的石英砂充分研磨,用含0.1%蛋白胨的无菌水定容到10 mL,在200 r/min 25 ℃处理1 h,静置5 min。取1 mL上清液进行10倍系列梯度稀释,从10-3、10-4、10-53个稀释度中分别吸取0.1 mL稀释液涂布在各种培养基上,18 ℃培养3~5 d,长出的菌落根据形状、颜色、大小、边缘及表面特性等性状初步分类,并采用各自的分离培养基划线纯化至没有杂菌。
采用小液滴冻结法[12-13]检验菌株冰核活性的有无并测定其活性的强弱。在超净工作台上挑取长出的各种菌落,接种在KB平板上,24 ℃培养72 h。用超纯水冲洗菌苔,调整菌液浓度约108cfu/mL(用KB平板计数),4 ℃处理5 h,作为冰核活性测试液。按照文献提供的方法[10],在不超过20 ℃的环境温度下,以超纯水为对照,测定每个菌株108cfu/mL菌液在-5 ℃下5 min内的10滴液滴的冻滴率,每个重复有20%以上小液滴结冰认为该菌株具有冰核活性,试验重复3次。筛选出来的冰核细菌接种到KB斜面上,在24 ℃培养48 h后保存在4 ℃冰箱内备用。
试验用培养基[11]:
(1)甘油酪朊水解物培养基。甘油10 mL,酪蛋白水解物1 g,Na2HPO42.3 g,蔗糖10 g,NH4Cl 5 g,十二烷基硫酸钠0.6 g,琼脂15 g,蒸馏水1000 mL,pH7.0,121 ℃灭菌15 min。
(2)蔗糖蛋白胨培养基。蔗糖20 g,蛋白胨5 g, K2HPO40.5 g,MgSO40.25 g,琼脂15 g,蒸馏水1000 mL,pH7.0,121 ℃灭菌15 min。
(3)欧文氏菌选择性培养基。牛肉膏3 g,蛋白胨10 g,甘油25 mL,NaCl 50 g,琼脂15 g,蒸馏水1000 mL,pH7.2,121 ℃灭菌15 min。
(4)KB培养基。蛋白胨20 g,甘油25 mL[14],K2HPO41.5 g,MgSO41.5 g,琼脂15 g,蒸馏水1000 mL,pH7.2,121 ℃灭菌15 min。
1.2 冰核细菌对叶片霜冻害的影响
1.2.1 葡萄幼苗培养
试材为美乐1年生扦插苗,当幼苗长出10片功能叶时,选取长势一致的苗木进行试验。苗木培养环境为昼/夜温度25 ℃/20 ℃,600~800 μmoL/(m2·s)光强,空气相对湿度70%~75%。
1.2.2 菌液准备
各菌株接种在KB培养基上,20 ℃培养3 d,用无菌水冲洗菌苔,调整菌液浓度至108cfu/mL,放在4 ℃冰箱备用。
1.2.3 降温处理[15]
设置清水对照和喷布菌液两个处理。处理后在暗处晾干,将每个处理的幼苗各30株搬到人工气候箱内,模拟自然界霜冻降温天气,按19 ℃/h速度从室温降至4 ℃,再以2 ℃/h降至-3 ℃,维持4 h,之后以3 ℃/h速度回温到25 ℃,24 h后观察叶片的霜冻情况,霜冻指数/%=每棵幼苗受冻叶片数/每棵幼苗总叶片数×100。
将热电偶固定在第3片叶上,以2 ℃/h速度继续降温,直到监测的电压信号陡增,将电压信号陡增的温度点作为过冷点。
1.3 冰核细菌的分子鉴定
1.3.1 引物设计
根据黄晓琴[16]的方法设计通用引物,送北京金唯智生物科技有限公司进行引物合成。

1.3.2 菌落PCR[17-20]
前处理:挑取少量菌落,充分溶解在1 mL无菌水中,沸水煮15 min。
建立反应体系:ddH2O 10 μL,2×Taq Master Mix 8 μL,引物1 μL,菌液1 μL,总体积10 μL。
扩增条件:95 ℃预变性10 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,32次循环,72 ℃延伸5 min,4 ℃终止反应。
扩增后取7 μL PCR产物进行琼脂糖凝胶电泳,检查产物的特异性,特异性好的切胶回收,并送北京华大基因科技有限公司测序。
1.3.3 菌株同源性和系统发育分析
将测序结果在NCBI上进行Blast比对,并选择Gene bank中同源性较高的菌株序列与测试菌株进行比对,确定待测菌株的分类地位,同时用CLUSTAL 1.8.3和MEGA 5.2进行同源性分析,构建系统进化树。
2 结果与分析
2.1 冰核细菌的分离情况
本试验获得了10株具有冰核活性的细菌,如表1所示。其中6株分离自蓬莱国宾酒庄葡萄基地,另外4株分离自泰安市山东农业大学试验站葡萄园。1号、2号菌在-5 ℃测试环境下冻滴率可以达到100%,是所有菌株中冰核活性最强的菌株。分离自蓬莱地区的冰核细菌(1~6号)冻滴率最高为100%,最低为40%,平均为78.3%;分离自泰安地区的冰核细菌冻滴率最高为60%,最低为30%,平均为42.5%。从本试验结果看,泰安地区的冰核细菌冰核活性要小于蓬莱地区的。
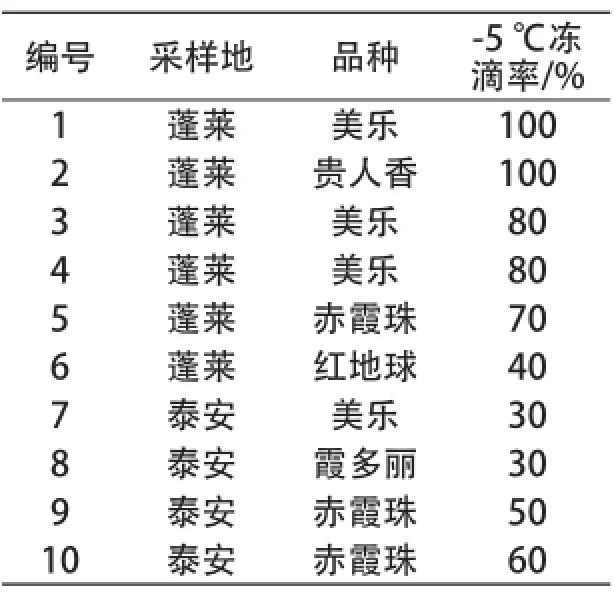
表1 具有冰核活性的菌株
2.2 冰核细菌对葡萄叶片霜冻害的影响
冰核细菌对植物而言,最大的危害在于能诱发和加重植物遭受霜冻害。表2显示了不同冰核细菌菌株喷布到葡萄叶片上后,进行霜冻处理,叶片霜冻遭受霜冻伤害的程度。从表2可以看出,与对照相比,冰核细菌能升高叶片的过冷点,增加霜冻指数。但不同的冰核细菌其致害效果不同。分离自蓬莱地区的1~6号菌,过冷点相对较高,造成叶片的霜冻指数也较高,1~5号处理后叶片的过冷点和霜冻指数要显著高于对照,其中2号菌的致害效果最明显,用其处理叶片,叶片的过冷点为-4.458 ℃,相对于对照的-6.768 ℃升高了2.3 ℃左右,同时造成叶片霜冻指数达到90.42%,较对照显著提升了34%。分离自泰安的4株冰核细菌,只有10号的作用效果与对照相比有显著差别,使叶片过冷点提高了0.7 ℃左右,霜冻指数增加了10%左右。
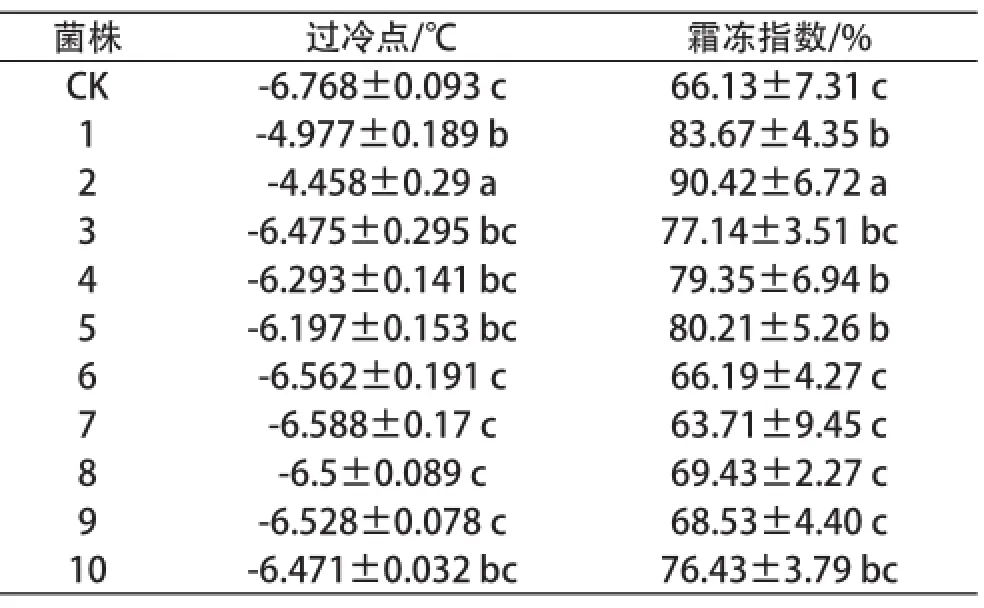
表2 冰核细菌对叶片霜冻的影响
2.3 冰核细菌的同源性分析
将10株冰核细菌测得的16S rDNA序列在NCBI上进行Blast比对发现,10个菌株分别与已经发表的10种菌具有99%以上的相似性,如表3所示。分离到的冰核细菌大部分属于假单胞菌属。
2.4 冰核细菌的系统发育分析
用CLUSTAL 1.83软件进行多重序列比较后,再用MEGA5.2 软件构建了系统进化树,发现2、4、5号菌可以聚合在一起,3、10号菌可以聚合在一起,说明其彼此之间起源较近。初步将各菌株确定为1、2、4、9是Pseudomonas sp.中的菌株,3、10是Pseudomonas fluorescens中的菌株,5号为Agrobacterium中的菌株,6号为Staphylococcus中的菌株,7号为Brevibacterium中的菌株,8号为Microbacterium中的菌株。
3 讨论与结论

表3 待测菌株的序列比对结果
冰核活性细菌影响植物对低温的敏感性及反应已经得到了大量的验证,在果树方面也取得了一些研究进展,但是在葡萄领域还未见报道,因此,本试验对葡萄上的冰核活性细菌进行分离鉴定并研究其对葡萄霜冻害发生的影响具有重要意义。

图1 10株菌的系统进化树
试验获得10株具有冰核活性的细菌,经鉴定大部分为假单孢菌属,同时也发现,未在文献中报道的其他细菌也具有一定的冰核活性。但后续的霜冻试验发现,只有1、2、3、4、5、10号菌能较大幅度增加叶片的过冷点和霜冻指数,另外4株并未造成显著的影响。这说明,细菌具有冰核活性和能造成霜冻伤害并不完全等同。细菌的冰核活性通常被认为来自冰核蛋白,而冰核只要求成核物质的结构与水分子结构相似,在降温过程中可以使冰晶有序排列即可,因此冰核蛋白可能并不是唯一的有机态冰晶排列模板。如果细菌自身的结构也可以满足成核要求,则会有不少细菌具有冰核活性。但是冰核细菌要对叶片造成霜冻影响,就必须产生冰核蛋白,进入寄主细胞,或者锚定在寄主细胞膜上,通过凝核结冰的效果破坏膜的完整性,以造成伤害。冰核细菌具有冰核活性但不一定能诱发和加重霜冻害的现象需要进一步的研究。
在10株菌中,1号和2号菌冰核活性最高、致害效果最好,造成叶片的过冷点大约在-4.5~-5 ℃之间。在自然环境下,冰核细菌的种群密度很难达到试验室环境下的高浓度(108cfu/mL),因此本研究初步认为,虽然葡萄上的某些冰核细菌(如2号)具有一定的冰核活性,但葡萄上的冰核细菌可能并不是诱发和加重霜冻的主要因素。
在研究中发现,蓬莱较泰安分离到的冰核细菌数目多、活性强,说明沿海的气候环境可能更适合冰核细菌的生长,冰核细菌的存在及活性表达可能需要特定的温湿环境。由于大陆性季风气候的影响,我国的葡萄产区葡萄春季萌芽期多具有干旱、多风的特点,这种气候并不适合冰核细菌的生长,因此会进一步削弱冰核细菌的致害效果。因此,冰核细菌对葡萄霜冻的影响仍有待于进一步研究。
参考文献
[1] LINDOW S E, ARNY D C, UPPER C D.Bacterial ice nucleation: a factor in frost injury to plants[J].Plant physiology, 1982, 70(4): 1084-1089.
[2] KIEFT T L.Ice nucleation activity in lichens[J].Appl Environ Microbiol, 1988, 54(7): 1678-1681.
[3] 孙福在, 赵廷昌.冰核细菌生物学特性及其诱发植物霜冻机理与防霜应用[J].生态学报, 2003, 23(2): 336-345.
[4] 张波.福建省香蕉上冰核细菌种类、分布及其与香蕉寒冻害关系的研究[D].福建农林大学, 2010.
[5] 张世光, 韦建福.云南植物上冰核细菌多样性研究[J].植物病理学报, 1999, 29(3): 256-260.
[6] 孙福在, 赵廷昌, 杨建民, 等.杏树上冰核细菌种类及其冰核活性与杏花霜冻关系的研究[J].中国农业科学, 2000, 33(6): 50-58.
[7] 黄晓琴.山东茶树冰核细菌的分离、鉴定及其与霜冻害关系研究[D].山东农业大学, 2009.
[8] 刘招舰.小麦上冰核细菌种类、分布及其与小麦霜冻关系的研究[D].山东农业大学, 2002.
[9] 王慧, 彭建平, 方树民, 等.枇杷幼果中定殖的冰核细菌与冻害关系[J].植物保护, 2008, 34(2): 43-46.
[10] 韦建福, 张世光.冰核细菌的研究方法[J].云南农业大学学报,2000, 15(2): 165-167.
[11] 方中达.植病研究方法[M].第3版.北京: 中国农业出版社,1998: 187.
[12] VALI G.Quantitative evaluation of experimental results on the heterogeneous freezing nucleation of supercooled liquids[J].J.Atmos.Sci., 1971, 28(3): 402-409.
[13] LINDOW S E.Erwinia herbicola: a bacterial ice nucleus active in increasing frost injury to corn[J].Phytopathology, 1978, 68(3): 523- 527.
[14] HILL T C J, MOFFETT B F, DEMOTT P J, et al.Measurement of ice nucleation-active bacteria on plants and in precipitation by quantitative PCR[J].Appl Environ Microbiol, 2014, 80(4): 1256-1267.
[15] 杨建民, 孟庆瑞, 彭伟秀, 等.冰核细菌对杏花器官抗寒性的影响[J].园艺学报, 2002, 29(1): 20-24.
[16] 黄晓琴, 束怀瑞, 刘会香, 等.山东省茶树冰核细菌的鉴定[J].茶叶科学, 2010, 30(3): 191-194.
[17] 徐丽, 蔡俊鹏.菌落PCR方法的建立及其与常规PCR方法的比较[J].华南理工大学学报(自然科学版), 2004, 32(5): 51-55.
[18] 毛伟华.菌落PCR产物直接测序方法的建立及在水稻基因测序中的应用[J].中国水稻科学, 2005, 19(5): 463-466.
[19] 李睿, 许芳, 张忠美, 等.检测产志贺毒素大肠杆菌的菌落PCR方法[J].食品科学, 2010, 31(16): 258-260.
[20] 陈书霞, 王晓武, 房玉林.单菌落PCR法直接快速鉴定重组克隆[J].微生物学通报, 2006, 33(3): 52-56.
中图分类号:S663.1
文献标识码:A
DOI:10.13414/j.cnki.zwpp.2016.04.001
收稿日期:2016-03-10
基金项目:国家现代农业产业体系建设专项资金项目(CARS-30);长江学者和创新团队发展计划项目(IRT15R42)
作者简介:孙鲁龙(1987-),男,在读博士,主要从事葡萄抗寒生理研究。E-mail: lulongsun@126.com
*通讯作者:翟衡,E-mail: zhaih@sdau.edu.cn
Isolation and identification of ice nucleation active bacteria from leaves of grapevine
SUN Lulong, SONG Wei, ZHAI Heng*
(State Key Laboratory of Crop Biology, College of Horticultural Science and Engineering,Shandong Agricultural University, Tai'an 271018, Shandong, China)
Abstract:To investigate the distribution of ice nucleation active bacteria in grapevine and detect its influence on frost damage of leaf, ice nucleation active bacteria were isolated and identified from leaves of grapevine.Effects of frost damage on leaves induced by strains with high ice nucleation activity were examined.10 strains of ice nucleation active bacteria were obtained, the most active strains NO.1 and NO.2 belonged to Pseudomonas.Frost index of leaves reached 83.67% and 90.42% after sprayed by NO.1 and NO.2 strains separately, while the control group was 66.13%.The most active strain was NO.2, raising 2.3 ℃ of leaf supercoiling temperature.
Key words:grapevine; ice nucleation active bacteria; isolation; identification; frost

