TNF-α+489位点多态性与慢性阻塞性肺疾病易感性关系的Meta分析
梁欢 何杰 李小燕 李万成 方恩容
TNF-α+489位点多态性与慢性阻塞性肺疾病易感性关系的Meta分析
梁欢1何杰2李小燕2李万成2方恩容2
610041 成都,四川大学华西医院感染科1
【摘要】目的探讨TNF-α+489位点多态性与慢性阻塞性肺疾病(COPD)发病风险的相关性。方法计算机检索PubMed、EMbase、WanFang、CNKI文献数据库,查找国内外关于TNF-α+489多态性与慢性阻塞性肺疾病易感性关系的病例对照研究,检索时限为建库至2015年7月20日。由2名评价者根据纳入和排除标准筛选文献,提取并评价资料后,采用RevMan 5.2软件及Stata 10.0软件进行Mete分析。结果在这项荟萃分析中,共纳入13个研究,有病例组患者2 459例、对照组患者2 823例;Meta分析结果显示,对于总体人群而言TNF-α+489位点基因多态性与慢性阻塞性肺疾病的患病风险不相关(OR=1.20,95% CI: 0.96~1.50,P=0.11 )。在研究人群种族的基础上进行亚组分析,结果显示:在高加索人群及亚组人群中,TNF-α+489与慢性阻塞性肺疾病(COPD)易感性关联均无统计学意义。吸烟是慢性阻塞性肺疾病最重要的危险因素之一,本研究对吸烟人群进行亚组分析,结果表明在这类人群中TNF-α+489与COPD易感性关联也无统计学意义(OR=1.24,95% CI: 0.96~1.59,P=0.09)。结论TNF-α+489基因多态性与COPD的发病风险可能不存在相关性。
【关键词】肺疾病,慢性阻塞性;肿瘤坏死因子-α;Meta分析;多态性
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是全球最主要的慢性疾病之一,对患者的健康、生活质量以及病死率有重要影响,其特点是不完全可逆的气流受限和持续性气道炎症[1-3]。据世界卫生组织的估计,在2014大约有6千万人罹患COPD,三百多万人死于该病[4]。COPD的发生和进展过程复杂,有各种危险因素参与,包括环境因素、遗传因素和吸烟状况等[5]。虽然吸烟是COPD发展的主要危险因素,但只有不到20%的吸烟者发展成为COPD[6];COPD患者中非吸烟者占了相当比例[7];这一结果表明环境和遗传因素可能在COPD的发病机制中有着重要作用[8-10]。
肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)是由巨噬细胞β单核细胞活化产生的一种具有多种生物学效应的细胞因子,在COPD患者的痰液、支气管肺泡灌洗液、肺活检标本中均可发现[11-13]。TNF-α在COPD患者早期气道炎症开始时即发挥着重要作用[14-15]。已有研究表明在COPD患者的急性加重期和稳定期均能检测到高浓度的TNF-α[12]。TNF-α的表达受相关基因多态性的调控,TNF +489基因多态性是最近研究热点之一。+489G/A是TNF-α基因第一内含子,参与TNF-α转录水平调节,控制TNF-α的转录活性[16-18]。在过去的十年中,有大量的文献研究关于TNF-α+489多态性与COPD发病风险的相关性,但是TNF-α基因与COPD的关系在不同人群种族、性别、年龄等因素下得到的结论不尽一致。Teramoto等[19]研究显示,TNF-α+ 489多态性与COPD发病风险无显著相关性。同样,Gingo等[20]对美国人群的研究中也证实了这一结论。然而,Kücükaycan等[21]发现TNF-α+489位点可能是增加COPD患病风险的危险因素。为了进一步探讨TNFα+ 489位点多态性与COPD易感性的关系,本研究采用Meta分析方法,综合评价TNF-α+489位点是否与COPD发病风险相关。
资料与方法
一、 检索策略
计算机全面检索PubMed,EMBASE,CNKI,CBM,Wanfang data,VIP数据库中有关TNF-α+489多态性和COPD发病风险的病例-对照研究(检索时限:均从建库至2015年7月)。文献检索策略采用主题词和自由词结合的原则,中文检索词包括:慢性阻塞性肺疾病、肿瘤坏死因子TNF-α、多态性等,英文检索词包括:chronic obstructive pulmonary disease、COPD、tumor necrosis factor-alpha、TNF-α、polymorphism等。
二、纳入与排除标准
所有的研究都符合以下的纳入标准:①研究内容为详细描述TNF-α+489多态性与COPD发病风险的相关性的文献;②研究设计类型:病例-对照研究;③病例-对照组基因型分布适中;④对照组基因型分布必须符合Hardy-Weinberg(HWE)遗传定律;⑤ 研究对象 根据相关指南明确诊断为COPD患者。排除标准:①以家系为基础研究;②研究方法不是以病例-对照研究,不能提供确切基本信息;③文摘、会议、重复文献;④对照组基因型分布不符合Hardy-Weinberg(HWE)遗传定律。
三、文献筛选、数据提取与质量评价
两名独立的研究员按照纳入排除标准对文献质量进行逐一筛选,并提取数据。对于符合标准的文献均提取以下内容:第一作者、出版时间、国家( 地区) 、种族、 样本大小、病例组-对照组数量,病例组和对照组基因型分布数量等。当意见不同时,由第三名研究人员协助评估解决。对每个纳入研究按照STERGA原则进行质量评分。评价内容如下:①样本量是否充分;②诊断标准是否清楚;③对照组是否与病例组具有可比性,对照组基因分布是否符合遗传平衡定律;④分组匹配情况;⑤基因检测方法合理性;⑥数据是否充分。以上6条,每满足1条计1分,总分大于3分视为质量可靠性好。
四、统计学方法
采用Cochrane 协助网RevMan 5.2版本软件对研究数据进行统计学分析,采用OR值与95%CI为效应量评价TNF-α+489多态性与COPD易感性的关系。首先对纳入研究的对照组基因型进行Hardy-Weinberg遗传定律检验,若不符合HWE,予以排除。对符合HWE的研究分别计算其在5种遗传模型(AA+AGvs. GG、AAvs. GA+GG、AAvs. GG、AGvs. GG、Avs. G)下的基因型分布,并采取Q检验进行异质性分析,若P>0.1且I2<50%,采用固定效应模型进行Meta分析;反之,采用随机效应模型进行Meta分析。发表偏倚的检验采用Stata10.0软件进行分析。
结 果
一、 文献检索结果
从PubMed、CNKI、万方数据库初步收索出242篇文献,见图1。经过逐步筛选,最终纳入12篇符合纳入排除标准文献,共13项病例对照研究[18,20-30]。有7项研究在亚洲人群中进行,有6项在高加索人群中进行。所有研究中COPD患者2 459例、健康对照组2 823例。有11项病例对照研究包含了吸烟者。依据STERGA原则对所有纳入文献质量进行评价,所有文献质量总分均大于3分,质量可靠性好,各研究文献的基本情况特征,见表1。各纳入研究的基因型和等位基因分布情况,见表2。
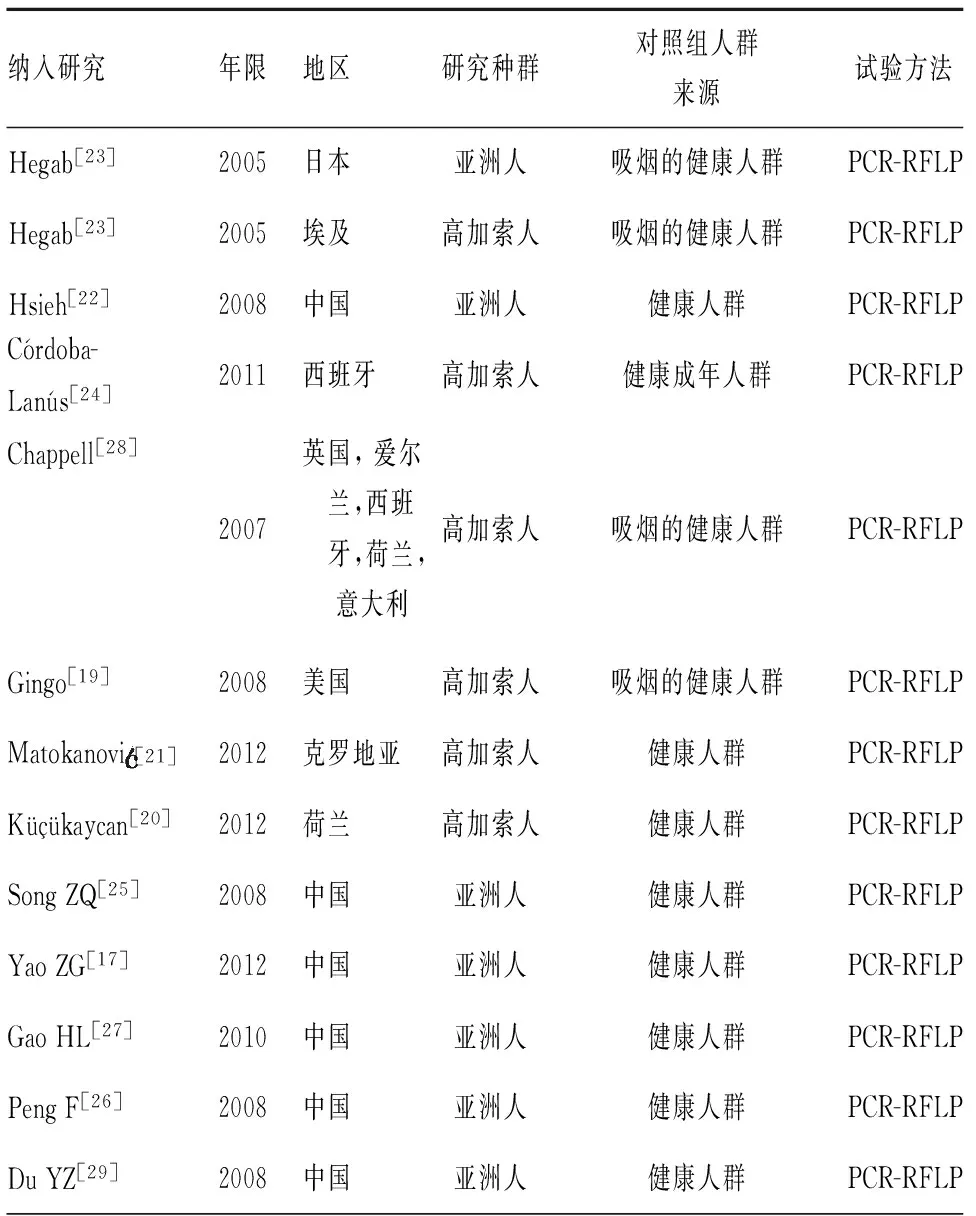
表1 纳入研究的基本特征
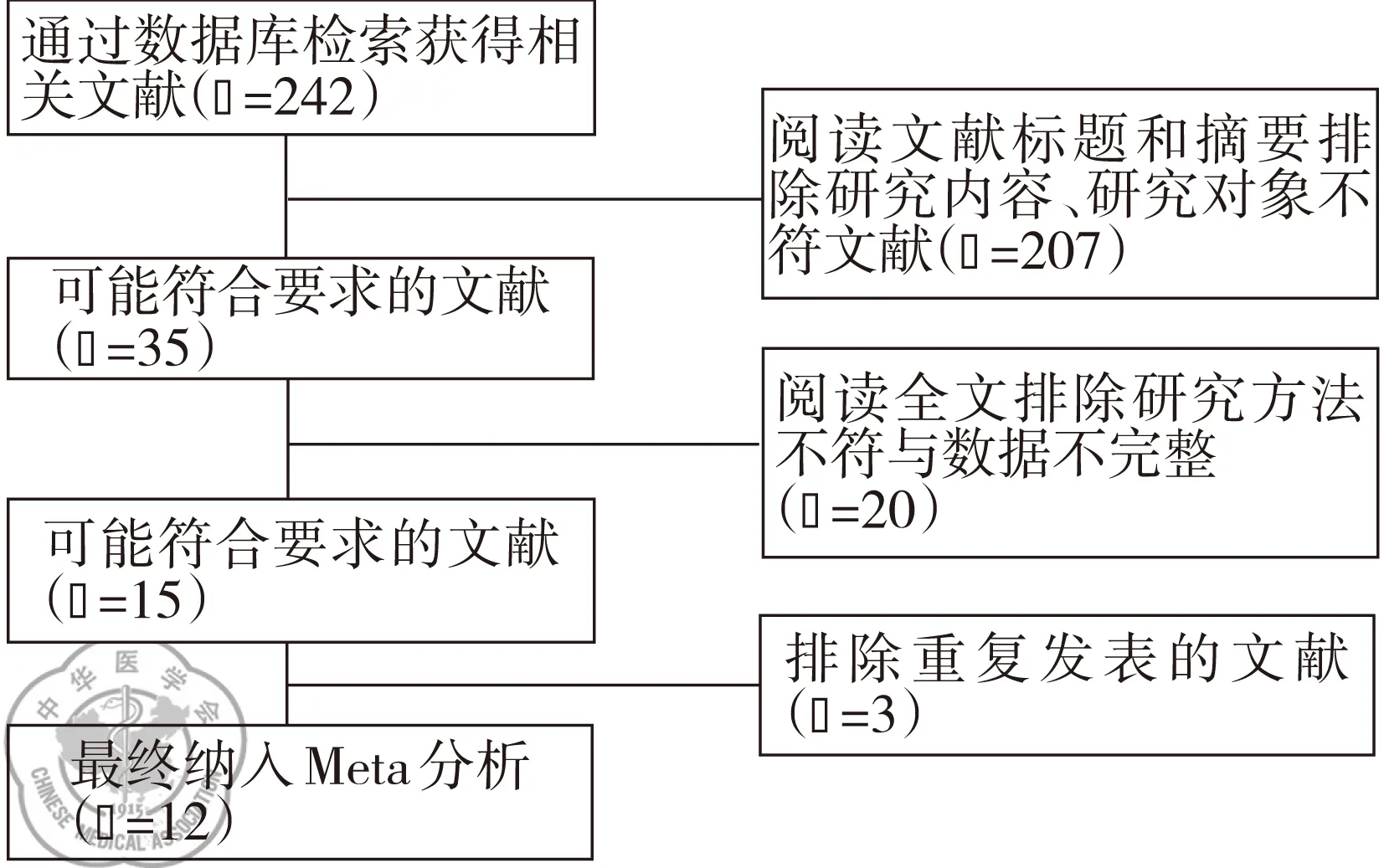
图1文献筛选流程及结果
二、Meta分析结果
1. 总体人群中的TNF-α+489多态性与COPD易感性的关系的Meta分析:本组研究纳入的13项研究中,经异质性检验,各研究间存在统计学异质性(χ2=28.29,P=0.005)。因此,采用随机效应模型来分析数据,结果显示:对总体人群而言,TNF-α+489G/A基因多态性与慢性阻塞性肺疾病易感性关联无统计学意义 (Avs. G:OR=1.20,95%CI: 0.96~1.50,P=0.11),携带等位基因A的个体可能与COPD发病风险无相关性,见图2。各个基因组比较,见表3。

图2TNF-α-489位点多态性与COPD易感性关系的总体及亚组分析结果(Avs. G)
2. 吸烟人群中的TNF-α+489多态性与COPD易感性的关系的Meta分析:由于吸烟是慢性阻塞性肺病的主要危险因素之一,本研究对吸烟者进行了Meta分析,发现TNFα+489多态性与COPD发病风险之间存无显著相关性(Avs. G:OR=1.24,95%CI:

表2 纳入研究基因型频率分布
注:Genotype:基固类型;Allele:等位基因;GG、GA、AA、A:基因型

表3 各种遗传模型的Meta分析结果
注:GG、GA、AA、A:基因型
0.96~1.59,P=0.09),见图3,其他比较结果,见表3。

图3TNF-α-489位点多态性与COPD易感性关系在吸烟人群中的分析结果(Avs. G)
3. TNF-α+489多态性与不同人群COPD关系的Meta分析结果:13项研究分为亚洲人群、高加索人群,使用等位基因模型进行Meta分析发现,在亚洲人群中,TNF-α+489基因多态性与COPD发病风险不相关(Avs. G:OR=1.45, 95%CI: 0.99~2.12,P=0.06),同时,在高加索人群中,TNF-α+489基因多态性与COPD发病风险也不存在相关性(Avs. G:OR=1.02, 95%CI: 0.87~1.18,P=0.84),见图2,其余基因型比较结果,见表3。
三、发表偏倚分析及敏感性分析
本研究采用Begg检验法、Egger回归法检验发表偏倚。Begg′s漏斗图的形状对称,见图4。同时采用Egger线性回归法检验漏斗图数据有无统计学意义(t=0.10,P=0.920)。以上数据表明,在本次Meta分析中纳入文献无发表偏倚。依次剔除每一病例对照研究,统计学结果未发生明显改变,其结果表明纳入的每个研究权重均对分析结果无明显影响。
讨 论
TNF-α基因位于人染色体的6p21.3区域,其编码的蛋白在免疫及炎症反应中发挥着重要作用[14]。在COPD患者血液和痰中检测到高浓度TNF-α表明,TNF-α参与了COPD局部和全身炎症反应[21]。由于TNF-α的表达受其基因多态性的调控,近年来,越来越多研究者均在研究TNF-α基因多态性对COPD易感性的影响。已有研究报道,TNF-α+489基因含等位基因A的可以促进TNF-α产生,并参与介导COPD患病易感性[30-31]。然而,目前TNF-α+ 489基因突变导致COPD发病风险增高的机制仍未明确。Castaldi等[32]对TNF-α+489多态性与COPD易感性进行了系统评价,认为携带等位基因A的个体可能增加COPD的患病风险,但在过去几年中,有较多研究发表了关于不同人群中TNF-α+489多态性与COPD易感性的文章,其结论不尽相同,这些新的数据资料应该被纳入。因此,TNF-α+489多态性与COPD易感性值得我们将所有符合条件的研究纳入进行分析,以便于我们准确的得到两者间的关系。
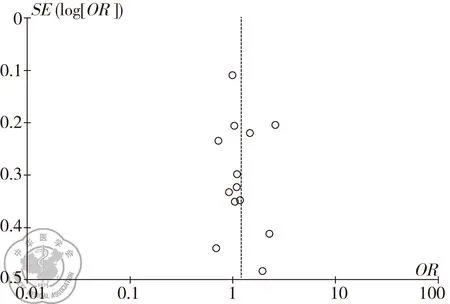
图4纳入文献的发表偏倚分析
本研究系统评价了TNF-α+489多态性与COPD易感性的相关病例对照研究。共纳入13项研究,包括2 459例COPD患者和2 823例健康正常人,采用等位基因模型进行Meta分析,对于总体人群而言,TNF-α+489多态性和COPD易感性关联无统计学意义;本研究结果表明,携带A基因及其等位基因的人可能不会增加或降低COPD发病风险。因纳入研究人群的遗传背景不同,本研究又按种族不同进行了亚组分析:亚洲人群和高加索人群。和以前的研究结论不同,TNF-α+489多态性在亚洲人群及高加索人群中与COPD发病风险不存在相关性。造成这种结果的原因可能为:①TNF-α其他位点共同参与编码TNF-α蛋白,可能只有部分TNF-α基因位点多态性涉及COPD疾病的发生;②不同位点的TNF-α基因多态性可能与不同疾病相关联,TNF-α基因对TNF-α水平的调控可能存在细胞、组织以及器官的特异性,并与外界不同刺激因素相关联;③与临床异质性,如:年龄、生存环境、吸烟情况、性别、基础肺功能等因素相关。根据吸烟情况进行分层分析时,发现吸烟人群的TNF-α基因多态性与COPD发病风险无显著相关性,表明吸烟状况可能不会影响TNF-α+489多态性对COPD易感性。在本研究中,纳入的各个研究间存在一定异质性,其原因可能是:纳入研究的人群和种族不同;各纳入研究的具体诊断标准、基因检测的方法不尽相同;吸烟人群的研究样本量相对较少,尤其是亚洲人群。据此,继续研究其他位点的单核苷酸特性,分析多个位点多态性与环境因素在COPD中的协同作用,以及在内环境中多个单核苷酸多态性对TNF-α表达的影响,将有可能进一步明确TNF-α基因多态性在COPD中的作用。
本研究也存在一定局限性,首先,本次研究纳入的数据局限于中文文献、英文文献,可能会导致部分潜在研究缺失;其次,由于缺乏原始数据,不能对纳入研究的其他临床资料,如年龄、性别、肺功能分级以及地区进行分析;再次,部分研究局限于亚洲人和白种人,缺乏对其他人群的研究,因此本研究结论只适用亚洲及高加索人群的分析。尽管存在以上局限性,本研究通过制定详细的研究计划将偏倚控制在最小范围内,如数据提取、统计分析等,保证了本研究结果的可信度。
综上所述,TNF-α+489多态性与COPD发病风险可能不存在相关性。为了进一步探索基因-基因、基因-环境的交互作用对TNF-α基因多态性与COPD发病风险的影响,仍需要开展大样本量、多中心、多基因以及同质性较好的病例对照研究。
参考文献
1任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志:电子版, 2009, 2(2): 104-115.
2van Dijk WD, Gupta N, Tan WC, et al. Clinical relevance of diagnosing COPD by fixed ratio or lower limit of normal: a systematic review[J]. COPD, 2014, 11(1): 113-120.
3Wang W, Li P, Chen Y, et al. Association between beta2-adrenergic receptor-16Arg/Gly gene polymorphism and chronic obstructive pulmonary disease risk: systematic review and meta-analysis[J]. Iran J Public Health, 2014, 43(7): 877-888.
4Park H, Jung SY, Lee K, et al. Prevalence of chronic obstructive lung disease in Korea using data from the fifth Korea national health and nutrition examination survey[J]. Korean J Fam Med, 2015, 36(3): 128-134.
5Bagdonas E, Raudoniute J, Bruzauskaite I, et al. Novel aspects of pathogenesis and regeneration mechanisms in COPD[J]. Int J Chron Obstruct Pulmon Dis, 2015, 10: 995-1013.
6Zhang S, Wang C, Xi B, et al. Association between the tumour necrosis factor-alpha-308G/A polymorphism and chronic obstructive pulmonary disease: an update[J]. Respirology, 2011, 16(1): 107-115.
7Lamprecht B, McBurnie MA, Vollmer WM, et al. COPD in never smokers: results from the population-based burden of obstructive lung disease study[J]. Chest, 2011, 139(4): 752-763.
8Marciniak SJ, Lomas DA. What can naturally occurring mutations tell us about the pathogenesis of COPD?[J]. Thorax, 2009, 64(4): 359-364.
9Wei L, Xu D, Qian Y, et al. Comprehensive analysis of gene-expression profile in chronic obstructive pulmonary disease[J]. Int J Chron Obstruct Pulmon Dis, 2015, 10: 1103-1109.
10Hobbs BD, Hersh CP. Integrative genomics of chronic obstructive pulmonary disease[J]. Biochem Biophys Res Commun, 2014, 452(2): 276-286.
11Ji J, von Scheele I, Bergstrom J, et al. Comsect1ment differences of inflammatory activity in chronic obstructive pulmonary disease[J]. Respir Res, 2014, 15: 104.
12Keatings VM, Collins PD, Scott DM, et al. Differences in interleukin-8 and tumor necrosis factor-alpha in induced sputum from patients with chronic obstructive pulmonary disease or asthma[J]. Am J Respir Crit Care Med, 1996, 153(2): 530-534.
13Takabatake N, Arao T, Sata M, et al. Circulating levels of soluble Fas ligand in cachexic patients with COPD are higher than those in non-cachexic patients with COPD[J]. Intern Med, 2005, 44(11): 1137-1143.
14Li YF, Gauderman WJ, Avol E,et al. Associations of tumor necrosis factor G-308A with childhood asthma and wheezing[J]. Am J Respir Crit Care Med, 2006, 173(9): 970-976.
15Mukhopadhyay S, Hoidal JR, Mukherjee TK. Role of TNFalpha in pulmonary pathophysiology[J]. Respir Res, 2006, 7: 125.
16Noguchi E, Yokouchi Y, Shibasaki M, et al. Association between TNFA polymorphism and the development of asthma in the Japanese population[J]. Am J Respir Crit Care Med, 2002, 166(1): 43-46.
17Lucey EC, Keane J, Kuang PP, et al. Severity of elastase-induced emphysema is decreased in tumor necrosis factor-alpha and interleukin-1beta receptor-deficient mice[J]. Lab Invest, 2002, 82(1): 79-85.
18姚志刚, 王浩彦, 贾楠. TNF-α+308、TNF-α+489基因态性与慢性阻塞性肺疾病的相关性研究[J]. 现代中西医结合杂志, 2012, 21(22): 2400-2402.
19Teramoto S, Ishii T, Ishii M, et al. Variation in the tumour necrosis factor-alpha gene is not associated with susceptibility to Asian COPD[J]. Eur Respir J, 2008, 31(3): 682-683.
20Gingo MR, Silveira LJ, Miller YE, et al. Tumour necrosis factor gene polymorphisms are associated with COPD[J]. Eur Respir J, 2008, 31(5): 1005-1012.
21Kücükaycan M, Van Krugten M, Pennings HJ, et al. Tumor necrosis factor-alpha+489G/A gene polymorphism is associated with chronic obstructive pulmonary disease[J]. Respir Res, 2002, 3: 29.
22Matokanovic M, Rumora L, Popovic-Grle S, et al. Association of hsp70-2 (+1267A/G), hsp70-hom (+2437T/C), HMOX-1 (number of GT repeats) and TNF-alpha (+489G/A) polymorphisms with COPD in Croatian population[J]. Clin Biochem, 2012, 45(10-11): 770-774.
23Hsieh MH, Chong IW, Hwang JJ, et al. Lack of associations between several polymorphisms in cytokine genes and the risk of chronic obstructive pulmonary diseases in Taiwan[J]. Kaohsiung J Med Sci, 2008, 24(3): 126-137.
24Hegab AE, Sakamoto T, Saitoh W, et al. Polymorphisms of TNFalpha,IL1beta, and IL1RN genes in chronic obstructive pulmonary disease[J]. Biochem Biophys Res Commun, 2005, 329(4): 1246-1252.
25Córdoba-Lanús E, Baz-Dvila R, de-Torres JP, et al. TNFA-863 polymorphism is associated with a reduced risk of chronic obstructive pulmonary disease: a replication study[J]. BMC Med Genet, 2011, 12: 132.
26宋泽庆, 彭峰, 陈敏. TNF-α位基因多态性与慢性阻塞性肺疾病的易感性研究[J]. 中国现代医学杂志, 2008, 18(19): 2775-2778.
27彭峰. TNF-α+489位基因多态性与慢性阻塞性肺疾病的易感性研究[C]. 广东医学院, 2008: 982-984.
28高欢玲. TNF-α和IL-6基因基因多态性与COPD易感性的关系研究[C]. 山西医科大学, 2010: 39-42.
29Chappell S, Daly L, Morgan K et al. Variation in the tumour necrosis factor gene is not associated with susceptibility to COPD[J]. Eur Respir J, 2007, 30(4): 810-812.
30杜昀泽, 刘林林, 纪凤祥, 等. 肿瘤坏死因子α+489G/A基因多态性与慢性阻塞性肺疾病的相关性研究[J]. 国际呼吸杂志, 2008, 28(12): 729-732.
31Murugan V, Peck MJ. Signal transduction pathways linking the activation of alveolar macrophages with the recruitment of neutrophils to lungs in chronic obstructive pulmonary disease[J]. Exp Lung Res, 2009, 35(6): 439-485.
32Castaldi PJ, Cho MH, Cohn M, et al. The COPD genetic association compendium: a comprehensive online database of COPD genetic associations[J]. Hum Mol Genet, 2010, 19(3): 526-534.
(本文编辑:黄红稷)
梁欢,何杰,李小燕,等. TNF-α+489位点多态性与慢性阻塞性肺疾病易感性关系的Meta分析[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(3): 286-291.
DOI:10.3877/cma.j.issn.1674-6902.2016.03.012
基金项目:四川省科技厅基金资助项目(2014JY0176)
通讯作者:何杰,Email: hejieli1987@sina.com
中图法分类号:R563
文献标识码:A
Corresponding author:He Jie, E-mail: hejieli1987@sina.com
(收稿日期:2015-08-18)
Tumor necrosis factor-α+489 polymorphism and risk of chronic obstructive pulmonary disease: A Meta-analysis
LiangHuan1,HeJie2,LiXiaoyan2,LiWancheng2,FangEnrong2.1Desect1mentofInfectiousDisease,WestChinaHospital,SichunUniversity,Chengdu610041,China,2Desect1mentofRespiratoryMedicine,TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu, 610500,China
【Abstract】ObjectiveTo investigate the association between tumor necrosis factor-α+48(TNF-α+489) and the risk of chronic obstructive pulmonary disease(COPD) by Meta-analysis. MethodsThe Embase, PubMed, CNKI, Wanfang databases were searched to identify domestic and foreign case-control studies involving the association between TNF-α+489 polymorphism and risk of COPD (last updated to June 20th 2015). Two independent reviewers collected the data and reached an agreement on all items according to the inclusion and exclusion criteria and extracted data. Statistical analysis was performed by Revman 5.2 software and Stata10.0 software. ResultsA total of 2 459 cases and 2 823 controls in thirteen case-control studies were included in this Meta-analysis. The results suggested that the +489 G/A polymorphism in TNF-α gene might not be associated with risk of COPD (OR=1.20, 95% CI: 0.96-1.50, P=0.11 for A vs. G). In the subgroup by ethnicity, no significant associations were found in Asians (OR=1.45, 95% CI: 0.99-2.12, P=0.06) and in Caucasians (OR=1.02, 95% CI: 0.87-1.18, P=0.84) for the comparison of A vs. G. As smoking is one of the most crucial risk factors for COPD, a Meta-analysis that included only smokers was carried out. The results indicated that significant associations were not found in this population (OR=1.24, 95% CI: 0.96-1.59, P=0.09 for A vs. G). ConclusionResults from the current Meta-analysis indicate that the TNF-α+489 G/A polymorphism might not contribute to susceptibility to COPD.
【Key words】Chronic obstructive pulmonary disease;Tumor necrosis factor-α;Meta-analysis;Polymorphism
610500 成都,成都医学院第一附属医院呼吸内科2

