基于稳定同位素分析不同蛋白源对大菱鲆生长的影响
李忠清夏 斌张利民王际英李宝山孙永智, 3王明辉
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 山东省海洋资源与环境研究院, 烟台 264006;3. 山东升索渔用饲料研究中心, 烟台 265500)
基于稳定同位素分析不同蛋白源对大菱鲆生长的影响
李忠清1, 2夏 斌2张利民2王际英2李宝山2孙永智2, 3王明辉1, 2
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 山东省海洋资源与环境研究院, 烟台 264006;3. 山东升索渔用饲料研究中心, 烟台 265500)
实验采用混合植物蛋白(玉米蛋白和大豆浓缩蛋白等氮1∶1混合)替代鱼粉蛋白投喂大菱鲆, 通过测定不同饲料组和体组织中氮稳定同位素的值, 估算氮同位素的周转率及不同蛋白源对大菱鲆生长的贡献比例。实验设计了4种配合饲料, 在等氮等能的基础上, 以混合植物蛋白分别替代饲料中0、10%、30%和50%的鱼粉蛋白, 即CS0、CS10、CS30和CS50。将初始体重为(57.72±0.25) g的大菱鲆分成4组, 每组设3个平行,实验周期为56d。实验开始后的7d、14d、28d、42d和56d采集并测定大菱鲆肌肉和肝脏中氮稳定同位素值(δ15N)。研究结果表明, 当替代量达到50%时, 大菱鲆摄食率和特定生长率显著低于其他组(P<0.05), 而饲料系数显著高于其他组(P<0.05)。不同实验组间氮同位素的周转率均存在显著性差异(P<0.05), 对照组的周转速度最快。各实验组肝脏的周转率均显著快于肌肉(P<0.05)。大菱鲆肌肉中氮同位素的周转半衰期(23.96—32.42d)显著高于肝脏的(12.38—16.83d) (P<0.05)。生长作用对大菱鲆肌肉氮同位素周转的贡献比例为57.33%—73.33%, 而对肝脏的贡献比例为29.17%—36.10%。基于时间的周转模型估算氮同位素分馏系数(Δ)为1.83‰— 2.83‰。采用Isosource软件计算显示, CS10、CS30和CS50组中鱼粉、玉米蛋白和SPC三种蛋白源对大菱鲆生长的贡献比例分别为80%、7%和13%, 62%、11%和27%, 46%、13%和41%。研究结果表明:生长作用和代谢作用共同驱动了氮稳定同位素在大菱鲆体组织中的周转代谢; 氮稳定同位素在肝脏组织中的周转速度明显快于肌肉的, 相应的周转半衰期更短; 各实验组中SPC对大菱鲆生长的贡献均优于玉米蛋白。
大菱鲆; 氮稳定同位素; 生长; 代谢; 周转模型
长期以来, 蛋白质营养一直是国内外动物营养学研究领域的重点和热点之一[1]。蛋白质周转作为机体营养代谢的直接反应, 对调节蛋白质在组织中的沉积, 去除细胞内的异常蛋白, 维持细胞内酶和结构蛋白的稳定状态以及细胞内环境的相对稳定具有重要作用, 是形成动物产品的唯一生物学途径和动物适应生存环境的基本生物学机制[2]。目前,定量揭示机体蛋白质周转代谢规律, 从代谢水平上探求蛋白源替代及蛋白质节约效应已经成为水生动物营养学研究中的重要课题。
随着稳定同位素技术及相应质谱检测技术的发展, 在非添加标记物的情况下基于稳定同位素自然丰度差异及富集变迁的示踪, 为机体蛋白质周转代谢机理的研究提供了新方法, 并逐渐向特定组织器官和细胞分子水平发展, 其具有干扰因素少、灵敏度高及结果可靠等优点, 且能反应机体长时间蛋白质周转代谢的变动情况。Gamboa-Delgdo等[3, 4]利用13C和15N的天然丰度并基于时间的周转模型,研究了不同蛋白源在凡纳滨对虾(Litopenaeus vannamei)中的周转代谢率及对其生长的贡献比例。Gianini-Abimorad等[5]通过平衡饲料中的赖氨酸和蛋氨酸含量, 利用稳定同位素技术分析了细鳞鲳(Piaractus mesopotamicus)幼鱼肌肉蛋白质的周转代谢率和氨基酸利用效率。
大菱鲆(Scophthatmus maximus L.) 属鲽形目(Pleuronectiformes), 鲆科(Bothidae), 菱鲆属(Psetta),俗称欧洲比目鱼, 在中国称“多宝鱼”、“瘤棘鲆”,现已成为我国重要的海水养殖品种[6, 7]。然而, 鱼粉资源的匮乏和价格不断飙升, 大大增加了其养殖成本[8—10]。因此, 寻求其他廉价、高效的蛋白源来替代鱼粉以应对日益发展的水产养殖业已势在必行[11, 12]。本实验采用玉米蛋白和大豆浓缩蛋白(Soy protein concentrate, SPC)按不同比例替代大菱鲆饲料中的鱼粉, 通过测定肌肉和肝脏中氮稳定同位素值的变动情况, 计算氮同位素的周转率及不同蛋白源对大菱鲆生长的贡献比例。
1 材料与方法
1.1 实验设计
以鱼粉、玉米蛋白和SPC为蛋白源, 鱼油和大豆卵磷脂为脂肪源, 按不同比例混合后配制成4种配合饲料。4种饲料在等氮等能的基础上, 以混合植物蛋白(玉米蛋白和SPC等氮1∶1混合)分别替代饲料中0、10%、30%和50%的鱼粉蛋白, 并相应命名为CS0、CS10、CS30和CS50(表 1)。将粉碎后的饲料原料过80目筛, 称重并采用逐级扩大法混合均匀, 然后加入鱼油和适量的蒸馏水二次混合均匀,将油脂颗粒搓散过网, 经螺旋挤压机加工成直径4 mm的硬颗粒饲料, 60℃恒温烘干后冷藏备用。
1.2 饲养管理
实验用大菱鲆幼鱼购于山东省蓬莱宗哲养殖有限公司, 为同批健康鱼苗。驯养2周后, 选取体质健壮、均重为(57.72±0.25) g的大菱鲆, 随机分为4组, 每组设3个平行, 每个平行36尾鱼, 分别放于圆柱形养殖桶内(直径80 cm, 高70 cm), 养殖周期56d。实验在微流水环境中进行, 24h充气增氧, 溶氧>6.5 mg/L, 水温(17.5±0.5)℃, 盐度在28‰—32‰,pH 7.8—8.0, 亚硝酸氮、氨氮含量均<0.1 mg/L。实验期间每天饱食投喂2次(8:00, 17:00), 日投喂量为鱼体重的1.5%—2%, 根据摄食情况适当调整投喂量。投喂30min后, 从排水口将残饵排出, 记录残饵量。
1.3 样品采集与生长指标计算
实验开始前, 随机取10尾大菱鲆的背肌和肝脏作为初始样。实验开始后的7d、14d、28d、42d和56d, 分别从每桶中随机取3尾鱼, 称重并取其背肌和肝脏, -80℃保存, 用于氮稳定同位素测定。
实验结束前1天停止投喂, 每桶鱼测定总重并记录总数。预先测定饲料的溶失率, 根据投饵量和矫正的残饵量计算生长性能指标, 公式如下:
摄食率(Feed intake, FR, %BW/d)=100×摄食量/[(初始体重+末重)/2]/天数;
增重率(weight gain rate, WGR, %)=(末重-初始重)/初始重×100;
肥满度(Condition factor, CF, g/cm3)=体重/体长3×100;
饲料系数(Feed coefficient, FC)=摄食饲料量/(末重-初始重)×100;
蛋白质效率(PER)=(末重-初始重)/摄入蛋白量(干物质)。
1.4 天然稳定同位素测定
饲料原料及大菱鲆体组织样品的氮稳定同位素值均采用元素分析仪偶联同位素比率质谱仪(EA-IRMS, ThermoFinnigan MAT Delta-plus)测定。稳定同位素结果以国际符号δ表示, 如下:

其中, X=15N, R=15N∶14N的比值。氮稳定同位素测定使用的标准品为国际统一标准物, 空气(Air) N2。
1.5 基于时间的氮同位素周转模型
本研究采用的时间周转模型基于Hesslein指数模型[13], 该模型将进食饲料前后机体稳定同位素随时间的变化归因于机体组织的生长作用和代谢作用, 如下:

δt为实验第t天时体组织的稳定同位素值, δf为体组织稳定同位素达到平衡状态时的δ15N值, δ0为实验开始时体组织δ15N值。k为实验期间的特定生长率,m为新陈代谢率, t为实验持续时间。特定生长率(k)通过如下公式计算[14]:

式中,W0为初始体重, Wf为取样时间点的体重。由生长作用单独驱动体组织氮稳定同位素周转时, 用方程(2)计算, 将m值设为0[15]。机体代谢作用(m)或生长作用(k)对体组织氮稳定同位素周转的贡献率(Pm)或(Pg), 用如下方程计算[14]:

当体组织稳定同位素与实验饲料达到平衡状态时,其分馏系数Δ计算如下[16]:

δd是实验饲料的δ15N值。体组织氮稳定同位素周转α%所需的时间(T)用如下公式计算[15]:组织中氮稳定同位素周转50%时, 对应的时间T为周转半衰期。


表 1 实验饲料配方和营养成分(%, 干重)Tab. 1 Formulation and proximate composition of the experimental diets (%, dry weight)
1.6 数据统计分析
运用稳定同位素混合模型[13]和Isosource[4]计算3种蛋白源对大菱鲆幼鱼生长的贡献比例。用软件SPSS 19.0中ANOVA和Tukey's对数据进行多重比较分析, P<0.05为差异显著。统计数据用平均值±标准差(Mean±SD)的形式表示。
2 结果
2.1 生长和饲料利用情况

表 2 大菱鲆的生长和饲料利用情况Tab. 2 The effect of four experiment diets on growth performance of turbot fed and feed utilization
由表 2知, 经56d的投喂实验后CS50组的增重率、肥满度、特定生长率和蛋白质效率均显著低于其他组(P<0.05), 而饲料系数则显著高于其他组(P<0.05)。
2.2 体组织δ15N值随时间变动情况
各实验组间肌肉和肝脏初始δ15N值均无差异(P>0.05, 图 1和图 2)。随养殖实验进行, 肌肉和肝脏的δ15N值均逐渐升高。与初始值相比, CS50组肌肉的δ15N值从14d起出现显著性差异(P<0.05), 而其他实验组均从7d起就观测到显著性差异(P<0.05); 肝脏均在7d观测到显著性差异, 且各实验组不同取样点间也均存在显著性差异(P<0.05)。

图 1 投喂不同实验饲料后大菱鲆肌肉δ15N值随时间的变动情况Fig. 1 Effects of 4 diets on δ15N values of turbot muscle

图 2 投喂不同实验饲料后大菱鲆肝脏δ15N指随时间的变动情况Fig. 2 Effects of 4 diets on δ15N values of turbot liver
2.3 生长作用和代谢作用对大菱鲆体组织中氮同位素周转的驱动
各实验组由生长作用和代谢作用共同驱动大菱鲆体组织氮同位素的周转速度(实线)明显快于由生长作用单独驱动的氮同位素周转(虚线)(图 3)。此外, 肝脏的周转速度明显快于肌肉。由表 3知,CS50组肌肉中的m值显著低于其他组(P<0.05); 各实验组肝脏中m值随替代鱼粉比例增加而逐渐减小, 但均显著高于肌肉的m值(P<0.05)。肝脏中代谢作用(m)对氮同位素周转的贡献比例(Pm)为63.90%—70.83%, 显著高于肌肉的26.67%—42.67% (P<0.05)。
2.4 氮同位素的周转半衰期和分馏系数
基于时间的周转模型计算可知, CS0、CS10和CS30组间大菱鲆肌肉的T0.5均无显著性差异(P>0.05), 而CS50组则显著高于其他组(P<0.05)。各实验组肝脏的T0.5均存在显著性差异(P<0.05), 且同组肝脏的T0.5均显著低于肌肉(P<0.05)(表 3)。图 4表明, T0.5值和饲料中鱼粉替代比例存在明显的相关性(肌肉的相关方程: y= 2.62x+23.15, r2=0.84; 肝脏的相关方程: y=1.43x+ 12.59, r2=0.96)。肌肉和肝脏中氮同位素周转达到95%分别需要103.54—140.01d和53.53—72.74d。
由表 3知, δf值随鱼粉替代比例的升高而逐渐降低。CS30和CS50组肌肉的Δ值与CS0和CS10组均有显著性差异(P<0.05)。各实验组间肝脏的Δ值也存在显著性差异(P<0.05)。由图 5知, Δ与δ15N值呈负相关(y=3.43-0.14x, r2=0.80)。
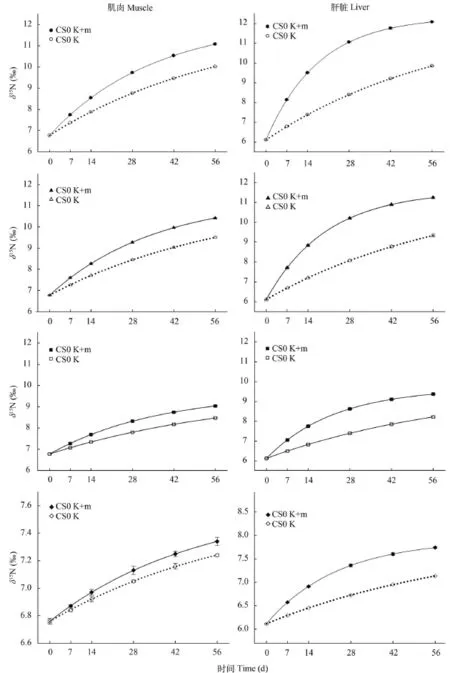
图 3 基于时间模型估计的大菱鲆肌肉和肝脏中δ15N值的变动情况Fig. 3 The curve of δ15N values of liver and muscle of turbot fed the four experimental diets for 56 days

表 3 大菱鲆肝脏和肌肉的周转半衰期(T0.5)、分馏系数(Δ)、生长作用(k)、代谢作用(m)、代谢作用贡献(Pm)和最终渐进稳定同位素值(δf)Tab. 3 Time-based half-life (T0.5), fractionation between diet and tissue (Δ), metabolic turnover constant (m), growth constant (k),proportion of metabolic contribution to nitrogen turnover (Pm), final asymptotic nitrogen isotopic value (δf) in the liver and muscle of turbot

图 4 大菱鲆肌肉和肝脏δ15N值的周转半衰期与实验饲料的鱼粉、SPC和玉米蛋白中N替代比例的关系Fig. 4 The relationship of the half-life (T0.5) of δ15N turnover for liver and muscle of turbot to the proportions of substituting N from fish meal with soy protein concentrate and corn meal

图 5 大菱鲆肌肉和肝脏的Δ值与饲料中δ15N值的关系Fig. 5 The relationship of Δ for liver and muscle of turbot to the δ15N of the experimental diets
2.5 不同蛋白源对大菱鲆生长的贡献比例
采用Isosource[4]计算CS10、CS30和CS50组中鱼粉、玉米蛋白和SPC对大菱鲆生长的贡献比例分别为80%、7%和13%, 62%、11%和27%, 46%、13%和41% (图 6)。玉米蛋白和SPC对大菱鲆的贡献比例随饲料中替代鱼粉比例的增加而显著升高(P<0.05)。玉米蛋白对大菱鲆的贡献比例显著低于SPC和鱼粉(P<0.05)。

图 6 各实验组中三种蛋白源对大菱鲆生长的贡献比例Fig. 6 Effects of three dietary protein sources to the growth of turbot
3 讨论
3.1 对大菱鲆生长性能和饲料利用的影响
Kotaro[17]研究表明, 玉米蛋白可替代日本比目鱼(Paralichthys olivaceus)饲料中40%的鱼粉而不影响其生长。刘兴旺等[18, 19]研究发现, 当饲料中玉米蛋白含量超过25%时, 大菱鲆特定生长率和饲料利用率将显著降低, 而SPC替代80%鱼粉时大菱鲆特定生长率才显著低于其他组。本研究用玉米蛋白和SPC同时替代大菱鲆饲料中的鱼粉, 结果表明随替代鱼粉比例的增加, 大菱鲆的增重率、特定生长率、摄食率以及蛋白质效率均呈下降趋势, 而饲料系数有升高趋势, 当替代比例达到50%时, 大菱鲆的生长和饲料利用率均显著低于其他组。这主要是由于随植物蛋白源替代鱼粉比例的升高, 饲料的适口性越来越差, 导致摄食率逐渐下降[20]。此外,植物中的抗营养因子和氨基酸不平衡也会降低大菱鲆的表观消化率[21—23]。
3.2 氮稳定同位素在体组织中的周转情况及周转半衰期
本研究表明, 不同实验组间大菱鲆肌肉和肝脏的氮同位素周转速度均存在差异。当替代50%鱼粉时, 大菱鲆肌肉的周转半衰期显著高于其他组,且肝脏的周转半衰期随替代鱼粉比例的升高而延长, 这可能是由于不同实验组的摄食蛋白来源和品质存在差异[24]。氮稳定同位素周转半衰期与饲料中替代鱼粉比例的线性相关关系(肌肉: r2=0.84; 肝:r2=0.96)也说明了摄食蛋白来源和品质对大菱鲆组织中氮稳定同位素周转代谢的影响。
当生物个体摄食与之前食物具有不同稳定同位素信号的新食物时, 其体组织中稳定同位素的比率取决于同位素在其体组织中的周转速度[25, 26]。本研究结果显示, 大菱鲆肝脏的周转半衰期(12.38—16.83d)显著低于肌肉(23.96—32.42d), 这表明氮稳定同位素在大菱鲆肝脏中的周转速度明显快于肌肉的。Suzuki等[27]研究发现, 日本鲈肌肉中氮同位素的周转半衰期为25.7d, 而肝脏氮同位素周转半衰期为14.4d。Logan等[28]在底鳉上的研究也表明肝脏中氮同位素的周转速度显著快于肌肉。这主要由于肝脏的组织替换及新陈代谢速度要比肌肉的快[29]。MacAvoy等[30]研究指出, 由于不同体组织代谢速度有所不同, 导致机体不同组织间同位素的周转存在差异, 代谢越旺盛的组织其同位素的周转率相应越快, 周转半衰期也越短。
3.3 生长作用和代谢作用对大菱鲆体组织中氮同位素周转的驱动
本研究发现大菱鲆体组织氮同位素的周转速度要显著快于由生长作用单独驱动的氮同位素周转, 这说明基于组织增加的生长作用和基于组织替代的代谢作用共同驱动了实验期间大菱鲆肌肉和肝脏的氮同位素周转[23]。肝脏中代谢作用对氮同位素周转的贡献率(63.90%—70.83%)显著高于肌肉(26.67%—42.67%), 这说明组织替代在肝脏的氮同位素周转中起主要作用, 而生长在肌肉氮同位素周转中起主导作用。在白鲑(Coregonus lavaratus)[25]、底鳉幼鱼(Fundulus heteroclitus)[28]和笋壳鱼(Pomatoschistus minutus)[31]的研究中也得到了类似的研究结果。
3.4 分馏系数
大菱鲆氮同位素的分馏系数范围为1.83‰—2.83‰, 且各实验组中肌肉和肝脏的分馏系数均随饲料中替代鱼粉比例的增加而显著升高。Le Vay等[32]研究表明分馏系数的大小与摄食蛋白的水平、质量和氨基酸水平等紧密相关。本研究中, 分馏系数与饲料中δ15N值呈明显的负相关性(r2=0.80),进一步证明了这一假设。此外, 各实验组间肌肉和肝脏的Δ值均存在差异。Xia等[14]研究指出氮同位素的分馏系数在不同物种或同一物种不同组织间均有差异。Sweeting等[33]研究发现欧洲鲈的肌肉、心脏和肝脏中氮同位素的分馏系数逐渐降低。不同体组织间分馏系数的差异可能与不同体组织的生化组成差异有关[24]。
3.5 鱼粉蛋白、玉米蛋白和SPC对大菱鲆的贡献比率
在本研究中替代10%鱼粉蛋白时, 玉米蛋白和SPC对大菱鲆生长和代谢的贡献比例(7%和13%)均高于其在饲料中的替代比例。黄云等[34]曾报道在饲料中补充适量植物蛋白时, 可以增强鱼肠胃的蠕动, 提高营养物质的利用率。Li等[35]研究也发现微量的抗营养因子能促进星斑川鲽消化酶的分泌, 促进其对饲料的消化利用。替代30%和50%鱼粉蛋白时, 玉米蛋白贡献比例则显著低于其在饲料中的替代比例, 同时显著低于SPC的贡献比例, 而SPC的贡献比率均显著高于其在饲料中的替代比例。周晖等[36]研究表明, 用10%玉米蛋白替代军曹鱼饲料中等量鱼粉蛋白后, 玉米蛋白对军曹鱼生长的贡献比率显著低于饲料中的替代比例, 这主要与玉米蛋白的氨基酸不平衡有关。刘兴旺等[18, 19]研究表明, 玉米蛋白可以替代大菱鲆幼鱼饲料中25%的鱼粉而不影响其生长, 而SPC替代比例大于80%时, 大菱鲆的特定生长率才显著下降。这均表明大菱鲆对SPC的利用效率显著优于玉米蛋白。此外, 研究还发现玉米蛋白和SPC对大菱鲆生长贡献比例的增加量, 随着饲料中替代鱼粉比例的升高而减少, 这说明随着饲料中玉米蛋白和SPC替代比例的升高,大菱鲆对饲料中植物蛋白的利用效率逐渐下降。
4 结论
本研究表明, 用玉米蛋白和SPC可同时替代大菱鲆饲料中30%的鱼粉蛋白而不影响其生长。生长作用和代谢作用共同驱动了大菱鲆体组织中氮稳定同位素的周转代谢, 肝脏氮稳定同位素的周转速度明显快于肌肉的, 相应的周转半衰期更短。各实验组中SPC对大菱鲆生长的贡献比例要大于玉米蛋白, 说明大菱鲆对SPC的利用效率优于玉米蛋白。
[1]Luo J Q, Cao Z M, Chen D W, et al. The challenge of studies on protein nutrition [J]. China Journal of Animal Science, 2012, 48(13): 73—76 [罗钧秋, 曹中明, 陈代文,等. 蛋白质营养研究新阶段. 中国畜牧杂志, 2012,48(13): 73—76]
[2]Zhang Y, Zhou A G. Protein turnover and measurement [J]. Chinese Journal of Animal Nutrition, 2001, 13(4):7—13 [张勇, 周安国. 蛋白质周转代谢及其测定. 动物营养学报, 2001, 13(4): 7—13]
[3]Gamboa-Delgado J, Le Vay L. Natural stable isotopes as indicators of the relative contribution of soy protein and fish meal to tissue growth in Pacific white shrimp (Litopenaeus vannamei) fed compound diets [J]. Aquaculture, 2009, 291(1—2): 115—123
[4]Gamboa-Delgado J, Rojas-Casas M G, Nieto-López M G,et al. Simultaneous estimation of the nutritional contribution of fish meal, soy protein isolate and corn gluten to the growth of Pacific white shrimp (Litopenaeus vannamei) using dual stable isotope analysis [J]. Aquaculture,2013, 380: 33—40
[5]Abimorad E G, Ducatti C, Castellani D, et al. The use of stable isotopes to investigate the effects of supplemental lysine and methionine on protein turnover and amino acid utilization in pacu, Piaractus mesopotamicus, juveniles [J]. Aquaculture, 2014, 433: 119—124
[6]Pan Y J. Aquatic Dictionary [M]. Shanghai: Shanghai Dictionary Press. 2007, 284—353 [潘迎捷. 水产辞典. 上海: 上海辞书出版社. 2007, 284—353]
[7]Wang J Y, Li P Y, Song Z D, et al. Effect of dietary Yucca Schidigera extract on the growth performance,blood physiological and biochemicals of turbot (Scophthalmus maximus) and water environment [J]. Acta Hydrobiologica Sinica, 2014, 38(6): 1117—1126 [王际英,李培玉, 宋志东, 等. 饲料中添加丝兰提取物对大菱鲆幼鱼生长和生理及水环境的影响. 水生生物学报, 2014,38(6): 1117—1126]
[8]Liu X Q, Zhu X M, Han D, et al. Effects of dietary ratio of fish meal and rapeseed meal on the growth and feed utilization Gibel garp (Carassius auratus gibelio) [J]. Acta Hydrobiologica Sinica, 2014, 38(4): 657—663 [刘晓庆, 朱晓鸣, 韩冬, 等. 饲料鱼粉, 菜粕比例对异育银鲫生长和饲料利用的影响. 水生生物学报, 2014, 38(4):657—663]
[9]Shi X, Luo Z, Huang C, et al. Effect of substituting Chlorella sp. for regular fishmeal on growth, body composition, hepatic lipid metabolism and histology in crucian carp Carassius auratus [J]. Acta Hydrobiologica Sinica, 2015, 39(3): 498—506 [石西, 罗智, 黄超, 等. 小球藻替代鱼粉对鲫生长, 体组成, 肝脏脂肪代谢及其组织学的影响. 水生生物学报, 2015, 39(3): 498—506]
[10]Naylor R L, Hardy R W, Bureau D P, et al. Feeding aquaculture in an era of finite resources [J]. Proceedings of the National Academy of Sciences, 2009, 106(36):15103—15110
[11]Tusche K, Arning S, Wuertz S, et al. Wheat gluten and potato protein concentrate Promising protein sources for organic farming of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2012, 344: 120—125
[12]Yan Q G, Zhu X M, Yang Y X, et al. Effect of replacement of fish meal with cottonseed meal on growth, hematological physiology, and body composition of grass garp [J]. Acta Hydrobiologica Sinica, 2014, 38(2):362—369 [严全根, 朱晓鸣, 杨云霞, 等. 饲料中棉粕替代鱼粉蛋白对草鱼的生长, 血液生理指标和鱼体组成的影响. 水生生物学报, 2014, 38(2): 362—369]
[13]Phillips D L, Gregg J W. Source partitioning using stable isotopes: coping with too many sources [J]. Oecologia,2003, 136(2): 261—269
[14]Xia B, Gao Q F, Li H, et al. Turnover and fractionation of nitrogen stable isotope in tissues of grass carp Ctenopharyngodon idellus [J]. Aquaculture Environment Interactions, 2013, 3: 177—186
[15]Hesslein R H, Hallard K A, Ramlal P. Replacement of sulfur, carbon, and nitrogen in tissue of growing broad white fish (Coregonus nasus) in response to a change in diet traced by34S,13C and15N [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(10): 2071—2076
[16]Buchheister A, Latour R J. Turnover and fractionation of carbon and nitrogen stable isotopes in tissues of a migratory coastal predator, summer flounder (Paralichthys dentatus) [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2010, 67(3): 445—461
[17]Kikuchi K. Partial replacement of fish meal with corn gluten meal in diets for Japanese flounder Paralichthys olivaceus [J]. Journal of the World Aquaculture Society,1999, 30(3): 357—363
[18]Liu X W, Ai Q H, Mai K S, et al. Effects of replacing fish meal with soy protein concentrate on feed intake and growth of turbot (Scophthalmus maximus) [J]. Journal of Fisheries of China, 2014, 38(1): 91—98 [刘兴旺, 艾庆辉, 麦康森, 等. 大豆浓缩蛋白替代鱼粉对大菱鲆摄食、生长及体组成的影响. 水产学报, 2014, 38(1):91—98]
[19]Liu X W, Mai K S, Ai Q H, et al. Replacement of fish meal by corn gluten meal in diets of Scophthatmus maximus [J]. Journal of Fisheries of China, 2012, 36(3):466—472 [刘兴旺, 麦康森, 艾庆辉, 等. 玉米蛋白粉替代鱼粉对大菱鲆摄食、生长及体组成的影响. 水产学报, 2012, 36(3): 466—472]
[20]Twibell R G, Wilson R P. Preliminary evidence that cho-lesterol improves growth and feed intake of soybean meal-based diets in aquaria studies with juvenile channel catfish, Ictalurus punctatus [J]. Aquaculture, 2004,236(1): 539—546
[21]Ai Q H, Xie X J. Advance in utilization of plant proteins by aquatic animals [J]. Periodical of Ocean University of China (Natural Science Edition), 2005, 36(6): 929—935[艾庆辉, 谢小军. 水生动物对植物蛋白源利用的研究进展. 中国海洋大学学报(自然科学版), 2005, 36(6):929—935]
[22]Hardy R W. Utilization of plant proteins in fish diets: effects of global demand and supplies of fish meal [J]. Aquaculture Research, 2010, 41(5): 770—776
[23]Deng J, Mai K, Ai Q, et al. Alternative protein sources in diets for Japanese flounder Paralichthys olivaceus (Temminck and Schlegel): Ⅱ. Effects on nutrient digestibility and digestive enzyme activity [J]. Aquaculture Research,2010, 41(6): 86—870
[24]Xia B, Wang J, Gao Q F, et al. The nutritional contributions of dietary protein sources to tissue growth and metabolism of sea cucumber Apostichopus japonicus (Selenka): Evidence from nitrogen stable isotope analysis [J]. Aquaculture, 2015, 435: 237—244
[25]Guelinckx J, Maes J, Van Den Driessche P, et al. Changes in δ13C and δ15N in different tissues of juvenile sand goby Pomatoschistus minutus: a laboratory dietswitch experiment [J]. Maine Ecology Progress Series,2007, 341: 205—215
[26]Harvey C J, Hanson P C, Essinton T E, et al. Using bioenergetic models to predict stable isotope ratios in fishes [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2002, 59(1): 115—124
[27]Suzuki K W, Kasai A, Nakayama K, et al. Diferential isotopic enrichment and half-life among tissues in Japanese temperate bass (Lateolabrax japonicus) juveniles: implications for analyzing migration [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2005, 62(3): 671—678
[28]Logan J, Haas H, Deegan L, et al. Turnover rates of nitrogen stable isotopes in the salt marsh mummichog, Fundulus heteroclitus, following a laboratory diet switch [J]. Oecologia, 2006, 147(3): 391—395
[29]Buchheister A, Latour R J. Turnover and fractionation of carbon and nitrogen stable isotopes in tissues of a migratory coastal predator, summer flounder (Paralichthys dentatus) [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2010, 67(3): 445—461
[30]MacAvoy S E, Ameson L S, Bassett E. Correlation of metabolism with tissue carbon and nitrogen turnover rate in small mammals [J]. Oecologia, 2006, 150(2): 190—201
[31]Perga M E, Gerdeaux D. ‘Are fish what they eat'all year round [J]? Oecologia, 2005, 144(4): 598—606
[32]Le Vay L, Gamboa-Delgado J. Naturally-occurring stable isotopes as direct meausres of larval feeding efficiency,nutrient incorporation and turnover [J]. Aquaculture,2011, 315(1): 95—103
[33]Sweeting C J, Barry J, Barnes C, et al. Effects of body size and environment on diet-tissue fractionation in fishes [J]. Journal of Experimental Marine Biology and Ecology, 2007, 340(1): 1—10
[34]Huang Y, Xiao D Y, Hu Y. Research status of alternative dietary protein sources for fish feed [J]. Feed Review,2010, (2): 11—15 [黄云, 肖调义, 胡毅. 鱼类饲料中替代蛋白营养的研究进展. 饲料博览, 2010, (2): 11—15]
[35]Li P Y, Wang J Y, Song Z D, et al. Evaluation of soy protein concentrate as a substitute for fish meal in diets for juvenile starry flounder (Platichthys stellatus) [J]. Aquaculture, 2015, 448: 578—585
[36]Zhou H, Chen G, Gu B H, et al. Contribution rate of dietary corn protein to protein growth of juvenile cobia (Rachycentron canadum L.) [J]. Chinese Journal of Animal Nutrition, 2013, 25(11): 2633—2642 [周晖, 陈刚, 古滨河, 等. 饲料中的玉米蛋白质对军曹鱼幼鱼蛋白质生长的贡献率. 动物营养学报, 2013, 25(11): 2633—2642]
THE NUTRIONAL CONTRIBUTIONS OF DIETARY PROTEIN SOURCES TO GROWTH OF TURBOT (SCOPHTHATMUS MAXIMUS L.): EVIDENCE FROM STABLE ISOTOPE ANALYSIS (SIA)
LI Zhong-Qing1, 2, XIA Bin2, ZHANG Li-Min2, WANG Ji-Ying2, LI Bao-Shan2, SUN Yong-Zhi2, 3and WANG Ming-Hui1, 2
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China; 3. Shengsuo Fishery Feed Research Centre of Shandong Province, Yantai 265500, China)
To investigate effects of dietary protein sources to turbot growth (Scophthatmus maximus L.), we substituted fish meal by plant protein blend (corn gluten and soy protein concentrate 1∶1 isonitrogenous mixed) in diets and determined nitrogen stable isotope ratios of diet and tissue. Four isonitrogenous and isoenergetic diets with different replacement 0, 10%, 30% and 50% fish meal protein by plant protein blend were formulated and correspondingly named as CS0, CS10, CS30 and CS50, respectively, for a 56 days experiment with 3 replicates in each group. Our results showed that food intake (FI) and specific growth rate (SGR) in CS50 were significantly lower but the feed coefficiency was higher compared with other groups. The turnover rates of nitrogen stable isotope were significantly different between each diet (P<0.05) with the highest turnover rate in the control group. Liver responded more quickly to the diet compared with muscle. Nitrogen half-lives (T0.5) of muscle were significantly higher than those of liver (P<0.05). The proportional contributions of growth to nitrogen turnover were 57.33%—73.33% for muscle and 29.17%—36.10% for liver, respectively. Based on turnover model, the fractionation (Δ) were ranged from 1.83‰ to 2.83‰. Calculated by Isosource software, the contributions of fish meal, corn gluten and SPC to tissue growth and metabolism of turbot were 80%, 7% and 13% for CS10, 62%, 11% and 27% for CS30, 46%, 13% and 41% for CS50, respectively. The result showed that stable isotopic turnover was driven by both tissue replacement in the form of metabolism and tissue increase in the form of growth, the proportional contritetiens of which between tissues exhibited significant discrepancy;nitrogen stable isotope, turnover rate of liver was faster than that of muscle, without, the half-time of liver was also faster; the contribution rate of dietary corn protein to the protein growth of the turbot was lower than the SPC.
Scophthatmus maximus L.; Nitrogen stable isotope; Growth; Metabolism; Turnover model
S917.4
A
1000-3207(2016)04-0843-10
10.7541/2016.109
2015-09-07;
2016-01-11
水生动物营养与饲料创新示范平台项目(201501006); 国家海洋公益性行业科研专项(201205025); 山东省科技发展计划(2014GHY115006)资助 [Supported by the Aquatic Animal Nutrition and Feed Research and Innovation Demonstration Platform (201501006); Public Science and Technology Research Funds of Ocean from the State Oceanic Administration, People's Republic of China (201205025); Shandong Science and Technology Plan Project (2014GHY115006)]
李忠清(1990—), 男; 山东临沂人; 硕士; 研究方向为水产动物营养与饲料。 E-mail: longxingzhongqing@163.com
张利民, 研究员; 硕士生导师; E-mail: ytzlm@139.com; 王际英, 研究员; 硕士生导师; E-mail: ytwjy@126.com

