饲料脂肪水平对芙蓉鲤鲫幼鱼血清生化指标、免疫反应及抗氧化能力的影响
何志刚王金龙, 2伍远安, 2李传武, 2李绍明刘文革
(1. 湖南省水产科学研究所, 长沙 410153; 2. 水产高效健康生产湖南省协同创新中心, 常德 415000)
饲料脂肪水平对芙蓉鲤鲫幼鱼血清生化指标、免疫反应及抗氧化能力的影响
何志刚1王金龙1, 2伍远安1, 2李传武1, 2李绍明1刘文革1
(1. 湖南省水产科学研究所, 长沙 410153; 2. 水产高效健康生产湖南省协同创新中心, 常德 415000)
为研究饲料脂肪水平对芙蓉鲤鲫(Furong crucian carp)幼鱼[初始体重, (2.04±0.01) g]血清生化指标、免疫指标及抗氧化能力的影响, 以鱼油为主要脂肪源, 配制五种脂肪水平分别为2.50%、4.39%、6.61%、8.42%和10.81%的等氮实验饲料。实验在室内循环水养殖系统中进行, 每种饲料3个重复, 每个重复随机放养30尾芙蓉鲤鲫, 养殖周期为60d。结果显示: 随着饲料中脂肪水平的升高, 芙蓉鲤鲫增重率和蛋白质效率呈现先显著升高后显著降低的趋势(P<0.05), 而饲料系数呈现相反的趋势。饲料脂肪水平升高显著提高了芙蓉鲤鲫血清中总胆固醇(CHO)和球蛋白(GLB)含量, 而显著降低总蛋白(TP)和白蛋白(ALB)含量。饲料脂肪水平未对鱼体血清高密度脂蛋白胆固醇(HDL-C)和甘油三酯(TG)含量造成显著影响(P>0.05)。芙蓉鲤鲫血清免疫球蛋白M (IgM)含量、血清和肝胰脏超氧化物歧化酶(SOD)活力、肝胰脏总抗氧化能力(T-AOC)随脂肪水平增加先升高后下降(P<0.05)。血清中过氧化氢酶(CAT)活力10.81%组显著高于其他各组(P<0.05)。肝胰脏CAT和丙二醛(MDA)活力在各处理组组间差异不显著(P>0.05)。研究结果表明, 在饲料中适宜的脂肪添加有助于改善芙蓉鲤鲫健康状况, 但过高的脂肪水平加重了芙蓉鲤鲫的代谢压力和氧化速率。增重率与饲料脂肪水平作二次回归分析显示, 芙蓉鲤鲫获得最大增长所需饲料脂肪最佳水平为6.94%。
芙蓉鲤鲫; 饲料脂肪水平; 生化指标; 免疫; 抗氧化
基于饲料工业迅猛发展和水产动物营养科研水平提高, 大部分商业配合饲料都能基本满足鱼类营养需求并实现快速生长[1]。但大量营养素或微量营养素的需求都是以鱼类生长指标或营养素缺乏症状作为衡量指标[2], 而较少考虑健康状况指标, 比如血液生化指标、免疫反应和抗氧化能力等[3]。目前鲫高密度、高集约化养殖方式严重受限于疾病感染[4]。一般认为通过营养途径能有效减轻疾病对养殖水产动物的影响, 而幼鱼期饲料营养是否均衡,对鱼类生长、疾病抵抗和健康状况有重要影响[5]。
饲料脂肪为鱼类提供能量和必需脂肪酸, 维持生物结构和细胞膜的正常功能[6], 保障鱼体正常生长、繁殖和机体运转[7]; 饲料脂肪作为非蛋白能量来源, 能够有效减少有机物和氮的损失, 起到蛋白质节约效应[8]。脂肪在鱼类营养作用非常重要, 已有的研究主要集中在脂肪水平对鱼类生长性能影响[2], 有关脂肪和免疫的研究则多侧重于饲料脂肪源或必需脂肪酸[9, 10], 研究饲料脂肪水平对血液生化指标、免疫反应和抗氧化能力的影响, 对于了解鱼类健康状况受脂肪代谢调控机制具有重要意义。
芙蓉鲤鲫(Furong crucian carp)是由湖南省水产科学研究所运用鲤鱼品种间杂交、鲤鲫种间杂交和系统选育等育种技术, 经20年研究培育而成, 属于大力推广的国家农业部水产新品种(GS-02-001-2009)[11]。芙蓉鲤鲫具有体型像鲫、生长快、肉质好、抗逆性强、性腺败育等优良特性, 深受养殖户的喜爱。作为优质鲫养殖品种, 针对芙蓉鲤鲫的人工繁育和养殖技术有较多研究报道[12, 13], 而对其营养需求研究较少, 仅见饲料中不同蛋白水平对其生长性能、体组成和消化酶的影响[14]。本研究通过配制不同脂肪含量的饲料考察其对芙蓉鲤鲫幼鱼生长性能、血清生化、免疫和抗氧化功能的影响,为其优质配合饲料开发提供参考数据。
1 材料与方法
1.1 实验设计与实验材料
饲料以鱼粉、豆粕和菜粕为主要蛋白源, 以优质鱼油为脂肪源, 鱼油的添加水平分别为0、2%、4%、6%和8%, 脂肪含量分别为2.50%、4.39%、6.61%、8.42%和10.81%。各组饲料的蛋白含量保持基本一致水平, 共配制5组实验饲料。各原料粉碎过60目筛, 以F (Ⅱ)-26型双螺杆挤条机(华南理工大学, 广州)加工成硬颗粒饲料(1.5 mm×2.0 mm), 日晒干并保存于冰柜中备用。饲料原料组成和营养成分含量(表 1)。

表 1 实验饲料配方及常规营养组成Tab. 1 Formulation and chemical compositions of experimental diets (%)
1.2 实验用鱼
实验用芙蓉鲤鲫幼鱼来自于湖南渔缘生物科技有限公司同一批孵化鱼苗, 驯养21d, 驯养结束后随机选取体质健壮, 外表无伤的芙蓉鲤鲫幼鱼450尾, 初始体平均质量为(2.04±0.01) g, 分配到15个水泥池, 每个水泥池30尾实验鱼。将水泥池随机分为5个处理组, 每处理组设置3个重复。
1.3 实验管理
实验用鱼饲养于湖南省水产科学研究所15个流水循环的水泥池中(1.5 m×0.8 m×0.5 m); 日投喂2次(09: 00, 16: 30), 投饵率3%—4%; 试验期间水温为26—32℃, 溶解氧在6 mg/L以上, pH为7.8±0.4。实验周期60d。
1.4 测定指标与计算方法
样品采集 在实验结束后, 禁食24h, 对各组试验鱼分别进行称重和计数。每个池随机取芙蓉鲤鲫5尾, 用丁香酚(50 mg/L)将鱼麻醉处理后, 在预先准备好的冰盘上进行血清和肝胰脏样品的采集。实验鱼通过尾静脉取血, 5尾鱼血样合并为一管, 4℃静置过夜, 于4000 r/min离心15min, 取上清液, 置于-70℃超低温冰箱中保存备用, 用于血液生理指标的测定。在冰盘上解剖实验鱼, 迅速分离出肝胰脏, 剔除表面脂肪等附着物, 用滤纸吸取干净,置于-70℃超低温冰箱中待测定抗氧化酶活力。
生长性能计算 计算增重率(Weight gain rate, %)、饲料系数(Feed conversion ratio)和蛋白质效率(Protein efficiency ratio), 计算公式如下:
增重率 WGR (%)=100×(Wf-Wi)/ Wi
饲料系数 FCR=F/(Wf-Wi)
蛋白质效率 PER=(Wf-Wi)/P
式中: Wi为试验初始鱼体重量(g), Wf为试验结束鱼体重量(g), F为饲料摄入干重(g), P为蛋白质摄入量干重(g)。
血清生理生化指标的测定 血清中总胆固醇(Total cholesterol, TCHO)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)、甘油三酯(Triglyceride, TG)、总蛋白(Total protein, TP)、白蛋白(Albumin, ALB)和球蛋白(Globulin, GLB)采用酶法, 试剂盒来源于上海名典生物工程公司, 使用迈瑞BS-400全自动生化分析仪进行测定。
免疫指标及抗氧化酶活力的测定 血清溶菌酶(Lysozyme, LZM)活性和免疫球蛋白M (Immunoglobulin M, Ig M)含量采用南京建成生物工程研究所的试剂盒测定。血清和肝胰脏的过氧化氢酶(Catalase, CAT)活力、超氧化物歧化酶(Superoxide dismutase, SOD)活力、总抗氧化能力(Total antioxidant capacity, T-AOC)活力以及丙二醛(Malondialdehyde, MDA)含量均采用南京建成生物工程研究所的试剂盒测定。测定方法参见试剂盒说明书。
1.5 数据统计与分析
原始数据经Excel 2007初步整理后, 采用SPSS11.5中的单因素方差分析(One-Way ANOVA)对数据进行统计分析。经齐性检验确定P值大于0.05, 再采用Duncan检验对组间数据进行多重比较, P<0.05认为差异显著。实验数据以平均值±标准误(Mean±SE)表示。
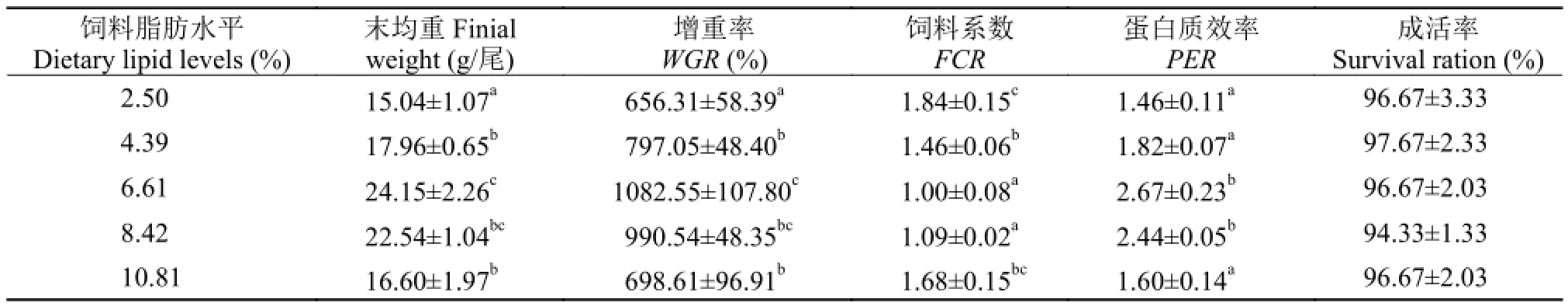
表 2 饲料脂肪水平对芙蓉鲤鲫幼鱼生长性能的影响(平均值±标准误, n=3)Tab. 2 The effect of dietary lipids on the growth performance of juvenile Furong crucian carp (Mean±SE, n=3)
2 结果
2.1 饲料脂肪水平对芙蓉鲤鲫生长性能的影响
由表 2可知, 在养殖60d后, 实验组芙蓉鲤鲫成活率均在94%以上, 各组间成活率无显著差异(P>0.05)。饲料脂肪水平对芙蓉鲤鲫的末均重、增重率、饲料系数和蛋白质效率均有显著的影响(P<0.05)。6.61%组鱼体的末均重和增重率最高, 显著高于2.50%组、4.39%组和10.81%组(P<0.05), 与8.42%组差异不显著(P>0.05)。6.61%组和8.42%组饲料系数显著低于2.50%组、4.39%组和10.81%组(P<0.05),2.50%组饲料系数显著高于4.39%组(P<0.05), 但与10.81%组差异不显著(P>0.05)。2.50%组、4.39%组和10.81%组蛋白质效率显著低于6.61%组和8.42%组(P<0.05), 这3组之间的蛋白质效率差异不显著(P>0.05)。
对饲料脂肪水平和芙蓉鲤鲫增重率进行二次多项式回归分析, 得到回归方程为Y=-20.891X2+ 289.76X+21.878 (图 1), 得出芙蓉鲤鲫获得最大增重时饲料中最适宜的脂肪水平为6.94%。
2.2 饲料脂肪水平对芙蓉鲤鲫血清生化指标的影响
由表 3可知, 饲料脂肪水平对芙蓉鲤鲫血清中的TCHO和LDL-C含量有显著的影响(P<0.05)。饲料脂肪水平最高10.81%组TCHO值最高, 显著高于2.50%组和4.39%组(P<0.05), 但与6.61%组和8.42%组差异不显著(P>0.05)。LDL-C随着饲料脂肪水平的递增表现出先上升后下降的趋势, 脂肪水平在6.61%以上3组实验组显著高于2.50%组和4.39%组(P<0.05), 但这3组之间差异不显著(P>0.05)。HDL-C随着饲料脂肪水平上升呈现升高的趋势, 但实验组间差异不显著(P>0.05)。饲料脂肪水平对血清TG含量没有显著影响(P>0.05)。
由表 4可知, 饲料脂肪水平对芙蓉鲤鲫血清TP、ALB和GLB含量有显著的影响(P<0.05)。随着饲料脂肪水平的上升, TP 和ALB呈现下降的趋势,2.50%组TP含量显著高于其他各组(P<0.05),2.50%组ALB含量显著高于8.42%组和10.81组(P<0.05), 但与4.39%组和6.61%组之间差异不显著(P>0.05); GLB随着饲料脂肪水平的增加呈现升高的趋势, 2.50%组GLB含量与4.39%组之间差异不显著(P>0.05), 但显著低于其他3实验组(P<0.05)。ALB/GLB随着饲料脂肪水平的上升呈现下降的趋势, 但在各组间没有显著差异(P>0.05)。

图 1 芙蓉鲤鲫增重率与饲料脂肪水平的关系Fig. 1 The effect of dietary lipids on the weight growth rate of juvenile Furong crucian carp

表 3 饲料脂肪水平对芙蓉鲤鲫幼鱼血清部分生化指标的影响(平均值±标准误, n=3)Tab. 3 Effects of dietary lipids on serum biochemical indices of juvenile Furong crucian carp (Mean±SE, n=3)

表 4 芙蓉鲤鲫血清总蛋白、白蛋白、球蛋白含量和白球比(平均值±标准误, n=3)Tab. 4 The level of serum TP, ALB, GLB and ALB/GLB of juvenile Furong crucian carp (Mean±SE, n=3)
2.3 饲料脂肪水平对芙蓉鲤鲫免疫指标的影响
饲料脂肪水平对芙蓉鲤鲫免疫功能的影响(表 5)。由表 5可见: 随着饲料脂肪水平的升高, 芙蓉鲤鲫幼鱼血清中Ig M含量呈现先上升后下降的趋势, 6.61%组和8.42%组显著高于其他各组(P<0.05), 6.61%组Ig M值最高, 与8.42%组之间差异不显著(P>0.05);LZM活力随着饲料脂肪水平的提高, 呈现逐渐上升的趋势, 但在各组间差异不显著(P>0.05)。
2.4 饲料脂肪水平对芙蓉鲤鲫抗氧化功能的影响
由表 6可知, 饲料脂肪水平对芙蓉鲤鲫血清中CAT活力和SOD活力以及肝胰脏中SOD活力和TAOC活力有显著的影响(P<0.05)。肝胰脏SOD和TAOC活力随脂肪含量的增加呈现先升高后下降的趋势, 6.61%组SOD活力显著高于2.50%组、8.42%组和10.81%组, 但与4.39%组无显著性差异(P<0.05), 6.61%组T-AOC活力显著高于2.50%组和10.81%组, 与4.39%组和8.42%组差异不显著(P<0.05); 血清中SOD活力呈现先升高后下降的趋势, 2.50%组显著低于其他4组(P<0.05), 这4组之间差异不显著(P>0.05); 10.81%组血清CAT活力显著高于其他各组, CAT活力随饲料脂肪水平升高呈现上升趋势(P<0.05); 肝胰脏MDA含量逐渐升高, 但各组间差异不显著(P>0.05); 饲料脂肪对肝胰脏中CAT活力没有显著影响(P>0.05)。
3 讨论
3.1 饲料不同脂肪水平对芙蓉鲤鲫幼鱼生长性能的影响
本研究结果显示, 饲料高脂肪组芙蓉鲤鲫增重率显著高于低脂肪水平2.50%组(P<0.05), 这与Jin等[1]和Watanabe[15]报道的脂肪水平升高能促进鱼类生长的研究结果一致。鱼类对脂肪具有较高的吸收利用能力, 适当增加饲料脂肪水平能提高蛋白质效率, 同时降低饲料系数[16], 本次试验获得类似结果。从表 2可以看出, 芙蓉鲤鲫蛋白质效率在饲料脂肪水平6.61%组最高, 在8.42%组保持稳定,间接说明适宜的饲料脂肪含量能节约饲料蛋白质[1]。本试验将芙蓉鲤鲫增重率与饲料脂肪水平作二次多项式回归方程分析(图 1), 得出其获得最大增重时饲料脂肪水平为6.94%。

表 5 饲料脂肪水平对芙蓉鲤鲫幼鱼免疫指标的影响(平均值±标准误, n=3)Tab. 5 Effects of dietary lipids on immune indices of juvenile Furong crucian carp (Mean±SE, n=3)

表 6 饲料脂肪水平对芙蓉鲤鲫幼鱼抗氧化酶活力的影响(平均值±标准误, n=3)Tab. 6 The effect of dietary lipids on antioxidant enzymes activity of juvenile Furong crucian carp (Mean±SE, n=3)
3.2 饲料不同脂肪水平对芙蓉鲤鲫幼鱼血清生化指标的影响
血液生化指标能反映鱼类的生理代谢状态, 其变化可以阐明营养素在机体代谢变化的作用机制,血清TCHO、HDL-C、LDL-C和TG水平受鱼类营养状况影响[7, 8, 16, 17]。TCHO参与形成细胞膜, 作为合成胆汁酸、维生素D以及甾体激素的原料, 是动物组织细胞所不可缺少的重要物质[18]。芙蓉鲤鲫血清TCHO含量随饲料脂肪水平增加呈现出显著升高的趋势, 类似的报道也见于大菱鲆(Psetta maxima)[8]和吉富罗非鱼(Oreochromis niloticus)[16]等鱼类; 血清TCHO浓度随饲料脂肪水平增加而上升表明鱼体为了响应饲料高水平的脂肪而产生更活跃的内源性脂肪转运[19], 这可能是高脂肪水平饲料加重了芙蓉鲤鲫的代谢压力所致[1]。大西洋白姑鱼(Argyrosomus regius)血清TCHO含量并不受饲料脂肪水平上升影响[17]。但在褐菖(Sebastiscus marmoratus)[18]和厚唇弱棘(Sooty grunter)[20]的研究中发现, 血清中TCHO与饲料脂肪水平呈现负相关, 原因可能是消化脂肪的胆汁分泌异常或肝胰脏功能障碍所致。TCHO的升降往往伴随着TG的升降[16], 本试验中芙蓉鲤鲫血液检测发现TG活性在各组之间差异不显著, 有待进一步的研究探讨。
研究表明, TCHO大部分由肝胰脏制造, 必须与脂蛋白结合才能运输[21]。血清脂蛋白作为动态系统与饵料摄入、投饲频率以及摄入脂肪类型密切相关, LDL-C主要将TCHO从肝胰脏运送到全身组织, 而HDL-C作为回收和运输工具将TCHO送回肝胰脏合成胆汁酸进行重复利用或者生成胆汁清除[18]。本实验中芙蓉鲤鲫血清中HDL-C含量随着饲料脂肪水平增加呈现上升的趋势(P>0.05), 研究表明鱼类HDL-C在脂蛋白中占主导地位[22], 其含量上升表明摄食高水平脂肪组鱼类可能通过脂类基因表达的直接调控或减少脂蛋白降解来对载脂蛋白合成进行正调节[10]; 而芙蓉鲤鲫血清中LDL-C含量, 随饲料脂肪水平上升呈现先升高后降低的趋势, 与尼罗罗非鱼[7]研究结果相似, LDL-C降低可能预示肝胰脏功能受损或其他代谢问题。
血清TP由ALB和GLB组成, 作为饲料蛋白吸收情况的敏感指标, 能够反映鱼体的健康状况[16]。本实验条件下, 饲料脂肪水平最低组TP含量显著高于其他实验组, 表明高脂肪组芙蓉鲤鲫健康状况下降。红鳍东方(Takifugu rubripes)[23]在投喂不同脂肪水平饲料养殖8周与24周时, 血清中TP含量变化趋势均与本研究结果相似, 并且高脂肪组还出现体色和体形异常症状, 健康状况进一步下降。ALB主要由肝脏合成, 起维持血浆胶体渗透压作用, 而GLB主要在肝细胞外生成, 参与机体免疫反应[24]。随着饲料脂肪水平上升, 芙蓉鲤鲫血清中ALB含量下降而GLB含量升高, ALB与GLB值在饲料脂肪最低组与饲料水平最高两组之间均存在显著差异(P<0.05), 说明高脂肪水平饲料组芙蓉鲤鲫肝胰脏可能受到一定损伤。
3.3 饲料不同脂肪水平对芙蓉鲤鲫幼鱼血清免疫指标的影响
众多研究结果表明饲料营养素不仅能提供营养, 还能刺激鱼类免疫系统使其远离疾病[5]。脂类不仅是鱼类生长发育所必需的物质基础, 同时对维持免疫系统功能起重要作用[18]。饲料脂肪作为重要的营养因子能影响鱼类免疫系统, 主要是因为脂肪能参与合成细胞膜, 而细胞膜在鱼类免疫系统中占优势地位[5]。免疫球蛋白(IgM)属于鱼类免疫系统中的特异性免疫, 是鱼类体液免疫系统的重要组成部分, 其活力高低在一定程度上可以反映出鱼体的免疫水平[18]。在本实验条件下, 随着脂肪水平的升高, 芙蓉鲤鲫血清IgM含量呈现先上升后下降的趋势, 有研究者认为必需脂肪酸不仅可以提高动物机体的体液免疫和细胞免疫, 还增强细胞因子的产生以及对有丝分裂原刺激的淋巴细胞增殖反应产生影响[25]。适宜的脂肪酸含量可能增强了芙蓉鲤鲫细胞的增殖活力, 促进胸腺、脾等免疫器官的生长以及促进血清蛋白的生物合成[18]。
LZM属于免疫系统中的非特异性免疫, 是鱼类最常见的体液免疫指标之一[26]。LZM由白细胞释放, 在抗菌活动中起着重要作用[1]。对于鱼类而言,非特异性免疫系统抵抗疾病的重要性要远高于特异性免疫系统[27]。本研究发现, 芙蓉鲤鲫血清中LZM活性与饲料脂肪水平呈正相关关系, 与石斑鱼(Epinephelus malabaricus)[26]、草鱼(Ctenopharyngodon idella)[1]和波纹短须石首鱼(Umbrina cirrosa)[28]研究结果类似, 说明饲料脂肪对于鱼体而言是一种免疫刺激剂, 高水平脂肪应激会产生短暂的人为LZM高活力。Henry等[28]研究指出LZM对于应激非常敏感, 受到急性刺激时LZM活力增加, 而慢性长期应激会抑制LZM活力。适当的脂肪水平能提高鱼体免疫力, 而脂肪过量则会引起代谢应激和提高肝胰脏代谢率, 从而损害肝胰脏功能并降低鱼体免疫力[1, 29]。
3.4 饲料不同脂肪水平对芙蓉鲤鲫幼鱼血清和肝胰脏抗氧化功能的影响
目前普遍认为, 鱼类抗氧化防御系统依赖于营养因子起作用[30], 饲料脂肪或不饱和脂肪酸水平升高会加重动物的氧化应激[31], 而氧化应激常常是由于活性氧的产生与清除不平衡引起[32]。CAT属于能特异性清除体内过多过氧化氢的抗氧化酶, 保护细胞免受过氧化损伤, 其活力一般随着应激增强而升高[33, 34]。在本实验中芙蓉鲤鲫血清CAT活力随着饲料脂肪水平增加显著升高(P<0.05), 与褐菖[18]研究结果类似。但也有研究表明饲喂不同脂肪水平饲料10周的草鱼, 其CAT最高值出现在0%脂肪组, 最低值为5%—7.5%脂肪组, 经过嗜水气单胞菌攻毒后CAT值反而上升, 研究者认为脂肪缺乏组相比高脂肪组可能引发草鱼更严重的应激反应[1]。
在本研究中芙蓉鲤鲫肝胰脏MDA活力随着饲料脂肪水平增加而平稳上升, 表明芙蓉鲤鲫对脂肪酸过氧化反应易感性增强。MDA是脂肪酸过氧化的代谢产物, 其含量被认为是肝胰脏损伤程度的指标[35]。在投喂不同脂肪水平饲料的草鱼[1, 9]和投喂不同碳水化合物/脂肪水平饲料的团头鲂(Megalobrama amblycephala)[30]中也有类似的结果报道。
SOD作为抗氧化酶, 能够清除有危害性的活性氧, 通过催化歧化作用将过氧化物自由基转变成过氧化氢和氧[36]。在本实验条件下, 芙蓉鲤鲫血清和肝胰脏SOD活力及肝胰脏T-AOC活力随着饲料中脂肪水平的升高, 均呈现先上升后下降的趋势, 这可能是一定的脂肪水平提高鱼体的抗氧化酶活力,减少脂质过氧化产物, 从而提高芙蓉鲤鲫的抗氧化能力, 但过高的脂肪水平减弱了机体清除自由基的作用, 使体内的过氧化物增多, 反而降低了芙蓉鲤鲫抗氧化能力。也有研究报道表明, 随着饲料脂肪水平的增加, 草鱼肝胰脏T-AOC活力显著下降, 研究者认为草鱼抗氧化能力显著受饲料脂肪水平影响, T-AOC活力可以用来标记草鱼对饲料脂肪的免疫反应[1]。由于MDA、SOD和T-AOC等抗氧化酶作为应激指标已普遍应用于毒理学实验研究, 可以有效衡量鱼类肝胰脏氧化和健康状况, 其变化趋势说明饲料高脂肪可能加重了芙蓉鲤鲫的代谢压力和氧化速率[1]。
[1]Jin Y, Tian L X, Zeng S L, et al. Dietary lipid requirement on non-specific immune responses in juvenile grass carp (Ctenopharyngodon idella) [J]. Fish & Shellfish Immunology, 2013, 34(5):1202—1208
[2]Halver J E, Hardy R W. Fish Nutrition (3rd edition) [M]. Amsterdam: Academic Press. 2002, 672—683
[3]Oliva-Teles A. Nutrition and health of aquaculture fish [J]. Journal of Fish Diseases, 2012, 35(2): 83—108
[4]Liu B, Xu L, Ge X P, et al. Effects of mannan oligosaccharide on the physiological responses, HSP70 gene expression and disease resistance of Allogynogenetic crucian carp (Carassius auratus gibelio) under Aeromonas hydrophila infection [J]. Fish & Shellfish Immunology,2013, 34(6): 1395—1403
[5]Kiron V. Fish immune system and its nutritional modulation for preventive health care [J]. Animal Feed Science and Technology, 2012, 173(1—2): 111—133
[6]Sargent J, Bell G, McEvoy L, et al. Recent developments in the essential fatty acid nutrition of fish [J]. Aquaculture, 1999, 177(1—4): 191—199
[7]Tian J, Wu F, Yang C G, et al. Dietary lipid levels impact lipoprotein lipase, hormone-sensitive lipase, andfatty acid synthetase gene expression in three tissues of adult GIFT strain of Nile tilapia, Oreochromis niloticus [J]. Fish Physiology and Biochemistry, 2015, 41(1):1—18
[8]Rogost C, Arzel J, Cardinal M, et al. Dietary lipid level,hepatic lipogenesis and flesh quality in turbot (Psetta maxima) [J]. Aquaculture, 2001, 193(3—4): 291—309
[9]Du Z Y, Clouet P, Huang L M, et al. Utilization of different dietary lipid sources at high level in herbivorous grass carp (Ctenopharyngodon idella): mechanism related to hepatic fatty acid oxidation [J]. Aquaculture Nutrition, 2008, 14(1): 77—92
[10]Salter A M, Mangiapane E H, Bennett A J, et al. The effect of different dietary fatty acids on lipoprotein metabolism: concentration-dependent effects of diets enriched in oleic, myristic, palmitic and stearic acids [J]. British Journal of Nutrition, 1998, 79(2):195—202
[11]Wang J L, Wu Y A, Li C W. Conventional freshwater fish new hybrids, Furong crucian carp [J]. Scientific Fish Farming, 2010, 5: 42—42 [王金龙, 伍远安, 李传武. 大宗淡水鱼新型杂交品种“芙蓉鲤鲫”. 科学养鱼, 2010, 5:42—42]
[12]Wang J L, Li C W. Practical breeding technology of Furong crucian carp [J]. Scientific Fish Farming, 2011, 1:41—43 [王金龙, 李传武. 芙蓉鲤鲫实用繁养殖技术. 科学养鱼, 2011, 1: 41—43]
[13]Li C W, Wang J L, Zeng C F. Gonadal structure histology and reproduction performance of Furong crucian carp (Cyprinus capio furong.♀×Carassius auratus red var.♂) [J]. Freshwater Fisheries, 2010, 40(3): 8—12 [李传武, 王金龙, 曾春芳. 芙蓉鲤鲫(芙蓉鲤♀×红鲫♂)的性腺组织学及繁殖性能研究. 淡水渔业, 2010, 40(3):8—12]
[14]Wang J L, He Z G, Wu Y A, et al. Effect of dietary protein level on growth performance and whole body composition of Furong crucian carp (Furong carp♀×red crucian carp♂) juvenile [J]. Feed Research, 2013, 8: 1—4[王金龙, 何志刚, 伍远安, 等. 饲料蛋白水平对芙蓉鲤鲫幼鱼生长和体组成的影响. 饲料研究, 2013, 8: 1—4]
[15]Watanabe T. Lipid nutrition in fish [J]. Comparative Biochemistry and Physiology, Part B, 1982, 73(1): 3—15
[16]Wang A M, Han G M, Feng G N, et al. Effects of dietary lipid levels on growth performance, nutrient digestibility and blood biochemical indices of gift tilapia (Oreochromis niloticus) [J]. Acta Hydrobiologica Sinica, 2011,35(1): 80—87 [王爱民, 韩光明, 封功能, 等. 饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响. 水生生物学报, 2011, 35(1): 80—87]
[17]Chatzifotis S, Panagiotidou M, Papaioannou N, et al. Effect of dietary lipid levels on growth, feed utilization,body composition and serum metabolites of meagre (Argyrosomus regius) juveniles [J]. Aquaculture, 2010,307(1—2): 65—70
[18]Shi Z H, Yue Y F, Peng S M, et al. Effects of dietary lipid levels on serum biochemistry indices, immunity, and antioxidant activity in Sebastiscus marmoratus [J]. Journal of Fishery Sciences of China, 2013, 20(1): 101—107[施兆鸿, 岳彦峰, 彭士明, 等. 饲料脂肪水平对褐菖鮋血清生化指标、免疫及抗氧化酶活力的影响. 中国水产科学, 2013, 20(1): 101—107]
[19]Du Z Y, Liu Y J, Tian LX, et al. Effect of dietary lipid level on growth, feed utilization and body composition by juvenile grass carp (Ctenopharyngodon idella) [J]. Aquaculture Nutrition, 2005, 11(2): 139—146
[20]Wang A Y, Han B, Song L P, et al. Effects of dietary lipids on the serum biochemical indices of Sooty grunter [J]. Journal of Zhejiang Ocean University (Natural Science), 2010, 29(3): 222—226 [王爱英, 韩勃, 宋理平, 等.不同脂肪水平对厚唇弱棘鯻血液生化指标的影响. 浙江海洋学院学报: 自然科学版, 2010, 29(3): 222—226]
[21]Zhou S W. Animal Biochemistry (3rd edition) [M]. Beijing: China Agriculture Press. 2000, 144—149 [周顺伍. 动物生物化学. 第3版. 北京: 中国农业出版社. 2000,144—149]
[22]Lie Ø, Sandvin A, Waagbø R. Influence of dietary fatty acids on the lipid composition of lipoproteins in farmed Atlantic salmon (Salmo salar) [J]. Fish Physiology and Biochemistry, 1993, 12(3): 249—260
[23]Kikuchi K, Furuta T, Iwata N, et al. Effect of dietary lipid levels on the growth, feed utilization, body composition and blood characteristics of tiger puffer Takifugu rubripes [J]. Aquaculture, 2009, 298(1—2): 111—117
[24]Wang A M, Han G M, Lü F, et al. Effect of dietary lipid levels on the growth performance, apparent digestibility coefficients of nutrients, and blood characteristics of juvenile Crucian carp (Carassius auratus gibelio) [J]. Turkish Journal of Fisheries and Aquatic Sciences, 2014, 14:1—10
[25]Yang Y J, Bing X W, Xu Z H, et al. Effects of non-specific immune and metabolism indices on Monopterus albus fed by feedstuff containing unsaturated fatty acids [J]. Journal of Fishery Sciences of China, 2008, 15(4):600—605 [杨鸢劼, 邴旭文, 徐增洪, 等. 不饱和脂肪酸对黄鳝部分非特异性免疫和代谢指标的影响. 中国水产科学, 2008, 15(4): 600—605]
[26]Lin Y H, Shiau S Y. Dietary lipid requirement of grouper,Epinephelus malabaricus, and effects on immune responses [J]. Aquaculture, 2003, 225(1—4): 243—250
[27]Anderson D P. Immunostimulants, adjuvants, and vaccine carriers in fish: application to aquaculture [J]. Annual Review of Fish Diseases, 1992, 2: 281—307
[28]Henry M, Fountoulaki E. Optimal dietary protein/lipid ratio for improved immune status of a newly cultivated Mediterranean fish species, the shi drum Umbrina cirrosa L. [J]. Fish & Shellfish Immunology, 2014, 37(2):215—219
[29]Li X F, Liu W B, Lu K L, et al. Dietary carbohydrate/lipid ratios affect stress, oxidative status and non-specific immune responses of fingerling blunt snout bream, Megalobrama amblycephala [J]. Fish & Shellfish Immunology,2012, 33(2): 316—323
[30]Sheikhzadeh N, Tayefi-Nasrabadi H, Oushani A K, et al. Effects of Haematococcus pluvialis supplementation on antioxidant system and metabolism in rainbow trout (Oncorhynchus mykiss) [J]. Fish Physiology and Biochemistry, 2012, 38(2): 413—419
[31]Huang C H, Lin W Y, Chu J H. Dietary lipid level influences fatty acid profiles, tissue composition, and lipid peroxidation of soft-shelled turtle, Pelodiscus sinensis [J]. Comparative Biochemistry and Physiology, Part A, 2005,142(3): 383—388
[32]Tocher D R, Mourente G, Van Der Eecken A, et al. Effects of dietary vitamin E on antioxidant defense mechanisms of juvenile turbot (Scophthalmus maximus L.),halibut (Hippoglossus hippoglossus L.) and sea bream(Sparus aurata L.) [J]. Aquaculture Nutrition, 2002, 8(3):195—203
[33]Gul S, Belge-kurutas E, Yildiz E, et al. Pollution correlated modifications of liver antioxidant systems and histopathology of fish (Cyprinidae) living in Seyhan Dam Lake, Turkey [J]. Environment International, 2004, 30(5):605-609
[34]Raico E, Laria L, Raquel S C, et al. Phenoloxidase and peroxidase activity in the shrimp Litopenaeus schmitti,exposed to low salinity [J]. Aquaculture Research, 2005,36(13): 1293—1297
[35]Mourente G, Tocherd R, Diaz E, et al. Relationships between antioxidants, antioxidant enzyme activities and lipid peroxidation products during early development in Dentex dentex eggs and larvae [J]. Aquaculture, 1999,179(1—4): 309—324
[36]Fattman C L, Schaefer L M, Oury T D. Extracellular superoxide dismutase in biology and medicine [J]. Free Radical Biology & Medicine, 2003, 35(3): 236—256
EFFECT OF DIETARY LIPID LEVELS ON SERUM BIOCHEMICAL INDICES,IMMUNE RESPONSES AND ANTIOXIDANT CAPABILITY OF JUVENILE FURONG CRUCIAN CARP (FURONG CARP♀× RED CRUCIAN CARP♂)
HE Zhi-Gang1, WANG Jin-Long1, 2, WU Yuan-An1, 2, LI Chuan-Wu1, 2, LI Shao-Ming1and LIU Wen-Ge1
(1. Fisheries Research Institute of Hunan Province, Changsha 410153, China; 2. Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province, Changde 415000, China)
To investigate effects of dietary lipids on serum biochemical indices, immunity, and antioxidant capability of juvenile Furong crucian carp (Furong carp♀× red crucian carp♂) [mean initial body weight, (2.04±0.01) g], five isonitrogenous experimental diets were formulated with increasing lipid levels (2.50%, 4.39%, 6.61%, 8.42% and 10.81% lipid) using fish oil as the lipid source to feed triplicate groups of fish for 60 days. The results showed that with the increase of dietary lipid level, weight gain rate (WGR) and protein efficiency ratio (PER) significantly increased and then decreased, and the maximum of WGR and PER were found in the 6.61% lipid group (P<0.05). The feed conversion ratio (FCR) showed the opposite trend. Dietary lipids significantly increased serum total cholesterol (CHO) and globulin (GLB) contents, but significantly decreased total protein (TP) and albumin (ALB) content (P<0.05). Dietary lipids have no effect in high density lipoprotein cholesterol (HDL-C) and triglyceride (TG) content (P>0.05). The immunoglobulin M (Ig M) content, serum superoxide dismutase (SOD), hepatic SOD activity and total antioxidant capacity (T-AOC) significantly increased and then decreased with increasing dietary lipid levels (P<0.05). The maximum of serum catalase (CAT) activity was found in the 10.81% lipid group, which are significantly higher than other groups (P<0.05). There were no significant difference in hepatic CAT activity and malondialdehyde (MDA) content among dietary treatments (P>0.05). These results suggest that proper die- tary lipid level can improve the health of Furong crucian carp, but excess dietary lipid may exert adverse effects. Based on the second-order regression analysis of WGR,the optimal dietary lipid level in juvenile furong crucian carp was 6.94%.
Furong crucian carp (Furong carp♀×red crucian carp♂); Dietary lipid levels; Biochemistry indices;Immune function; Antioxidant capability
S965.1
A
1000-3207(2016)04-0655-08
10.7541/2016.88
2015-05-10;
2015-10-07
国家大宗淡水鱼类产业技术体系项目(CARS-46-41); 中央财政农业科技推广专项资金(2011, 2013)资助 [Supported by the Earmarked Fund for China Agriculture Research System (CARS-46-41); the Special Central Finance Funds for the Technology Extension of Agricultural (2011, 2013)]
何志刚(1982—), 男, 湖南南县人; 硕士; 研究方向为水产动物营养与饲料。E-mail: oceanhzg@163.com
伍远安, 研究员; E-mail: wuyuanan9259@163.com

