鸡肉粉完全替代鱼粉饲料中补充包被氨基酸对凡纳滨对虾生长、体成分及组织氨基酸含量的影响
林建伟张春晓, 2孙云章, 2翟少伟, 2宋 凯, 2叶继丹, 2
(1. 厦门市饲料检测与安全评价重点实验室, 厦门 361021; 2. 农业部东海海水健康养殖重点实验室, 厦门 361021)
鸡肉粉完全替代鱼粉饲料中补充包被氨基酸对凡纳滨对虾生长、体成分及组织氨基酸含量的影响
林建伟1张春晓1, 2孙云章1, 2翟少伟1, 2宋 凯1, 2叶继丹1, 2
(1. 厦门市饲料检测与安全评价重点实验室, 厦门 361021; 2. 农业部东海海水健康养殖重点实验室, 厦门 361021)
为了探讨鸡肉粉完全替代鱼粉时饲料氨基酸的平衡性以及外源氨基酸的添加方式与凡纳滨对虾生长、体成分、血浆游离氨基酸及肌肉氨基酸含量的关系, 本试验采用2×6因子试验设计进行了为期56d的饲养试验。2个饲料蛋白质水平分别为40%和32%, 6个饲料处理分别为鱼粉组(对照组)、鸡肉粉组、鸡肉粉+晶体EAA组、鸡肉粉+晶体EAA+晶体NEAA组、鸡肉粉+包被EAA组、鸡肉粉+包被EAA+包被NEAA组, 配制12组饲料。将凡纳滨对虾(0.30±0.01) g随机分配到36个圆桶(150 L)中, 每桶30尾, 每3个桶为一个处理组, 饲喂一种饲料, 每天饱食投喂三次。在每一饲料蛋白质水平下, 无论是补充晶体氨基酸(CAA)组还是包被氨基酸组对虾的增重率均显著高于鸡肉粉组(P<0.05), 且在32%蛋白质水平下, 包被EAA组对虾增重率达到了鱼粉组水平(P>0.05); 补充晶体EAA+NEAA组对虾增重率与补充晶体EAA组无差异(P>0.05), 但均显著低于补充包被氨基酸组(P<0.05); 补充包被EAA组对虾增重率显著高于补充包被EAA+NEAA组(P<0.05)。饲料系数的变化正好与增重率变化相反(P<0.05)。饲喂高蛋白质水平饲料较之饲喂低蛋白质饲料明显提高对虾增重率、虾体蛋白含量(P<0.05), 但降低虾体脂肪含量(P<0.05)。包被氨基酸组凡纳滨对虾血浆游离氨基酸含量总体显著低于CAA组(P<0.05)。除谷氨酸、甘氨酸以及脯氨酸外, 各组对虾肌肉氨基酸含量无显著差异(P>0.05)。结果表明, 在32%饲料蛋白质水平下, 用鸡肉粉完全替代鱼粉时, 饲料中补充包被EAA可明显促进凡纳滨对虾的生长, 且达到了鱼粉组的饲喂效果。
凡纳滨对虾; 鸡肉粉; 氨基酸平衡; 生长性能; 游离氨基酸
鱼粉以其高的必需氨基酸含量、良好的氨基酸平衡性而著称, 是水产动物饲料中最为重要的一类优质蛋白源, 部分水产养殖种类的饲料配方中不可或缺。由于鱼粉资源量不断减少, 供给日益趋紧,迫使人们努力寻找适宜的鱼粉替代品, 而且这个探寻的脚步长期以来就一直没有停止过。有研究表明, 用鸡肉粉最高可替代凡纳滨对虾(Litopenaeus vannamei)饲料中80%的鱼粉而不影响其生长[1, 2],是潜在的鱼粉替代品[1—7]。饲料蛋白质的质与量直接影响动物生长, 而其质量的高低又较大程度地反映在必需氨基酸(Essential amino acids,EAA)的丰缺程度和平衡性上, 甚至还可能受到非必需氨基酸(Nonessential amino acids,NEAA)的影响。Ye等[8]通过调配饲料中赖氨酸和蛋氨酸平衡后可将凡纳滨对虾饲料中的鱼粉水平降低至15%。一般来说,解决饲料氨基酸平衡性的方法有两种, 一是通过调配饲料中各种蛋白源的比例来来解决, 二是通过在饲料中直接添加外源合成氨基酸使饲料氨基酸达到平衡, 而后者无疑是最为直接的解决方案。在以往的鱼粉替代研究中, 通常只考虑通过补充少数必需氨基酸来弥补替代鱼粉后的EAA的不足问题[9, 10], 而较少关注替代鱼粉后饲料中所有EAA和NEAA的平衡性问题。此外, 饲料中外源氨基酸的添加方式也会影响水产动物对饲料氨基酸的利用率[11—14]。为此, 本试验设计了两个不同蛋白质水平的参考饲料配方, 并以参考配方的EAA和NEAA水平为标准, 采用外源添加氨基酸方式, 设计鸡肉粉完全替代鱼粉后饲料氨基酸平衡性不同的饲料配方, 探讨饲料氨基酸的平衡性与对虾生长、体成分及血浆、肌肉氨基酸间的关系, 为合理设计高效和低鱼粉的凡纳滨对虾饲料配方提供理论依据。
1 材料与方法
1.1 试验饲料
本试验按2×6因子试验设计, 设两个饲料蛋白质水平(40%和32%)。每个蛋白质水平下设置鱼粉组(对照组)、鸡肉粉组(鸡肉粉完全替代鱼粉组)、鸡肉粉+晶体EAA组、鸡肉粉+包被EAA组、鸡肉粉+晶体EAA+晶体NEAA组和鸡肉粉+包被EAA+包被NEAA组, 饲料配方及常规成分列于表1。在40%饲料蛋白质水平下, 试验料分别记为D1-D6, 其中D2不添加氨基酸, D3、D4分别补足相对于D1缺乏的EAA, D5、D6分别补足相对于D1缺乏的EAA+NEAA; 在32%饲料蛋白质水平下, 试验料分别记为D7-D12, 其中D8不添加氨基酸, D9、D10分别补足相对于D7缺乏的EAA, D11、D12分别补足相对于D7缺乏的EAA+NEAA。D3-D6、D8-D12晶体氨基酸和硬化油脂包被氨基酸混合物组成见表 2。鱼粉和鸡肉粉中氨基酸含量见表 3。将所有原料用粉碎机粉碎后过80目筛网, 然后制成直径为1.5 mm的硬颗粒饲料, 自然风干后于-20℃冰箱保存备用。饲料氨基酸组成和凡纳滨对虾必需氨基酸建议需要量列于表 4。
包被氨基酸壁材的选择与制作 对水产动物而言, 尤其是虾类, 饲料高的耐水性有助于减少营养物质在水中的溶失, 提高饲料效率。常用的包被壁材有蛋白质和脂类, 由于脂类具有很高的耐水性, 而晶体氨基酸(Crystalline amino acids, CAA)易溶于水, 因此使用脂类作为包被CAA的壁材更为理想[15—17]。
本试验使用的包被壁材为硬化牛油(学名“三硬脂酸甘油酯”), 其熔点在58—62℃左右。使用熔化冷凝分散法制作包被氨基酸, 操作步骤如下: 将硬化牛油于70℃熔化, 与粉碎后的晶体氨基酸1∶1混合, 搅拌分散, 滴加到70℃丙二醇、甲醇混合溶液(2∶1)中, 用磁力搅拌器搅拌得到分散液滴, 迅速冷却, 过滤、干燥后得硬化油脂包膜氨基酸[18]。
包被氨基酸溶失率的测定 取20 mL蒸馏水于烧杯中, 加入0.4 g晶体或硬化油脂包被氨基酸,分别浸泡5min、10min、20min和40min后, 迅速过滤, 取10 mL上清液, 用凯氏定氮仪测定水中氮含量, 计算氨基酸溶失率。
氨基酸溶失率=100×(加入氨基酸一定时间后水中氮含量-蒸馏水中氮含量)/加入氨基酸的氮含量
1.2 试验动物与管理
从厦门翔安养殖场购进健康凡纳滨对虾仔虾,放入2个1000 L的循环水装置的圆桶内培育, 1个月后仔虾规格达到0.25 g左右, 选取较大规格的虾苗(0.30±0.01) g, 随机分配到36个循环水装置的圆桶(150 L)中, 每桶30尾, 每3个桶为一个处理组, 共12个处理组。
1.3 饲养管理
养殖过程中每天分别在08:00, 14:00和20:00定时投喂饲料, 每次投喂2—3轮至饱食, 第一轮少量投喂, 确保虾能够快速摄食无残饵, 1h后进行第二轮投喂, 30min后吸去残料和粪便, 记下残料量, 并换水。每天换水量约为1/3。养殖试验持续56d。养殖期间水温25—30℃, 盐度26‰—29‰, 氨氮含量低于0.2 mg/L, 溶氧量4.7—5.5 mg/L, pH 8.0—8.4。
1.4 样品采集
养殖试验结束后, 对每桶虾称重, 再将虾放回圆桶内稳定24h。在饲喂后30min, 用经预冷抗凝剂[22](配置1 L抗凝剂: 50 mmol柠檬酸钠+10 mmol EDTA·Na2+蒸馏水)润湿后的1 mL注射器, 从虾的心脏取血, 血样以4000 r/min离心10min, 收集血浆,血浆样本保存在-80℃冰箱中待测。抽完血后, 剥离虾壳留取肌肉, 保存在-20℃冰箱中。
1.5 样品测定
饲料和全虾样品中水分含量采用105℃烘箱干燥法测定, 粗蛋白含量采用Foss凯氏定氮仪测定;粗脂肪含量采用索氏抽提法测定; 粗灰分含量采用马福炉灼烧法测定。
饲料氨基酸及肌肉氨基酸含量的测定[23]: 取风干饲料或风干肌肉样品先用6 mol/L HCl真空110℃水解22h, 再经0.45 μm滤膜过滤后, 真空抽干,加入0.02 mol/L HCl, 用日立L-8900氨基酸分析仪检测。测定饲料色氨酸时用4 mol/L NaOH水解样品。测定饲料含硫氨基酸时样品先用过甲酸(88%甲酸与30%过氧化氢按9∶1)氧化, 再用6 mol/L HCl水解。血浆游离氨基酸的测定[24]: 将血浆样品与4%的磺基水杨酸按3∶1的比例混合, 超声波匀质, 13000 r/min下离心沉淀蛋白质。取上清液经0.45 μm滤膜过滤, 滤液用日立L-8900氨基酸分析仪检测。

表 1 饲料组成及营养水平(风干基础)Tab. 1 Ingredients and composition of experimental diets (on an as fed basis) (g/kg)
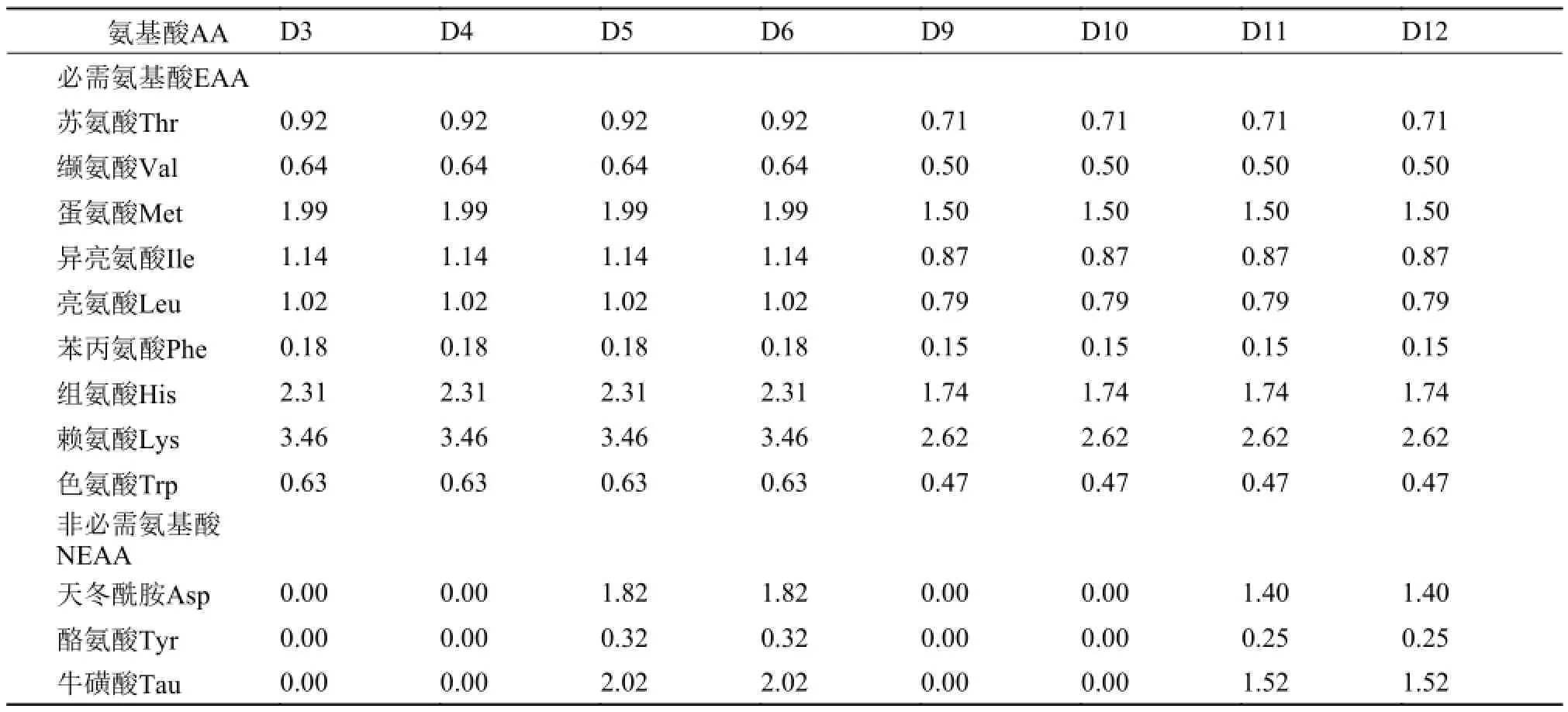
表 2 晶体氨基酸和硬化油脂包被氨基酸混合物组成(风干基础)Tab. 2 Composition of crystalline amino acid and hardened lipid coated amino acids mix (on an as fed basis) (g/kg)
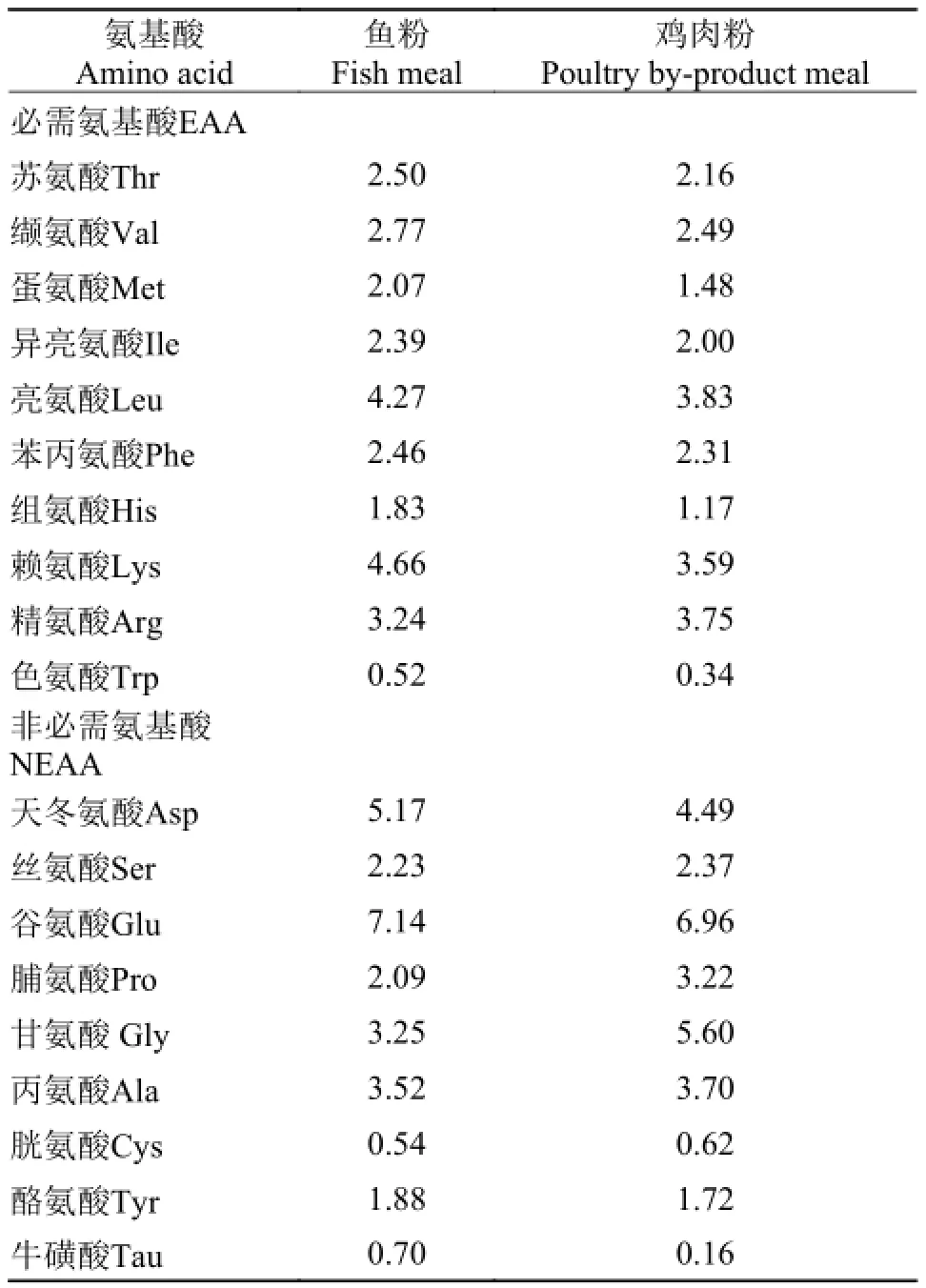
表 3 原料氨基酸含量(风干基础)(%)Tab. 3 Amino acid profile of protein source used in the experiment (on an as fed basis) (%)
1.6 计算公式
增重率(Weight gain rate, WGR)(%)=100×(实验虾终末均重-实验虾初始均重)/实验虾初始均重;
特定生长率(Specific growth rate, SGR) (%/ d)=100×(ln实验虾终末均重-ln实验虾初始均重)/饲喂天数;
饲料系数(Feed conversion ratio, FCR)=实验虾进食总量/(实验虾终末重+死亡虾重量-实验虾初始重);
成活率(Survival rate, SR, %) =100×(实验末虾数量/实验初虾数量);
每尾日摄食量[Feed intake, FI, mg/(尾/d)]=摄食饲料总重/(实验虾终末数量×饲养天数);
蛋白沉积率(Protein deposition ratio, PDR, %)= 100×(实验虾终末总重×实验虾终末体蛋白质含量-实验虾初始总重×实验虾初始体蛋白质含量)/ 实验虾摄入蛋白质总量
1.7 数据统计
所有实验数据采用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA)和二因素方差分析(two-way ANOVA), 若处理组之间存在显著差异(P<0.05), 则采用Student-Newman-Keuls法进行多重比较分析, 实验数据以平均值±标准差(mean±SD)的形式表示。
2 结果
2.1 生长性能
由表 5可知, 饲料蛋白质水平及不同的氨基酸处理(饲料氨基酸平衡性和外源氨基酸的添加方式)均显著影响凡纳滨对虾的生长性能。与32%饲料蛋白质水平相比, 40%饲料蛋白质水平显著提高对虾WGR和SGR(P<0.05), 降低FCR(P<0.05)。在每一个饲料蛋白质水平下, 鱼粉组和包被EAA组凡纳滨对虾FI均显著高于鸡肉粉组(P<0.05), 包被氨基酸组对虾WGR和SGR均分别显著高于CAA组(P<0.05), 但包被EAA组对虾WGR显著高于包被EAA+包被NEAA组(P<0.05)。在40%蛋白质水平下, 对照组对虾WGR(903.0%)显著高于其余各组(P<0.05), 但是在32%饲料蛋白质水平下, 包被EAA组凡纳滨对虾WGR(769.0%)与对照组对虾WGR(770.5%)无显著性差异(P>0.05), 说明鸡肉粉替代鱼粉的饲料中添加EAA对凡纳滨对虾生长的促进作用要优于同时添加EAA和NEAA, 在饲料中添加包膜氨基酸比添加CAA更能够明显地改善对虾生长性能, 因此, 在低蛋白质水平下, 凡纳滨对虾能更有效地利用外源氨基酸。凡纳滨对虾存活率在各组间无显著性差异(P>0.05)。饲料的蛋白质水平和饲料的氨基酸平衡之间存在显著的交互作用(P<0.05)。

表 4 试验饲料氨基酸含量Tab. 4 Amino acid profile of experimental diets (%)
2.2 体成分
与32%饲料蛋白质水平相比, 40%饲料蛋白质水平显著提高凡纳滨对虾的虾体粗蛋白质和灰分含量(P<0.05), 而降低粗脂肪含量(P<0.05)。在每一个饲料蛋白质水平下, 外源添加氨基酸能够显著提高凡纳滨对虾体蛋白质沉积率(P<0.05), 但氨基酸添加与否或以何种形式添加对凡纳滨对虾虾体成分没有明显的影响(P>0.05)。饲料的蛋白质水平和饲料氨基酸平衡性之间交互作用不显著(P>0.05)(表 6)。
2.3 包被氨基酸的溶失率
氨基酸溶失率见表 7。
2.4 血浆游离氨基酸
从表 8可见, 饲料处理对凡纳滨对虾摄食30min后血浆游离氨基酸含量影响显著(P<0.05)。在每一个饲料蛋白质水平下, 相比于鸡肉粉组, CAA组对虾在摄食后, 血浆游离氨基酸含量显著上升(P<0.05),且显著高于鱼粉组(P<0.05)。无论是补充EAA还是EAA+NEAA, 包被氨基酸组对虾的血浆游离氨基酸浓度相对于CAA组均有所下降(P<0.05)。
2.5 肌肉氨基酸
各饲料组间(除谷氨酸、脯氨酸、甘氨酸外)肌肉氨基酸和总氨基酸均无显著性差异(P>0.05)(表 9)。
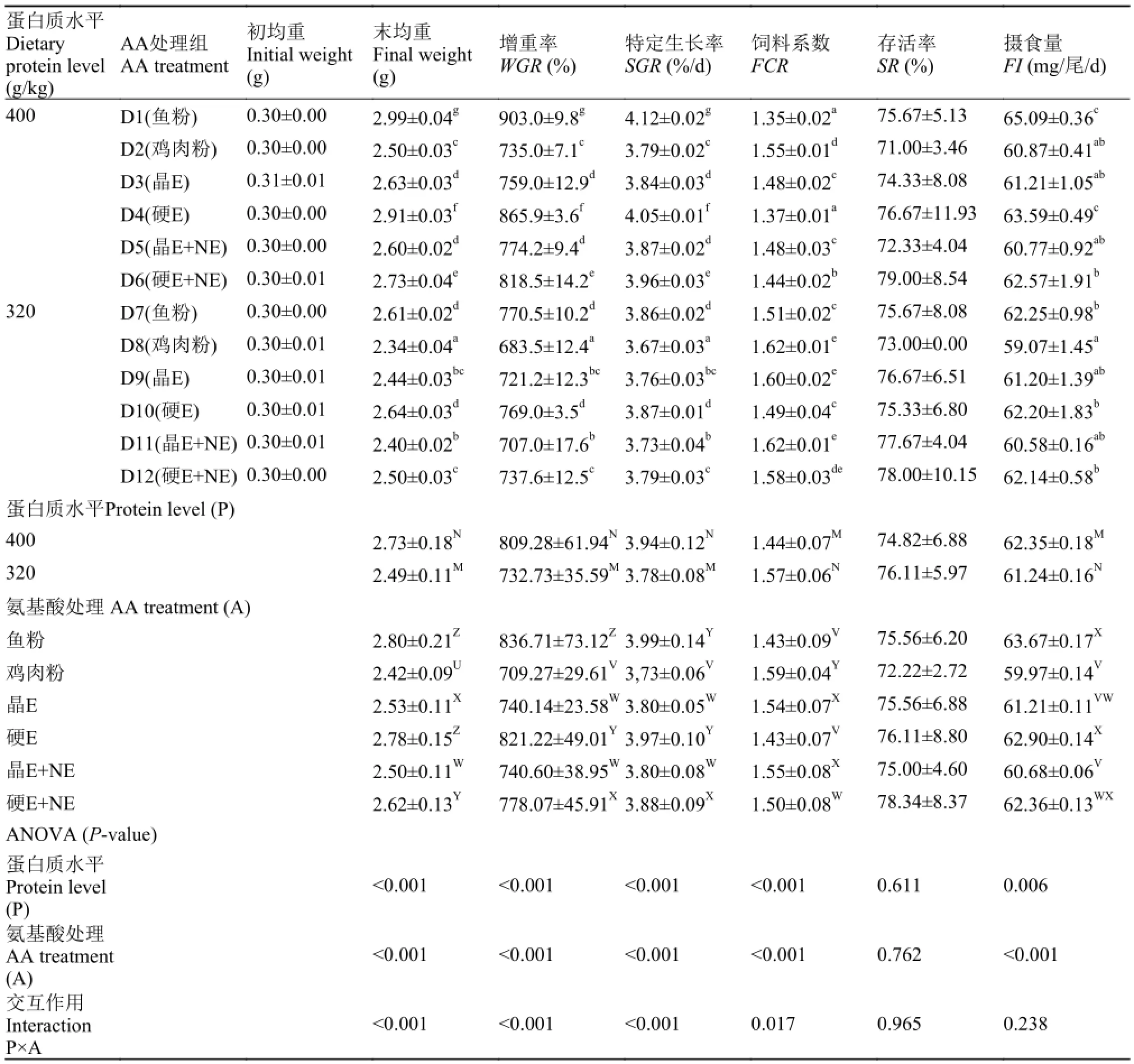
表 5 不同实验饲料对凡纳滨对虾生长性能的影响Tab. 5 Growth performance of shrimp fed different experimental diets
3 讨论
3.1 生长性能
本试验表明, 饲料蛋白质水平、饲料氨基酸平衡性、外源氨基酸的添加方式都明显影响凡纳滨对虾的生长和饲料利用率。且高的饲料蛋白质水平明显促进凡纳滨对虾的生长和饲料利用, 这与Ye等[25]、李广丽等[26]的研究相一致, 说明处于快速生长阶段的凡纳滨对虾需要高的饲料蛋白质水平来满足其生长需要。本试验结果表明, 在每一蛋白质水平下, 鱼粉组和包被EAA组凡纳滨对虾的摄食要明显好于鸡肉粉组, 这与饲料中鱼粉或添加包被EAA促进饲料的适口性有关。本试验结果显示, 在40%饲料蛋白质水平下, 各试验组凡纳滨对虾的生长均明显低于对照组水平, 而在32%饲料蛋白质水平下, 鸡肉粉+包膜EAA组凡纳滨对虾的生长到达了与鱼粉组水平, 这可能是因为低蛋白质水平饲料中的氨基酸水平, 特别是EAA水平, 并未满足凡纳滨对虾的生长需求(表 4), 因此相比于高的饲料蛋白质水平, 在低的饲料蛋白质水平下, 凡纳滨对虾对饲料中所补充的外源氨基酸存在更高的利用率,从而使低蛋白质水平下的鸡肉粉+包膜EAA组对虾的生长达到了鱼粉组水平。饲料氨基酸平衡不仅仅是指饲料中EAA的数量与比例上满足动物体生长的需要[27, 28], 饲料中NEAA的质与量也会影响动物体的生长[29—32]。Mambrini等[31]研究表明, 罗非鱼饲料中NEAA占总氨基酸的比例不宜超过60%。Green等[30]报道, 当饲料EAA/NEAA为57/43时, 虹鳟获得最大氮沉积与最小氮排泄。本试验表明, 在每一蛋白质水平下, 凡纳滨对虾的生长和饲料效率均与饲料EAA/NEAA呈相同趋势, 即鱼粉组(50/50)>鸡肉粉+包被EAA组(49/51)>鸡肉粉+包被EAA+包被NEAA组(48/52)>鸡肉粉组(46/54), 这说明可以通过平衡饲料中氨基酸组成的方式来提高凡纳滨对虾的饲料蛋白质的利用率, 进而提高饲料效率, 从而可以实现在不影响对虾生长的情况下适当降低对虾饲料蛋白质含量[33, 34]。研究人员通常使用外源氨基酸来平衡饲料中的氨基酸组成, 然而不同外源氨基酸的添加方式也会影响外源氨基酸的利用效果[11]。Alam等[11]使用CAA替代饲料中所有的酪蛋白后, 日本囊对虾的生长明显下降, 然而使用酪蛋白-明胶包被的氨基酸替代饲料中所有的酪蛋白后, 对虾的生长达到了对照组水平。刘永坚等[12]研究表明, 在草鱼饲料中添加包膜赖氨酸对其生长的促进作用要优于添加晶体赖氨酸。本试验结果也表明, 在鸡肉粉替代鱼粉的饲料中添加硬化油脂包被的氨基酸对凡纳滨对虾生长的促进作用要明显好于直接添加CAA。本试验晶体EAA组与晶体EAA+NEAA组凡纳滨对虾生长没有明显差异,而包被EAA组凡纳滨对虾的生长却又好于包被EAA+NEAA组, 这说明饲料EAA/NEAA比例(即饲料氨基酸平衡性)与凡纳滨对虾生长之间的关系密切。上述研究表明, 将CAA通过包被处理后, 能够有效提高水产动物对外源合成氨基酸的利用效率。当前对于水产动物利用CAA效果不如包被氨基酸的原因主要有: (1) CAA在水中溶失率高; (2) CAA与完整蛋白质氨基酸吸收不同步; (3) 由于CAA在水产动物体内吸收过快, 超出了水产动物体内游离氨基酸库对饲料来源氨基酸的容纳量或水产动物体内游离氨基酸库对某些氨基酸在短时间内大量吸收的缓冲能力有限, 因此先被吸收的氨基酸可能被水产动物用于能量消耗或是通过转氨基作用分解排泄掉了[35—37], 这也解释了为什么畜禽能够很好的利用饲料中的CAA[38, 39], 而水产动物对饲料中CAA利用效果不理想的原因, 即动物体对体内氨基酸的短期存储和利用能力不同[15]。而将CAA包被后, 即可以降低CAA的溶失, 又可以延缓CAA的吸收, 因此更有利于水产动物的生长。

表 6 不同实验饲料对凡纳滨对虾体成分及蛋白质沉积率的影响(湿重基础)Tab. 6 Whole-body composition and protein deposition ratio of shrimp fed different experimental diets (wet weight basis) (%)

表 7 晶体或包被氨基酸在水中的溶失率Tab. 7 The leaching rate of crystal and coated amino acids (%)

表 8 不同试验饲料对凡纳滨对虾血浆游离氨基酸含量的影响Tab. 8 Plasma free amino acid concentrations of shrimp fed different experimental diets (mg/100 mL)
3.2 体成分
Ye等[25]报道, 高饲料蛋白质水平促进凡纳滨对虾虾体蛋白质和灰分沉积, 降低虾体脂肪沉积。该结果与本试验结果相一致。低饲料蛋白质水平导致虾体蛋白质沉积降低而体脂沉积增加, 原因可能是, 低的饲料蛋白质水平更易出现氨基酸平衡失衡问题, 尤其是EAA的失衡(表 4), 因此, 部分EAA被用于能量代谢, 过多能量会转化为脂肪并以体脂的形式沉积, 而相应地减少了氨基酸用于蛋白质的沉积。Xie等[40]研究表明, 饲料赖氨酸含量从2.23%降到1.99%时, 凡纳滨对虾虾体的蛋白质含量随之明显下降。他们认为, 饲料赖氨酸的缺乏可能增加了其他EAA的氧化, 降低了氨基酸的沉积。本试验表明, 在每一个饲料蛋白质水平下, 外源添加氨基酸能够明显提高凡纳滨对虾体蛋白质沉积率, 这一结果与陈乃松等[41]在大口黑鲈上的研究结果一致。本试验结果还显示, 外源添加氨基酸与否并不影响凡纳滨对虾的虾体成分, 可见, 凡纳滨对虾的体成分与饲料氨基酸之间的平衡性无关。González等[42]研究表明, 随着饲料中脂肪含量增加, 凡纳滨对虾肝胰腺与肌肉脂肪含量明显上升。吴尚忠等[43]报道, 日本对虾能够利用饲料中的三棕榈酸甘油酯。本试验表明, 在每一个饲料蛋白质水平下,鸡肉粉+包被氨基酸组凡纳滨对虾的体脂肪沉积要明显高于其他各组, 这可能是因为本试验选用脂类作为CAA的包被壁材, 增加了包被氨基酸组饲料中的脂肪含量, 进而提高了对虾的体脂肪沉积。
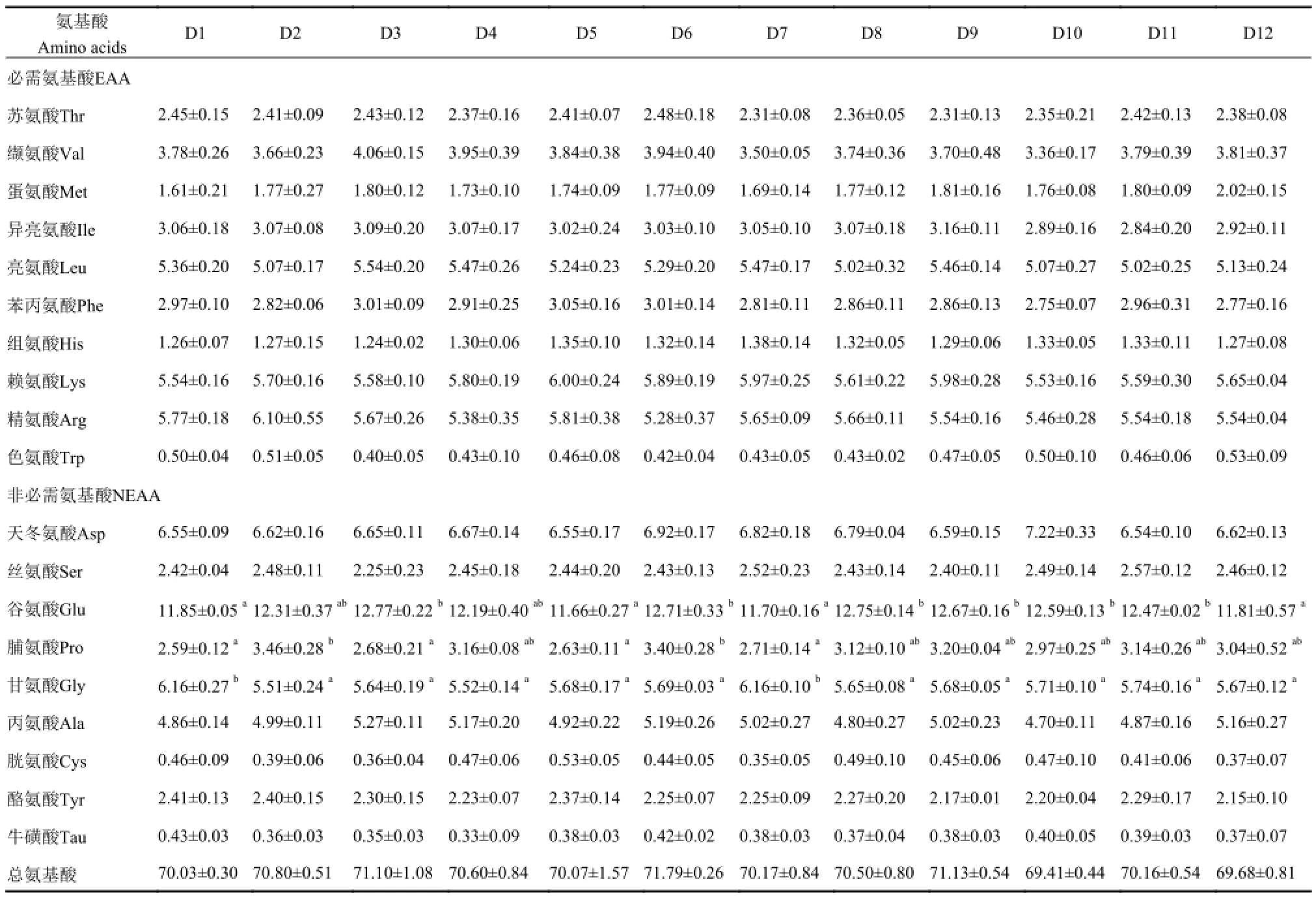
表 9 不同实验饲料对凡纳滨对虾肌肉氨基酸含量的影响Tab. 9 Muscle amino acid contents of shrimp fed different experimental diets (mg/100 g)
3.3 血浆游离氨基酸及肌肉氨基酸
动物体内游离氨基酸水平能够在一定程度上反映不同饲料蛋白质的利用程度[12, 13, 44, 45]。Segovia-Quintero等[44]研究表明, 使用软脂酸甘油酯聚乙烯醇包被蛋氨酸, 能够有效延缓罗非鱼肠道对游离蛋氨酸的吸收。Schuhmacher等[45]报道, 虹鳟在饲喂小麦蛋白饲料18h后血浆游离氨基酸浓度达到峰值, 而在饲喂氨基酸饲料后9h其血浆游离氨基酸浓度就达到峰值; 冷向军等[13]报道, 相对CAA而言, 饲料中补充环糊精或淀粉包膜氨基酸使异育银鲫血清游离氨基酸峰值有所延迟, 且补充环糊精或淀粉包膜氨基酸组异育银鲫的生长要明显好于补充CAA组。以上研究表明, 水产动物对CAA的吸收速度要快于完整蛋白质氨基酸, 通过包被CAA可有效延缓CAA在水产动物肠道内的吸收速度, 降低血液中游离氨基酸的浓度, 提高外源氨基酸与完整蛋白质氨基酸吸收的同步性, 从而提高饲料蛋白质的利用率, 进而有效促进水产动物的生长。本试验结果也表明, 在饲喂30 min后, 补充包被氨基酸组凡纳滨对虾的血浆游离氨基酸浓度要明显低于补充CAA组, 且在32%蛋白质水平下, 鸡肉粉+包被EAA组凡纳滨对虾的生长与鱼粉组水平一致。这说明使用硬化油脂包被CAA能够有效降低CAA在凡纳滨对虾肠道内的吸收速率, 提高与完整蛋白质氨基酸吸收的同步性, 促进对虾生长。各处理组凡纳滨对虾肌肉氨基酸含量(除谷氨酸、甘氨酸、脯氨酸外), 均无明显差异, 这与牛化欣[14]的研究结果类似, 说明饲料氨基酸平衡与否对对虾肌肉氨基酸含量影响不大。
4 结论
(1)在鸡肉粉完全替代鱼粉的饲料中添加外源合成EAA或EAA+NEAA能够明显促进凡纳滨对虾的生长, 添加硬化油脂包被氨基酸对凡纳滨对虾生长的促进作用要明显好于添加CAA, 在低蛋白质水平(32%)鸡肉粉组饲料中添加硬化油脂包被EAA,能使凡纳滨对虾的生长达到鱼粉组水平, 在添加了EAA的鸡肉粉组饲料中进一步补充NEAA没有改善凡纳滨对虾的生长。(2)相对于CAA而言, 在鸡肉粉完全替代鱼粉的饲料中添加硬化油脂包被AA能够有效延缓外源合成氨基酸的吸收速率, 降低血浆游离氨基酸浓度, 提高与完整蛋白氨基酸吸收的同步性, 降低外源合成氨基酸的溶失率, 从而提高凡纳滨对虾的生长。(3)饲喂高蛋白质水平(40%)的饲料比饲喂低蛋白质水平(32%)的饲料更能促进凡纳滨对虾的生长, 且高饲料蛋白质水平增加凡纳滨对虾的体蛋白质沉积, 减少体脂肪沉积。
[1]Cruz-Suárez L E, Nieto-López M, Guajardo-Barbosa C,et al. Replacement of fish meal with poultry by-product meal in practical diets for Litopenaeus vannamei, and digestibility of the tested ingredients and diets [J]. Aquaculture, 2007, 272(1): 466—476
[2]Chi S, Tan B, Mai K, et al. Growth and feed efficiency of juvenile shrimp Litopenaeus vannamei fed formulated diets containing different levels of poultry by-product meal [J]. Journal of Ocean University of China, 2009,8(4): 399—403
[3]Zhu W, Mai K, Zhang B, et al. A study on the meat and bone meal and poultry by-product meal as protein substitutes of fish meal in practical diets for Litopenaeus vannamei juveniles [J]. Journal of Ocean University of China, 2004, 3(2): 157—160
[4]Samocha T M, Davis D A, Saoud I P, et al. Substitution of fish meal by co-extruded soybean poultry by-product meal in practical diets for the Pacific white shrimp, Litopenaeus vannamei [J]. Aquaculture, 2004, 231(1):197—203
[5]Davis D A, Arnold C R. Replacement of fish meal in practical diets for the Pacific white shrimp, Litopenaeus vannamei [J]. Aquaculture, 2000, 185(3): 291—298
[6]Cheng Z J, Behnke K C, Dominy W G. Effects of poultry by-product meal as a substitute for fish meal in diets on growth and body composition of juvenile Pacific white shrimp, Litopenaeus vannamei [J]. Journal of Applied Aquaculture, 2002, 12(1): 71—83
[7]Saoud I P, Rodgers L J, Davis D A, et al. Replacement of fish meal with poultry by-product meal in practical diets for redclaw crayfish (Cherax quadricarinatus) [J]. Aquaculture Nutrition, 2008, 14(2): 139—142
[8]Ye J D, Liu X H, Kong J H, et al. The evaluation of practical diets on a basis of digestible crude protein, lysine and methionine for Litopenaeus vannamei [J]. Aquaculture Nutrition, 2012, 18(6): 651—661
[9]El-Saidy D M S D, Gaber M. Complete replacement of fish meal by soybean meal with dietary L-lysine supplementation for Nile tilapia Oreochromis niloticus (L.) fingerlings [J]. Journal of the World Aquaculture Society,2002, 33(3): 297—306
[10]Hu M, Wang Y, Wang Q, et al. Replacement of fish meal by rendered animal protein ingredients with lysine and methionine supplementation to practical diets for gibel carp, Carassius auratus gibelio [J]. Aquaculture, 2008,275(1): 260—265
[11]Alam M S, Teshima S, Koshio S, et al. Effects of supplementation of coated crystalline amino acids on growth performance and body composition of juvenile kuruma shrimp Marsupenaeus japonicas [J]. Aquaculture Nutrition, 2004, 10(5): 309—316
[12]Zhang S, Ai Q H, Mai K S, et al. Effects of fish meal replacement with crystalline amino acid on digestive and metabolic enzymes of tongue sole (Cynoglossus semilaevis günther, 1873) larvae [J]. Acta Hydrobiologica Sinica, 2014, 38(5): 801—808 [张珊, 艾庆辉, 麦康森,等. 晶体氨基酸替代鱼粉蛋白对半滑舌鳎稚鱼消化酶和代谢酶活力的影响. 水生生物学报, 2014, 38(5):801—808]
[13]Leng X J, Tian J, Chen B A, et al. Comparison study on utilizing crystalline or coated methionine by tilapia (Oreochromis niloticus × O. aureus) [J]. Acta Hydrobiologica Sinica, 2013, 37(2): 235—242 [冷向军, 田娟, 陈丙爱,等. 罗非鱼对晶体蛋氨酸、包膜蛋氨酸利用的比较研究. 水生生物学报, 2013, 37(2): 235—242]
[14]Niu H X. Preparation of microencapsulated amino acids and its evaluation in feed processing and shrimp culture [D]. Wuxi: Jiangnan University. 2011 [牛化欣. 微胶囊氨基酸制备及其在饲料加工和虾养殖中的效果研究. 无锡: 江南大学. 2011]
[15]Deng J M, Mai K S. A review on utilization of crystalline amino acids by fishes [J]. Journal of Yunnan Agricultural University, 2008, 23(4): 552—557 [邓君明, 麦康森. 鱼类对晶体氨基酸利用效率的研究进展. 云南农业大学学报, 2008, 23(4): 552—557]
[16]Langdon C J, Buchal M A. Comparison of lipid-walled microcapsules and lipid spray beads for the delivery of water-soluble, low-molecular weight materials to aquatic animals [J]. Aquaculture Nutrition, 1998, 4(4): 275—284
[17]López-Alvarado J, Langdon C J, Teshima S I, et al. Effects of coating and encapsulation of crystalline amino acids on leaching in larval feeds [J]. Aquaculture, 1994,122(4): 335—346
[18]Liang Z Q. Microencapsulation Technology and Application [M]. Beijing: China Light Industry Press. 1999,255—256 [梁治齐. 微胶囊技术及其应用. 北京: 中国轻工业出版社. 1999, 255—256]
[19]Akiyama D M. Future considerations for shrimp nutrition and the aquaculture feed industry [C]. Proceeding of the Special Session on Shrimp Farming World Aquaculture Society. Baton Rouge USA. 1992
[20]Wilson R P. Amino Acid Requirements of Finfish and Crustaceans [M]. Amino Acids in Animal Nutrition. CABI Publishing. 2003, 427—447
[21]Wang Y L. Study on the requirements of threonine, leucine, tryptophan and valine for juvenile Pacific white shrimp, Litopenaeus vannamei [D]. Master thesis, Zhanjiang: Guangdong Ocean University. 2013 [王用黎. 凡纳滨对虾幼虾对苏氨酸, 亮氨酸, 色氨酸和缬氨酸需要量的研究. 硕士毕业论文. 湛江: 广东海洋大学. 2013]
[22]Jiang Q, Wang L. Selection of anticoagulant to the hemolymph of Penaeus chinesis [J]. Journal of Fisheries of China, 2001, 25(4): 359—362 [蒋琼, 王雷. 中国对虾血淋巴抗凝剂的筛选. 水产学报, 2001, 25(4): 359—362]
[23]Mente E, Coutteau P, Houlihan D, et al. Protein turnover,amino acid profile and amino acid flux in juvenile shrimp Litopenaeus vannamei: effects of dietary protein source [J]. Journal of Experimental Biology, 2002, 205(20):3107—3122
[24]Findley A M, Stickle W B. Effects of salinity fluctuation on the hemolymph composition of the blue crab Callinectes sapidus [J]. Marine Biology, 1978, 46(1): 9—15
[25]Ye J D, Wang K, Li F D, et al. Incorporation of a mixture of meat and bone meal, poultry by-product meal,blood meal and corn gluten meal as a replacement for fish meal in practical diets of Pacific white shrimp Litopenaeus vannamei at two dietary protein levels [J]. Aquaculture Nutrition, 2011, 17(2): e337-e347
[26]Li G L, Zhu C H, Zhou Q C. Effects of dietary protein level on the growth of Penaeus vannamei [J]. Marine Science, 2001, 25(4): 1—4 [李广丽, 朱春华, 周歧存. 不同蛋白质水平的饲料对凡纳滨对虾生长的影响. 海洋科学, 2001, 25(4): 1—4]
[27]Rollin X, Mambrini M, Abboudi T, et al. The optimum dietary indispensable amino acid pattern for growing Atlantic salmon (Salmo salar L.) fry [J]. British Journal of Nutrition, 2003, 90(5): 865—876
[28]Twibell R G, Griffin M E, Martin B, et al. Predicting dietary essential amino acid requirements for hybrid striped bass [J]. Aquaculture Nutrition, 2003, 9(6): 373—381
[29]Peres H, Oliva-Teles A. Effect of the dietary essential to non-essential amino acid ratio on growth, feed utilization and nitrogen metabolism of European sea bass (Dicentrarchus labrax) [J]. Aquaculture, 2006, 256(1): 395—402
[30]Green J A, Hardy R W, Brannon E L. The optimum dietary essential: nonessential amino acid ratio for rainbow trout (Oncorhynchus mykiss), which maximizes nitrogen retention and minimizes nitrogen excretion [J]. Fish Physiology and Biochemistry, 2002, 27(1—2): 109—115
[31]Mambrini M, Kaushik S J. Partial replacement of dietary protein nitrogen with dispensable amino acids in diets of Nile tilapia, Oreochromis niloticus [J]. Comparative Biochemistry and Physiology Part A: Physiology, 1994,109(2): 469—477
[32]Heger J. Essential to non-essential amino acid ratios [C]. Amino Acids in Animal Nutrition. 2003, 103—204
[33]Yamamoto T, Sugita T, Furuita H. Essential amino acid supplementation to fish meal-based diets with low protein to energy ratios improves the protein utilization in juvenile rainbow trout Oncorhynchus mykiss [J]. Aquaculture, 2005, 246(1): 379—391
[34]Gaylord T G, Barrows F T. Multiple amino acid supplementations to reduce dietary protein in plant-based rainbow trout, Oncorhynchus mykiss, feeds [J]. Aquaculture,2009, 287(1): 180—184
[35]Ye Y T. Freshwater fish nutrition and feed formulation technology trends analysis (A) [J]. Feed China, 2005, 10:32—34 [叶元土. 淡水鱼类营养与饲料配制技术发展趋势与存在问题分析(上). 饲料广角, 2005, 10: 32—34]
[36]Zarate D D, Lovell R T, Payne D M. Effects of feeding frequency and rate of stomach evacuation on utilization of dietary free and protein-bound lysine for growth by channel catfish Ictalurus punctatus [J]. Aquaculture Nutrition,1999, 5(1): 17—22
[37]Cowey C B, Walton M J. Studies on the uptake of (14C)amino acids derived from both dietary (14C) protein and dietary (14C) amino acids by rainbow trout, Salmo gairdneri Richardson [J]. Journal of Fish Biology, 1988, 33(2):293—305
[38]Adeola O, Lawrence B V, Cline T R. Availability of amino acids for 10-to 20-kilogram pigs: lysine and threonine in soybean meal [J]. Journal of Animal Science,1994, 72(8): 2061—2067
[39]Fernandez S R, Parsons C M. Bioavailability of the digestible lysine and valine in cottonseed and soybean meals for chicks [J]. Poultry Science, 1996, 75(2):216—223
[40]Xie F, Zeng W, Zhou Q, et al. Dietary lysine requirement of juvenile Pacific white shrimp, Litopenaeus vannamei [J]. Aquaculture, 2012, 358—359: 116—121
[41]Chen N S, Liang Q L, Xiao W W et al. Effects of supplementing EAA to lower protein diets on growth, body composition and immunological index of largemouth bass (Micropterus salmoides) [J]. Acta Hydrobiologica Sinica,2014, 38(2): 262—271 [陈乃松, 梁勤朗, 肖温温, 等. 在低蛋白质饲料中补充必需氨基酸对大口黑鲈生长, 体组成和免疫指标的影响. 水生生物学报, 2014, 38(2):262—271]
[42]González-Félix M L, Gatlin D M, Lawrence A L, et al. Effect of various dietary lipid levels on quantitative essential fatty acid requirements of juvenile Pacific white shrimp Litopenaeus vannamei [J]. Journal of the World Aquaculture Society, 2002, 33(3): 330—340
[43]Wu S Z, Effects of phospholipid on transporting [^ 14C]tripalmitin in vivo for Penaeus japonicas [J]. Foreign Fisheries, 1989, (2): 24—27 [吴尚忠. 饵料中磷脂在日本对虾体内输送 [^ 14C] 三棕榈酸甘油酯的作用. 国外水产, 1989, (2): 24—27]
[44]Segovia-Quintero M A, Reigh R C. Coating crystalline methionine with tripalmitin-polyvinyl alcohol slows its absorption in the intestine of Nile tilapia, Oreochromis niloticus [J]. Aquaculture, 2004, 238(1): 355—367
[45]Schuhmacher A, Wax C, Gropp J M. Plasma amino acids in rainbow trout (Oncorhynchus mykiss) fed intact protein or a crystalline amino acid diet [J]. Aquaculture,1997, 151(1): 15—28
COMPLETE REPLACEMENT OF FISH MEAL BY POULTRY BY-PRODUCT MEAL IN PRACTICAL DIETS SUPPLEMENTED WITH COATED AMINO ACIDS FOR PACIFIC WHITE SHRIMP LITOPENAEUS VANNAMEI
LIN Jian-Wei1, ZHANG Chun-Xiao1, 2, SUN Yun-Zhang1, 2, ZHAI Shao-Wei1, 2, SONG Kai1, 2and YE Ji-Dan1, 2
(1. Xiamen Key Laboratory for Feed Quality Testing and Safety Evaluation, Xiamen 361021, China; 2. Key Laboratory of Healthy Mariculture for the East China Sea, Ministry of Agriculture, Xiamen 361021, China)
A 2 × 6 factorial experiment with two levels of dietary protein (32% and 40%) and six amino acid (AA)treatments were conducted to determine effects of complete replacement of fish meal (FM) with poultry by-product meal (PBM) in diets on a basis of EAAs or EAA+NEAAs on the growth and body composition of Pacific white shrimp over an 8-week feeding trial. Six AA-treated diets were formulated and expressed as diet FM (basal diet), diet PBM,PBM+ crystalline EAA, diet PBM+ coated EAA, diet PBM+ crystalline EAA+ crystalline NEAA and diet PBM+ coated EAA+ coated NEAA, respectively. For each dietary protein level, WGR in groups of PBM+ crystalline EAA and PBM+ crystalline EAA+ crystalline NEAA were higher than that in PBM group (P<0.05). No difference in WGR between group PBM+ coated EAA and control groups at 32% dietary protein level (P>0.05) was observed. The WGR in group PBM+ crystalline EAA and in group PBM+ crystalline EAA+ crystalline NEAA was not different (P>0.05), but it was lower than that in group PBM+ coated EAA and group PBM+ coated EAA+ coated NEAA groups (P<0.05). The WGR value in group of PBM+ coated EAA was significantly higher than that in group PBM+ coated EAA+ coated NEAA (P<0.05). Changes in FCR was the opposite of WGR (P<0.05). The shrimp fed the 40% protein diets had higher WGR and body protein content but lower body lipid content (P<0.05) compared to those shrimp fed 32% protein diets. Plasma free AA concentrations of group PBM+ coated AA were generally lower than those in group PBM+ crystalline AA (P<0.05). There were no differences in muscle AA contents (P>0.05) except glutamate, glycine and proline across dietary treatments (P<0.05). Feeding a diet with PBM+ coated EAA can lead to a growth comparable to feeding the basal diet at 32% dietary protein level.
Litopenaeus vannamei; Poultry by-product meal; Amino acid balance; Growth; Free amino acids
S968.2
A
1000-3207(2016)04-0700-12
10.7541/2016.93
2015-05-25;
2015-12-16
国家公益性行业(农业)专项(201303053); 厦门市科技计划项目(3502Z20130040)资助 [Supported by the Special Fund for Agroscientific Research in the Public Interest (201303053); Xiamen Science and Technology Plan Project (3502Z20130040)]
林建伟(1990—), 男, 福建南平人; 硕士研究生; 研究方向为水产动物营养与饲料学。E-mail: linjianwei1013@163.com
叶继丹(1966—), 男, 博士; 研究员; 硕士生导师; E-mail: yjdwk@sina.com

