SCN5A基因L812Q突变体细胞模型的建立与细胞定位
倪 磊, 许德晖, 刘利英, 王爱英, 汪鲁敏
(西安交通大学医学部环境与疾病相关基因教育部重点实验室,细胞生物学与遗传学系,西安 710061; *通讯作者,E-mail:wanglumin1@mail.xjtu.edu.cn)
SCN5A基因L812Q突变体细胞模型的建立与细胞定位
倪磊, 许德晖, 刘利英, 王爱英, 汪鲁敏*
(西安交通大学医学部环境与疾病相关基因教育部重点实验室,细胞生物学与遗传学系,西安710061;*通讯作者,E-mail:wanglumin1@mail.xjtu.edu.cn)
摘要:目的建立SCN5A基因L812Q突变体细胞模型,并细胞定位。 方法应用重叠PCR的方法构建SCN5A基因L812Q突变;以pMD19-T载体克隆SCN5A基因L812Q突变体;SCN5A-L812Q通过EcoR Ⅰ和ACC Ⅰ限制性内切酶位点插入表达载体质粒pEGFP-C1-hH1中,测序鉴定;将构建好的pEGFP-C1-hH1-L812Q突变型质粒、pEGFP-C1-hH1野生型质粒瞬时转染进入HEK293细胞,通过免疫荧光检测L812Q突变的细胞定位;将pEGFP-C1-hH1、pEGFP-C1-hH1-L812Q和pEGFP-C1-hH1+pEGFP-C1-hH1-L812Q分别转染进入HEK293细胞,用Western blot方法分析L812Q突变体的表达。结果测序结果显示pEGFP-C1-hH1-L812Q表达载体构建成功。荧光检测验证,野生型SCN5A主要定位在细胞膜上,而突变型定位在细胞质中。通过Western blot分析发现,突变型通道蛋白在细胞质中的表达量高于野生型。结论本研究成功构建了SCN5A基因突变载体pEGFP-C1-hH1-L812Q,证明SCN5A基因L812Q突变型主要定位在细胞质中。
关键词:Brugada综合征;SCN5A基因;基因突变;细胞定位
Brugada综合征是一种罕见的常染色体显性遗传疾病,已知致病基因包括SCN5A、GPD1L、SCN1B、SCN2B、SCN3B、RANGRF、SLMAP、KCNE3、KCNJ8、HCN4、KCNE5、KCND3、CACNA1C、CACNB2B、CACNA2D1和TRPM4[1]。其中,SCN5A不同位点的突变表现不同的临床症状,既可引起Brugada综合征,也可诱导LQTs的发生[2,3]。SCN5A定位于3p21基因,基因长80 kb,含有28个外显子,编码2 016个氨基酸。SCN5A基因作为心脏电压门控钠通道的α亚基的编码基因,其包含4个同源结构域(Ⅰ-Ⅳ),每个结构域包含6个α螺旋跨膜片段(S1-S6),S5和S6片段之间的连接环构成通道孔区,也称为P环,决定了离子通道的选择通透性,S4片段含有带正电荷的氨基酸残基,为通道的易感器[4]。SCN5A基因的突变点涉及到了钠离子通道α亚基的各个区域,并且突变位点与其所导致的通道功能异常的机制有关,主要有负显性效应的影响和钠通道动力学的改变[5,6]。
基因突变并不一定引起临床表型的改变。本课题组的前期研究发现,Brugada综合征的患者携带有SCN5A基因L812Q新突变,为了鉴定其与功能的关系,拟构建SCN5A基因L812Q新突变细胞模型,为功能研究奠定基础。
1材料与方法
1.1质粒和主要试剂
质粒PEGFPN2-hH1和HEK293细胞由本研究室提供。正反向引物及测序引物由北京奥科生物技术公司合成。高保真热启动DNA聚合酶、普通Taq DNA聚合酶、T4 DNA Ligase、PMD19-T simple Vector、EcoR Ⅰ和ACCⅠ限制性内切酶购于日本TaKaRa公司,DNA ladder、Agarose Gel DNA Purification Kit和质粒小提试剂盒购于北京天根生化科技公司,Anti-Calnexin购于美国Millipore公司,异硫氰酸荧光素(FITC)购于美国Sigma公司;山羊抗血清与荧光二抗(TRITC)购于中杉金桥生物技术有限公司。
1.2重叠衍生PCR扩增SCN5A基因L812Q突变体片段
使用重叠延伸PCR方法构建突变体。SCN5A基因的外侧端引物:5′-TCAAGCAGGGAGTGAAGTTGGTGGT-3′和5′-GAAGATGAGGCAGACGAGGAGGACG-3′;L812Q突变点的邻近引物:L812Q-forward 5′-CTCCTTCCGCCAGCTGCGGGTCTTC-3′和L812Q-reverse 5′-GAAGACCCGCAGCTGGCGGAAGGAG-3′。第1步PCR 以SCN5A基因的外侧5′-端引物和L812Q-reverse 3′端引物扩增SCN5A基因5′-DNA片段,片段大小为331 bp;第2步PCR以SCN5A基因的外侧3′端引物和L812Q-forward 5′端引物扩增SCN5A-CDNA片段,片段大小为1 608 bp。应用凝胶回收前两步PCR产物,第3步PCR连接5′端和3′端DNA片段,用两外侧端引物扩增此片段,约1 915 bp。凝胶回收DNA片段,由北京奥科生物技术有限责任公司测序鉴定,备用。
1.3L812Q突变体的克隆与测序分析
将测序正确的L812Q突变体DNA片段连接到pMD19-T载体上,转化感受态大肠杆菌,克隆并扩增。将4 μl的L812Q突变体DNA与1 μl的pMD19-T载体在16 ℃水浴中过夜连接,取10 μl连接产物加入到100 μl大肠杆菌中进行转化,经冰浴30 min、42 ℃热休克90 s、LB培养基37 ℃孵育1 h、5 000 r/min离心3 min弃上清后将菌液悬浮铺于含有抗性的LB培养基中37 ℃培养过夜。挑选出单克隆菌落于抗性培养基中37 ℃震荡培养12 h后提质粒。质粒提取参见北京天根生化科技公司质粒小提说明书。质粒提取后,用EcoR Ⅰ和ACCⅠ限制性内切酶对质粒进行双酶切,琼脂糖凝胶电泳鉴定,将酶切鉴定正确的质粒送北京奥科生物技术有限责任公司测序,检测突变点。
1.4L812Q突变体真核表达载体的连接、酶切和测序鉴定
应用EcoRⅠ和ACCⅠ限制性内切酶分别酶切克隆载体以及真核表达载体pEGFP-C1-hH1,将酶切产物进行电泳分离后,通过凝胶回收纯化试剂盒分别回收克隆载体中L812Q突变体片段和pEGFP-C1-hH1载体中的大片段进行连接。将2.8 μl的L812Q突变片段和1 μl的pEGFP-C1-hH1于含1 μl的T4 DNA Ligase的体系中22 ℃过夜连接后进行转化。挑选出单克隆菌落后于抗性培养基中37 ℃震荡培养12 h提质粒。质粒提取后,用EcoRⅠ和ACCⅠ限制性内切酶双酶切,进行琼脂糖凝胶电泳鉴定,将酶切鉴定正确的质粒测序。
1.5HEK293细胞培养与转染
HEK293细胞培养于10 %小牛血清的全培养基DMEM中,培养条件为37 ℃,5%CO2。将HEK293细胞以1×105个/ml加入于24孔培养板中,培养24 h。在转染前1 h,将含血清培养基换成无血清的培养液。转染分为3组:pEGFP-C1-hH1、pEGFP-C1-hH1-L812Q和pEGFP-C1-hH1+pEGFP-C1-hH1-L812Q。用50 μl无血清培养基稀释0.8 μg DNA和2 μl脂质体2000,轻轻混匀后室温放置20 min;直接将复合物加入到细胞培养孔中,摇动培养板,于37 ℃,5 %CO2培养4-6 h更换全培养基。
1.6Western blot分析SCN5A表达水平
按照常规的Western blot的方法进行实验。电泳转膜后,将膜正面向下放入已加入1 ml Anti-Calnexin一抗(1∶2 000)的玻璃皿中,4 ℃过夜;弃一抗,TBST洗3次,将膜正面向下放入已加入1 ml HRP(辣根过氧化物酶)标记的二抗(1∶2 000)的玻璃皿中,摇床温和振摇2 h;弃二抗,TBST洗3次,每次10 min;用吸水纸吸干膜上的水分,膜正面向上放在干净的玻璃皿上。化学发光底物显示杂交印迹,照相并分析结果。
2结果
2.1SCN5A基因L812Q突变体的扩增与鉴定
通过重叠PCR,分别获得了3步PCR的产物,琼脂糖凝胶电泳检测显示,第1步PCR产物片段大小为331 bp,第2步PCR产物片段大小为1 608 bp,第3步PCR产物片段大小为1 915 bp,均与预期片段大小一致(见图1)。测序结果表明,在SCN5A基因cDNA上2629位碱基T突变为A,而其他序列均无改变(见图2)。
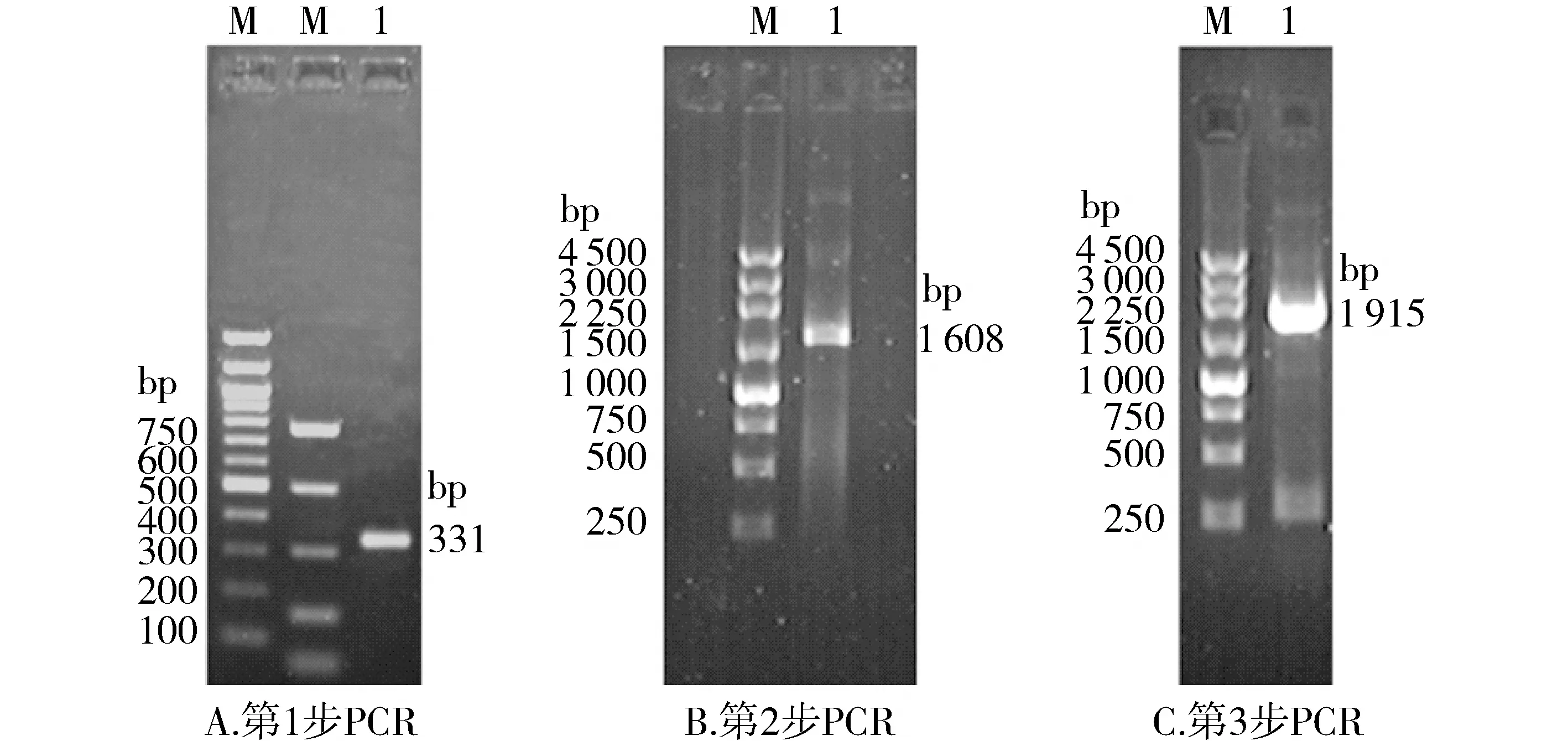
M.DNA ladder;1.PCR产物图1 三步PCR结果的电泳鉴定Figure 1 Electrophoresis identification of three-step PCR results
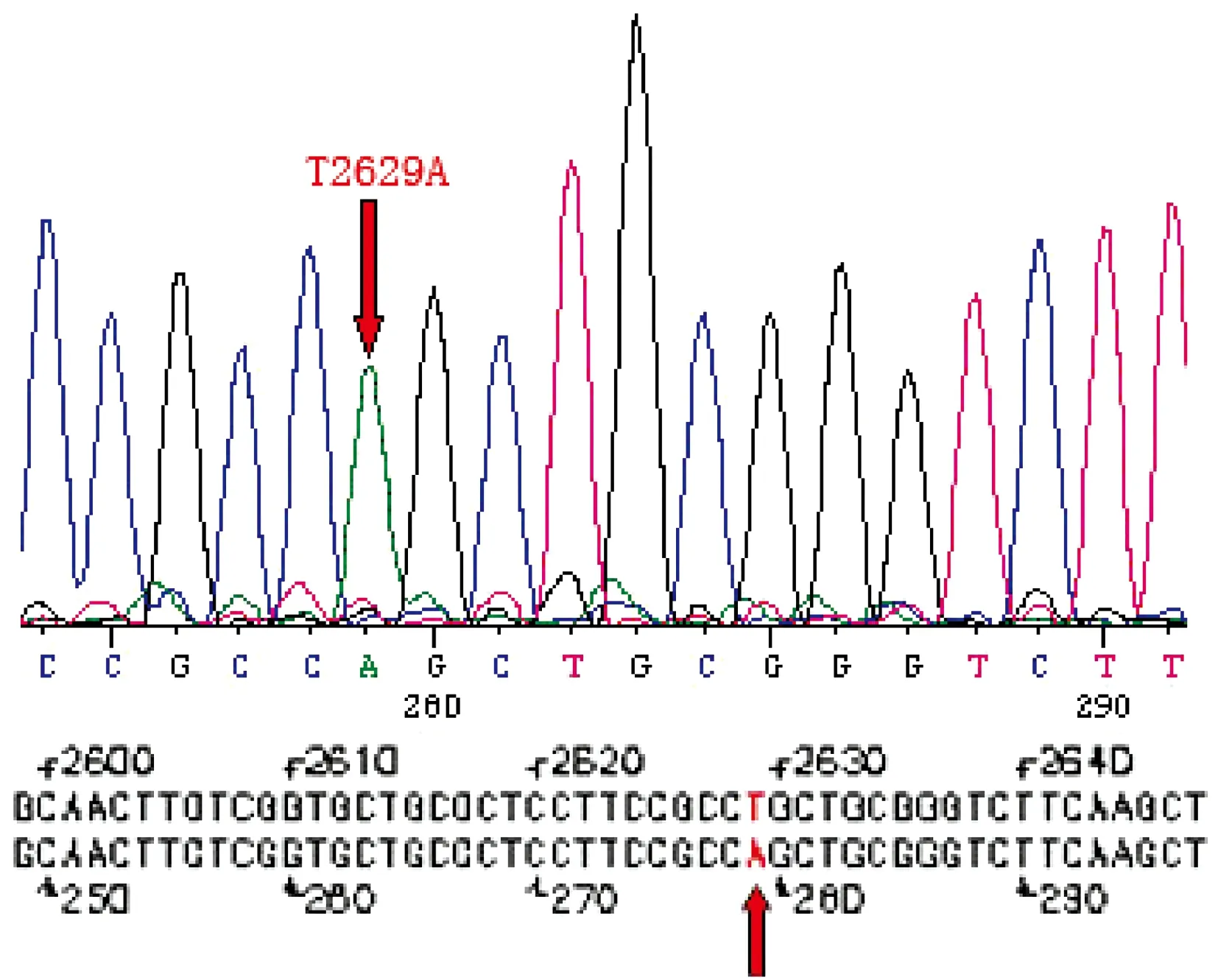
图2 第三步PCR测序结果Figure 2 Sequencing of the third PCR result
2.2L812Q突变体表达载体pEGFP-C1-hH1-L812Q的构建与鉴定
野生型SCN5A(hH1)cDNA全长8.5 kb,pEGFP-C1-hH1全长13.2 kb。在突变位点两侧即2 425位点和4 031位点各有一个酶切位点,对应的酶分别是EcoR Ⅰ和ACCⅠ。通过双酶切可以看到2个片段,分别是长为1.6 kb和11.6 kb(见图3A)。应用T4 DNA连接酶将L812Q的突变片段的1 606 bp片段与pEGFP-C1-hH1的11.6 kb片段连接起来,重组成pEGFP-C1-hH1-L812Q。野生型pEGFP-C1-hH1与重组质粒pEGFP-C1-hH1-L812Q电泳结果一致(见图3B),表明突变体构建成功。

图3 SCN5A基因L812Q突变体表达载体的构建与鉴定Figure 3 The construction and identification of SCN5A gene-L812Q mutant expression vector
2.3L812Q突变体蛋白质表达和定位
在荧光显微镜下可见pEGFP-C1-SCN5A组及pEGFP-C1-SCN5A-L812Q组转染的HEK293细胞均发出绿色荧光,而未转染的HEK293细胞未见绿色荧光,表明2个表达载体构建成功,并分别表达SCN5A和SCN5A-L812Q。野生型SCN5A蛋白定位于细胞膜,而SCN5A-L812Q主要定位于细胞质(见图4)。为了证明SCN5A-L812Q的细胞质定位,应用Western blot法鉴定SCN5A基因L812Q的细胞质表达水平,结果显示突变型通道蛋白在细胞质中的表达量高于野生型(见图5)。

图4 pEGFP-C1-SCN5A及pEGFP-C1-SCN5A-L812Q表达蛋白的定位Figure 4 The location of expression protein of pEGFP-C1-SCN5A and pEGFP-C1-SCN5A-L812Q

1.野生型;2.杂合型;3.突变型图5 野生型、杂合型和突变型蛋白在细胞质的表达Figure 5 The expression of wild type, heterozygous type and mutant type protein in the cytoplasm
3讨论
Brugada综合征是由西班牙Brugada兄弟于1992年发现的离子通道病,以V1-V3导联右束支传导阻滞(RBBB)的心电图变化和心脏性猝死为特征,常表现为常染色体显性负效应[7,8]。其遗传背景复杂,已发现的相关基因多达14个,其中SCN5A基因突变与Brugada综合征密切相关[9]。本课题组前期在一名Brugada综合征患者基因组中筛查到SCN5A基因的新突变T2629A(L812Q),但不清楚该突变是否与Brugada综合征的临床表征相关,因此,建立突变体的细胞模型是功能鉴定的基础。
目前,建突变体的方法主要有以下3种方法:突变试剂盒、寡核苷酸引物介导的定点诱变以及PCR法。由于PCR的方法简单,易操作,花费省而多被实验室所采用。常见的PCR定点诱变的方法有大引物PCR、快速定点诱变PCR、重叠延伸PCR等,其中重叠延伸PCR因其不受突变类型和突变位置的限制,不仅可以完成单纯的基因点突变,而且还能实现某一基因大片段的插入及缺失,因此应用最为广泛。该方法的特点是在待突变位点上(即引物包含突变位点)和扩增片段的上下游分别设计引物。本实验主要采取的是定点突变中重叠延伸PCR的方法。由于T载体上缺少内切酶切点,因此在上下游引物上设计了EcoRⅠ和ACCⅠ的切点。经过三步PCR获得突变体的DNA片段,将其插入T载体进行扩增,其后通过双酶切获得突变体片段插入表达载体。测序结果提示SCN5A cDNA 2629位点碱基T变为A,氨基酸第812位密码子由甘氨酸变为谷氨酰胺,即L812Q突变,除该位点外其余位点无碱基变化,证明定点突变过程成功。
HEK293细胞其内源性电压门控通道不包括INa电流,所以采用了HEK293细胞作为表达体系。本实验主要运用阳离子脂质体法分别将pEGFP-C1-hH1和pEGFP-C1-hH1-L812Q转染HEK293细胞。由于pEGFP绿色荧光蛋白和SCN5A基因所编码的钠离子通道蛋白是融合表达的,因此通过荧光显微镜便可以观察到转染是否成功和转染的效率。本结果表明,野生型SCN5A蛋白定位于细胞膜,而SCN5A-L812Q主要定位于细胞质。Western blot法进一步证明基因L812Q的细胞质表达水平高于野生型,提示是L812Q突变所表达的缺陷hH1蛋白在内质网上合成后,不能被进一步加工并转运到细胞膜上,而是滞留于内质网中,减少了细胞膜上有功能的离子通道,使膜转运功能不足,进而使INa通道电流减少,心内外膜的负极化过程发生改变,引发Brugada综合征。
参考文献:
[1]Nielsen MW,Holst AG,Olesen SP,etal.The genetic component of Brugada syndrome[J].Front Physiol,2013,4:179.
[2]Kinoshita K,Takahashi H,Hata Y,etal.SCN5A(K817E),a novel Brugada syndrome-associated mutation that alters the activation gating of NaV1.5 channel[J]. Heart Rhythm,2016,13(5):1113-1120.
[3]Hu RM,Tan BH,Orland KM,etal.Digenic inheritance novel mutations in SCN5a and SNTA1 increase late I(Na) contributing to LQT syndrome[J].Am J Physiol Heart Circ Physiol,2013,304(7):H994-H1001.
[4]Balser JR.Structure and function of the cardiac sodium channels[J].Cardiovasc Res,1999,42(2):327-338.
[5]Remme CA.Cardiac sodium channelopathy associated with SCN5A mutations: electrophysiological,molecular and genetic aspects[J].J Physiol,2013,591(17):4099-4116.
[6]Zhang J,Chen Y,Yang J,etal.Electrophysiological and trafficking defects of the SCN5A T353I mutation in Brugada syndrome are rescued by alpha-allocryptopine[J].Eur J Pharmacol,2015,746:333-343.[7]Brugada J,Brugada P.Further characterization of the syndrome of right bundle branch block,ST segment elevation,and sudden cardiac death[J].J Cardiovasc Electrophysiol,1997,8(3)325-331.
[8]Priori SG,Napolitano C,Gasparini M,etal.Clinical and genetic heterogeneity of right bundle branch block and ST-segment elevation syndrome:A prospective evaluation of 52 families[J].Circulation,2000,102(20):2509-2515.
[9]Tan BY,Yong RY,Barajas-Martinez H,etal.A Brugada syndrome proband with compound heterozygote SCN5A mutations identified from a Chinese family in Singapore[J].Europace,2015,pii:euv058.
基金项目:国家自然科学基金-中加合作项目(81161120549);西安交通大学生物医学共享平台建设资助项目(2015FWPT-14)
作者简介:倪磊,女,1965-11生,本科,实验师,E-mail:nilei@xjtu.edu.cn
收稿日期:2016-05-12
中图分类号:R596.1
文献标志码:A
文章编号:1007-6611(2016)07-0585-04
DOI:10.13753/j.issn.1007-6611.2016.07.001
Construction of cell model of the SCN5A gene-L812Q mutation and its celluar localization
NI Lei, XU Dehui, LIU Liying, WANG Aiying, WANG Lumin*
(KeyLaboratoryofEnvironmentandGenesRelatedtoDiseases,MinistryofEducation,DepartmentofCellBiologyandGenetics,Xi’anJiaotongUniversityCollegeofMedicine,Xi’an710061,China;*Correspondingauthor,E-mail:wanglumin1@mail.xjtu.edu.cn)
Abstract:ObjectiveTo establish the cell model of the SCN5A gene-L812Q mutation and to explore its cell localization.MethodsThe overlapping derivative PCR was used to construct the L812Q mutation of SCN5A gene, and the L812Q of SCN5A gene was cloned into pMD19-T simple vector. Furthermore,L812Q was inserted into the pEGFP-C1-hH1 vector between the EcoR Ⅰ and ACC Ⅰ restriction enzyme sites and then verified by sequencing. The pEGFP-C1-hH1-L812Q and pEGFP-C1-hH1 vector were transfected into HEK293 cells respectively, the cell location of L812Q mutation was verified using immunofluorescence assay. The pEGFP-C1-hH1, pEGFP-C1-hH1-L812Q and pEGFP-C1-hH1+pEGFP-C1-hH1- L812Q vector were transfected into HEK293 cells respectively, and then the expression of L812Q was determined by Western blot.ResultsThe pEGFP-C1-hH1-L812Q expression vector was successfully constructed. Wild type SCN5A was mainly located on the cell membrane and mutant type SCN5A was located in the cytoplasm. Western blot results showed that the expression level of L812Q mutation was higher than that of wild type in cytoplasm.ConclusionThe pEGFP-C1-hH1-L812Q expression vector is successfully constructed. The L812Q mutant type of SCN5A gene is located in the cytoplasm.
Key words:Brugada syndrome;SCN5A gene;gene mutation;celluar localization

