L-核糖的生物合成及其在药物中的应用
王 静,武首香
(1.天津市轻工业化学研究所有限公司,天津 300350;2.天津现代职业技术学院,天津 300350)
L-核糖的生物合成及其在药物中的应用
王静1,2,武首香2
(1.天津市轻工业化学研究所有限公司,天津 300350;2.天津现代职业技术学院,天津 300350)
摘要:L-核糖是一种重要的药物中间体。综述了以核糖醇及L-阿拉伯糖为原料的L-核糖的生物合成方法,介绍了L-核糖在L-核苷类药物、糖缀合物、寡核苷酸中的应用进展。
关键词:L-核糖;生物合成;L-核苷类药物;糖缀合物;寡核苷酸
核糖是一种典型的五碳糖,是与生物遗传相关的重要稀少糖类,其在生理上具有十分特殊的作用,是各种核糖核酸、核苷酸辅酶、ATP及NADP的组成成分。L-核糖是D-核糖的手性对映异构体,在自然界中并不存在,一般只能通过合成的方法得到[1],其分子结构见图1。
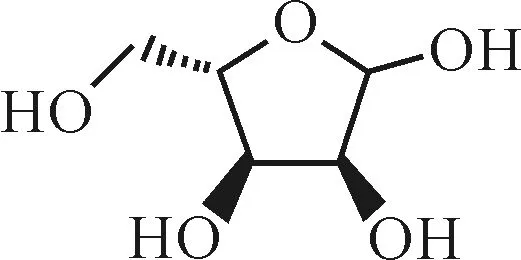
图1 L-核糖的分子结构1 The molecular structure of L-ribose
合成L-核糖属于国际上功能糖领域的尖端技术,目前主要有化学合成法与生物合成法两种。化学合成法路线繁杂,所需试剂昂贵,副产物多,不利于L-核糖分离,最终产率不高,且存在环境污染等问题[2];与化学合成法相比,生物合成法以天然糖为原料,生产条件温和,副产物少,利于L-核糖的分离和回收再利用,绿色环保,更具工业化应用前景。
1L-核糖的生物合成
目前,生物合成法主要是以核糖醇及L-阿拉伯糖为原料,经酶催化合成L-核糖。
1.1以核糖醇为原料合成L-核糖
1999年,Kawaguchi等[3]报道了L-核糖异构酶的制备,使得以核糖醇为原料合成L-核糖得以实现。核糖醇可经两种途径合成L-核糖,一种是由微生物细胞先将核糖醇转化为L-核酮糖,再经L-核糖异构酶(L-RI)催化生成L-核糖(图2)。这种方法主要由Izumori课题组[4-5]提出,利用醋酸杆菌将核糖醇转化为L-核酮糖,再通过大肠杆菌表达来源于不动杆菌DL-28的L-RI使L-核酮糖转化为L-核糖,转化达到平衡时,L-核糖与L-核酮糖之比为70∶30。随后,Izumori等[6]又发现了源于解鸟氨酸拉乌尔菌MB426的L-RI,与DL-28的L-RI相比,其热稳定性更好,相同条件下,温度可提高15 ℃。核糖醇市场价格贵且较难从天然物质中分离得到,因此该法生产L-核糖的成本较高。为解决这一问题,Kawaguchi等[7]在该法的基础上,以价格相对较低的葡萄糖为原料,经真菌类丝孢酵母发酵生产核糖醇后,再用葡萄糖杆菌的细胞和L-RI将核糖醇分两步转化为L-核糖,反应24 h后,1 L发酵液中可含39.1 g L-核糖、16.0 g L-核酮糖和7.0 g二羟基丙酮,有效地降低了生产成本,使L-核糖的工业化生产成为可能。
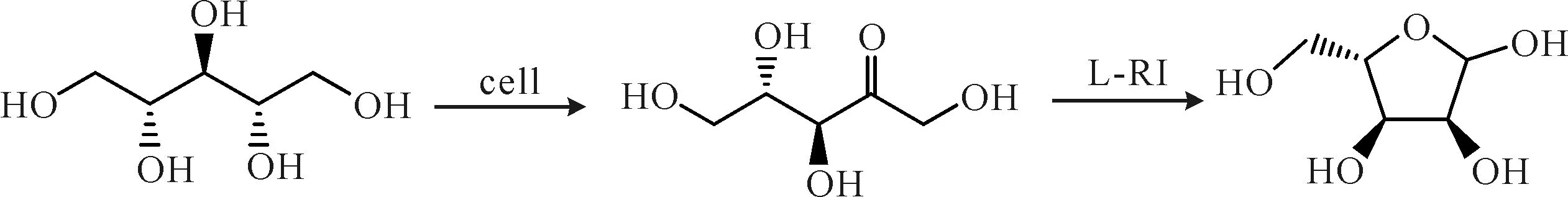
图2 两步法核糖醇转化L-核糖Fig.2 Two-step conversion of L-ribose from ribitol
Woodyer等[8]提出了另一种新的生物合成途径(图3),即通过大肠杆菌表达来自于芹菜籽中的甘露糖醇-1-脱氢酶(MDH),可将核糖醇直接转化为L-核糖,100 g·L-1核糖醇72 h转化率可达55%,远高于其它生物合成法。但该法在诱导过程中需改变温度及使用昂贵的诱导剂异丙基-β-D-1-硫代半乳糖苷,因而限制了其发展。为解决这些问题,Woodyer课题组[9]展开了深入研究,在原有的基础上采取易错聚合酶链反应(error-prone PCR)使大肠杆菌基因突变,并表达来自于芹菜籽中的MDH,改善了MDH的热稳定性和活性,同时提高了L-核糖产率。
1.2以L-阿拉伯糖为原料合成L-核糖
相比核糖醇,L-阿拉伯糖是一种来源丰富、价格低廉的原料,其液体形式的市场价仅为0.1美元·kg-1,而L-核糖市场价大约为500美元·kg-1[10],因此,以L-阿拉伯糖为原料合成L-核糖是目前最可能实现工业化生产的一种方法。L-阿拉伯糖转化为L-核糖主要有两种路线:一种是Helanto等[11]利用L-阿拉伯糖异构酶(L-AI)和不同酶源(大肠杆菌和植物乳杆菌)的L-RI催化合成L-核糖,转化率均为20%左右;另一种是利用L-AI和甘露糖-6-磷酸异构酶(MPI)催化得到L-核糖,其产率高于前一途径。如图4所示。
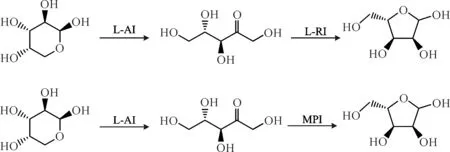
图4 L-阿拉伯糖转化L-核糖的两种路线Fig.4 Two routes of conversion of L-ribose from L-arabinose
Yeom等[12]对MPI展开了深入研究,将从枯草芽孢杆菌获得的MPI基因转化到大肠杆菌中诱导表达,得到的MPI表现出对L-核酮糖的高度选择特异性,L-核酮糖的单步反应最高转化率达71%,远远高于L-RI。在此基础上,获得了R142N突变体MPI,L-核糖产率是野生型MPI的1.5倍[13]。Lim等[14]从热脱硝芽孢杆菌中获得三点组合突变体MPI(W17Q-N90A-L129F),酶的最高催化效率可达1 120 L·mmol-1·s-1,L-核糖产率可达213 g·L-1·h-1。Kim等[15]将源于热脱硝芽孢杆菌的L-AI和MPI同时转化到大肠杆菌中诱导表达,通过固定细胞催化L-阿拉伯糖转化为L-核糖,转化率达33%,是此途径转化率报道的最高值。
目前,生产成本较高和产率较低是制约L-核糖进一步工业化发展的主要瓶颈,而解决以上问题的关键是催化所用的酶,因此生物合成法目前的研究热点主要集中在热稳定性好、成本低、高产酶的菌株的开发和异构酶的表征研究[10,16-18],以期实现低成本L-核糖的规模化生产。
2L-核糖在药物中的应用
L-核糖可代替D-核糖导入生物机体中,在细胞内合成L-核糖核酸[19],而L-核糖核酸可在生物机体内被异常细胞利用,通过破坏病毒转录,干扰或终止病毒核酸的合成而具有抗病毒作用[20],或通过干扰肿瘤DNA的合成,影响核酸的转录过程,抑制蛋白质的合成,从而达到治疗肿瘤的效果,因此,L-核糖的衍生物在临床上可用作治疗病毒和肿瘤的药物。
2.1L-核糖在L-核苷类药物中的应用
20世纪90年代,L-核苷类化合物被证实了在抗肝炎B病毒(HBV)、肝炎C病毒(HCV)、肝炎D病毒(HDV)、人类疱疹病毒第四型病毒(EBV)、巨细胞病毒(CMV)等方面的强大潜能[21-22]。目前已进入临床阶段的可由L-核糖合成的L-核苷类药物见图5。

图5 由L-核糖制备的L-核苷类药物Fig.5 L-Nucleosides medicine prepared from L-ribose
克拉夫定即氟代替比夫定,是由University of Georgia 和Yale University 开发的一种抗HBV的长效制剂,目前处于Ⅲ期临床阶段。1995年,Chu等[23]以L-核糖为起始原料首次合成了克拉夫定,并通过研究其对2.2.15、H1、MT2、CEM细胞的作用,发现克拉夫定对HBV和HDV具有高度的抗性且副作用小。随后,通过改变尿嘧啶和胸腺嘧啶的取代基,合成了一系列克拉夫定类似物,研究发现,仅2种嘧啶衍生物2′-脱氧-2′-氟代-β-阿拉伯呋喃糖基胞嘧啶(L-FAC)和2′-脱氧-2′-氟代-5-碘-β-阿拉伯呋喃糖基胞嘧啶(L-FIAC)具有较强的抗HBV活性,但活性远远低于克拉夫定[24],其结构见图6。
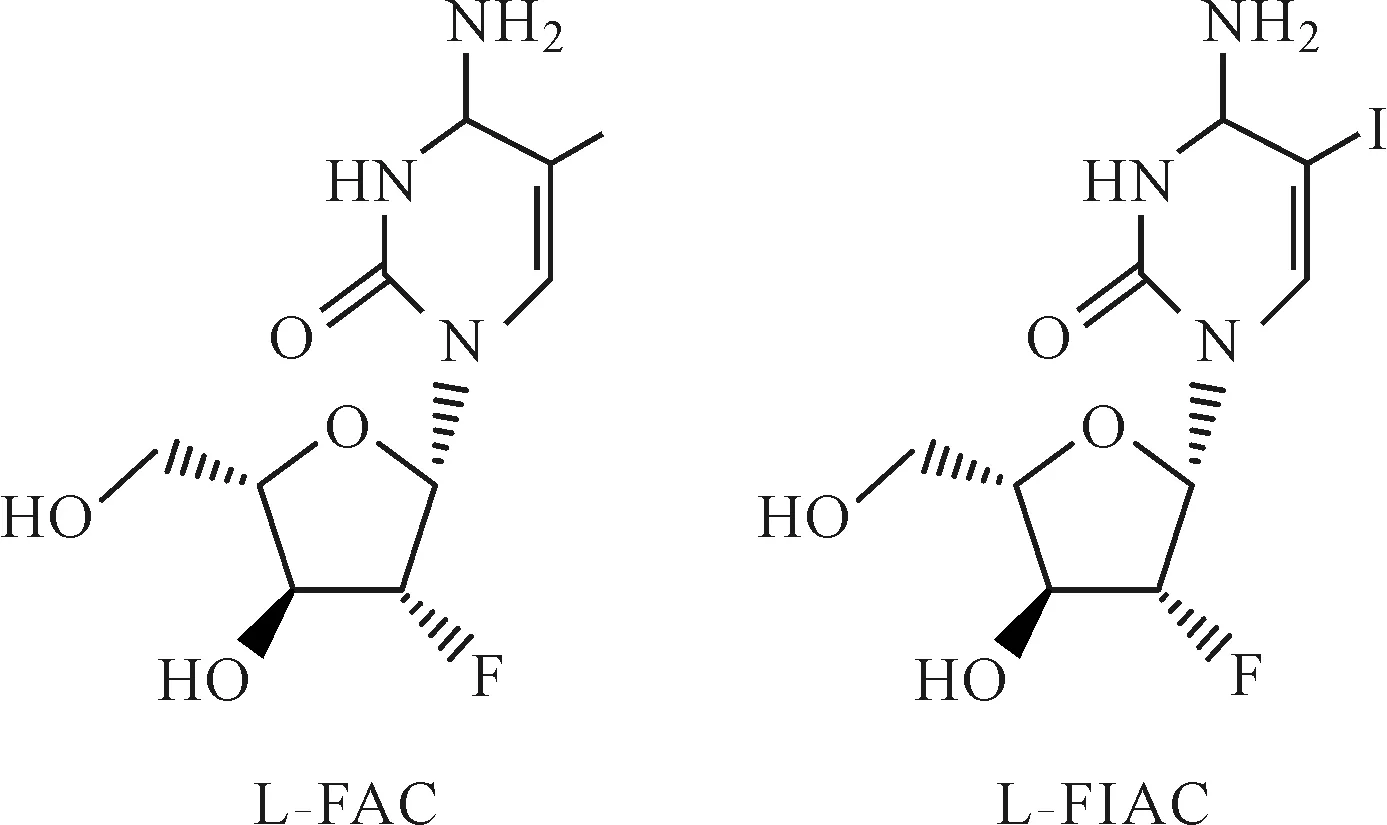
图6 新型L-核苷类化合物结构Fig.6 The structure of the new L-nucleosides
Koszalka等[25]开发了一种抗CMV药物马里巴韦,该药物具有更高的抗巨细胞病毒潜力,细胞毒性小且安全性高,对CMV病毒抗性专一,目前处于Ⅲ期临床阶段。
左利巴韦林是利巴韦林的左旋异构体,是一种抗HCV药物,与目前使用的利巴韦林相比具有更好的抗HCV活性和更高的安全性。但临床研究发现其口服生物利用度较低[26]。Huang等[27]将左利巴韦林与缬氨酸进一步反应,酯化得到R1518,提高了其口服生物利用度。目前,左利巴韦林处于Ⅲ期临床阶段,R1518处于Ⅱ期临床阶段。
2.2L-核糖在糖缀合物中的应用
糖缀合物是指糖与蛋白质、多肽、脂质、核酸和抗体等生物分子以及其它小分子以共价键相互连接而形成的化合物,具有多种生物功能,在医药领域逐步得到应用,如研究发现地洋黄毒苷不仅可以治疗心血管疾病,还具有抗癌活性。Thorson等[28]通过L-核糖修饰地洋黄毒苷得到一种地洋黄毒苷类似物,研究发现其对人体癌细胞和肿瘤都具有细胞毒活性,其结构见图7。
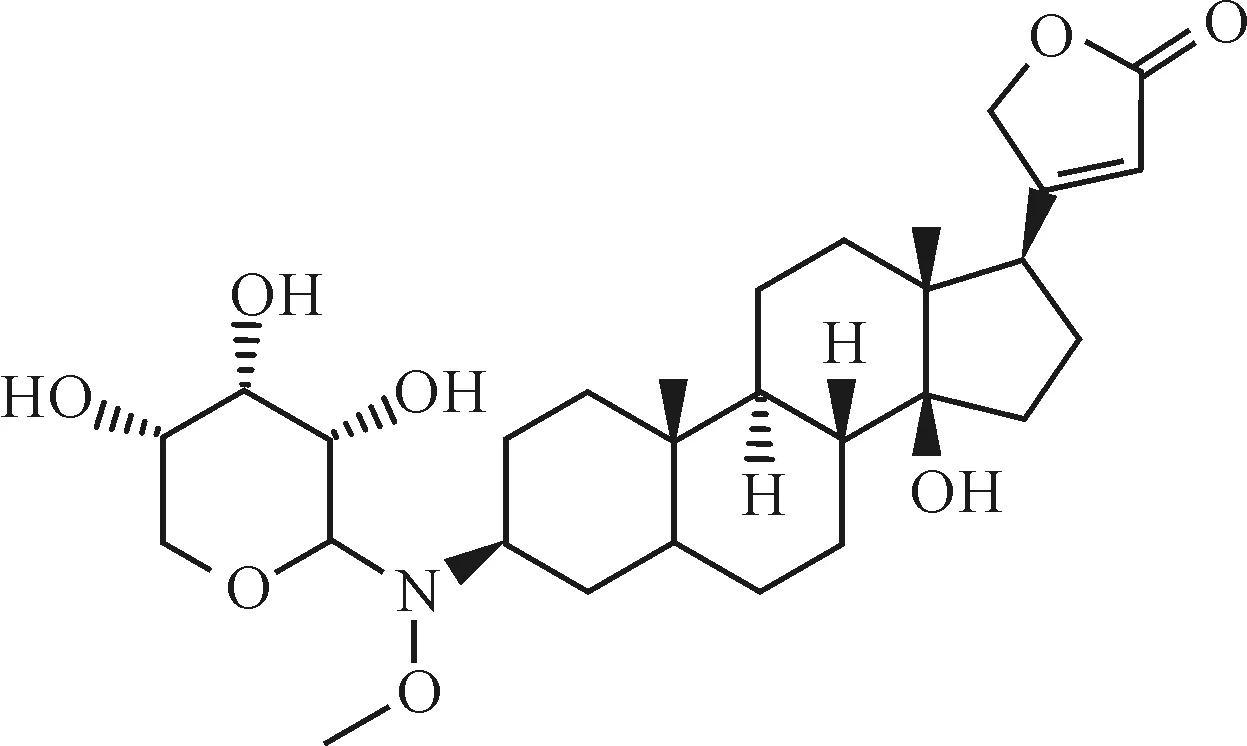
图7 L-核糖修饰的地洋黄毒苷类似物Fig.7 Digitoxin analogues modified by L-ribose
2.3L-核糖在寡核苷酸中的应用
寡核苷酸是一类只有20个以下碱基的短链核苷酸的总称。调控寡核苷酸用于抑制RNA片段,防止其翻译成蛋白,在抑制癌细胞活动方面能起一定的作用。早期,L-核糖被应用在寡核苷酸领域主要是为了研究RNA的结构和生物功能[29]。随着寡核苷酸在临床药物中的应用,发现寡核苷酸对核苷酶的耐受性较差,其应用受到限制。而以L-核糖为起始原料合成的L-RNA寡核苷酸具有较好的核苷酶耐受性,避免了其在未到达体内病灶时就被核苷酶降解[30],从而扩宽了L-核糖在寡核苷酸上的应用。
3结语
在L-核糖的合成方法中,生物合成法是一种绿色方法,对环境污染小,具有化学合成法所无法比拟的优越性,发展前景诱人。随着低毒高活性的L-核苷类药物、寡核苷酸等的生产和新药研发的需求,L-核糖的需求量将日益增多,其生物合成研究也将取得更大的进展。
参考文献:
[1]詹伊婧,徐铮,许露,等.L-核糖的生产研究进展[J].生物加工过程,2013,11(5):74-78.
[2]张卫红,冯亚青,战佩英.L-核糖的合成研究进展[J].有机化学,2002,22(3):153-158.
[3]KAWAGUCHI T,HARA M,UEDA M.Production of L-ribose:JP11215996[P].1999-10-08.
[4]AHMED Z,SHIMONISHI T,BHUIYAN S H,et al.Biochemical pre-paration of L-ribose and L-arabinose from ribitol: a new approach[J].Journal of Bioscience and Bioengineering,1999,88(4):444-448.
[5]MIZANUR R M,TAKATA G,IZUMORI K.Cloning and characterization of a novel gene encoding L-ribose isomerase fromAcinetobactersp.Strain DL-28 inEscherichiacoli[J].Biochimica et Biophysica Acta (BBA):Gene Structure and Expression,2001,1521(1/2/3):141-145.
[6]IZUMORI K,MORIMOTO K,TAKATA G,et al.Thermostable L-ribose isomerase and method for producting same and use of same:US8227232[P].2012-07-24.
[7]KAWAGUCHI T,HARA M,UEDA M.Process for producing L-ribose:US6348326[P].2002-02-19.
[8]WOODYER R D,WYMER N J,RACINE F M,et al.Efficient production of L-ribose with a recombinantEscherichiacolibiocatalyst[J].Applied and Environmenta Microbiology AEM,2008,74(10):2967-2975.
[9]CHRIST T N,DEWEESE K A,WOODYER R D.Directed evolution toward improved production of L-ribose from ribitol[J].Combinatorial Chemistry and High Throughput Screening,2010,13(4):302-308.
[10]XU Z,LI S,FENG X H,et al.L-Arabinose isomerase and its use for biotechnological production of rare sugars[J].Applied Microbiology Biotechnology,2014,98(21):8869-8878.
[11]HELANTO M,KIVIHARJU K,GRANSTROM T,et al.Biotechnological production of L-ribose from L-arabinose[J].Applied Microbiology and Biotechnology,2009,83(1):77-83.
[12]YEOM S J,JI J H,KIM N H,et al.Substrate specificity of a mannose-6-phosphate isomerase fromBacillussubtilisand its application in the production of L-ribose[J].Applied and Environmenta Microbiology,2009,75(14):4705-4710.
[13]YEOM S J,SEO E S,KIM B N,et al.Characterization of a mannose-6-phosphate isomerase fromThermusthermophilesand increased L-ribose production by its R142N mutant[J].Applied and Environmental Microbiology,2011,77(3):762-767.
[14]LIM Y R,YEOM S J,OH D K.Production of L-ribose from L-ribulose by a triple-site variant of mannose-6-phosphate isomerase fromGeobacillusthermodenitrificans[J].Applied and Environmental Microbiology,2012,78(11/12):3880-3884.
[15]KIM K R,SEO E S,OH D K.L-Ribose production from L-arabinose by immobilized recombinantEscherichiacolico-expressing the L-arabinose isomerase and mannose-6-phosphate isomerase genes fromGeobacillusthermodenitrificans[J].Applied Bioche-mistry and Biotechnology,2014,172(1):275-288.
[16]YOSHIDA H,YOSHIHARA A,TERAOKA M,et al.X-Ray s-tructure of a novel L-ribose isomerase acting on a non-natural sugar L-ribose as its ideal substrate[J].FEBS Journal,2014,281(14):3150-3164.
[17]MORIMOTO K,TERAMI Y,MAEDA Y,et al.Cloning and characterization of the L-ribose isomerase gene fromCellulo-monasparahominisMB426[J].Journal of Bioscience and Bioengineering,2013,115(4):377-381.
[18]TERAMI Y,YOSHIDA H,UECHI K,et al.Essentiality of tetramer formation ofCellulomonasparahominisL-ribose isomerase involved in novel L-ribose metabolic pathway[J].Applied Microbiology & Biotechnology,2015,99(15):6303-6313.
[19]AKAGI M,OMAE D,TAMURA Y,et al.A practical synthesis of L-ribose[J].Chemical and Pharmaceutical Bulletin,2002,50(6):866-868.
[20]CASEY J L,KORBA B E,COTE B G,et al.Method of treating hepatitis delta virus infection:US6670342[P].2003-12-30.
[21]GUMINA G,SONG G Y,CHU C K.L-Nucleoside as chemotherapeutic agent[J].FEMS Microbiology Letters,2001,202(1):9-15.
[22]BEERENS K,DESMET T,SOETAERT W.Enzymes for the biocatalytic production of sugars[J].Journal of Industrial Microbiology Biotechnology,2012,39(6):823-834.
[23]CHU C K,MA T,SHANMUGANATHAN K,et al.Antimicrobial agents and chemotherapy[J].Antimicrobial Agents and Chemotherapy,1995,39(4):979-981.
[24]MA T,BALAKRISHNA P S,ZHU Y L,et al.Structure-activity relationships of 1-(2-deoxy-2-fluoro-beta-L-arabino-furanosyl)pyrimidine nucleosides as anti-hepatitis B virus agents[J].Journal of Medicinal Chemistry,1996,39(14):2835-2843.
[25]KOSZALKA G W,CHAMBERLAIN S D,HARVEY R J,et al.Benzimidazoles for the treatment of human cytomegalovirus [J].Antiviral Research,1996,30(1):43-44.
[26]TAM R C,RAMASAMY K,BARD J,et al.The ribavirin analog ICN 17261 demonstrates reduced toxicity and antiviral effects with retention of both immunomodulatory activity and reduction of hepatitis-induced serum alanine aminotransferase levels[J].Antimicrobial Agents and Chemotherapy,2000,44(5):1276-1283.
[27]HUANG Y,OSTROWITZKI S,HILL G,et al.Single- and multiple-dose pharmacokinetics of levovirin valinate hydrochloride (R1518) in healthy volunteers[J].Journal of Clinical Pharmacology,2005,45(5):578-588.
[28]THORSON J S,LANGENHAN J M.Neoglycorandomization and digitoxin analogs:US20100256078[P].2010-08-07.
[29]van BOECKEL C A A,VISSER G M,HEGSTROM R A,et al.Amplification of chirality based upon the association of nucleic acid srands of opposite handedness[J].Journal of Molecular Evolution,1978,25(2):100-105.
[30]OKANO K.Synthesis and pharmaceutical application of L-ribose[J].Tetrahedron,2009,65(10):1937-1949.
基金项目:天津市科技计划项目(15YFFCTG00130)
收稿日期:2016-03-17
作者简介:王静(1978-),女,辽宁沈阳人,博士,副教授,研究方向:精细化学品合成与应用,E-mail:wangjing-1110@163.com。
doi:10.3969/j.issn.1672-5425.2016.07.002
中图分类号:TQ 464.6
文献标识码:A
文章编号:1672-5425(2016)07-0007-04
Biosynthesis of L-Ribose and Its Application in Pharmaceuticals
WANG Jing1,2,WU Shou-xiang2
(1.TianjinLightIndustryChemicalResearchInstituteCo.,Ltd.,Tianjin300350,China;2.TianjinModernVocationalTechnologyCollege,Tianjin300350,China)
Abstract:L-Ribose is an important pharmaceutical intermediate.The biosynthesis methods for L-ribose with ribitol or L-arabinose as a raw material were reviewed,and its applications in L-nucleosides medicine,glycoconjugates and oligonucleotides were introduced.
Keywords:L-ribose;biosynthesis;L-nucleosides medicine;glycoconjugate;oligonucleotide
王静,武首香.L-核糖的生物合成及其在药物中的应用[J].化学与生物工程,2016,33(7):7-10,14.

