湿地土壤产纤维素降解菌株的筛选及其性质研究
罗春良,张 琇,徐小春
(北方民族大学生物科学与工程学院,宁夏 银川 750021)
湿地土壤产纤维素降解菌株的筛选及其性质研究
罗春良,张琇,徐小春
(北方民族大学生物科学与工程学院,宁夏 银川 750021)
摘要:采用稀释涂平板法从宁夏湿地土壤样品中筛选出一株纤维素降解活力较高的菌株C6-2,经鉴定该菌株为烟曲霉菌(Aspergillus fumigates),对菌株C6-2发酵产酶条件及其所产酶的部分酶学性质进行了研究。结果表明,菌株C6-2的最适培养温度为30 ℃,该菌株能在以微晶纤维素或羧甲基纤维素钠或小麦秸秆为唯一碳源的培养基中生长,并可产生具有较好热稳定性的羧甲基纤维素酶、木聚糖酶和葡聚糖酶。
关键词:湿地土壤;纤维素降解菌;筛选;烟曲霉菌
以农作物秸秆等木质纤维素[1]原料开发纤维素乙醇等清洁能源是解决能源危机的重要途径。纤维素乙醇是环境友好型生物质燃料[2],可通过纤维素酶、半纤维素酶转化木质纤维素得到。虽然纤维素酶和半纤维素酶已应用于工业中,但酶解效率低仍是木质纤维素生产第二代燃料乙醇的瓶颈[3-6]。纤维素酶来源非常广泛,原生动物、微生物(细菌、真菌、放线菌等)都具有降解纤维素或合成、分泌纤维素的能力。其中微生物的种类丰富、分布广泛,是纤维素酶、半纤维素酶的重要来源[2]。微生物降解木质纤维素主要依靠自身产生的纤维素酶和半纤维素酶[7]。湿地生态系统蕴藏着丰富的微生物资源[8-9]。但从湿地生态系统分离筛选纤维素酶产生菌鲜有报道。
宁夏气候干燥,降雨量少,土壤pH值呈弱碱性,湿地生态系统具有独特的环境特点,土壤微生物具有独特的适应性。鉴于此,作者采集宁夏银川阅海国家湿地公园和银川沙湖景区的湿地土壤,通过稀释涂平板法筛选获得纤维素降解菌株,并选择其中一株进行了发酵培养测试和菌株鉴定,拟为纤维素酶资源的开发利用提供参考。
1实验
1.1土壤样品采集
土壤样品采集于银川阅海国家湿地公园芦苇荡中含有腐烂芦苇秸秆的土壤以及银川沙湖景区芦苇荡中砂质土壤和含有腐烂芦苇秸秆的土壤,土壤样品采集完毕后保存于4 ℃冰箱,备用。
1.2小麦秸秆样品的制备
小麦秸秆采集于北方民族大学校园北侧1km处的小麦田,自然晾干后用粉碎机粉碎至粒径约为1mm,再依次用自来水、蒸馏水清洗、过滤,除去小麦秸秆中的灰尘。清洗后的小麦秸秆置于45 ℃烘箱中烘干,再置于14%氨水(固液比为1∶10)中于70 ℃水浴锅中密闭浸泡18h,然后用蒸馏水反复浸泡冲洗小麦秸秆至清洗液pH值为中性,即得到小麦秸秆样品。
1.3培养基
产酶菌株筛选液体培养基(g·L-1):(NH4)2SO45,KH2PO41,MgSO4·7H2O0.5,FeSO4·7H2O0.01,CaCl20.1,小麦秸秆10,pH=5.0。固体培养基加入20g·L-1的琼脂粉。
羧甲基纤维素钠-刚果红固体培养基(g·L-1):羧甲基纤维素钠2,KH2PO41,MgSO4·7H2O0.5,(NH4)2SO42,NaCl0.5,刚果红0.2,明胶2,琼脂15,pH=7.3。
赫奇逊氏无机盐培养基[10](g·L-1):KH2PO41,NaCl0.1,MgSO4·7H2O0.3,NaNO32.5,FeCl30.01,CaCl20.1,pH=5.0。
滤纸条培养基:40mL赫奇逊氏无机盐培养基中加入1条去淀粉新华滤纸(1cm×6cm)后装于100mL三角瓶中,121 ℃灭菌20min。
发酵培养基(g·L-1):蛋白胨3,酵母粉0.5,(NH4)2SO42,KH2PO44,MgSO4·7H2O0.3,CaCl2·2H2O0.3,羧甲基纤维素钠2,pH=5.0。
发酵诱导培养基(g·L-1):蛋白胨3,酵母粉 0.5,(NH4)2SO42,KH2PO44,MgSO4·7H2O0.3,CaCl2·2H2O0.3,小麦秸秆20,吐温20 0.2,pH=5.0。
1.4纤维素降解菌的筛选
在超净工作台中,按无菌操作程序,取0.5g土壤样品置于100mL无菌三角瓶中,加入30mL无菌水和5~10个灭菌的小玻璃珠,30 ℃、120r·min-1振荡30min,充分混匀得到土壤悬液,在无菌操作台中静置5~10min,采用梯度稀释法将稀释至10-3~10-6的土壤悬液分别涂布于产酶菌株筛选固体培养基平板上,于30 ℃恒温箱培养,每种平板重复2次。
待产酶菌株筛选固体培养基平板上长出菌落,观察菌落大小、颜色、表面皱褶等,挑取形态有差异的菌落置于产酶菌株筛选液体培养基中,于30 ℃、220r·min-1下培养24~48h。再通过菌落划线法将菌液培养于产酶菌株筛选固体培养基平板,纯化菌株,同时将筛选的菌株保藏于20%甘油中。
为验证筛选到的木质纤维素降解菌分泌表达羧甲基纤维素酶、木聚糖酶和葡聚糖酶的特性,将筛选到的80株菌株用无菌牙签点种于羧甲基纤维素钠-刚果红固体培养基上,30 ℃培养箱培养,每隔12h观察并记录水解圈直径及透明度、菌落直径,选取水解圈直径/菌落直径(D)大于2的单菌落进行后续实验。
将筛选得到的菌株接种于发酵培养基中, 30 ℃、220r·min-1下培养,分别测定各菌液的羧甲基纤维素酶、木聚糖酶和葡聚糖酶活力;另将所获单菌落接种于滤纸条培养基中,于30 ℃摇床中30r·min-1培养120h,观察滤纸条降解情况。
1.5纤维素降解菌相关酶活力的测定
纤维素降解菌的羧甲基纤维素酶活力、木聚糖酶活力和葡聚糖酶活力均采用DNS方法测定。所用底物分别为1%(质量分数)的羧甲基纤维素钠、榉木木聚糖和大麦葡聚糖,缓冲液为0.1 mol·L-1的磷酸氢二钠-柠檬酸缓冲液(pH=5.0)。取1 800 μL相应底物和200 μL稀释的发酵液在50 ℃水浴锅中反应10 min,加入3 mL DNS终止反应,煮沸,5 min后冷却至室温,用分光光度计测定540 nm处吸光度(OD540)。将分析纯的葡聚糖和木聚糖按上述方法绘制标准曲线,根据标准曲线计算相关酶的活力。
1.6纤维素降解菌发酵特性和产酶分析
分析筛选菌株的发酵液酶活力及滤纸降解性能,最终选择菌株C6-2作为测试菌株。在三角瓶中利用发酵培养基分别测试以2 g·L-1羧甲基纤维素钠、2 g·L-1微晶纤维素和2 g·L-1小麦秸秆为底物时发酵液中不同酶活力的差异,分析测试不同培养温度下菌株的生长情况和酶活力变化,利用发酵诱导培养基培养菌株C6-2,测试纤维素降解酶的热稳定性。
1.7菌种鉴定
离心收集发酵培养的C6-2菌株菌体,按照真菌基因组DNA提取试剂盒(E.Z.N.A.®Fungal DNA Midi Kit)的说明进行真菌基因组提取,以真菌18S rDNA的通用引物(NS1 5′-GTAGTCATATGCTTGTCTC-3′和NS8 5′-TCCGCAGGTTCACCTACGGA-3′)对菌株C6-2进行PCR 扩增,反应体系(50 μL)为:10×PCR buffer 5 μL,dNTP mixture (2.5 mmol·L-1) 4 μL,Taq 酶(5 U·μL-1) 0.5 μL,NS1(20 μmmol·L-1) 1 μL,NS8(20 μmmol·L-1) 1 μL,基因组DNA(30 ng·μL-1) 1 μL,ddH2O 37.5 μL。
PCR扩增参数为:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳分析。将电泳获得的产物切胶纯化、测序[11]。
2结果与讨论
2.1纤维素降解菌的筛选
通过产酶菌株筛选固体培养基平板共获得具有水解圈的菌株30株,其中D大于2的菌株共18株,其性状见表1。
表1纤维素降解菌株的性状
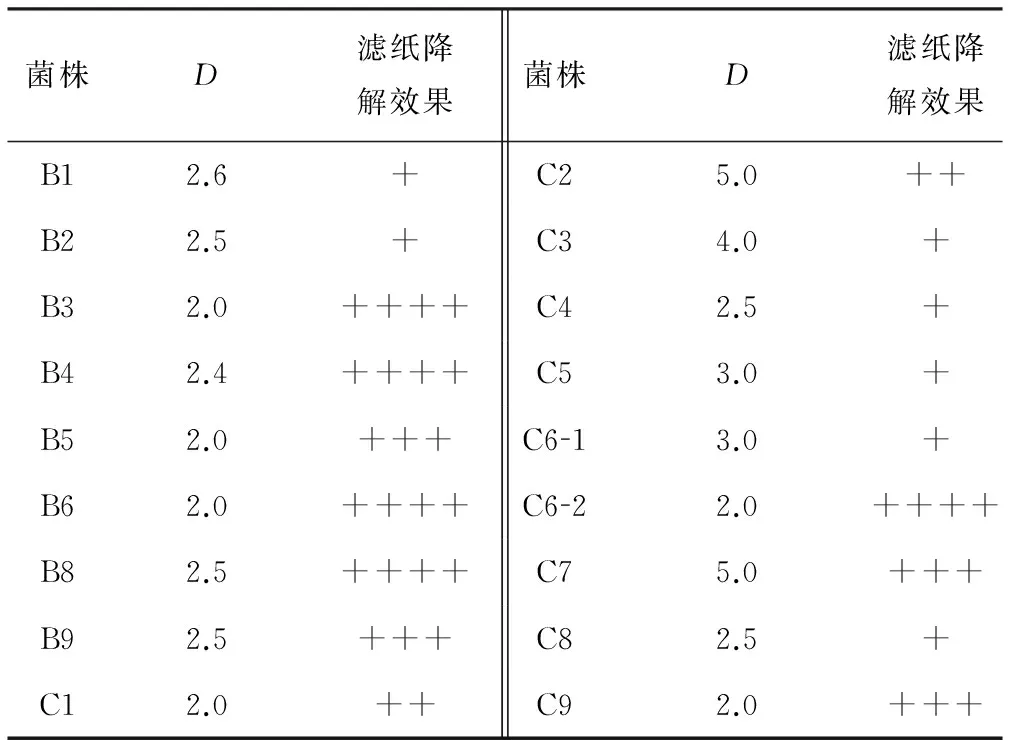
Tab.1 Characteristics of cellulose degradation strains
注:“+”表示滤纸边缘膨胀;“++”表示滤纸整齐膨胀并弯曲;“+++”表示滤纸不定型;“++++”表示滤纸成团糊状。
由表1可知,菌株C6-2能有效降解滤纸。
通过测定18株菌株在发酵培养基中培养120 h的发酵液的木聚糖酶活力、葡聚糖酶活力和羧甲基纤维素酶活力,筛选出9株性状优良的菌株,其发酵培养液的酶活力见表2。
由表2可知,在以2 g·L-1羧甲基纤维素钠为碳源的发酵培养基中培养120 h,菌株C6-2发酵液中的木聚糖酶活力、葡聚糖酶活力和羧甲基纤维素酶活力均明显高于其它菌株。因此,选择菌株C6-2作为纤维素降解菌。
表2性状优良的菌株发酵培养液的酶活力/(IU·mL-1)

Tab.2 Enzyme activities for fermentation broth of strains with good properties/(IU·mL-1)
2.2菌株C6-2的鉴定
以菌株C6-2基因组DNA为模板PCR扩增18S rDNA序列。PCR产物用1%琼脂糖凝胶电泳检测,扩增出的18S rDNA片段为2.3 kb左右。将测序得到的18S rDNA序列使用Blast工具与GenBank序列比对,结果显示,该序列与烟曲霉菌(Aspergillusfumigates)的相似性为99%。
2.3菌株C6-2的发酵特性分析
2.3.1发酵培养基对酶活力的影响
在250 mL三角瓶中分别用含有2 g·L-1的羧甲基纤维素钠、微晶纤维素、小麦秸秆的发酵诱导培养基在30 ℃、220 r·min-1下培养菌株C6-2,每隔24 h取样,测定葡聚糖酶活力和木聚糖酶活力,结果见图1。

图1 发酵培养基对酶活力的影响Fig.1 Effect of fermentation medium on enzyme activity
由图1可知,以微晶纤维素为碳源时发酵液中木聚糖酶活力和葡聚糖酶活力最高;以羧甲基纤维素钠为碳源时葡聚糖酶活力高于以小麦秸秆为碳源时的酶活力;发酵24 h,以小麦秸秆为碳源时木聚糖酶活力最高,以羧甲基纤维素钠为碳源时木聚糖酶活力最低;发酵48 h和72 h,以微晶纤维素为碳源时木聚糖酶活力最高;发酵48 h,以小麦秸秆为碳源时的木聚糖酶活力高于以羧甲基纤维素钠为碳源时的酶活力;发酵72 h,以羧甲基纤维素钠为碳源时的木聚糖酶活力高于以小麦秸秆为碳源时的酶活力。
2.3.2培养温度对酶活力的影响
在250 mL三角瓶中用含有2 g·L-1小麦秸秆的发酵诱导培养基培养菌株C6-2,分别在30 ℃、37 ℃、40 ℃、50 ℃、55 ℃下于200 r·min-1培养,每隔24 h取样,测定葡聚糖酶活力和木聚糖酶活力,结果见图2。

图2 培养温度对酶活力的影响Fig.2 Effect of cultural temperature on enzyme activity
由图2可知,相同培养温度下,葡聚糖酶活力和木聚糖酶活力均随着培养时间的延长而迅速升高,48~72 h的酶活力显著升高;相同培养时间下,随着培养温度的升高,葡聚糖酶活力和木聚糖酶活力总体呈下降趋势。当培养温度为40 ℃时,第48~72 h的葡聚糖酶活力略高于37 ℃时的酶活力。当培养温度为30 ℃、培养时间为72 h时,葡聚糖酶活力和木聚糖酶活力均最高。表明,该菌株的最适培养温度为30 ℃,但30~40 ℃时的酶活力未出现显著下降,说明该菌株能够适应30~40 ℃的培养温度。
2.4菌株C6-2发酵产酶分析
采用发酵诱导培养基在相同条件下培养菌株C6-2,每隔24 h取样,测定羧甲基纤维素酶、葡聚糖酶和木聚糖酶的活力,结果见图3。

图3 菌株C6-2在发酵诱导培养基 发酵培养时的酶活力Fig.3 Enzyme activity of strain C6-2 cultivated in fermentation induction medium
由图3可知,随着培养时间的延长,羧甲基纤维素酶活力、葡聚糖酶活力和木聚糖酶活力均呈升高趋势。在相同条件下,羧甲基纤维素酶活力和葡聚糖酶活力相差不大,而木聚糖酶活力最高。
将培养了72 h的发酵液离心,取上清液在50 ℃水浴锅中分别热处理30 min和60 min,测试相应的酶活力,结果见图4。

图4 菌株C6-2纤维素降解酶的热稳定性Fig.4 Thermostability of cellulose degradation enzyme from strain C6-2
由图4可知,热处理30 min后,葡聚糖酶残余酶活力为65.76%,木聚糖酶残余酶活力为74.25%,羧甲基纤维素酶残余酶活力为72.87%;热处理60 min后,葡聚糖酶、木聚糖酶、羧甲基纤维素酶的残余酶活力依次为61.53%、69.03%和69.64%。表明,菌株C6-2所产纤维素降解酶具有较好的热稳定性。
2.5讨论
通过稀释涂平板法筛选出一株具有良好纤维素降解性能的烟曲霉菌C6-2,该菌株易于培养,能够利用多种木质纤维素底物生长,具有较宽的生长温度范围。
发酵培养实验表明,菌株C6-2能在以微晶纤维素或羧甲基纤维素钠或小麦秸秆为唯一碳源的发酵诱导培养基中生长,同时产生纤维素酶和半纤维素酶。所产羧甲基纤维素酶、木聚糖酶和葡聚糖酶均具有较好的热稳定性。因此,以木质纤维素小麦秸秆基础发酵培养基为原料,同时也作为诱导物,能够开发适应于木质纤维素降解菌的发酵工艺,在降低生产成本的同时也能够生产纤维素、半纤维素降解酶,有助于扩大农作物秸秆的应用范围。
3结论
采用稀释涂平板法从宁夏湿地土壤样品中筛选出一株纤维素降解活力较高的菌株C6-2,经鉴定该菌株为烟曲霉菌(Aspergillusfumigates)。对菌株C6-2发酵产酶条件及其所产酶的部分酶学性质进行了研究。结果表明,菌株C6-2的最适培养温度为30 ℃,该菌株能在以微晶纤维素或羧甲基纤维素钠或小麦秸秆为唯一碳源的培养基中生长,并可产生具有较好热稳定性的羧甲基纤维素酶、木聚糖酶和葡聚糖酶。
参考文献:
[1]李亚军,张英杰,郑红磊,等.农作物秸秆微生物降解的技术研究进展[J].山东化工,2015,44(4):38-40.
[2]李争明,张娟,邓中洋,等.纤维素酶产生菌的筛选、鉴定及发酵产酶条件优化[J].生物技术通报,2015,31(5):146-152.
[3]许凤华,翟珊珊,刘亭亭,等.高效纤维素降解真菌的筛选及粗酶活性[J].安徽农业科学,2015,43(21):7-10.
[4]RITTER C E T,CAMASSOLA M,ZAMPIERI D,et al.Cellulase and xylanase production byPenicilliumechinulatumin submerged media containing cellulose amended with sorbitol[J].Enzyme Research,2013,2013:240219.
[5]LIU G,ZHANG J,BAO J.Cost evaluation of cellulase enzyme for industrial-scale cellulosic ethanol production based on rigorous Aspen Plus modeling[J].Bioprocess Biosyst Eng,2016,39(1):133-140.
[6]SARKAR N,GHOSH S K,BANNERJEE S,et al.Bioethanol production from agricultural wastes:an overview[J].Renewable Energy,2012,37(1):19-27.
[7]刘晓梅,邹亚杰,胡清秀,等.菌渣纤维素降解菌的筛选与鉴定[J].农业环境科学学报,2015,34(7):1384-1391.
[8]钟国祥,姚健,张诚,等.纤维素降解菌的筛选及其酶学性质研究[J].江西农业学报,2015,27(6):85-89.
[9]郑春雨,王光华.湿地生态系统中主要功能微生物研究进展[J].湿地科学,2012,10(2):243-249.
[10]HENDRICKS C W,DOYLE J D,HUGLEY B.A new solid medium for enumerating cellulose-utilizing bacteria in soil[J].Applied and Environmental Microbiology,1995,5(61):2016-2019.
[11]张宇宏.冰川土壤低温脂肪酶基因多样性研究及其基因克隆[D].北京:中国农业科学部,2008.
基金项目:国家民委留学人员择优资助项目,宁夏自然科学基金资助项目(NZ13080),北方民族大学研究生创新项目
收稿日期:2016-03-08
作者简介:罗春良(1985—),男,河北保定人,硕士研究生,研究方向:生物资源利用,E-mail:luochunliang2008@126.com;通讯作者:张琇,博士,教授,E-mail:zhangxiu101@aliyun.com。
doi:10.3969/j.issn.1672-5425.2016.07.010
中图分类号:Q 939.9
文献标识码:A
文章编号:1672-5425(2016)07-0043-05
Screening and Characteristics of Cellulose Degradation Strains from Wetland Soils
LUO Chun-liang,ZHANG Xiu,XU Xiao-chun
(CollegeofBiologicalScienceandEngineering,BeifangUniversityofNationalities,Yinchuan750021,China)
Abstract:Strain C6-2 with high cellulose degradation activity was screened from Ningxia wetland soil samples by a dilution plate method.And it was identified as Aspergillus fumigates.The fermentation conditions and enzymatic properties of the strain C6-2 were studied.Results showed that,the optimal fermentation temperature was 30 ℃.Strain C6-2 could grow in a fermentation medium with wheat avicel or CMC or straw as the only carbon source and produce carboxymethyl cellulase,xylanase and glucanase with good thermostability.
Keywords:wetland soil;cellulose degradation strain;screening;Aspergillus fumigates
罗春良,张琇,徐小春.湿地土壤产纤维素降解菌株的筛选及其性质研究[J].化学与生物工程,2016,33(7):43-47.

