人鱼精蛋白1多态性与汉族男性生育力的相关性分析*
李俊,刘芳,宋亚曼,谭宇哲,杨雪梅,冯艳萍
(河北医科大学第一医院 生殖医学科,河北 石家庄 050031)
论著
人鱼精蛋白1多态性与汉族男性生育力的相关性分析*
李俊,刘芳,宋亚曼,谭宇哲,杨雪梅,冯艳萍
(河北医科大学第一医院 生殖医学科,河北 石家庄 050031)
摘要:目的研究人类鱼精蛋白1(PR M1)C321A多态性与汉族男性生育力的相关性。方法选取174例原发不育男性患者为观察组,172例生育男性为对照组,分别分析两组常规精液参数,采用限制性酶切及DNA测序技术对PR M1 C321A位点进行基因分型。结果不育患者PR M1 C321A位点AA基因型频率(8.05%)显著高于生育男性(2.33%)(P<0.01),分析显示AA基因型与男性不育的遗传易感性明显相关[^OR=4.24(95%CI:1.33,13.51)]。AA基因型可使精子前向运动能力及正常形态比例等参数明显下降,可能是其导致男性不育的主要因素。结论PR M1 C321A多态性改变与汉族男性生育力相关。
关键词:人鱼精蛋白1;单核苷酸多态性;男性不育;遗传易感性
在精子发生的圆形精子细胞期组蛋白被过渡蛋白替换,在随后的长形精子细胞期鱼精蛋白取代过渡蛋白与精子DNA紧密结合。人鱼精蛋白1(Protamine 1,PRM1)、人鱼精蛋白2(Protamine 2,PRM2)分别由位于16p13.3的PRM1、PRM2基因编码,鱼精蛋白在精子DNA凝聚及包装中发挥重要作用,是主要的DNA结合蛋白[1]。研究发现,小鼠敲除鱼精蛋白基因可导致鱼精蛋白表达量减少、精子DNA损伤及功能下降。基因敲除小鼠虽可产生精子,但精子形态异常、活力下降,影响其受精能力[2]。
鉴于鱼精蛋白在精子细胞分化中发挥重要作用,推测其基因序列的改变可导致男性不育。研究发现PRM2 C248T多态性改变与日本男性生育力相关[3],10%的美国男性不育患者可检测出PRM1 G197T位点的多态性改变[4]。但也有研究指出PRM基因多态性位点与男性生育力无明显相关性。TANAKA等[3]发现,PRM基因存在8个多态性位点,其中7个单核苷酸多态性(single nucleotide polymorphism,SNP)位点(PRM1中的A133G、C160A、G320A、C321A、A431G;PRM2基因中的G398C及A473C)在日本生育及不育男性中的分布频率无差异,研究指出PRM1 C321A及PRM2 C248T位点多态性改变与伊朗男性生育力无相关性[1]。
目前尚未见PRM1 C321A位点多态性与汉族男性生育力的相关性研究,为探明该多态性位点对汉族男性生育力的影响,本研究分析PRM1 C321A基因型在生育及不育组男性中的分布频率及不同基因型对常规精液参数的影响。
1 资料与方法
1.1研究对象
选取2013年8月-2014年12月于河北医科大学第一医院生殖医学科就诊患者为研究对象。不育组为排除女方因素,未避孕≥1年未育的男性患者,已知临床因素(如精索静脉曲张、输精管梗阻等)和遗传因素(如染色体异常、Y染色体微缺失等)导致不育的患者除外。生育组(对照组)男性为未借助辅助生殖技术的已育查体患者。实验包括174例不育患者,172例男性对照组患者。
1.2方法
1.2.1精液分析患者禁欲2~7 d手淫法无菌采集精液,按世界卫生组织标准[5]称量精液体积,分析精子形态,精子浓度及前向运动精子比例采用计算机辅助分析方法。
1.2.2PR M1 C321A位点基因型分析应用DNA提取试剂盒由精液标本分离DNA(北京康为世纪生物科技有限公司),正向引物:5'-CAGAGTTCCACCT GCTCACA-3',反向引物:5'-TCCCCTCTCAAGAACA AGGA-3',建立25μl聚合酶链反应(polymerase chain reaction,PCR)体系,包括2μl模板DNA,12.5μl高保真2×Gold Star Taq Master Mix(北京康为世纪生物科技有限公司),正、反向引物各1μl,双蒸水8.5μl。反应条件为:95℃预变性10 min;95℃变性30s,55℃退火30s,72℃延伸1 min,共35个循环;72℃继续延伸5min。扩增产物为514bp,将扩增得到的PCR产物纯化(北京天根生化科技有限公司凝胶纯化试剂盒)后双向测序(上海英潍捷基公司)及酶切(Bst UI酶60℃消化过夜),酶切产物用2%琼脂糖凝胶电泳检测。
1.3统计学方法
采用SPSS 16.0统计软件进行数据分析,χ2检验用来检测SNP位点在检测人群中的分布是否符合哈迪-温伯格定律并检测基因型在不育组及对照组中的分布频率、关联比值比(odds ratio,OR)及95%置信区间(confidence interval,CI),单因素方差分析用于比较不同基因型对常规精子参数的影响,P<0.05为差异有统计学意义。
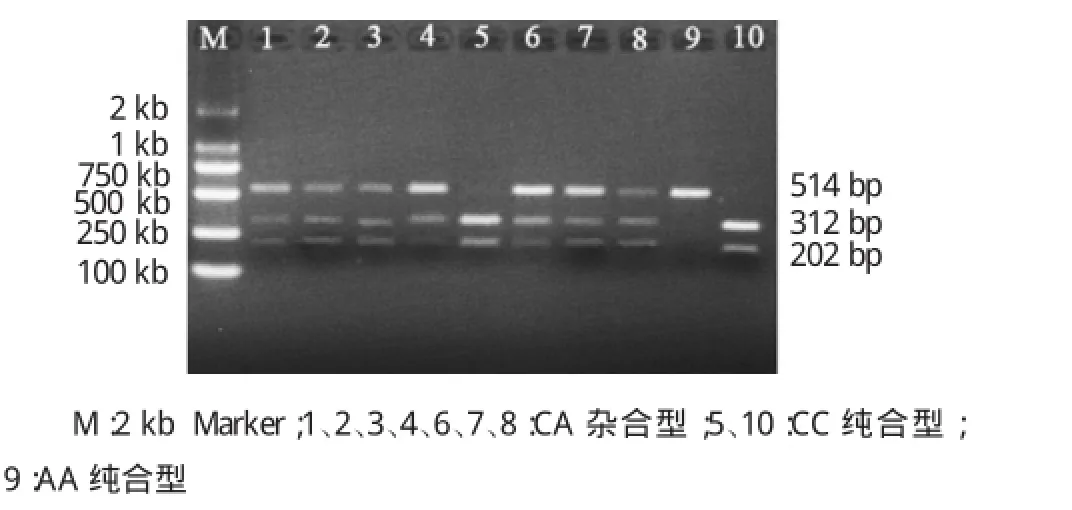
图1 目的片段限制性酶切产物电泳结果
2 结果
2.1PRM1基因C321A位点基因型分析
生育及不育男性组均可检测到CC、CA、AA 3种基因型,限制性酶切及DNA测序结果分别见图1、2。
2.2PRM1基因C321A位点多态性与汉族男性生育力的相关性分析
经检测,PRM1基因C321A位点基因型频率在检测标本中符合哈迪-温伯格平衡定律。不育组男性AA基因型频率为8.05%,高于生育组(2.33%)(P< 0.01),分析表明AA基因型可增加男性不育症的发病风险[^OR=4.24(95%CI:1.33,13.51)]。见表1。
2.3PRM1基因C321A位点多态性对常规精液参数的影响
PRM1基因C321A位点多态性对常规精液参数的影响见表2。AA基因型的前向运动精子比例低于CC基因型(P=0.023),正常精子形态比例亦低于CC基因型(P=0.017),而精子总数在基因型间无差异。箱线图分析亦表明CC基因型前向运动精子比例及正常精子形态比例中位数均高于AA基因型(见图3)。

图2 目的片段PRM1 C321A位点DNA测序结果

表1 生育组及不育组男性PRM1 C321A基因型频率分布 例(%)
表2 不同PRM1 C321A基因型对常规精液参数的影响(±s)

表2 不同PRM1 C321A基因型对常规精液参数的影响(±s)
注:†与CC比较,P<0.05
PRM1C321A基因型正常精子形态比例/% CC 532.41±333.00 43.18±15.11 6.57±3.24 CA 541.65±360.91 40.35±16.32 6.65±3.40 AA 554.80±501.53 30.44±15.10† 3.78±2.11†精子总数/ ×106个前向运动精子比例/%
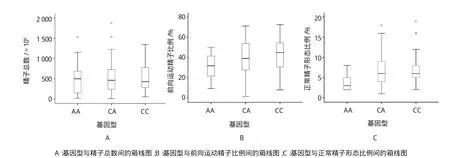
图3 PRM1 C321A基因型与常规精液参数间的箱线图分析
3 讨论
据报道不孕不育患者占已婚夫妇的10%~15%,男性因素造成的不育达50%[6],遗传异常是男性不育的主要因素[7]。鱼精蛋白是精子核中主要的DNA结合蛋白,其基因突变可致精子发生异常、印迹缺陷,诱导精子染色质损伤及DNA断裂,与男性不育密切相关[1]。近年来多项研究探讨鱼精蛋白基因多态性与男性不育的相关性,结果因研究对象遗传背景差异而不同。本文首次分析PRM1 C321A位点与汉族男性生育力的关系。
C321A多态性位点位于PRM1基因编码区,其主要基因型为CC基因型[3]。本研究发现,AA基因型是汉族男性不育的易感基因型,其不育症的发病风险为CC基因型的4.24倍,该结果与先前报道不一致[1,3],研究对象的选择标准及遗传背景差异可能是导致不同结论的原因。FANG等[6]指出由于单一多态性的低显性遗传效应通常取决于与其他多态性位点的相互作用及包括饮食、生活方式等在内的特定环境因素的综合影响,因此遗传变异的影响可能为其他尚未发现的致病因素所掩盖。
研究指出>90%的男性不育是由精液质量差引起的,PRM基因多态性改变可影响常规精液参数。PRM1 C190A位点多态性改变与西班牙男性精子头部异常相关[8],HE等[9]指出PRM1 rs35576928位点多态性改变与汉族男性重度少精症相关。研究发现由PRM1 230A>C、PRM2 298G>C及373C>A组成的ACC单倍型与精子浓度及总数间存在显著连锁不平衡,ACC单倍型精子浓度、总数为非ACC型的2倍[10],说明PRM1/PRM2多态性在调控精子发生中发挥作用。本研究分析PRM1 C321A位点多态性改变对常规精液参数的影响,结果发现各基因型间精子总数无差异,但AA基因型中前向运动精子比例及正常精子形态比例均低于CC基因型,由于前向运动精子及正常形态精子比例是衡量男性生育能力的重要指标[5],因此其可能是AA基因型男性生育力下降的主要因素。
正常精子发生过程中,85%~95%的精子DNA与鱼精蛋白相互结合[11],鱼精蛋白表达异常与精子形态异常、精子总数及活力下降相关[12-13],研究发现,鱼精蛋白基因编码区及非编码区基因的微小改变可导致鱼精蛋白的表达异常[9]。由上推断,C321A位点多态性改变可能引起鱼精蛋白表达量异常,从而影响精子运动能力及正常形态比例,造成男性生育力下降。
综上所述,PRM1 C321A多态性改变与汉族男性生育力相关。AA基因型可使精子前向运动能力及正常形态比例显著降低,可能是导致男性不育的重要原因。
参考文献:
[1]SIASI E,ALEYASIN A,MOWLA J,et al.Association study of six SNPs in PRM1,PRM2 and TNP2 genes in iranian infertile men with idiopathic azoospermia[J].Iran J Reprod Med,2012,10(4): 329-336.
[2]CHO C,JUNG H H,WILLIS W D,et al.Protamine 2 deficiency leads to sperm DNA damage and embryo death in mice[J].Biol Reprod,2003,69(1):211-217.
[3]TANAKA H,MIYAGAWA Y,TSUJIMURA A,et al.Single nucleotide polymorphisms in the protamine-1 and-2 genes of fertile and infertile human male populations[J].Mol Hum Reprod, 2003,9(2):69-73.
[4]IGUCHI N,YANG S,LAMB D J,et al.An SNP in protamine 1:a possible genetic cause of male infertility[J].J Med Genet, 2006,43(4):382-384.
[5]World Health Organization.WHO laboratory mannual for the examination and processing of human semen[M].Cambridge University Press:5th ed,New York,2010.
[6]FANG J,WANG S,WANG H,et al.The Cytochrome P4501A1 gene polymorphisms and idiopathic male infertility risk:a metaanalysis[J].Gene,2014,535(2):93-96.
[7]GE Y Z,XU L W,JIA R P,et al.Association of polymorphisms in estrogen receptors(ESR1 and ESR2)with male infertility:a meta-analysis and systematic review[J].J Assist Reprod Genet, 2014,31(5):601-611.
[8]GAZQUEZ C,ORIOLA J,De MATEO S,et al.A common protamine 1 promoter polymorphism(-190 C->A)correlates with abnormal sperm morphology and increased protamine P1/P2 ratio in infertile patients[J].J Androl,2008,29(5):540-548.
[9]HE X J,RUAN J,DU W D,et al.PRM1 variant rs35576928 (Arg>Ser)is associated with defective spermatogenesis in the Chinese Han population[J].Reprod Bio Med Online,2012,25(6): 627-634.
[10]TUTTELMANN F,KRENKOVA P,ROMER S,et al.A common haplotype of protamine 1 and 2 genes is associated with higher sperm counts[J].Int J Androl,2010,33(1):240-248.
[11]BALHORN R.The protamine family of sperm nuclear proteins[J]. Genome Biol,2007,8(9):227.
[12]UTSUNO H,MIYAMOTO T,OKA K,et al.Morphological alterations in protamine-deficient spermatozoa[J].Hum Reprod, 2014,29(11):2374-2381.
[13]FRANCIS S,YELUMALAI S,JONES C,et al.Aberrant protamine content in sperm and consequential implications for infertility treatment[J].Hum Fertil(Camb),2014,17(2):80-89.
(申海菊编辑)
中图分类号:R 698.2
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.13.009
文章编号:1005-8982(2016)13-0048-04
收稿日期:2015-12-01
*基金项目:河北省人口和计划生育委员会基金(No:2013-A08)
[通信作者]杨雪梅,E-mail:meicherrymissyou@163.com
Association ofPRM1gene polymorphism with male infertility in Chinese Han population*
Jun Li,Fang Liu,Ya-man Song,Yu-zhe Tan,Xue-mei Yang,Yan-ping Feng
(Department of Reproductive Medicine,the First Hospital of Hebei Medical University,Shijiazhuang,Hebei 050031,China)
Abstract:Objective To determine the association of single nucleotide polymorphism(SNP)locus C321A in human protamine 1(PRM1)with male infertility in Chinese Han population.Methods A total of 174 infertile men were recruited as the observation group and 172 fertile men were recruited as the control group. Routine semen analysis was performed.Restricted enzyme digestion and DNA direct sequencing of C321A in PRM1gene of the infertile and fertile men were conducted to identify the genotype of C321A SNP locus. Results The frequency of AA genotype ofPRM1C321A was significantly different between the infertile men (8.05%)and the fertile men(2.33%,P<0.01)and it was associated with increased risk of male infertility (OR^ =4.24;95%CI:1.33,13.51).Moreover,it was discovered that sperm progressive motility as well as normal morphology rate of AA genotype were dramatically decreased compared with that of CC genotype(P<0.05),which would probably lead to infertility.ConclusionsPRM1C321A polymorphism is associated with male infertility as well as routine semen characteristics in Chinese Han population.
Keywords:PRM1;single nucleotide polymorphism;male infertility;genetic susceptibility

