阴囊短暂、轻度热处理对小鼠睾丸应激反应的影响
刘洪茂,穆柯瀚,姬艳丽,2,张 君,张桂彬,刘 路,王 华,徐德祥
◇预防医学研究◇
阴囊短暂、轻度热处理对小鼠睾丸应激反应的影响
刘洪茂1,穆柯瀚1,姬艳丽1,2,张 君3,张桂彬3,刘 路3,王 华3,徐德祥3
目的 探讨单次、短暂、轻度热处理(43℃、15 min)对小鼠睾丸的应激反应。方法 将24只成年ICR雄性小鼠随机分为4组。将热处理组小鼠身体的下1/3部分浸于43℃恒温水浴中15 min,于热处理后0.5、2、6 h取睾丸组织。将对照组小鼠身体的下1/3部分浸入22℃水浴15 min,6 h后取睾丸组织。采用Western blot法检测睾丸总蛋白热休克蛋白32(HO-1)、3-硝基酪氨酸(3-NT)和葡萄糖调节蛋白78(GRP78)的表达;采用免疫组化法检测GRP78的表达。结果 HO-1为热应激的标志物,在热处理后,睾丸HO-1表达显著上调(P<0.01),并呈时间依赖性。3-NT为蛋白质硝化标志物,热处理明显增强睾丸组织蛋白的硝化(P<0.01)。此外,与对照组比较,热处理下调内质网应激标志物GRP78在睾丸中的表达(P<0.05)。结论 单次短暂轻度阴囊热处理明显诱导睾丸组织HO-1和3-NT表达,而下调GRP78表达,提示热应激、硝化应激和内质网应激可能参与了短暂、轻度阴囊热处理诱导的睾丸损伤。
阴囊热应激;睾丸;热应激;硝化应激;内质网应激
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.028.htm l
男性不育是一项亟待解决的重大公共卫生问题。影响男性精液质量下降的因素有很多,其中职业环境与男性不育的相关性已成为公众关注的一项新的研究热点。研究[1]显示高温作业或洗桑拿浴的成年男子生育力明显降低,研究[2]证实阴囊温度略有增加就能够干扰精子发生甚至导致不育,然而目前关于热对男性生殖功能影响的分子机制尚不清楚。研究[3]表明低氧应激和氧化应激在热诱导的睾丸生殖细胞损伤中起重要作用。该研究主要探讨单次、短暂、轻度阴囊热处理(43℃、15 min)对小鼠睾丸热应激、硝化应激和内质网应激的影响。
1 材料与方法
1.1 实验动物 健康清洁级ICR小鼠24只(8周龄、雄性、28~35 g),购自安徽省实验动物中心。小鼠于实验前适应性喂养1周。实验遵循国家科学技术部颁布的《中华人民共和国实验动物管理条例》,尽量减少实验动物使用的数量和减少实验动物的痛苦,禁止虐待动物。
1.2 化学试剂 聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Millipore公司;化学发光增强检测试剂盒购自美国 Pierce公司;热休克蛋白32(heat shock protein 32,HO-1)、3-硝基酪氨酸(3-nitrotyrosine,3-NT)抗体购自美国SantaCruz公司;葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)抗体购自美国Cell Signaling Technology公司;β-actin抗体购自北京博奥森科技有限公司。
1.3 动物处理 24只小鼠随机分为对照组、0.5 h组、2 h组和6 h组。将热处理组小鼠身体的下1/3部分(包括阴囊、后腿、尾巴)浸于43℃恒温水浴中15 min,于热处理后0.5、2、6 h剖杀。将对照组小鼠身体的下1/3部分浸入22℃水浴中15 min,于6 h后剖杀取睾丸组织,采用Western blot法检测睾丸总蛋HO-1、3-NT和GRP78的表达;采用免疫组化法检测睾丸组织GRP78的表达。
1.4 睾丸组织切片 取小鼠一侧完整包膜未破损的睾丸,置于4%MDF液(含30%甲醛、15%乙醇、5%冰乙酸及50%三蒸水)固定。每组分别制备不同小鼠HE染色切片,经无水乙醇脱水、二甲苯透明、石蜡包埋、5μm连续切片、HE染色、光学树脂封片,在光学显微镜下观察睾丸组织病理学变化并拍照。
1.5 TUNEL检测 采用TUNEL方法检测睾丸组织生殖细胞凋亡。每组选取睾丸组织石蜡切片各6张,经二甲苯脱蜡,梯度乙醇水化、浸洗、细胞通透、平衡液反应15 min、TUNEL反应混合液湿盒37℃孵育1 h、浸入2×SSC 15 min以终止反应、浸洗、封闭内源性过氧化物酶,进行酶标记反应30 min,最后用DAB进行显色、苏木精复染、梯度酒精脱水、二甲苯透明和中性树胶封片。经TUNEL染色后凋亡细胞核染成深综色或深褐色。
1.6 W estern blot法检测睾丸组织HO-1、3-NT、GRP78表达 每孔上45μg蛋白,进行垂直电泳(浓缩胶电压50 V,分离胶电压115 V)3 h,再以平行电泳的方式将凝胶中的蛋白条带转移到PVDF膜上。转移有蛋白的 PVDF膜在5%脱脂牛奶中4℃封闭过夜。PVDF膜分别用一抗[β-actin(1∶1 000)、HO-1(1∶1 000)、3-NT(1∶1 000)、GRP78 (1∶1 000)]室温孵育2~3 h。用含0.05%吐温-20的磷酸盐缓冲液溶液洗涤3次,每次10 min,洗涤后的PVDF膜用辣根过氧化物酶标记的二抗孵育2 h。采用增强化学发光试剂盒进行发光检测、压片,胶片用扫描仪扫描后采用IPP软件分析目的条带的光密度值,进行定量分析。Western blot分析中将目的蛋白的表达水平用内参β-actin进行标化,将对照组标化后的比值定为1。
1.7 免疫组化法检查睾丸组织蛋白表达 参考文献[4]:本实验采用免疫组化多聚物(PV-9001)法检测GRP78的表达情况。取睾丸病理切片进行常规脱蜡至水化,用3%H2O2封闭内源性过氧化物酶15 min;将切片放入枸橼酸钠缓冲液(pH 6.0)中,微波加热进行抗原修复,山羊血清封闭处理20 min,一抗GRP78封闭过夜,相应的二抗处理,DAB显色处理,苏木精复染、梯度酒精脱水、二甲苯透明,最后中性树胶封片。在显微镜下观察GRP78的分布及表达情况。
1.8 统计学处理 采用SPSS 17.0软件进行分析,数据以±s表示。采用单因素方差分析检验各组之间的差异有无统计学意义。
2 结果
2.1 热处理对小鼠睾丸组织病理的影响 对照组小鼠睾丸内生精小管内细胞排列紧密,层次均较清晰(图1A)。与对照组比较,热处理所引起的睾丸损伤非常明显,单次热应激处理2 h后睾丸生殖细胞细胞核浓缩(图1B),而热处理后6 h病理改变进一步加重,表现为睾丸组织生精小管间隙增大,生精小管内细胞排列紊乱,细胞核浓缩细胞明显增多,并可见多核巨细胞(图1C)。
2.2 热诱导睾丸生殖细胞凋亡 采用TUNEL法进行凋亡分析。结果显示,对照组TUNEL+生殖细胞很少(图2A1、A2),在热处理后2 h睾丸TUNEL+生殖细胞明显增多(图2B1、B2)。而热处理后6 h TUNEL+生殖细胞进一步增多,且TUNEL+细胞主要为精原细胞和初级精母细胞,含TUNEL+生殖细胞的生精小管数量明显增加(图2C1、C2)。
2.3 热处理对小鼠睾丸HO-1蛋白表达的影响
HO-1是一种重要的热应激蛋白标志物。本研究探讨了单次、短暂、轻度阴囊热处理对小鼠睾丸组织HO-1蛋白表达的影响。结果显示,正常小鼠睾丸组织中也能检测到HO-1蛋白的表达。与对照组比较,热处理能明显上调HO-1蛋白的表达,并呈时间效应关系(F=122.23,P<0.01),见图3。
2.4 热处理对小鼠睾丸3-NT蛋白表达的影响 3-NT是一个特异的蛋白质硝化标志物。本次研究结果表明:单次、短暂、轻度阴囊热处理能够显著诱导睾丸3-NT的表达(F=200.47,P<0.01),见图4,提示热处理能够引起睾丸组织发生硝化应激。
2.5 热处理对小鼠睾丸GRP78表达的影响
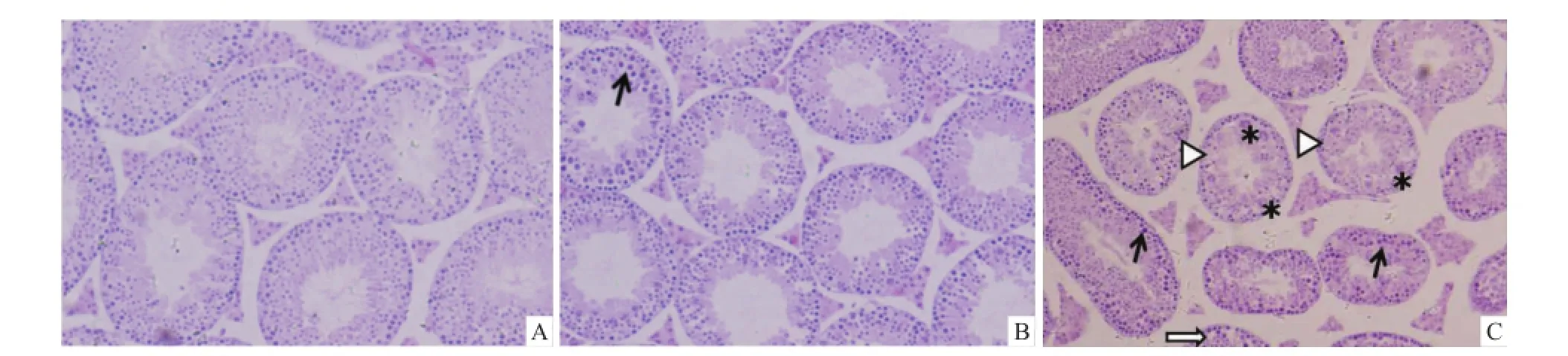
图1 阴囊热处理对小鼠睾丸组织病理学的影响 HE×100A:对照组;B:2 h组;C:6 h组;↑:细胞核浓缩细胞;⇧:支持细胞空泡;*:多核巨细胞;▷:胞质与细胞核消融的细胞
GRP78是一个重要的内质网分子伴侣。采用Western blot法探讨单次、短暂、轻度阴囊热处理对小鼠睾丸组织GRP78蛋白表达的影响。结果显示,与对照组比较,热处理后6 h组GRP78的表达明显降低(F=13.28,P<0.05),见图5。进一步采用免疫组化法分析小鼠睾丸组织GRP78蛋白的表达,结果显示,对照组GRP78主要在精原细胞和初级精母细胞表达,在Sertoli细胞、Leydig细胞、圆形及长形精子细胞中几乎没有 GRP78表达(图6A),而热处理后6 h组GRP78的表达明显降低(图6C),与Western blot结果相一致(图5)。
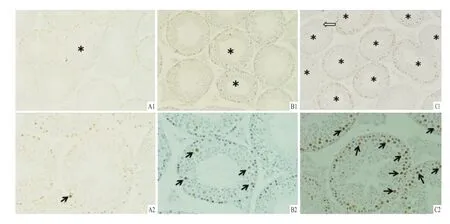
图2 阴囊热处理对小鼠睾丸生殖细胞凋亡的影响 DABA:对照组;B:2 h组;C:6 h组;1:×100;2:×200;↑:TUNEL+生殖细胞;*:含有TUNEL+的生精小管;⇧:多核精细胞


图3 阴囊热处理对睾丸组织 HO-1表达的影响1:对照组;2:0.5 h组;3:2 h组;4:6 h组;与对照组比较:**P <0.01


图4 阴囊热处理对睾丸组织3-NT表达的影响1:对照组;2:0.5 h组;3:2 h组;4:6 h组;与对照组比较:**P <0.01
3 讨论
本研究将小鼠下腹部浸于43℃恒温水浴中15 min,能够引起明显的睾丸病理损伤,诱导睾丸生殖细胞凋亡。本研究进一步探讨了热处理对小鼠睾丸热应激、硝化应激和内质网应激的影响。
HO-1是一种重要的热应激蛋白标志物[5-6],此外HO-1的诱导与氧化应激和低氧应激也有关联。当细胞和组织处于应激状态时,HO-1可作为保护性蛋白被诱导,以对抗各种应激所引起的损伤。本课题组前期研究[7-8]显示,镉显著诱导睾丸组织HO-1的表达。本实验结果显示:阴囊热处理明显上调睾丸HO-1的表达,并具有明显的时间效应关系,提示单次、短暂、轻度阴囊热处理诱导睾丸组织发生热应激反应。实验[6]表明HO-1可以在各种应激损伤中起到保护作用,但也有不同的观点认为HO-1过度表达在一些疾病的发生发展中起了作用。本研究结果表明热处理能明显上调睾丸HO-1的表达,但这种表达具有保护作用还是促进作用目前尚不清楚。
硝化应激指机体内活性氧簇与活性氮簇生成增加导致机体内产生大量硝化能力极强的一类硝化物质,对机体内的一些蛋白质产生硝化作用或者对细胞的核酸物质产生硝化作用,进而引起一些机体的病理变化[9]。蛋白质酪氨酸硝化可以导致一些酶的失活,影响酪氨酸磷酸化调节的信号传导,通过改变细胞的细微结构导致细胞凋亡。3-NT是蛋白质硝化的主要产物,被认为是硝化应激的标志蛋白,在多种疾病中都伴随着3-NT水平的升高[7-8,10]。本研究结果显示,阴囊热处理能够时间依赖性地诱导3-NT的表达,提示热处理引起睾丸组织发生硝化应激。
内质网是细胞内重要的细胞器,蛋白质和脂质合成、加工、折叠和运输均在内质网进行。当细胞内质网受损或蛋白质合成增加即引起内质网应激,诱导未折叠蛋白质反应[11-12]。内质网蛋白质加工和包装需要内质网特异性分子伴侣的协助,其中GRP78是最常见的内质网特异性分子伴侣。本研究显示阴囊热处理能够抑制睾丸组织GRP78的表达,提示热处理引起睾丸组织发生内质网应激。


图5 阴囊热处理对睾丸组织GRP78表达的影响1:对照组;2:0.5 h组;3:2 h组;4:6 h组;与对照组比较:*P<0.05

图6 免疫组化检测睾丸组织中 GRP78的表达分布 PV二步法×100 A:对照组;B:2 h组;C:6 h组
综上所述,单次、短暂、轻度阴囊热处理能够引起睾丸组织发生复杂的应激反应,包括热应激、硝化应激和内质网应激,然而这些应激反应在热诱导的睾丸组织损伤中的作用尚需要进一步探讨。以上研究结果也进一步证实,环境温度与男性生殖健康密切相关,长时间在高温环境下工作的男性应加强保护措施,注意自我防护,避免职业高温因素对男性精液质量产生的不良影响,预防男性不育的发生。
[1] Garolla A,TorinoM,Sartini B,etal.Seminalandmolecularevidence that sauna exposure affects human spermatogenesis[J]. Hum Reprod,2013,28(4):877-85.
[2] Kanter M,Aktas C,Erboga M.Heat stress decreases testicular germ cell proliferation and increases apoptosis in short term:an immunohistochemical and ultrastructural study[J].Toxicol IndHealth,2013,29(2):99-113.
[3] Paul C,Teng S,Saunders P T.A single,mild,transient scrotal heat stress causes hypoxia and oxidative stress in mouse testes,which induces germ cell death[J].Biol Reprod,2009,80(5):913-9.
[4] 夏玲玲,周仲松,谢琴秀,等.白芍总苷对糖尿病大鼠肝脏内质网应激的调节作用[J].安徽医科大学学报,2015,50 (10):1451-5.
[5] Pae H O,Chung H T.Heme oxygenase-1:its therapeutic roles in inflammatory diseases[J].Immune Netw,2009,9(1):12-9.
[6] Solano M E,Arck P C.Heme oxygenase-1:for better,for worse,in sickness and in health[J].Oncotarget,2015,6(17):14733 -4.
[7] Ji Y L,Wang H,Meng C,et al.Melatonin alleviates cadmiuminduced cellular stress and germ cellapoptosis in testes[J].JPineal Res,2012,52(1):71-9.
[8] JiY L,Wang H,Zhao X F,etal.Crosstalk between endoplasmic reticulum stress and mitochondrial pathway mediates cadmium-induced germ cell apoptosis in testes[J].Toxicol Sci,2011,124 (2):446-59.
[9] Mayo JN,Beard RSJr,Price TO,etal.Nitrative stress in cerebral endothelium ismediated bymGluR5 in hyperhomocysteinemia [J].JCereb Blood Flow Metab,2012,32(5):825-34.
[10]Abdelmegeed M A,Jang S,Banerjee A,etal.Robustprotein nitration contributes to acetaminophen-induced mitochondrial dysfunction and acute liver injury[J].Free Radic Biol Med,2013,60:211-22.
[11]Brewer JW.Regulatory crosstalk within the mammalian unfolded protein response[J].Cell Mol Life Sci,2014,71(6):1067-79.
[12]Gardner B M,Pincus D,Gotthardt K,et al.Endoplasmic reticulum stress sensing in the unfolded protein response[J].Cold Spring Harb Perspect Biol,2013,5(3):a013169.
Effect of transient scrotal hypertherm ia on testicular stress response in m ice
Liu Hongmao1,Mu Kehan1,Ji Yanli1,2,et al
(1Dept of Occupational and Environmental Health,2Dept of Inspection and Quarantine Health,School of Public Health,Anhui Medical University,Hefei 230032)
Objective To evaluate the stress response in mouse testes following a singlemild transient scrotal heat exposure(43℃ for 15 min).Methods Twenty-four male mice were random ly divided into four groups and there were six animals in each group.Mice in scrotal hyperthermia groupswere subjected to a single heat stress of 43℃(treated)for 15 min and killed at 0.5,2,and 6 h after heat exposure.Controlmice were immersed in a water bathmaintained at22℃ for 15 min and killed at6 h after exposure.The expressions of testicular heat shock protein 32(HO-1),3-nitrotyrosine(3-NT)and glucose-regulated protein 78(GRP78)protein were measured using Western blot.Testicular GRP78 was also identified by immunostaining.Results HO-1,a stress-inducible enzyme,expressed at a low level in the testes,was significantly increased in a time-dependentmanner in testes ofmice exposed to scrotal hyperthermia(P<0.01).The intensity of3-NT,amarker of protein nitration,was obviously aggravated in testes of heat-treated mice(P<0.01).In addition,scrotal hyperthermiamarkedly reduced protein level of testicular GRP78(P<0.05).Conclusion A single,acute scrotal hyperthermia significantly induces the expression of testicular HO-1 and 3-NT,and reduces the protein level of GRP78.These results suggest that heat stress,nitrative stress and endoplasmic reticulum stressmay contribute to scrotal hyperthermia-induced testicular impairment.
scrotal hyperthermia;testis;heat stress;nitrative stress;endoplasmic reticulum stress
R 134.3;R 114
A
1000-1492(2016)04-0521-05
2015-12-25接收
国家自然科学基金(编号:31000664、31571557);安徽医科大学2011年博士科研资助项目(编号:XJ201114);安徽医科大学“青年拔尖人才支持计划”;高等学校省级特色专业建设点项目(编号:2013tszy010)
安徽医科大学公共卫生学院1劳动卫生与环境卫生学系、2卫生检验与检疫学系、3卫生毒理学系,合肥230032
刘洪茂,男,硕士研究生;姬艳丽,女,副教授,硕士生导师,责任作者,E-mail:jiyanlidev@126.com

