模拟微重力对猕猴肺组织趋化因子CCL20及其受体CCR6表达的影响
许崇玉,王 萍,陈 杨,朱敏立,司少艳,蔡艺灵,马华松,陈志明
模拟微重力对猕猴肺组织趋化因子CCL20及其受体CCR6表达的影响
许崇玉1,王 萍1,陈 杨2,朱敏立2,司少艳3,蔡艺灵4,马华松5,陈志明5
目的 探讨模拟微重力对猕猴肺组织CC亚族趋化因子配体20(CCL20)及趋化因子受体6(CCR6)mRNA和蛋白表达的影响。方法 15只猕猴分为3组,每组5只:对照组、模拟组、恢复组。HE观察猕猴肺组织结构,实时荧光定量 PCR、免疫组化法检测肺组织中CCL20及CCR6 mRNA和蛋白表达。结果 模拟组和恢复组猕猴肺组织可见肺泡间隔增厚,肺间质内及支气管旁可见淋巴细胞浸润,恢复组较模拟组减轻。模拟组、恢复组CCL20 mRNA的表达水平较对照组增高,但差异无统计学意义。模拟组CCR6 mRNA的表达水平较对照组、恢复组显著增高(P<0.01)。模拟组CCL20及CCR6蛋白表达较对照组、恢复组显著升高(P<0.05)。结论 中、长期模拟微重力可引起肺组织结构破坏、淋巴细胞浸润,并可引起猕猴肺组织中CCL20及CCR6表达增强。
模拟微重力;猕猴;肺组织;CCL20;CCR6
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.012.htm l
随着我国载人航天事业的深入发展,空间环境中机体防护显得尤为重要。由于肺自身特点,导致其对重力变化极其敏感[1]。研究[2]表明,失重可导致肺组织结构病理损伤并伴有细胞因子的变化。CCL20是近期发现的趋化因子,与其唯一同源性受体CCR6[3]结合,可诱导多种淋巴细胞迁移,在炎症损伤和免疫应答中发挥重要作用[4]。研究[5-6]表明CCL20/CCR6可参与多种肺组织疾病,促进气道炎症的发生和发展。汤楚华等[7]发现,模拟失重可引起猕猴牙龈组织CCL20和CCR6表达增加,在牙龈组织应激过程中发挥作用。然而,目前国内外未见失重状态下CCL20/CCR6在肺组织中相关作用的报道。该研究以猕猴为对象,采用模拟微重力模型[8],观察失重对肺组织结构及CCL20、CCR6 mRNA和蛋白表达的影响,为进一步研究空间环境下肺组织结构及功能变化提供理论基础。
1 材料与方法
1.1 试剂和动物模型
1.1.1 主要试剂 一抗为山羊抗人CCL20多克隆抗体、鼠抗人CCR6单克隆抗体(美国R&G公司);二抗为抗兔/抗鼠通用型免疫组化试剂盒(丹麦Da-Ko公司);山羊超敏二步法检测试剂盒(北京中杉金桥生物技术有限公司);TRIzol试剂(美国Invitrogen公司);Revert Aid First Strand cDNA Synthesis Kit(美国 Thermo公司);SYBRⓇGreen Real-time PCR Master Mix试剂盒(日本TOYOBO公司)。
1.1.2 模型制备 健康雄性猕猴15只,年龄4~8岁,体重约8 kg,由北京协尔鑫生物资源研究所提供。猕猴按体重配对,随机均等分为3组,即对照组:在笼内自由活动6周;模拟组:在特制的头低位模拟失重效应装具上生活6周;恢复组:在特制的头低位模拟失重效应装具上生活6周,随后在笼内自由活动4周。以猕猴卧床头低位-10°模拟微重力效应。所有猕猴用标准动物饲料喂养,室温(22± 2)℃,人工控制室内照明,保持12 h光照(8:00~20:00)和黑暗(20:00~次日8:00)交替循环。实验动物的使用及操作过程全部符合实验动物国家标准,且通过了中国人民解放军第306医院伦理委员会的批准。
1.2 方法
1.2.1 取材与切片制作 饲养周期结束后,猕猴在麻醉状态下放血处死。取猕猴肺组织标本,分别置于10%福尔马林溶液、RNAlater溶液及冻存于液氮中备用。按常规石蜡切片制作方法制作4μm连续切片,进行后续的HE及免疫组化染色。
1.2.2 HE染色观察肺组织病理学变化 将上述石蜡切片按常规HE染色法染色,即二甲苯脱蜡后经无水乙醇、90%酒精、80%酒精、75%酒精下行至蒸馏水;苏木精染色;1%盐酸酒精分化;伊红染色;从低至高梯度酒精脱水,二甲苯透明,光学树胶封片。Leica显微镜观察,拍照。
1.2.3 实时荧光定量PCR(Q-PCR)法检测肺组织CCL20、CCR6 mRNA的表达
1.2.3.1 引物的设计与合成 根据GenBank中猕猴 CCL20及CCR6 mRNA序列,以Primer Premier 3.0软件设计特异性引物,由生工生物工程(上海)股份有限公司合成,以 GAPDH为内参照,引物序列见表1。

表1 Q-PCR使用的特异性引物序列
1.2.3.2 总RNA的提取 取冻存于-80℃冰箱RNAlater溶液中的肺组织,应用TRIzol试剂盒,按照说明书提取总RNA。以ND-1000核酸定量检测仪(美国Thermo公司)测定总RNA的浓度及吸光度(absorbance,A)值即A260、A280,以 1.8≤A260/A280≤2.0为合格。总RNA经1%琼脂糖凝胶电泳鉴定,可见明显的18 S、28 S两条区带,所有样本总 RNA均为1.8≤A260/A280≤2.0,证明所提取的总 RNA质量较好。
1.2.3.3 逆转录反应 吸取2μg总RNA,按RevertAid First Strand cDNA Synthesis Kit说明书操作步骤逆转录合成 cDNA。逆转录条件:65℃、5 min;42℃、60 min;70℃、5 min;-20℃保存。
1.2.3.4 Q-PCR法检测 反应体系:SYBRⓇGreen Real-time PCR Master Mix 10μl,上游引物(10 μmol/L)0.4μl,下游引物(10μmol/L)0.4μl,cDNA 1μl,RNase Free Water 8.2μl;以GAPDH为内参。反应条件为:95℃预变性30 s;95℃、5 s;60℃、34 s;共40个循环;95℃、15 s;60℃、1 min;95℃、15 s。实验数据应用2-ΔΔCt进行处理,计算各样本平均Ct值及ΔCt值(ΔCt=Ct目的基因-CtGAPDH),计算2-ΔΔCt,其数值表示CCL20、CCR6 mRNA相对于GAPDH的表达倍数。
1.2.4 免疫组织化学染色 采用SP免疫组化法,切片按常规经二甲苯脱蜡后经无水乙醇、90%酒精、80%酒精、75%酒精下行至蒸馏水;0.01 mol/L柠檬酸盐缓冲液热抗原修复;30%H2O2室温封闭内源性过氧化物酶30 min;蒸馏水洗3次;山羊血清封闭30 min;滴加CCL20抗体(1∶1 000)或CCR6抗体(1∶2 000),4℃,过夜;蒸馏水、1×PBS分别洗3次;滴加抗山羊或抗鼠/抗兔二抗,室温孵育1 h;蒸馏水、1×PBS分别洗3次;DAB显色;苏木精染色;1%盐酸酒精分化;从低至高梯度酒精脱水,二甲苯透明,光学树胶封片。Leica显微镜观察猕猴肺组织中CCL20/CCR6的表达情况。以肺组织和(或)结缔组织胞膜或胞质中有黄色或棕黄色颗粒为CCL20/CCR6阳性反应。
采用双盲法观察切片,每张切片随机选取5个高倍视野(×200),主动排除“边缘效应”的干扰,分别对阳性细胞的百分比和染色强度给予评分,总分为两者之积,半定量判断结果。阳性细胞的百分比:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51% ~75%为 3分,76% ~100%为 4分。染色强度:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。
1.3 统计学处理 采用SPSS 18.0软件进行分析,计量资料数据以±s表示。多样本均数的比较采用单因素方差分析;两组间差异性比较,方差齐性者采用LSD法检验,方差不齐则采用Dunnett t检验;变量间的相关分析采用Spearman秩相关分析。
2 结果
2.1 肺组织病理结构改变 对照组猕猴肺组织肺泡壁形态、大小均匀,肺泡腔内未见淤血、水肿;模拟组肺组织部分肺泡间隔增宽,肺间质内及支气管旁可见淋巴细胞团块状浸润;恢复组上述病理改变较模拟组稍减轻。见图1。
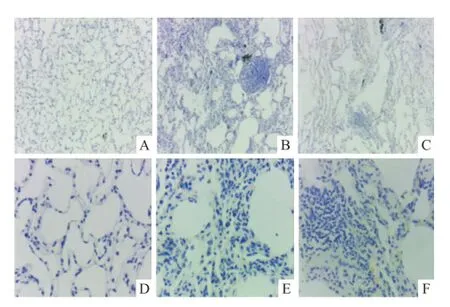
图1 猕猴肺组织HE染色A:对照组;B:模拟组;C:恢复组;1:×100;2:×400
2.2 肺组织CCL20、CCR6 mRNA表达情况 QPCR结果显示,对照组(8.48±5.36)、模拟组(7.27 ±2.43)、恢复组(6.61±1.51)猕猴肺组织CCL20 mRNA表达呈增高趋势,模拟组是对照组的2.31倍,恢复组是对照组的3.65倍,但各组间差异无统计学意义(F=0.36)。各组猕猴肺组织CCR6 mRNA表达分别为对照组(8.22±1.93)、模拟组(5.10 ±1.46)、恢复组(8.56±1.32),模拟组是对照组的9.63倍,恢复组是对照组的0.87倍,模拟组表达CCR6较对照组、恢复组增高,差异有统计学意义(F =7.19,P<0.01),但对照组和恢复组比较差异无统计学意义(F=7.19)。对CCL20和CCR6 mRNA在各组猕猴肺组织中表达变化进行相关性分析显示,两者之间无显著相关性(rs=0.48)。见图2。
2.3 肺组织CCL20免疫组化结果 CCL20免疫组化染色结果表明,各组猕猴肺组织均可见CCL20弱阳性表达,呈黄色或棕黄色,阳性细胞既可分布于支气管上皮细胞、血管内皮细胞、肺泡上皮细胞,胞质、胞核均有表达,胞质多见,亦可见于肺组织中浸润的淋巴细胞中(图3)。各组CCL20免疫组化评分结果分别为:对照组(1.20±1.10)分、模拟组(3.20± 0.84)分、恢复组(1.60±1.14)分。与对照组、恢复组比较,模拟组CCL20免疫组化评分显著增高,差异有统计学意义(F=5.25,P<0.05),对照组、恢复组间比较差异无统计学意义(F=5.25)。


图2 CCL20 m RNA和CCR6 mRNA在猕猴肺组织中表达的相关性分析

图3 各组猕猴肺组织CCL20免疫组化染色结果 SP×400 A:对照组;B:模拟组;C:恢复组
2.4 肺组织CCR6免疫组化结果 CCR6主要表达于支气管上皮细胞、血管内皮细胞、肺泡上皮细胞及淋巴细胞浸润区域,胞质、胞核均可着色,以胞质为主,呈黄色或棕黄色(图4)。各组猕猴肺组织CCR6免疫组化评分结果分别为:对照组(1.20± 0.45)分、模拟组(5.20±1.79)分、恢复组(2.00± 1.87)分。与对照组、恢复组比较,模拟组CCR6免疫组化评分分值显著增高,差异有统计学意义(F= 9.74,P<0.01),对照组、恢复组比较差异无统计学意义(F=9.74)。
3 讨论
趋化因子是一组有相似结构特点、低分子量(8~10 ku)细胞因子家族,由多种组织细胞及炎性细胞产生,有多种生物学活性,能够趋化多种免疫细胞的迁移,在多种疾病的炎症损伤和免疫应答中发挥重要作用[9-10]。根据其N末端保守的半胱氨酸残基的排列方式,趋化因子可分为4类:CC亚族、CXC亚族、C亚族和CX3C亚族[11]。趋化因子受体属于G蛋白偶联受体家族,主要表达于内皮细胞和免疫细胞。根据结合的配体不同,亦可分为4类:CCR类、CXCR类、CR类和CX3CR类。趋化因子与其相应受体结合,对多种免疫细胞发挥趋化作用,在特异性和非特异性免疫应答中发挥重要作用,同时在生理及病理条件下也参与机体多种生物学功能[7]。CCL20是近年来发现的CC亚族新成员,CCR6是CCR类趋化因子受体,是一个高度保守的G蛋白偶联受体,主要表达于未成熟的树突状细胞,也可表达于T细胞、NKT细胞、B细胞及肺、肠和肝等组织[3,12],CCL20和CCR6间相互作用可介导上述免疫细胞向黏膜组织的转移,参与局部炎症反应及免疫应答。

图4 各组猕猴肺组织 CCR6免疫组化染色结果 SP×400A:对照组;B:模拟组;C:恢复组
目前,国内外尚未见失重或模拟失重状态下肺组织CCL20和CCR6表达情况及CCL20/CCR6是否在失重状态下肺组织淋巴细胞浸润中发挥作用的相关报道。因此本研究首次采用了在生物进化上以及组织器官结构、生理习性和代谢机能上同人类相近的猕猴,利用地面模拟微重力模型观察中、长期微重力状态下猕猴肺组织结构的病理改变及从mRNA和蛋白水平上对肺组织中CCL20、CCR6的表达进行探讨。本研究显示模拟微重力状态下猕猴肺组织间隔增厚、部分肺泡融合,淋巴细胞浸润程度较高,呈团块状浸润,证实了失重或模拟微重力可引起肺组织结构破坏、淋巴细胞浸润增多,这与王小辉等[13]的研究结果一致。
本实验Q-PCR结果显示对照组、模拟组、恢复组猕猴肺组织 CCL20 mRNA的表达水平呈增加趋势,但差异无统计学意义,可能与CCL20在肺组织本身表达量较低有关;与对照组、恢复组比较,模拟组肺组织CCR6 mRNA表达水平显著增加,但对照组与恢复组之间差异无统计学意义。免疫组化结果表明,CCL20和CCR6在模拟组肺组织中表达较对照组及恢复组显著增高,表明失重或模拟微重力效应可引起猕猴肺组织CCL20、CCR6蛋白表达增加。Q-PCR和免疫组化结果提示:模拟微重力状态下猕猴肺组织中CCR6 mRNA和蛋白表达水平增高,而CCL20 mRNA表达水平未见明显升高,但蛋白表达增强。CCR6作为CCL20的唯一同源性受体,两者mRNA的表达无显著相关性。模拟微重力引起趋化因子CCL20 mRNA和蛋白水平表达的不一致性,可能与基因的转录后调控有关,具体机制有待于进一步研究。Conejo-Garcia et al[14]发现β-防御素是人体内能够作用于CCR6的生物活性物质,能够与CCL20竞争CCR6结合位点,而发挥相似的作用。Zissel et al[15]的初步研究结果显示CCL18也可作用于CCR6而发挥趋化作用。结合本研究结果,考虑CCL20/CCR6可能参与模拟微重力下肺组织中淋巴细胞浸润过程,但通过何种途径介导该过程,还需进一步的研究。
综上所述,中、长期模拟微重力可引起猕猴肺组织结构破坏、淋巴细胞浸润,同时可引起CCL20及CCR6表达增强,这可能是介导模拟微重力状态下肺组织中淋巴细胞浸润增多的原因之一。
[1] Prisk G K.Mircogravity and the respiratory system[J].Eur Respir J,2014,43(5):1459-71.
[2] 李天志,刘长庭,李向红,等.模拟失重对大鼠血清及肺组织细胞因子的影响研究[J].重庆医学,2007,36(12):1152-4.
[3] Ito T,Carson W F 4th,Cavassani K A,et al.CCR6 as amediator of immunity in the lung and gut[J].Exp Cell Res,2011,317 (5):613-9.
[4] Lee A Y,Phan T K,Hulett M D,etal.The relationship between CCR6 and its bidding partners:does the CCR6-CCL20 axis have to be extended?[J].Cytokine,2015,72(1):97-101.
[5] Demedts IK,Bracke K R,Van Pottelberge G,etal.Accumulation of dendritic cells and increased CCL20 levels in the airways of patients with chronic obstructive pulmonary disease[J].Am JRespir Crit Care Med,2007,175(10):998-1005.
[6] PichavantM,Charbonnier A S,Taront S,etal.Asthmatic bronchialepithelium activated by the proteolytic allergen Der p 1 increases selective dendritic cell recruitment[J].JAllergy Clin Immunol,2005,115(4):771-8.
[7] 汤楚华,牛忠英,郑燕华,等.模拟失重30 d后再超重对猴牙龈组织趋化因子CCL20及其受体CCR6表达的影响[J].上海口腔医学,2014,23(3):273-9.
[8] Regnard J,Heer M,Drummer C,et al.Validity of microgravity simulationmodels on earth[J].Am JKidney Dis,2001,38(3):668-74.
[9] Balkwill F R.The chemokines system and cancer[J].JPathol,2012,226(2):148-57.
[10]Blanchet X,Langer M,Weber C,et al.Touch of chemokines[J]. Front Immunol,2012,3:175.
[11]Zlotink A,Yoshie O.Chemokines:a new classification system and their role in immunity[J].Immunity,2000,12(2):121-7.
[12]Elgueta R,Marks E,Nowak E,et al.CCR6-dependent positioning ofmemory B cells is essential for their ability tomounta recall response to antigen[J].J Immunol,2015,194(2):505-13.
[13]王小辉,王 萍,朱敏立,等.N-乙酰半胱氨酸对模拟失重肺炎大鼠的保护性研究[J].安徽医科大学学报,2014,49(11):1544-8.
[14]Conejo-Garcia JR,Benencia F,CourregesM C,et al.Tumor-infiltrating dendritic cell precursors recruited by a beta-defensin contribute to vasculogenesis under the influence of Vegf-A[J].Nat Med,2004,10(9):950-8.
[15]Zissel G,Hohne K,Kilic A,et al.CCR6 is a receptor for CCL18 expressed on human lung fibroblasts from IPF lungs[J].Eur Respir J,2011,38(Suppl 55).
Effect of simulated weightlessness on the expression of chemokine CCL20 and it′s receptor CCR6 in lung of rhesusmonkey
Xu Chongyu1,Wang Ping1,Chen Yang2,et al
(1The 306th Hosptial of PLA Cinical College of Anhui Medical University,Beijing 100101;
2Deptof Respiratory and Critical Care Medicine,The306th Hosptial of PLA,Beijing 100101)
Objective To investigate the effect of simulated weightlessness on themRNA and protein expression of chemokine CCL20 and it′s receptor CCR6 in lung of rhesusmacaque.Methods Fifteen healthy youngmale rhesus monkeyswere randomly divided into3 groups:control group,simulated group and recovery group.HE stainingwas used to observe the histopathological structure changes of pul-monary tissues.And themRNA and protein expression of CCR6 and CCL20 in lung tissue were detected by immunohistochemistry and quantitative real-time PCR(QPCR).Resu lts Compared with the control group,histopathological examination revealed alveolar septal thickening,and alveolar and interstitial lymphocytic infiltration in simulated group and recovery group,and the pathological changes in recovery group were lighter than those in simulated group.The expressions of CCL20mRNA in simulated group and the recovery group were higher than that in the control group,but there was no significant difference;the expression of CCR6 mRNA in simulated group was significantly higher than that in the control group and the recovery group(P<0.01),but there was no significant difference between the control group and the recovery group.Immunohistochemistry results showed that CCL20 and CCR6 were expressed in the lung tissues of each group,but the expression of CCL20 was weak.The positive cells were found mainly in the cytopl-asm of bronchial and alveolar epithelial cellsand vascular endothelial cells.The protein expression of CCL20 and CCR6 in simulated group were significantly higher than that in the control group and the recovery group(P<0.05).Conclusion Medium or long term simulated weightlessness can induce the destruction of lung tissue structure and infiltration of lymphocytes,and it can also significantly enhance the mRNA and protein expression of CCL20 and its receptor CCR6 in lung tissues.
simulated weightlessness;rhesusmacaque;lung;CCL20;CCR6
R 563.9;V 7
A
1000-1492(2016)04-0484-05
2016-01-18接收
总装备部试验技术研究重点项目(编号:SMFA13K02)
1安徽医科大学解放军306临床学院,北京 100101
解放军第306医院2呼吸与危重症学科、3特种医学实验研究中心、4神经内科、5骨科,北京 100101
许崇玉,男,硕士研究生;
王 萍,女,教授,硕士生导师,责任作者,E-mail:pingwang306hpbj@163.com

