酒精对幼鼠海马神经组织发育及Kainate受体的影响☆
赵娟熊峰鲍美华张玉茜周少鸿曾杰李广意李建明
论著
酒精对幼鼠海马神经组织发育及Kainate受体的影响☆
赵娟*熊峰*鲍美华*张玉茜*周少鸿*曾杰*李广意*李建明*
目的探讨酒精对幼鼠神经组织发育及红藻氨酸(kainate,KA)受体表达的影响。方法从小鼠P7龄开始,用20%酒精皮下注射法建立胎儿酒精系列紊乱(fetal alcohol spectrum disorder,FASD)模型并以生理盐水注射的幼鼠为对照组(酒精实验组80只,对照组40只),两组各每天测量体重,并观察一般生物学特性,建模完成后进行Morrirs水迷宫行为学检测。另取P7小鼠30只(酒精实验组15只,对照组15只),皮下注射酒精和生理盐水24h后取脑组织进行FJB染色。免疫荧光法检测KA受体亚型KA1、KA2、GluR-6及GFAP的表达情况。结果注射3周后,与对照组相比,实验组小鼠体重增长速度明显降低(对照组21.13g±1.72g,实验组13.96g±2.98g,P<0.05);Morrirs水迷宫实验发现,实验组较对照组逃避潜伏期时间明显延长(对照组21.05s±5.31s,实验组34.15s±3.26s,P<0.05),穿越平台次数也明显减少(对照组2.70次±1.25次,实验组0.93次±0.80次,F=2.505,P<0.05);GFAP荧光结果显示实验组小鼠从酒精注射7 d开始星形胶质细胞发育发生异常;FJB结果显示实验组皮质、海马、丘脑都有神经元细胞大量死亡;实验组小鼠P14龄GluR-6和KA2亚型在海马CA区表达有上调。结论海马CA区KA受体GluR-6和KA2亚型可能与酒精影响的幼鼠海马神经组织发育有关。
酒精神经细胞星形胶质细胞KA受体
ZHAO Juan,XIONG Feng,BAO Meihua,ZHANG Yuqian,ZHOU Shaohong,ZENG Jie,LI Guangyi,LI Jianming.De⁃partment of Anatomy,Histology and Embryology,ChangshaMedical University,Changsha 410219.Tel:0731-88498021.
【Abstract】Objectives To investigate the effects of ethanol on neural development and kainate receptor expression in young mice.Methods Fetal alcohol spectrum disorder model was established by administration of 20%ethanol solu⁃tion to 7-day-old Kunming mice and control animals received physiological saline(The number of treatment and control were 80 and 40,respectively).Body weight and general biological features were observed every day.Morris water maze was used to test learning and memory ability.Fluoro-Jade B was used to examine neural cells 24 hours after treatment in additional thirty 7-day-old Kunming mice which were further divided into two groups:a treatment group receiving 20% ethanol solution(n=15)and a control group receiving physiological saline(n=15).The development of neural cells and expression levels of kainite receptors were examined by using immunofluorescence staining.Results The body weight was significantly lighter in treatment group than in control group(control:21.13±1.72g,treatment:13.96±2.98g,P<0.05).Morris test showed that model group had longer latency than control group to find hidden platform(control:21.05± 5.31s,treatment:34.15±3.26s,P<0.05).Spatial probe test revealed that the number of passing through the platform were significantly smaller in model group than in control group(control:2.70±1.25 times,treatment:0.93±0.80 times,P<0.05).Astrocyte development anomaly was evident after ethanol treatment for 7 days.The expression levels of kainite re⁃ceptor GluR-6 and KA2 were up-regulated in the CA region of the hippocampus after ethanol treatment for 7 days.Conclusion Kainite receptor GluR-6 and KA2 in CA region of the hippocampus may contribute to ethanol-induced hippo⁃campal neural development anomaly.
【Key Words】Ethanol Nerve cells Astroglia cells Kainate receptor
胎儿酒精系列紊乱(fetal alcohol spectrum dis⁃order,FASD)是指酒精相关性胎儿发育障碍,如酒精相关性疾病、酒精相关性生理缺陷、酒精相关性神经系统发育障碍等,包含胎儿和婴幼儿酒精暴露所致的发育、生理、心理、行为和学习等方面的问题[1,2]。红藻氨酸(kainate,KA)受体家族由5种不同亚基组成,分别是GluR5、GluR6、GluR7及亲和力更高的KA1和KA2,这5种亚基分别由Grik1-5基因表达形成[3]。KA受体家族在神经系统中有着广泛分布,GluR5主要存在于背根节细胞、大脑扣带皮质及小脑的Purkinje细胞中;GluR6主要分布在海马的齿状回以及CA1区、CA3区、小脑颗粒细胞、纹状体中,在大脑脑回神经元的树突等位置也有分布;GluR7在全脑都呈低水平表达;KA1几乎只分布在海马的CA3区;KA2则广泛分布在中枢神经系统中[4]。KA受体是脊椎动物中枢神经系统中一类兴奋性神经递质受体,参与突触传递过程[5]。另外,KA受体在神经系统的发育中也有着重要的作用[6]。有报道表明,KA受体在动物发育时期对树突的生长有调节作用[7]。目前KA受体在神经细胞兴奋性中毒机制、神经退行性疾病及精神疾病中有所研究[8],但KA受体是否参与酒精影响的神经发育中目前尚不明确。本文意在建立小鼠FASD模型,研究KA受体在小鼠神经发育过程中的变化,并初步研究酒精对幼鼠神经发育的影响及机制。
1材料与方法
1.1研究对象清洁级昆明小鼠(湖南斯莱克景达实验动物有限公司提供)置于12 h昼夜循环的恒温(24℃)湿度(50%±5%)动物房内喂养,按雌、雄鼠3:1合笼,每日8时检查雌鼠是否有阴道栓确定受孕日期,定为妊娠开始,妊娠5d小鼠20只随机平均分为对照组和实验组。小鼠出生第1天称为P0 (P=days postnatal,P0=the first 24hours after birth),在小鼠P7龄时,参照Ikonomidou C的方法建模[9]。
1.2动物模型制备先将56°红星二锅头用生理盐水稀释成含20%酒精的溶液[10],轻取P7龄小鼠称量体重,用75%的酒精溶液擦拭小鼠背部,实验组用二锅头稀释成的含20%酒精的溶液按2.5g/kg倾斜15°在幼鼠背处皮下注射,分两次进行,两次间隔2h;对照组则用生理盐水代替按相同的方法处理[9]。
1.3一般情况检查[11]每天测量小鼠体重变化情况,观察其毛发、进食量、排尿量、排便量等一般营养状态,并观察是够合并有脑血管意外等神经系统损伤的表现,如:偏侧肢体瘫痪、抽搐发作等。
1.4 Morris水迷宫检测小鼠学习和记忆能力酒精皮下注射21 d,即小鼠P28龄后,参照赖红[12]的方法进行水迷宫实验,经过连续4d的训练后,撤掉隐藏的平台,通过检测记录并分析小鼠的定位航行能力与空间探索能力(定位航行实验的考察指标为逃避潜伏期所用的时间,空间探索实验检测检测指标为小鼠60s内穿越有效区域次数),用来判断小鼠的学习能力和空间记忆能力[13]。
1.5取材取两组小鼠,2.5%三溴乙醇(16mL/kg)腹腔注射麻醉,经左心室灌注生理盐水再灌注浓度为4%甲醛,取全脑放入4%多聚甲醛中后固定,置于4℃的冰箱固定过夜,次日置于30%蔗糖PBS溶液48 h,至脑沉底。将全脑在-30℃冷冻切片机切片,厚度为15μm。将切片保存在用多聚赖氨酸处理过的玻片上,为后续的荧光染色备用。
1.6 FJB染色检测小鼠脑组织神经细胞死亡情况
另取P7龄小鼠30只,背部酒精皮下注射24h后,取脑冷冻切片,常规Fluoro-Jade B(FJB)染色[14]先用含1% NaOH的80%乙醇溶液浸泡2min,再放入0.06%高锰酸钾溶液,恒温摇床20 min,最后使用0.000 4%FJB染色20 min。通过荧光显微镜进行观察。
1.7免疫荧光检测KA受体的表达和星形胶质细胞的发育将含KA1、KA2、GluR-5、GluR-6、GluR-7和GFAP的体积分数为5%的小牛血清和0.3%Tri⁃ton-100的PBS溶液滴加在切片上,置于4℃中反应过夜,次日经PBS浸洗后,切片在相应的荧光二抗里孵育2 h,然后在荧光显微镜下观察检测[15]。
2结果
2.1一般情况两组共110只小鼠,经过3周造模后共死亡28只.其中,实验组幼鼠80只死亡25只(31.25%),无操作不当导致死亡;对照组小鼠40只死亡3只(7.5%),无操作不当导致死亡。实验组由于酒精刺激作用,一直存在着注射困难,并于P21龄后出现毛发杂乱、无光泽、干枯等情况。P28龄后实验组出现脱毛、倦怠、消瘦、精神萎靡不振(造模小鼠55只中有50只出现这类情况,占总数的91%)。经重复测量设计资料的方差分析,不同处理时相之间小鼠体重存在差别(F= 391.628,P<0.01);不同处理的小鼠体重之间也存在差别(F=21.490,P<0.01);处理时相和不同处理之间也存在交互作用(F=24.204,P<0.01)。与对照组相比,实验组P14、P21、P28龄小鼠的体重明显较轻(对照组:7.61g±1.29g,12.20g±2.14g,21.13g±1.72g;实验组:6.21g±0.93g,8.41g±1.22g,13.96g±2.98g),两组有显著差异(P<0.05),见表1。
2.2Morris水迷宫检测记忆及学习能力在定位航行试验中,经重复测量设计资料的方差分析,不同处理时相之间小鼠寻找平台所需潜伏期存在差别(F=13.734,P<0.01);不同处理的小鼠寻找平台所需潜伏期之间也存在差别(F=11.726,P<0.01);但处理时相和不同处理之间不存在交互作用(F= 1.708,P>0.05)。两组小鼠寻找平台所需潜伏期均有随着训练进程而下降的趋势,但除了Day1(训练第一天)外,实验组的潜伏期都要长于对照组,实验组与对照组相比具有显著差异(P<0.05)(Day2、Day3、Day4对照组的逃避潜伏期为:34.68s±8.89s、28.40s±4.54s、21.05s±5.31s;实验组为49.15s±9.81s、42.75s±10.08s、34.15±3.26s),见表2。在空间探索实验中,对照组小鼠的运动轨迹大多集中在有效区域象限,并停留搜索时间较长,跨越有效区域象限位置次数较多。而实验组多沿池壁运动,运动轨迹随机分布。实验组小鼠穿越平台的次数少于对照组小鼠(对照组:2.70次±1.25次;实验组:0.93次± 0.80次),两者有显著差异(F=2.505,P<0.05)。
2.3 FJB检测细胞死亡FJB可与变性死亡的神经元结合而产生绿色荧光。实验组小鼠皮下注射酒精24h后,进行FJB染色,结果显示在小鼠的整个脑区有大面积的神经元细胞死亡,以皮质、海马和丘脑下部尤为显著,而对照组中仅有个别细胞发生死亡,应为自然死亡(见图1)。
2.4免疫荧光检测星形胶质细胞的数量及形态星形胶质细胞特异性标记物胶原纤维酸性蛋白(gli⁃al fibral acidic protein,GFAP)免疫荧光结果显示实验组小鼠酒精皮下注射7 d后开始出现胞体瘦小,突起变细变短的现象,到皮下注射21 d后,实验组小鼠星形胶质细胞数量明显少于对照组,且细胞体积较小,突触数量远远少于对照组(见图2)。

表1 两组小鼠体重(g)的变化比较

表2 Morris水迷宫测试各组小鼠逃避潜伏期(s)
2.5免疫荧光KA受体的表达差异KA受体几种亚型KA1、KA2、GluR-6的免疫荧光(红色)分析结果显示:在连续注射生理盐水7 d后的小鼠中,KA2的表达海马在CA2和CA3区都有微量的表达(见图3,N),GluR-6主要在CA3区有低表达(见图3,V)。实验组小鼠连续酒精注射7 d后,KA2 在CA2、CA3的表达明显上升,而GluR-6在CA1、CA2、CA3区域都有明显的表达增加。而KA1亚型则在实验验组和对照组都几乎没有表达。当鼠龄至21 d后,对照组和实验组在海马区域,KA1、KA2、GluR-6均无表达。
3讨论

图1 皮下注射24h后,细胞凋亡情况。实验组小鼠的皮质、海马和丘脑下部都出现了神经元死亡的现象
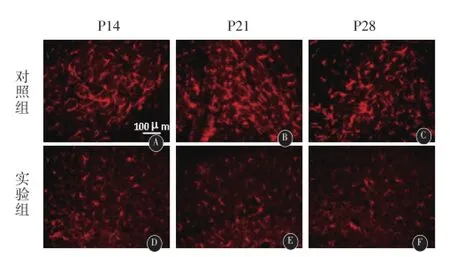
图2 星形胶质细胞的形态变化。与对照组小鼠相比,实验组小鼠的星形胶质细胞的细胞数量、突触数量明显较少
婴幼儿时期酒精暴露会引起FASD,导致婴幼儿发育异常。酒精对发育中的神经损伤表现的尤为突出,而在大脑中,以海马、皮质区域对酒精的敏感性最高[16],在本实验中,P7小鼠皮下酒精注射24 h后,其海马、皮质及丘脑下部都出现了明显的神经元死亡,这说明海马、皮质及丘脑下部对酒精具有很高的敏感性。
星形胶质细胞是中枢神经系统最主要的神经胶质细胞之一,对神经元具有营养支持作用,并能引导神经元的定向迁移和分化成熟,既可以通过自兴奋性及突触传导的调节释放化学递质与神经元形成突触联系,也可以增加成熟突触的数目和功能[17]。在本实验中,对照组小鼠的星形胶质细胞发育正常,胞体大小正常,数量随生长而大量增加,突触也正常发育;而实验组中从皮下注射7d后开始,GFAP表达降低,胞体瘦小、突起变细变短,这与于海艳[18]的结果相似。星形胶质细胞数目和突触减少,会导致其连接支持神经元功能降低,干扰神经元分化成熟,导致神经元功能发育异常。在水迷宫实验中,模型组小鼠的学习和空间记忆能力明显差于对照组,这可能是与酒精引发星形胶质细胞发育异常,间接影响海马神经元异常有关。因此,FASD产生的原因之一可能是酒精导致星形胶质细胞发育异常。
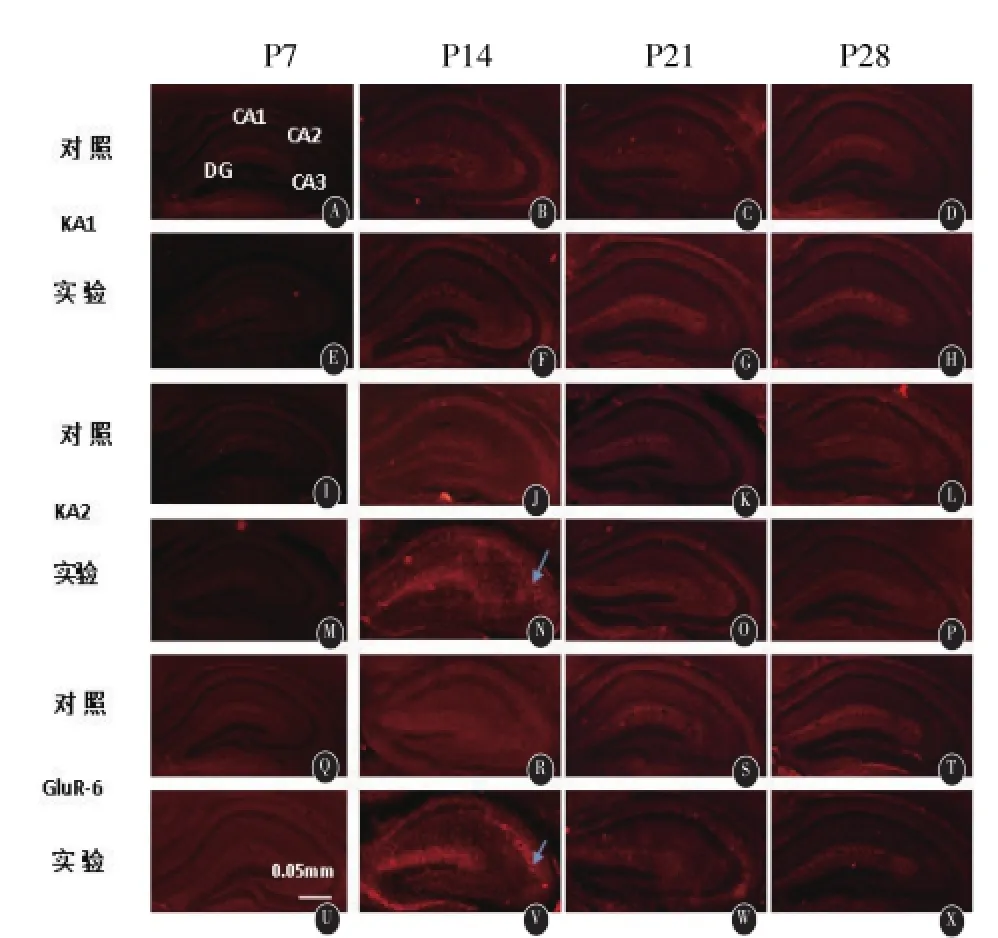
图3 连续注射7d、14d、21d后KA受体表达变化。实验组小鼠在注射酒精7d后KA受体KA2亚型在海马CA2、CA3表达上调,GluR-6亚型在海马CA1、CA2、CA3区域表达明显上调。KA1亚型在实验组和对照组均无表达
在本实验中,新生小鼠在注射酒精的过程中出现了KA2、GluR6表达的上调的现象,这说明酒精对KA受体有调节作用。实验证明GluR6是神经系统中不可缺少的受体,它参与神经元的可塑性,对学习和记忆有着重要的作用,同时还有调节突触活动的功能[19-20]。酒精影响的神经发育的其中一个机制是真核细胞翻译起始因子-2α(eukary⁃otic initiation factor-2α,eIF2α)被磷酸化,导致蛋白质合成停止[21],本实验室早前的研究发现,KA受体表达上调与P-eIF2α(磷酸化的eIF2α)上调有显著相关性[22]。本实验的结果显示,在连续皮下注射酒精7 d后,KA受体亚型KA2、GluR-6的表达明显上升,同时海马区域的星形胶质细胞胞体开始变小,突触变细变小,这提示我们KA受体的表达短时间增高,同时激发了下游信号通路,从而影响了突触的形成,抑制了神经元的发育。KA受体在酒精处理过程中出现增高表达的现象也可能是KA受体参与信号转导作用,使得从而使小鼠神经系统发育也受到影响。总之,海马CA3区KA受体GluR-6和KA2亚型在酒精影响小鼠神经组织发育中发挥了一定的作用,但是具体的作用机制,还需要进一步的研究才能揭示。
[1]BANAKAR MK,KUDLUR NS,GEORGE S.Fetal alcohol spec⁃trumdisorder(FASD)[J].IndianJPediatr,2009,76(11):1173-1175.
[2]MUKHERJEE RA,HOLLINS S,CURFS L.Fetal alcohol spec⁃trum disorders:is it something we should be more aware of[J].J R Coll Physicians Edinb,2012,42(2):143-150.
[3]PERRAIS D,VERAN J,MULLE C.Gating and permeation of kainate receptors:differences unveiled[J].Trends Pharmacol,Sci,2010,31(11):516-522.
[4]BASN S,VOLK B,WISDEN W.Kainate recept or gene expression inthedevelopingratbrain[J].JNeurosci,1994,14(1):5525-5547.
[5]STRAUB C,HUNT DL,YAMASAKI M,et al.Distinct func⁃tions of kainate receptors in the brain are determined by the auxiliary subunit Neto1[J].Nat Neurosci,2011,14(7),866-873.
[6]KIDD FL,ISAAC JTR.Developmental and activity-dependent regulation of kainate receptors at thalamocortical synapses[J]. Nature,1999,400(6744):569-573.
[7]LERMA J,MARQUES JM.Kainate receptors in health and dis⁃ease[J].Neuron,2013,80(2):292-311.
[8]CLARKE VRJ,MOLCHANVA SM,HIRVONEN T,et al.Activi⁃ty-dependent upregulation of presynaptic kainite receptors at iromature synapses[J].J Neuro,2014,34(50):1.
[9]IKONOMIDOU C,BITTIGAU P,ISHIMARU MJ.Ethanol-in⁃duced apoptotic neurodegeneration and fetal alcohol syndrome[J].Science,2000,2879(11):1056-1060.
[10]田维毅,王文佳,韩浩,等.葛根散等3首解酒方对急性酒精中毒小鼠Caspase3/8活性的影响[J].中成药,2012,34(11):2233-2236.
[11]贾明月,赵腾,陈嘉峰,等.慢性大鼠酒精中毒钙神经素在脑内的分布与表达及离子改变[J].中风与神经疾病杂志,2012,29(9):776-779.
[12]赖红,赵海花,高杰,等.新型胆碱酯酶抑制剂对AD大鼠空间记忆及海马结构胆碱能纤维的影响[J].中国药理学通报,2005,21(7):807-810.
[13]胡镜清,温泽淮,赖世隆.Morris水迷宫检测的记忆属性与方法学初探[J].广州中医药大学学报,2000,17(2):117-119.
[14]CHEN ZL,INDYK JA,STRICKLAND S.The Hippocampal Laminin Matrix Is Dynamic and Critical for Neuronal Survival. Mol Biol Cell,2003,14(7):2665-2676.
[15]CHEN ZL,YU HX,YU WM,et al.Proteolytic fragments of lam⁃inin promote excitotoxic neurodegeneration by up-regulation of the KA1 subunit of the kainate receptor[J].J Cell Biol,2008,183 (7):1299-313.
[16]SACHIN MOONAT,BELA G.Starkman,et al.Neuroscience of alcoholism:molecular and cellular mechanisms[J].Cell Mol Life Sci,2010,67(1):73-88.
[17]李佩尧,张成岗.星形胶质细胞分泌血小板反应蛋白(TSP)促进神经突触形成[J].军事医学科学院院刊,2006,30(4):372-374.
[18]于海艳,黄巨恩,吴世芬,等.体外SD大鼠皮层星形胶质细胞培养及酒精的损伤作用研究[J].广西医科大学学报,2013,30(2):184-186.
[19]NAM-NISHIMURA Y,JAFFE H,ISAACRR,et a1.Differential regulaticuof kainato meeptor trafficking by phosphoryhtion of distinct siteson GluR6[J].J Biol Chem,2010,285(4):2847-2856.
[20]SHALTIEL G,MAONG S,MALKESMAN O,el al.Evidence for the involvement of the kainam receptor subunit G1uR6(GRIK2)inmediating behavioral displays related to behavioral symptoms of mania[J].Mol Psychiatry,2008,13(9):858-872.
[21]CHEN G,MA C,BOWER KA,et al.Interaction between RAX and PKR modulates the effect of ethanol on protein synthesis and survival of neurons[J].J Biol Chem,2006,281(23):15909-15915.
[22]袁磊,龚济钦,张海霞,等.KA1亚受体在内质网应激致海马神经元死亡中的作用[J].南方医科大学学报,2015,35 (2):191-195.
(责任编辑:甘章平)
The effects of ethanol on the hippocampal neural tissue development and kainite receptor expression in young
R651
Amouse.
10.3969/j.issn.1002-0152.2016.05.001
☆湖南省高等学校“十二五”重点建设学科专项建设项目(编号:湘教发[2011]76号);湖南省自然科学基金(编号:2013JJ6010);湖南省教育厅科研项目(编号:15C0152、15C0146)
*长沙医学院人体解剖与组织胚胎教研室(长沙410219)
(E-mail:ljming0901@sina.com)
2015-04-21)

