3个鸡种NKX2-5基因多态性与胫长的关联性分析
杨 红,张 勇,何 琦,李 俊,张 雄,彭 松
(1.毕节市农业经营管理站,贵州 毕节 551700;2.贵州大学高原山地动物遗传育种与繁殖省部共建教育部重点实验室/贵州大学动物科学学院/贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025;3.贵阳市花溪区农业局,贵州 贵阳 550025)
3个鸡种NKX2-5基因多态性与胫长的关联性分析
杨 红1,张 勇2,何 琦3,李 俊2,张 雄2,彭 松2
(1.毕节市农业经营管理站,贵州 毕节 551700;2.贵州大学高原山地动物遗传育种与繁殖省部共建教育部重点实验室/贵州大学动物科学学院/贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025;3.贵阳市花溪区农业局,贵州 贵阳 550025)
以贵州特有鸡种高脚鸡、矮脚鸡和百宜黑鸡为试验对象,利用PCR-SSCP和DNA测序等方法检测了NKX2-5 基因T563C、C675T位点在3个试验鸡群中不同基因型与胫长的关联性。T563C与胫长关联分析表明,高脚鸡群体中TT基因型个体胫长显著高于CC型,百宜黑鸡群体中TT基因型显著高于CT型,矮脚鸡群体中不同基因型个体间胫长差异不显著;C675T突变位点在3个鸡种中只有CC和CT两种基因型,且各鸡种不同基因型个体间胫长差异不显著。
NKX2-5 基因;鸡;胫长;SSCP;多态性
杨红,张勇,何琦,等.3个鸡种NKX2-5基因多态性与胫长的关联性分析[J].广东农业科学,2016,43(6):156-162.
NKX2-5基因是NK-2基因家族中被发现的第5个基因,因此命名为NKX2-5[1]。人NKX2-5基因对心脏发育具有非常重要的作用,也是最早的心脏前体细胞分化标志之一,在心脏前体细胞分化、传导系统和方式分隔的形成、维持正常成熟心脏功能起着关键作用[2-3]。NKX2-5基因参与了心脏发生及发育的每个过程,其正常表达对心室和心房发育、房室瓣形成、动脉干分隔、心脏的环化及房室传导维持均有着重要作用[4-5]。陈丹盈[6]在NKX2-5/TBX5/GATA4等基因在鸡、鹌鹑及其属间杂交种胚胎心脏发育过程中的表达研究中报道,NKX2-5在禽类心脏的发育及成熟具有调控作用。也有报道称,NKX2-5基因在调节组织分化所需的组织特异性基因表达和决定发育的时空类型上具有重要作用[7]。关于鸡NKX2-5基因对胫骨发育影响的研究报道较为少见,孙艳发等[8]在鸡胫长和胫围的全基因组关联分析中,发现了1个与鸡胫长达到5%全基因组水平显著关联的基因,即位于13号染色体上的NKX2-5基因,另有4个潜在基因,分别为FAM48A、CLSTN2、 GABRG2 、HOXB3。
我们前期在不同鸡品种NKX2-5基因外显子1中检测到两个SNP位点,分别为T563C和C675T,且均为错义突变。其中,T563C位点导致其编码的丝氨酸(Ser)变为脯氨酸(Pro),C675T位点导致其编码的丙氨酸(Ala)变为缬氨酸(Val)[9],为进一步研究该基因在不同鸡种中的差异性,确定高脚鸡遗传机制,特展开本试验。
1 材料与方法
1.1 试验材料
109份高脚鸡血样采自贵州省安顺市普定县坪上乡硝洞高脚鸡保种场及周边村寨;99份矮脚鸡血样采自贵州省黔西南州兴义市兴牧畜禽水产科技服务中心矮脚鸡养殖场;69份百宜黑鸡血样采自其中心产区贵州省贵阳市乌当区百宜乡。各鸡群健康且为自然散养。于鸡翅下静脉采血3~5 mL,装于肝素钠抗凝管中并充分混匀,冰盒带回实验室-20℃低温冰箱中保存备用。
主要试剂:TBE缓冲液、DEPC处理水(实验室自备);血液基因组DNA提取试剂盒、核酸染料、DL2000 DNA Marker等均购自上海生工生物工程技术服务有限公司。
试验仪器:Bio-rad C1000 TouchTM Thermal Cycler PCR仪、北京六一仪器厂DYCZ-24F电泳仪、Bio-radIQ5伯乐荧光定量PCR仪、伯乐ChemidocTMXRS+凝胶成像仪、Thermo NANODROP 2000微量分光光度计、Eppendorf 各型号移液器。
1.2 鸡胫长测量
根据中华人民共和国农业部发布的《家禽生产性能名词术语和度量统计方法》(NY/T 823-2004)中胫长测量方法进行测量,用卡尺测量胫骨上关节到第3趾与第4趾间的垂直距离。
1.3 DNA提取和检测
利用血液基因组DNA提取试剂盒进行DNA提取。将DNA样品用1%琼脂糖凝胶电泳进行检测,用凝胶成像系统观察,成像保存,并用核酸浓度测量仪测量其具体浓度。
1.4 PCR扩增
1.4.1 引物设计与合成 根据GenBank 中已发布的NKX2-5基因序列(登录号: NC_006100.3),采用Primer Premier 5.0、Oligo 6.0等软件,设计T563C和C675T多态位点扩增引物(表1)。
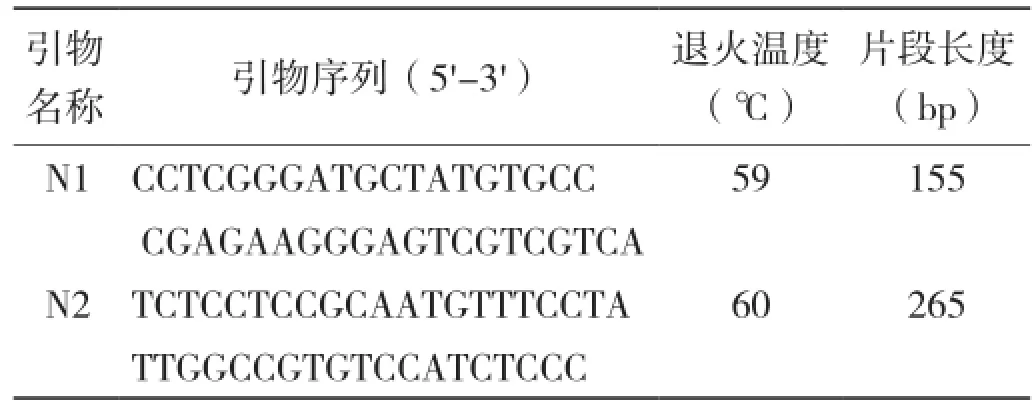
表1 PCR-SSCP 引物及扩增条件
1.4.2 PCR扩增体系及条件 本试验采用10 μL PCR反应体系:DNA模板1 μL,上下游引物各1 μL,2×Taq PCR Master Mix 5 μL,ddH2O 2 μL。PCR反应条件:94~95℃进行预变性5 min;94~95℃变性30 s,59~62℃退火30~40 s,72℃延伸40~60 s,共30~32个循环;72 ℃延伸5~7 min;4℃保存。将PCR扩增产物进行琼脂糖凝胶电泳检测,凝胶成像系统成像并保存。
1.5 SSCP
1.5.1 聚丙烯酰胺凝胶制备 利用本试验所设计引物所扩增的PCR产物均适用于10%聚丙烯酰胺凝胶。本试验根据胶板大小需要150 mL凝胶体系,含60 mL 30%聚丙烯酰胺、10×TBE 15 mL、ddH2O 44.1 mL、10% APS 816 μL、TEMED 48 μL。
1.5.2 PCR产物样品处理 取7 μL PCR产物和7 μL变性缓冲液充分混匀后短暂离心。置于沸水中变性10 min取出,置于冰盘中移至-20℃冰箱中冰浴20 min。
1.5.3 聚丙烯酰胺凝胶电泳及银染 220 V预电泳30 min,使凝胶孔进一步沉聚。用微量进样器将变性后的PCR产物全部加到胶孔中,同时加入5 μLDNA Marker 作参照。加样结束后打开电源,220 V高压电泳10 min使条带分开,再将电压调至120 V电泳过夜(12~14 h),直至溴酚蓝条带接近凝胶下缘。之后进行剥胶、银染、显影、脱色、照相保存。
1.6 多态片段测序
根据PCR-SSCP分析结果,将不同带型个体的PCR产物送北京诺赛基因公司测序。
1.7 相关软件及统计方法
引物设计软件:Premier Primer 6.0、Oligo 6.0等软件,NCBI Primer-blast(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)。序列分析软件:DNAStar软件(SeqMan、MegAlign、Editseq)等。常规统计软件:SAS(9.0),SPSS(18.0)等。
2 结果与分析
2.1 基因组DNA提取结果
试剂盒提取鸡基因组DNA后,用含核酸染料的1%琼脂糖凝胶电泳检测,结果见图1。电泳条带清晰明亮,整齐无拖尾,说明所提取的基因组DNA完整、无降解和污染,可用于后续PCR反应。
图1 高脚鸡、矮脚鸡和百宜黑鸡基因组DNA电泳检测结果
2.2 PCR扩增结果
根据所设计的PCR引物进行PCR扩增,用含核酸染料的1%琼脂糖凝胶电泳检测,结果(图2)扩增产物条带清晰,无非特异性产物,可用于测序分析。
图2 PCR扩增产物电泳检测结果
2.3 NKX2-5 基因T563C位点遗传变异分析
2.3.1 PCR-SSCP分型和测序结果 针对NKX2-5基因T563C位点设计特异性引物N1(表1)对该位点进行PCR-SSCP分析,在高脚鸡、矮脚鸡和百宜黑鸡NKX2-5基因T563C位点处检测到2个等位基因,分别为T和C,存在3种基因型,分别定义为TT、CT和CC(图3)。
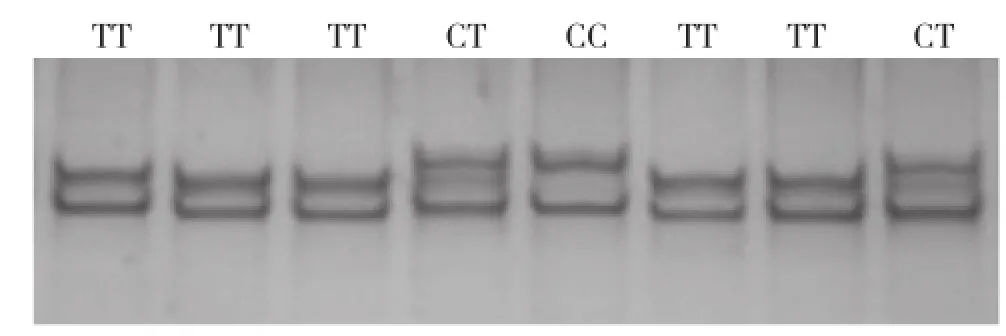
图3 NKX2-5基因T563C位点PCR-SSCP电泳图谱
随机挑选不同品种不同带型样本共9个,将其PCR产物送至北京诺赛基因组研究中心有限公司进行切胶纯化测序。运用SeqMan软件分析测序结果拼接后进行BLAST比对,结果发现TT基因型个体序列与与GenBank上所公布的序列(登录号: NC_006100.3)一致,定义为野生型,CC基因型则定义为突变型,CT基因型定义为杂合型(图4)。
2.3.2 群体遗传变异分析 对所发现的T563C位
点在3个鸡种中进行群体遗传参数统计分析。由表2可知,在高脚鸡和矮脚鸡群体中,3种基因型频率的分布为CT > TT > CC,CT为优势基因型。而在百宜黑鸡群体中,3种基因型频率的分布为TT >CT >CC,TT为优势基因型。在3个受试鸡群体中,T为优势等位基因,有效等位基因数均接近2,说明该等位基因在群体中分布均匀,3个群体中的杂合度分别为0.491、0.462和0.461,表明该SNP位点在3个群体中的变异较大。多态信息含量(PIC)均介于0.25~0.50 之间,为中度多态,说明该遗传标记位点提供的遗传信息比较合理,可以应用。卡方适合性检验显示,3个试验群体中的该基因座处于Hardy-Weinberg平衡状态(P > 0.05)。
2.3.3 T563C位点与鸡胫长性状的关联性分析 采用SPSS18.0软件对高脚鸡、矮脚鸡和百宜黑鸡NKX2-5 基因T563C位点不同基因型与其对应的胫长性状进行关联分析。由表3可知,在高脚鸡群体中,CC基因型个体胫骨最长,其次为TT基因型,CT基因型最短,其中CC基因型个体平均胫长显著高于CT型;在矮脚鸡群体中,TT基因型胫长最长,其次为CC基因型,CT基因型最短,但差异不显著;在百宜黑鸡群体中,TT基因型个体平均胫长最大,其次为CC基因型,CT基因型最短,其中TT基因型个体胫长显著高于CT基因型。
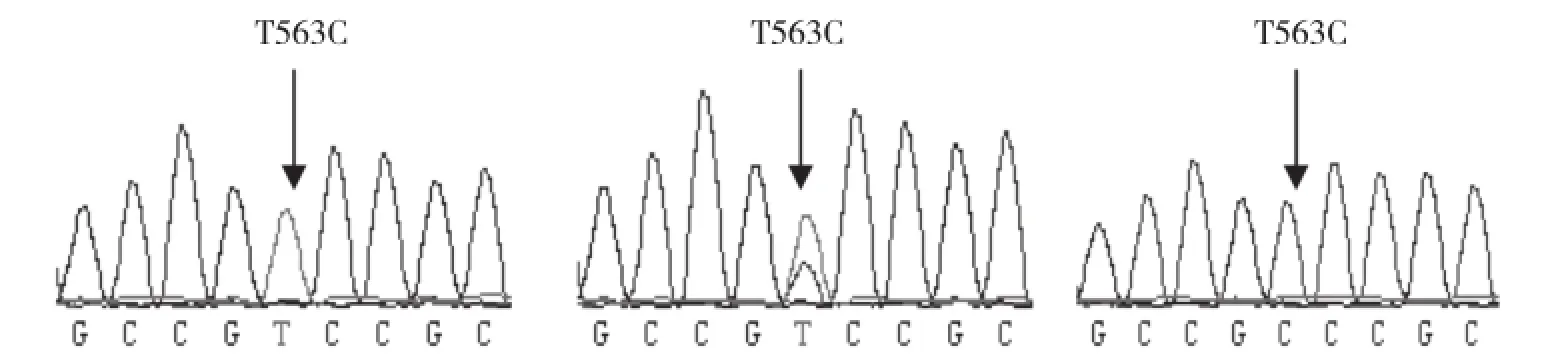
图4 NKX2-5基因T563C位点测序结果
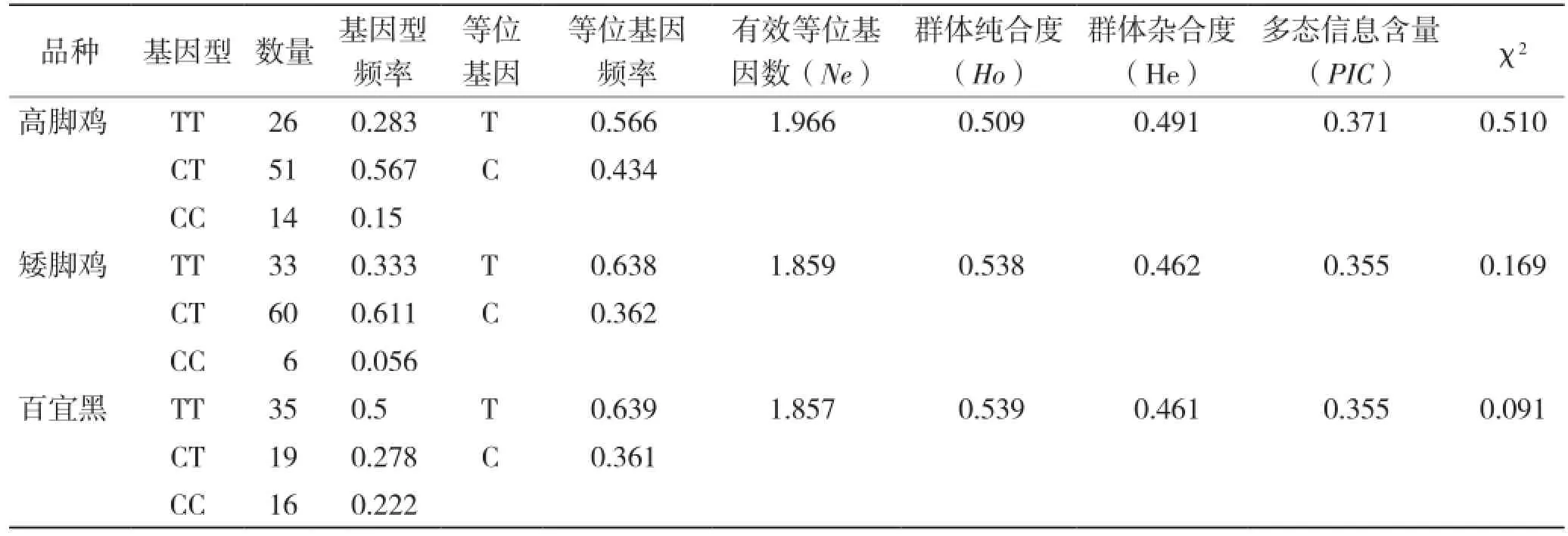
表2 NKX2-5基因T563C位点基因型频率、等位基因频率和群体遗传特性

表3 NKX2-5基因T563C位点与不同鸡品种胫长(mm)的关联分析
2.4 NKX2-5 基因C675T位点遗传变异分析
2.4.1 PCR-SSCP分型和测序结果 针对C675T位点设计特异性引物N2(表1),运用PCRSSCP检测C675T位点在3个群体中的多态性。发现了2种基因型,分别命名为CC和CT,电泳图谱见图5。
挑选不同带型不同品种共6个样品PCR产物委托北京诺赛基因组研究中心有限公司进行切胶纯化测序。将测序结果运用SeqMan 软件进行比对分析。结果发现CC基因型个体与GenBank上所公布的序列(登录号: NC_006100.3)一致,定义为野生型,TT基因型定义为突变型,则CT基因型为杂合型,测序结果见图6。
2.4.2 群体遗传学分析 对所发现的C675T位点在3个鸡种中进行群体遗传参数统计分析。由表4可知,在3个受试群体中,3种基因型的分布为CC>CT,无TT基因型分布,CC为优势基因型。在3个鸡群中,有效等位基因数均显著小于实际等位基因数,说明该等位基因在群体中分布较为不均匀,3个群体中的杂合度分别为0.018、0.239 和0.104,表明该SNP位点在3个群体中的变异较小。多态信息含量(PIC)均小于0.25 之间,表现为低度多态,说明该遗传标记位点提供的所反映的遗传变异信息较低少,在应用时需要谨慎考虑。卡方适合性检验显示,3个试验群体中的该基因座处于Hardy-Weinberg不平衡状态(P<0.05)。
2.4.3 C675T位点与鸡胫长性状的关联性分析 采用SPSS 18.0软件对高脚鸡、矮脚鸡和百宜黑鸡NKX2-5 基因C675T位点不同基因型与其对应的胫长性状进行关联分析,由表5可知,各品种不同基因型个体之间胫长差异不显著。
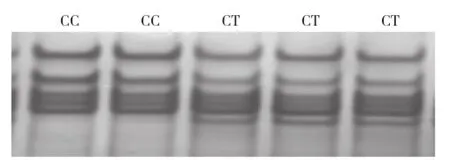
图5 NKX2-5基因C675T位点PCR-SSCP电泳图谱
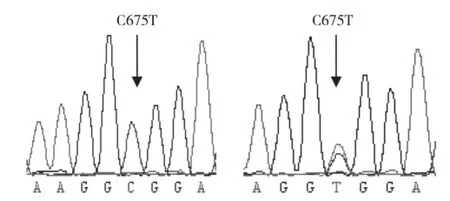
图6 NKX2-5基因C675T位点测序结果
3 讨论
3.1 基因SNP位点的检测方法
核苷酸多态性是指在基因组上单个核苷酸的变异而引起的一种二等位基因或二态的遗传变异,其包括置换、颠换、缺失和插入,具有数量多和多态性丰富等特点。从理论上看,每个SNP位点都可有4种不同变异形式,但实际多发生2种,即转换和颠换,两者之比为1∶2。SNP在基因组中分布比较广泛,在人类基因组中每300 bp就会出现1次单核苷酸多态性。通过SNP发现与疾病相关基因突变位点较为容易,而有些SNP虽然不直接参与疾病基因的表达,但其与某些疾病基因相邻,对疾病基因的表达有间接诱导作用。因此,SNP成为了疾病诊断以及开展畜禽遗传变异研究的一种重要遗传标记。
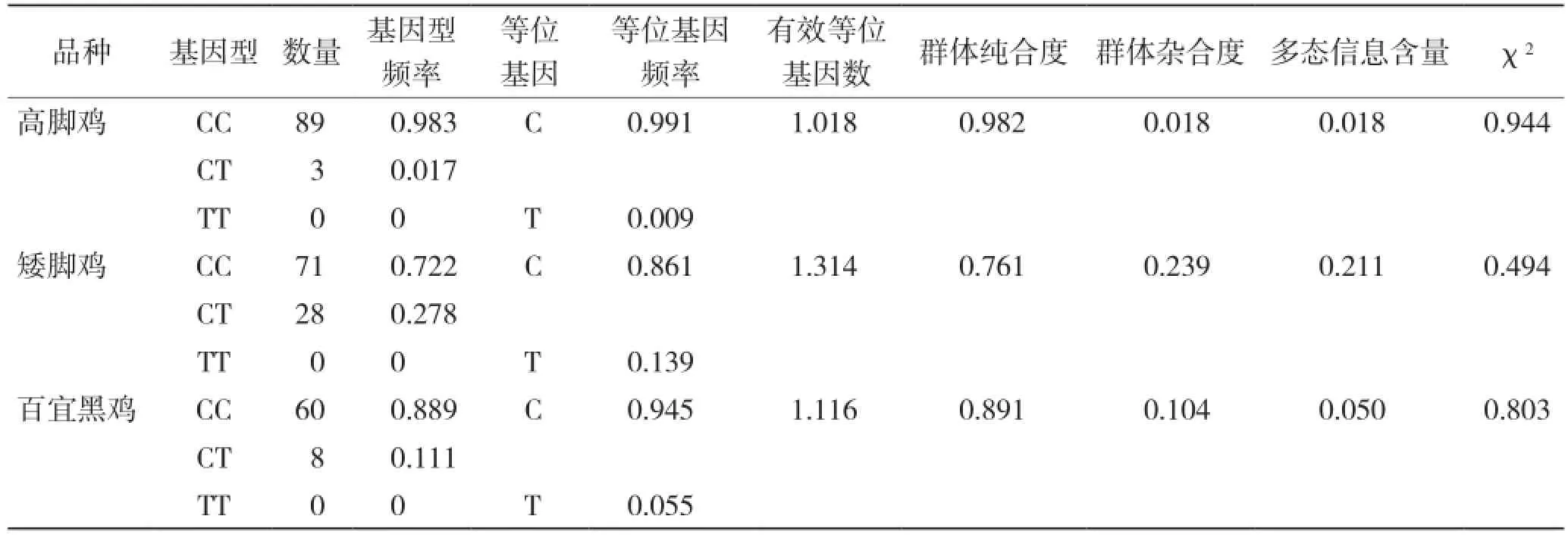
表4 NKX2-5基因C675T位点基因型频率、等位基因频率和群体遗传特性
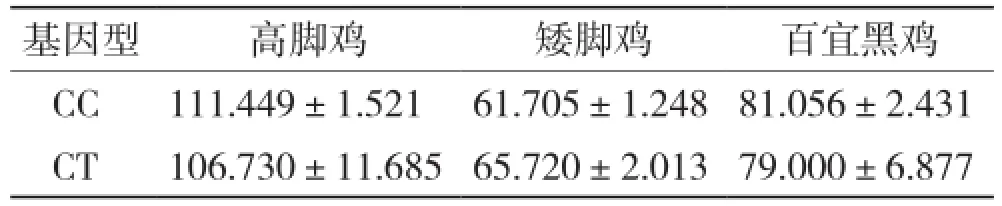
表5 NKX2-5基因C675T位点与不同鸡品种胫长(mm)的关联分析
3.2 NKX2-5基因的群体遗传结构及其与鸡胫长性状的关联分析
真核生物的基因由外显子和内含子组成,外显子部分序列所构成的编码区内核苷酸的变异可能会引起mRNA二级结构发生变化,改变蛋白质结构进而影响其生物功能[10]。本试验在高脚鸡、矮脚鸡和百宜黑鸡3个鸡品种NKX2-5基因外显子1中检测到两个错义突变,分别为T563C和C675T。试验所检测到的两个错义突变位点均导致了mRNA二级结构的改变,当T563C发生T突变为C时,二级结构发生了明显改变,自由能增加,结构稳定性降低;当C675T发生C突变为T时二级结构也发生了改变,自由能增加,结构稳定性也有一定程度的降低。
在试验群体中,T563C位点处于中度多态(0.25<PIC<0.5),多态信息含量丰富度偏低,表明试验群体的遗传多样性较低,具有较高的遗传一致性。同时该基因座在3个试验群体中均处于Hardy-Weinberg平衡状态(P>0.05),说明3个试验群体在选择中均不易受外界干扰,该位点能提供较为合理的遗传信息。所有受试群体中,有效等位基因数均接近2,相对较高,试验群体的杂合度也较高,表明该等位基因在群体中分布较为均匀且在群体中变异较大,这可能是由于试验群体未受过高强度的选育而导致的。C675T位点在试验群体中处于低度多态(PIC <0.25),多态信息含量较为单一,表明试验群体的遗传多样性很低,其遗传一致性很高。且在3个受试群体中均只存在CC 和CT两种基因型,无TT基因型存在,这有可能是由于TT型基因纯合致死使得受试群体中均无TT基因型出现。该基因座在受试群体中处于Hardy-Weinberg平衡状态(P > 0.05),说明3个试验群体在选择中均不易受外界的干扰,该位点可提供较为合理的遗传信息。在3个受试群体中有效等位基因数和杂合度均较低,表明该等位基因在群体中分布较为不均匀,这可能是因为该基因的保守性较大而导致的。
胫骨性状的研究多集中在数量性状基因座上[11-12],而胫的发育与生长阶段密切相关,不同发育阶段的胫长和胫围受不同QTL的影响[13];Ankra-Badu 等[14]将影响9周龄胫长和胫围的QTL定位在1、4和26号染色体上。孙艳发等[8]在鸡胫长和胫围的全基因组关联分析中,报道了1个与鸡胫长达到5%全基因组水平显著关联的基因,即位于13号染色体上的NKX2-5基因。NKX2-5基因在调节组织分化所需的组织特异性基因表达和决定发育的时空类型上具有重要作用[5]。有研究报道NXK2-5基因为促甲状腺激素(TSH)受体基因,与人类甲状腺发育不全(TD)有关[15]。且在人类胚胎发育早期阶段,NKX2-5基因在咽喉部和甲状腺芽的中央位置有表达[16],虽然后期阶段其转录产物在甲状腺内消失,但其对甲状腺的发育作用不可忽略。在动物实验组,敲除NKX2-5基因的小鼠在胚胎中甲状腺芽与未敲除NKX2-5基因的小鼠相比较而言明显变小,证明了NKX2-5基因对于甲状腺发育的重要性[17]。McElhinney等[1]报道了NKX2-5基因的12种突变与先天性甲状腺功能减低症(CH)相关。于晓霞等[18]也报道了伴甲状腺异位的先天性甲状腺功能减低症患儿的NKX2-5基因发生了突变。
本研究分析了T563C、C675T 2个位点不同基因型与3个受试鸡品种群体胫长性状的相关性。在T563C位点上,发现高脚鸡CC基因型个体胫长显著高于TT基因型个体,矮脚鸡各基因型个体胫长性状差异不显著(P > 0.05),百宜黑鸡TT基因型显著高于CT基因型。从这一结果可以看出,高脚鸡胫长性状较高个体与矮脚鸡、百宜黑鸡不一致,这可能是由于不同鸡种的胫骨在发育过程中遗传机制不同而引起的。对于C675T位点而言,高脚鸡和百宜黑鸡群体中CC基因型个体胫长性状较高,矮脚鸡群体中为CT基因型个体胫长较高。
[1]McElhinney D B,Geiger E,Blinder J.NKX2-5 mutation in patients with congenital heart diease[J].J Am Coll Cardiol,2003,42(9):1650-1655.
[2]Linhares V L F,Almeida N A S,Meneaes D C, et al.Transcriptional regulation of the murine Connexin40 promoter by cardiac factors NKX2-5,GATA4 and TBX5[J].Cardiovasc Res,2004,64:402-411.
[3]Kasahara H,Ueyama T,Wakimoto H, et al.Nkx2.5 Homeoprotein regulates expression of gap junction protein connexin 43 and sarcomere organization in postnatal cardiomyocytes[J].J Mol Cell Cardilo,2003,35:243-256.
[4]Qian B,Liu X J,Hui W Q, et al.Comparative Analysis of Nkx2-5/GATA4/TBX5 Expression in Chicken,Quail and Chicken-quail Hybrids during the Early Stage of Cardiac Development in Embryos[J].Asian-Australasian Journal of Animal Sciences,2013,26(4):476-482.
[5]Clark C D,Zhang B,Lee B,et al.Evolutionary conservation of Nkx2.5 autoregulation in the second heart field[J].Developmental Biology,2013,374 (1):198-209.
[6]陈丹盈.Nkx2.5/TBX5/GATA4等基因在鸡、鹌鹑及其属间杂交种胚胎心脏发育过程中的表达研究[D].石河子:石河子大学,2012.
[7]Shiojima,Komuro I,Inazawa A J,et al.Assignment of cardiac homebox gene CSX to human chromosome 5q34 [J].Genomics,1995,27(1):204-206.
[8]孙艳发,刘冉冉,郑麦青,等.鸡胫长和胫围的全基因组关联分析[J].畜牧兽医学报,2013,44(3):358-365.
[9]杨红,孙鹃,裘贵华,等.3个贵州地方鸡种NKX2-5基因多态性及生物信息学分析.中国畜牧兽医,2014,41(12):209-414.
[10]高爱琴,李金泉,李宁,等.绵羊FGF5基因SNP的生物信息学分析[J].中国畜牧杂志,2008,44(5):5-7.
[11]Kabir M,Oni O O,Akpa G N,et al.Heritability estimates and the interrelationships of body weight and shank length in rhode island red and white chickens [J].Pakistan Journal of Biological Sciences,2006,9 (15):2892-2896.
[12]Sun G R,Zhang Y F,Li G X,et al.Mapping quantitative trait loci associated with growth quality traits in a chicken population on chromosome 8,9, 10,11,13[J].Journal of Animal and Veterinary Advances,2012,11(11) :1939.
[13]Gao,Du Z Q,Feng C G,et al.Identification of quantitative trait loci for shank length and growth an different development stages in chicken[J].Animal Genet,2010,41(1):101-104.
[14]Ankra-Badu G A, Le Bihan-Duval E,Grasteau S,et al.Mapping QTL for growth and shank traits in chickens divergently selected for high or low body weight[J].Animal Genet,2010,41(1):400-405.
[15]Schott J J,Benson D W,Basson C T,et al.Congenital heart disease caused by mutation in the transcription factor NKX2-5[J].Science,1998,281:108-111.
[16]Lints T J,Parsons L M,Hartley L,et al..Nkx-2.5:a novel murine homeobox gene expressed in early heart progenitor cells and their myogenic descendants[J].Development,1993,119(2):419-431.
[17]Dentice M,Cordeddu V,Rosica A,et al.Missense mutation in the transcription factor NKX2-5:a novel molecular event in the pathogenesis of thyroid dysgenesis[J].J Clin Endocrinol Metab,2006,91 (4):1428-1433.
[18]于晓霞,邹蕙,柴建,等.伴甲状体腺异位的先天性甲状腺功能减低症患儿NKX2-5基因突变研究[J].中国实用儿科临床杂志,2014,29(8):586-589.
(责任编辑 崔建勋)
Polymorphism and association analysis of NKX2-5 gene with shank length in three chickens
YANG Hong1,ZHANG Yong2,HE Qi3,LI Jun2,ZHANG Xiong2,PENG Song2
(1.Bijie City Agricultural Management Station of Guizhou,Bijie 551700,China;2.Key Laboratory of Animal Genetics,Breeding and Reproduction in the Plateau Mountainous Region,Ministry of Education/College of Animal Science,Guizhou University/Guizhou Key Laboratory of Animal Genetics,Breeding and Reproduction,Guiyang 550025,China;3.Huaxi Agricuhure Bureau of Guiyang,Guiyang 550025,China)
Gaojiao chicken,Aijiao chicken and Baiyi black chicken in Guizhou province were used as experimental subjects in this study.SNPs of NKX2-5 genes were detected in three chicken vareties by PCR-SSCP and DNA sequencing technologies.The 2 SNPs were detected in the 3 chicken groups,T563C,C675T sites of NKX2-5 gene were missense mutations,The relevance between T563C site of NKX2-5 gene and chicken shank length showed that,TT genotype was significantly higher than CC genotype among Gaojiao chicken groups(P < 0.05),TT genotype was significantly higher than CT genetype in Baiyi black chicken groups(P < 0.05),uhile no significant level aruong 3 genotypes in Aijiao chicken.The C675T site of NKX2-5 had only CC and CT genotypes,and there was no significant level in different genotypes of 3 vareties.
NKX2-5 gene;chicken;shank length;SSCP;polymorphism
S813.3;Q343.1+5
A
1004-874X(2016)06-0156-07
10.16768/j.issn.1004-874X.2016.06.027
2016-03-01
贵州省农业动植物育种专项(黔农育专字[2012]10号);浙江大学基本科研业务费专项(2012XZZX003-1)
杨红(1990-),女,硕士,E-mail:15085933126@139.com
张勇(1975-),男,博士,副教授,E-mail:as.yzhang@gzu.edu.cn

