花绒寄甲methuselah-like基因的鉴定和表达1)
王化鹏 郝春凤 张正青 张伟 常勇 李孟楼
(西北农林科技大学,杨凌,712100)
花绒寄甲methuselah-like基因的鉴定和表达1)
王化鹏郝春凤张正青张伟常勇李孟楼
(西北农林科技大学,杨凌,712100)
摘要采用cDNA末端快速扩增技术获取了花绒寄甲(Dastarcus helophoroides)methuselah-like基因的cDNA全长序列,命名为mth-like2,采用多种生物信息学软件分析了Mth-like2受体蛋白的结构特征,并采用Real-time qPCR技术分析了该基因的表达情况。结果表明:mth-like2基因cDNA全长为2 117 bp,开放阅读框的大小为1 458 bp,编码485个氨基酸,相对分子质量为56 750,理论等电点为8.83,存在7个跨膜结构域。系统发育分析结果显示,该基因对应的受体蛋白序列与赤拟谷盗(Tribolium castaneum)Mth2-like亲缘关系最近。mth-like2基因在不同组织和不同虫态均有表达,其中雄性生殖系统的表达量显著高于其他组织,6龄幼虫显著高于其他虫态;mth-like2基因的表达量随存活时间的延长显著下调;在氧化、高温和饥饿条件下,mth-like2基因的表达量也均有显著变化,且在氧化和高温下雌雄有显著差异。
关键词花绒寄甲;Mth-like受体;基因克隆;实时荧光定量PCR
玛士撒拉基因编码一个G蛋白偶联受体,亦称玛士撒拉受体(Methuselah,Mth)。Mth受体属于B家族G蛋白偶联受体,最早发现于果蝇(Drosophila)中。研究表明,mth基因的突变使果蝇的寿命延长了35%,并且对饥饿、高温和百草枯等一系列外界胁迫因素的抵抗能力也显著提高[1]。随后的研究表明,mth基因不仅延缓了衰老而且加强了果蝇的感知运动能力[2]。但是,mth基因突变会抵消果蝇的生殖能力[3],这也证明了寿命和生殖能力之间的互抵效应。果蝇的小分子肽Stunted是科学家们发现的首个Mth受体内源性配体。而且,当编码Stunted的基因sun发生突变也会延长果蝇的寿命并且增强果蝇对氧化胁迫的耐受能力[4]。Mth/Stunted系统与果蝇的寿命、应激能力和生殖能力相关。至于其信号转导途径,只知道Dorsal 蛋白可以在mth基因的启动子区与2个激动元件(PE1 and PE2)相结合,并且最大程度抑制果蝇S2细胞中mth基因的表达[5]。除mth基因外,在昆虫中一系列mth同源基因也相继被发现,统称为methuselah-like (mth-like, mthl)基因。到目前为止,果蝇中发现15条,冈比亚按蚊(Anopheles gambiae)7条,家蚕(Bombyx mori)4条,意蜂(Apis mellifera)4条,豌豆长管蚜(Acyrthosiphon pisum)3条,赤拟谷盗(Tribolium castaneum)5条[6-10]。然而,这些研究都表明mth基因不存在于非果蝇昆虫中。科学家们认为mth和mth-like基因在昆虫中起源于一个共同的祖先基因,这个基因在后来的进化过程中发生了加倍[10],但现在还不清楚它们是否具有相同的功能。
花绒寄甲(Dastarcus helophoroides)是一种重要的天敌昆虫,它的幼虫寄生在天牛末龄幼虫和蛹上[11-12],可有效防治大型天牛类林木蛀干害虫[13-14]。花绒寄甲的成虫有着相对较长的寿命,在实验室人工饲养条件下可以存活8年以上[15]。到目前为止,关于花绒寄甲分子层面的研究还比较少,衰老机制方面的研究更是鲜有报道。本研究从分子水平研究花绒寄甲mth-like基因与寿命和抗逆能力的关系,为进一步揭示mth-like基因的功能,花绒寄甲衰老机制和抗逆能力提供基础。
1材料与方法
1.1供试昆虫
试验所用的花绒寄甲幼虫、蛹和成虫均由西北农林科技大学林学院森林害虫生物控制实验室提供,成虫由人工饲料喂养,饲料主要成分为蚕蛹粉、琼脂等,幼虫接种在替代寄主大麦虫(Zophobas atratus)蛹上。成虫和幼虫均饲养在养虫室内,温度(23±1)℃,相对湿度70%~80%[15]。
1.2花绒寄甲mth-like基因的检索
西北农林科技大学林学院森林害虫生物控制实验室已经获得完整的花绒寄甲转录组序列[16]。所有unigene序列与蛋白数据库nr、Swiss-Prot、KEGG和COG做blastx比对(Evalue<10-5),并对其进行注释。通过关键词(methuselah-like, mth-like或mth)检索,在注释文件中筛选出花绒寄甲的mth-like序列。
1.3总RNA提取和cDNA合成
按照使用说明书,用UNIQ-10 Trizol 总RNA抽提试剂盒提取4头新羽化花绒寄甲成虫总RNA,经1.0%的琼脂糖凝胶电泳检测其完整性后,利用微量核酸分析仪测定其浓度和纯度,取1 μg总RNA,按照SMARTerTMRACE kit试剂盒说明书进行操作制备3′RACE cDNA模板。
1.4PCR扩增、克隆和测序
根据检索到的基因片段,利用Premier Primer 5软件设计基因特异引物3′GSPs(表1)。3′RACE-PCR的反应体系为:9.5 μL RNase-free water,1 μL 3′cDNA模板,1 μL下游通用引物UPM,1 μL上游3′GSP1特异性引物,12.5 μL ES-Taq聚合酶。以第1轮PCR反应产物稀释100倍后作为模板,上游引物换成(GSP2),下游引物换成NUP(试剂盒自带),进行第2轮巢式PCR扩增。PCR的反应程序均为:94 ℃、3 min;94 ℃、30 s,60 ℃、40 s,72 ℃、2 min,35个循环;72 ℃ 10 min。PCR产物经1.0%琼脂糖凝胶电泳分离、切胶回收后,连接到pUCm-T载体,转入到感受态细胞中,在LB液体培养基上培养,PCR筛选阳性克隆后测序。
1.5序列分析
将测序所得3′序列通过DNAMAN 6.0软件与原序列进行拼接,获得完整的cDNA序列。得到全长序列后针对基因的ORF(开放阅读框)设计全长验证引物(表1)进行全长验证。将上述完整的cDNA序列进行生物信息学分析,用NCBI中的ORF finder(http:// http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)工具,分析其可能的开放阅读框并翻译为氨基酸序列;用ExPASy工具(http://web.expasy.org/compute_pi/)预测蛋白的相对分子质量和等电点;用在线工具TMHMM(http://www.cbs.dtu.dk/services/TMHMM)进行跨膜区域预测;利用MEGA5.0软件中的Neighbor joining法进行1 000次重复构建系统进化树[17]。

表1 试验中用到的引物
1.6样品收集与定量分析
分别收集1~6龄幼虫、蛹和成虫,3次独立采集作为3个生物学重复;收集200头成虫进行解剖,分别收集头、胸、中肠、后肠、雄性生殖系统、雌性生殖系统、脂肪体和腹部残体,将每个收集都平均分成3份,作为3个生物学重复;将成虫依据羽化后时间的长短(2、4、10、12、18、20、26、30个月)分为8个不同的组,每组雌雄1∶1,共设3个重复。提取各处理总RNA,用DNA I(Takara,日本)去除DNA污染,反转录成cDNA。采用实时定量PCR(RT-qPCR)技术检测mth-like基因在不同处理中的表达量。不同虫态和不同组织选用花绒寄甲EF-1α作为内参基因,不同存活时间选用α-Tubulin基因作为内参基因,设计定量引物EF-1αF,EF-1αR和α-TubulinF,α-TubulinR;目的基因的定量引物mth-like2-F和mth-like2-R(表1)。PCR反应条件:95 ℃、3 min ;95 ℃、30 s;60 ℃、30 s;72 ℃、30 s,50个循环。测定溶解曲线的反应条件:65 ℃到95 ℃,每升高0.5 ℃停留10 s,采集荧光。
1.7胁迫处理与定量分析
氧化处理,用浓度为40 mmol·L-1的百草枯处理新羽化花绒寄甲成虫,分别在处理后1、2、3、4、5、6、12、18、24 h收集样品,以未处理为对照。高温处理,41 ℃处理新羽化成虫,分别在处理后0.5、1.0、1.5、2.0、3.0、6.0、12.0 h收集样品,以未处理为对照。饥饿处理,只给水,不放饲料,分别在处理后2、4、6、8、10、12、14 d收集样品,以未处理为对照。以上操作对雌、雄成虫分别进行处理,重复3次。按照1.7的方法,检测氧化胁迫、高温胁迫和饥饿胁迫下mth-like2基因的表达量。内参基因选用α-Tubulin。
1.8数据处理
所得数据用相对定量法(2-ΔΔCt)计算分析[18]。对于不同虫态的分析,以1龄幼虫基因的表达量数值为参照(设为1),不同组织以头部基因的表达量数值为参照(设为1),不同虫龄则以羽化后2个月的成虫基因表达量数值为参照(设为1),氧化、高温和饥饿条件下均以未处理成虫基因的表达量数值为参照(设为1)。结果以平均值±标准差表示。数据显著差异性分析采用SPSS 20中的Tukey方法。
2结果与分析
2.1花绒寄甲mth-like2基因的检索和cDNA序列测定
通过检索花绒寄甲成虫的转录组数据库得到1个mth-like基因序列,Unigene 23675,长度为1 597 bp,用NCBI中的ORF finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)工具分析发现序列的5′端已完整,3′端不全。通过3′RACE-PCR反应,产物经1.0%琼脂糖凝胶电泳,出现600 bp左右的条带(图1)。测序获得604 bp的序列,经DNAMAN 6.0软件拼接后获得2 117 bp的序列,含有完整的开放阅读框,全长验证的测序结果与拼接序列一致。
M.DM2000 Marker;1-3.目的条带。
2.2花绒寄甲mth-like2基因核苷酸与氨基酸序列
经ORF finder工具分析,将上述序列的开放阅读框翻译成氨基酸序列(图2)。通过Blastp工具在线比对,发现其与赤拟谷盗的mth-like2基因(XP-008190990.1)的同源性最高(54%),与果蝇mth(NP-523871.1)的相似度为30%、与果蝇mth-like2 (NP-788462.2)的相似度为26%。将序列命名为mth-like2(GenBank登录号:KU363814),相对应的蛋白质序列命名为Mth-like2。mth-like2的开放阅读框的大小为1 458 bp,编码485个氨基酸,相对分子质量为56 750,理论等电点为8.83。用在线工具TMHMM对mth-like2编码蛋白跨膜结构进行预测,发现此受体蛋白具有7个α螺旋跨膜区,跨膜区的位置分别是第185~204、216~233、243~265、287~309、338~360、389~411、421~443位氨基酸,并且该受体的N端序列在细胞膜外,C端在膜内。为了明确花绒寄甲Mth-like2氨基酸序列与其他昆虫之间的进化关系,对来自5个目的13条昆虫Mth-like2(Mth2-kike)氨基酸序列进行同源性比较分析,构建系统进化树(图 3)。系统发育分析表明,所有物种在进化树上分为两个大的分枝,双翅目(Diptera)的果蝇和桔小实蝇(Bactrocera dorsalis)聚为一枝,其他物种则聚在另一分枝,其中膜翅目(Hymenoptera)的阿根廷蚁(Linepithema humile)、佛罗里达弓背蚁(Camponotus floridanus)、红收获蚁(Pogonomyrmex barbatus)、意蜂、大蜜蜂(Apis dorsata)和蝇蛹金小蜂(Nasonia vitripennis)聚在一起,等翅目(Isoptera)的内华达古白蚁(Zootermopsis nevadensis)和同翅目(Homoptera)的豌豆长管蚜(Acyrthosiphon pisum)聚在一起,花绒寄甲则与其同为鞘翅目昆虫的赤拟谷盗聚为一组。花绒寄甲Mth-like2氨基酸序列与赤拟谷盗亲缘关系最近,与膜翅目、同翅目和等翅目昆虫亲缘关系较近,与双翅目昆虫亲缘关系较远。
2.3花绒寄甲mth-like2基因表达量
由表2可见,应用RT-qPCR技术,检测mth-like2基因在花绒寄甲不同虫态中的表达情况,mth-like 2基因在各虫态均有表达,6龄幼虫表达量显著(p<0.05)高于其他虫态;不同组织的表达情况显示,mth-like2基因在成虫的不同组织内均有表达,雄性生殖系统的表达量显著(p<0.05)高于其他组织;随着存活时间的延长,mth-like2基因的表达量从第18个月开始明显下调,随后维持在较低的水平。
2.4花绒寄甲成虫在胁迫下mth-like2基因表达量
在氧化胁迫的条件下,雌成虫mth-like2基因的表达量(表3)随时间的延长缓慢上调,3 h时达到最高表达量,随后缓慢恢复,最后略高于起始水平但差异不显著。雄成虫mth-like2基因的表达量也随时间延长缓慢上调,4 h时达到最高表达量,随后缓慢下降,最后维持在较低的水平,约为起始水平的1/4。0~2 h雄性基因表达量显著低于雌性,3~5 h雌雄无显著差异,6 h以后雄性显著低于雌性。
在41 ℃高温环境下雌成虫mth-like2基因的表达量(表3)整体呈升高趋势,1.5 h后达到较高水平。雄成虫基因的表达量显著低于雌虫,且表达量无显著变化。
饥饿条件下,雌成虫mth-like2基因的表达量(表3)在第4天上调并达到最高表达量,随后缓慢下降,最后降到较低水平,约为起始水平的1/2。雄成虫基因的表达趋势与雌虫基本一致,在第2天达到最高,随后下降,整体上看雌虫和雄虫基因表达量无显著差异。

图2 花绒寄甲mth-like2 cDNA核苷酸及预测的氨基酸序列(方框标注为起始密码子和终止密码子)

发育阶段基因表达量组织基因表达量存活时间/月基因表达量1龄幼虫(参照)(1.00±0.07)b头部(参照)(1.00±0.05)b2(参照)(1.00±0.20)a2龄幼虫(2.44±0.11)b胸部(5.81±0.33)b4(1.04±0.25)a3龄幼虫(0.76±0.10)b中肠(0.34±0.03)b10(1.15±0.11)a4龄幼虫(1.20±0.21)b后肠(3.00±0.10)b12(1.11±0.20)a5龄幼虫(1.16±0.12)b雄性生殖系统(106.55±12.57)a18(0.78±0.11)ab6龄幼虫(32.11±1.77)a雌性生殖系统(1.01±0.07)b20(0.60±0.15)b蛹(2.64±0.39)b脂肪体(11.00±0.76)b26(0.44±0.12)b成虫(5.00±0.87)b腹部残体(9.35±0.34)b30(0.56±0.09)b
注:表中数据为平均值±标准差;不同发育阶段、不同组织、不同存活时间下,基因表达量数据后的字母不同表示差异显著(p<0.05)。
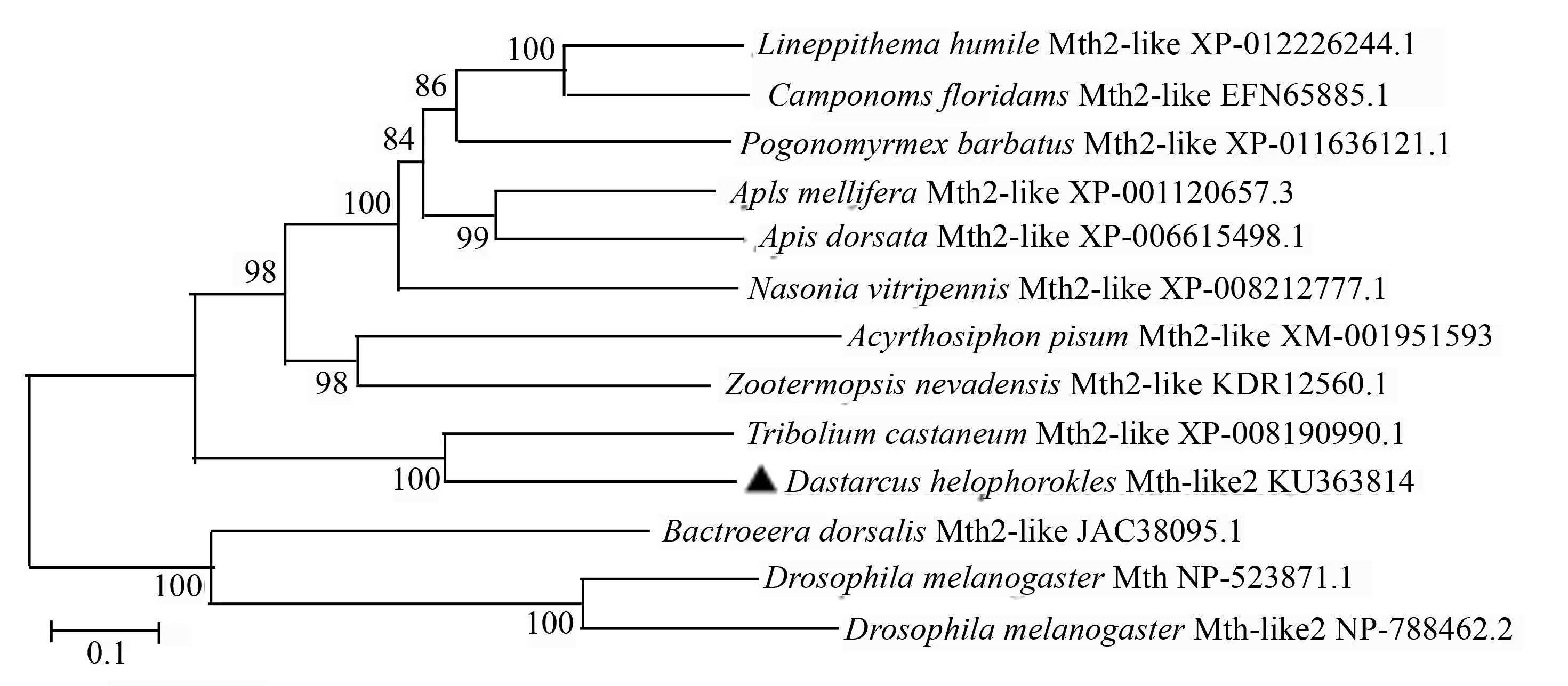
图3 花绒寄甲与其他昆虫Mth-like2氨基酸序列系统进化树(邻接法,Mth2-like=Mth-like2)

氧化胁迫时间/h基因表达量雌雄高温胁迫时间/h基因表达量雌雄饥饿胁迫时间/h基因表达量雌雄0(1.83±0.31)cde(1.00±0.14)g 0 (2.54±0.38)cde(1.00±0.16)e0(1.14±0.08)cd (1.00±0.15)cde 1(2.24±0.39)abc(1.37±0.11)efg0.5(3.63±0.49)bc(1.16±0.08)e2(1.03±0.15)cde(1.82±0.04)a2(2.36±0.33)abc(1.64±0.03)def1.0(3.37±0.44)cd(1.24±0.06)e4(1.64±0.12)ab(1.28±0.04)bc3(2.80±0.28)a(2.54±0.39)ab1.5(5.75±0.13)a(1.60±0.20)de6(1.01±0.19)cde(1.23±0.19)bc4(2.27±0.11)abc(2.57±0.18)ab2.0(5.58±0.19)a(1.69±0.22)de8(1.00±0.07)fg(0.86±0.15)cdef5(2.31±0.12)abc(2.34±0.08)abc3.0(5.45±1.20)ab(1.89±0.35)de10(1.17±0.17)cd(0.89±0.20)cdef6(2.22±0.34)abc(1.56±0.32)defg6.0(5.31±1.11)ab(1.24±0.19)e12(0.83±0.22)cdef(0.67±0.13)defg12(1.63±0.34)def(1.11±0.09)fg12.0(7.05±0.83)a(1.31±0.22)e14(0.61±0.17)efg(0.24±0.02)g18(2.04±0.30)bcd(0.27±0.04)h24(1.94±0.14)cde(0.19±0.02)h
注:表中数据为平均值±标准差。氧化胁迫中雄性0 h处理为参照,表达量设为1;高温胁迫中雄性0 h处理为参照,表达量设为1;饥饿胁迫中雄性0 d处理为参照,表达量设为1。同一胁迫处理下,同列数据后字母不同表示差异显著(p<0.05)。
3结论与讨论
本研究在从转录组数据库中获得基因片段的基础上,应用RACE-PCR技术进行扩增,获得了花绒寄甲mth-like2基因具有完整开放阅读框的cDNA序列。该基因的开放阅读框的大小为1 458 bp,编码485个氨基酸,预测该氨基酸序列有7个α螺旋跨膜区,并且该受体蛋白的N端序列在细胞膜外,C端位于胞内,符合Mth-like受体蛋白和Mth受体蛋白的特征[19-20],也与B家族G蛋白偶联受体的基本结构保持一致[6,21]。通过Blastp工具在线比对发现,花绒寄甲mth-like2基因与其他物种mth-like2基因的同源性都比较低。通过与其他5个目的13条昆虫mth-like2(Mth2-like)氨基酸序的系统进化分析发现,随着昆虫漫长的选择和进化,mth-like2 在不同昆虫间的亲缘关系也有所分歧。花绒寄甲mth-like2与鞘翅目的赤拟谷盗亲缘关系最近。这预示着,找到合适的mth-like2靶标位点,可能是以后利用mth-like2 防治害虫和研究新型药物的突破口。
mth/mth-like基因在果蝇胚胎发育过程中,在不同组织的不同发育时段是不对称表达分布的,具有一定的时空特性[20]。mth-like2基因在赤拟谷盗卵的早期阶段和蛹的后期阶段表达量高于其他阶段,也表现出一定的时空特性。并且,mth-like2基因对化蛹和羽化过程起到了至关重要的作用[22]。笔者的研究表明,花绒寄甲mth-like2基因的表达也表现出了不同虫态的差异性,在6龄幼虫、蛹和新羽化成虫中都维持着相对较高的表达量,6龄幼虫最高,这表明花绒寄甲mth-like2基因也可能在化蛹和羽化的过程中起到重要作用。从mth-like2基因在花绒寄甲不同组织中的表达情况来看,其在雄性生殖系统中的表达量显著高于其他组织,这表明mth-like2基因可能与花绒寄甲的生殖能力相关。这种情况在赤拟谷盗中也得到了验证,RNA干扰以后,mth-like2基因的表达量降低,一对赤拟谷盗的日均产卵量显著减少,并且卵的孵化率也会降低[22]。在果蝇中的研究表明,mth基因突变或抑制mth基因的表达都会延长果蝇的寿命[1,23]。随着存活时间的增长,花绒寄甲mth-like2基因的表达量明显下调,这可能提示花绒寄甲mth-like2基因与果蝇mth基因拥有相似的功能,mth-like2基因一直维持在较低表达水平可能是花绒寄甲寿命长的一方面原因。
为探究mth-like2基因在抗逆过程中的作用,测定了mth-like2基因在氧化、高温和饥饿条件下的表达情况。在40 mmol·L-1百草枯处理下,花绒寄甲mth-like2基因的表达量随时间呈现先升后降的变化趋势,后期雌性表达量显著高于雄性。mth基因突变会增强果蝇的抗氧化胁迫能力[20,10],花绒寄甲mth-like2基因可能也跟抗氧化胁迫能力相关,且雌性和雄性的抗氧化能力可能有所不同,但对赤拟谷盗的mth-like2基因进行RNA干扰后其抗氧化胁迫的能力无显著变化[1],所以对mth-like2基因的功能还应进一步研究。41 ℃环境条件下,雌性花绒寄甲mth-like2基因的表达量整体呈上调趋势,雄性则无显著变化。mth-like2基因下调会减弱赤拟谷盗对高温的耐受性,mth-like2基因对维持对高温的耐受性非常重要[1]。所以,花绒寄甲mth-like2基因的上调可能也提高了其对高温的耐受性,并且雌性可能比雄性更耐高温。在饥饿条件下,花绒寄甲mth-like2基因的表达量先升后降,这可能因为mRNA达到一定的量后抑制了基因的转录使mRNA的相对量又会降低。本研究分析认为,花绒寄甲mth-like2基因可能与赤拟谷盗一样,基因下调时降低其耐饥性[1],期初花绒寄甲mth-like2基因上调,其耐饥性可能也得以加强。至于为什么在持续饥饿的情况下,花绒寄甲mth-like2基因又会降低到如此低的水平,还需要进一步深入研究。
本研究克隆了一条花绒寄甲mth-like2基因,获得具有完整开放阅读框的序列,并对其表达情况进行了分析。研究发现了花绒寄甲mth-like2基因在不同情况下是差异性表达的,这表明花绒寄甲mth-like2基因的功能可能与其他昆虫相似,在变态发育过程中起重要作用,影响成虫的寿命,并且与成虫的抗氧化胁迫、抗高温胁迫和抗饥饿胁迫能力相关。本研究为进一步研究mth-like2受体及其他Mth-like受体的功能奠定了基础。
参考文献
[1]LIN Y J, SEROUDE L, BENZER S.Extended life-span and stress resistance in the Drosophila mutant Methuselah[J].Science,1998,282:943-946.
[2]PETROSYAN A, HSIEH I H, SABERI K.Age-dependent stability of sensorimotor functions in the life-extended Drosophila mutant methuselah[J].Behavior Genetics,2007,37(4):585-594.
[3]MOCKETT R J, SOHAL R S.Temperature-dependent trade-offs between longevity and fertility in the Drosophila mutant, methuselah[J].Experimental Gerontology,2006,41(6):566-573.
[4]CVEJIC S, ZHU Z, FELICE S J, et al.The endogenous ligand stunted of the GPCR Methuselah extends lifespan in Drosophila[J].Nature Cell Biology,2004,6(6):540-546.
[5]KIM H, KIM J, LEE Y, et al.Transcriptional regulation of the methuselah gene by dorsal protein in Drosophila melanogaster[J].Molecules and Cells,2006,21(2):261-268.
[6]BRODY T, CRAVCHIK A.Drosophila melanogaster G protein-coupled receptors[J].Journal of Cell Biology,2000,150(2):F83-F88.
[7]HILL C A, FOX A N, PITTS R J, et al.The G protein-coupled receptors in Anopheles gambiae[J].Science,2002,298:176-178.
[8]FAN Y, SUN P, WANG Y, et al.The G protein-coupled receptors in the silkworm, Bombyx mori[J].Insect Biochemistry & Molecular Biology,2010,40(8):581-591.
[9]BAI H, ZHU F, SHAH K, et al.Large-scale RNAi screen of G protein-coupled receptors involved in larval growth, molting and metamorphosis in the red flour beetle[J].Bmc Genomics,2011,12(4):388.http://www.biomedcentral.com/1471-2164/12/388.
[10]LI C, CHEN M, SANG M, et al.Comparative genomic analysis and evolution of family-B G protein-coupled receptors from six model insect species[J].Gene,2013,519(1):1-12.
[11]秦瑞豪,李孟楼,张翌楠,等.花绒坚甲防治松褐天牛最佳释放条件的筛选[J].西北农林科技大学学报(自然科学版),2012,40(2):92-96.
[12]雷琼,李孟楼,杨忠歧.花绒坚甲的生物学特性研究[J].西北农林科技大学学报(自然科学版),2003,31(2):62-66.
[13]李孟楼,李有忠,雷琼,等.释放花绒寄甲卵对光肩星天牛幼虫的防治效果[J].林业科学,2009,45(4):78-82.
[14]李孟楼,王培新,马峰,等.花绒坚甲对光肩星天牛的寄生效果研究[J].西北农林科技大学学报(自然科学版),2007,35(6):152-162.
[15]WANG H D, LI F F, HE C, et al.Molecular cloning and sequence analysis of novel cytochrome P450 cDNA fragments from Dastarcus helophoroides[J].Journal of Insect Science,2014,14(28):415-422.
[16]ZHANG W, SONG W, ZHANG Z Q, et al.Transcriptome Analysis of Dastarcus helophoroides (Coleoptera: Bothrideridae) using illumina HiSeq sequencing[J].Plos One,2014,9(9):100673.
[17]TAMURA K, PETERSON D, PETERSON N, et al.MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[18]LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25:402-408.
[19]PAABY A B, SCHMIDT P S.Functional significance of allelic variation at methuselah, an aging gene in Drosophila[J].Plos One,2008,3(4):1987.
[20]PATEL M V, HALLAL D A, JONES J W, et al.Dramatic expansion and developmental expression diversification of the Methuselah gene family during recent Drosophila evolution[J].Journal of Experimental Zoology Part B Molecular & Developmental Evolution,2012,318(5):368-387.
[21]HARMAR A J.Family-B G-protein-coupled receptors[J].Genome Biology,2001,2(12):reviews3013.1-reviews3013.10.http://genomebiology.com/2001/2/12/reviews/3013.1.
[22]LI C J, ZHANG Y, YUN X P, et al.Methuselah-like genes affect development, stress resistance, lifespan and reproduction in Tribolium castaneum[J].Insect Molecular Biology,2014,23(5):587-597.
[23]GIMENEZ L E D, GHILDYAL P, FISCHER K E, et al.Modulation of methuselah expression targeted to Drosophila insulin-producing cells extends life and enhances oxidative stress resistance[J].Aging Cell,2013,12(1):121-129.
第一作者简介:王化鹏,男,1989年2月生,西北农林科技大学林学院,硕士研究生。E-mail:hppWang@163.com。 通信作者:李孟楼,西北农林科技大学林学院,教授。E-mail:limenglou@hotmail.com。
收稿日期:2015年12月29日。
分类号S763.3;Q786
Identification and Expression of methuselah-like Gene in Dastarcus helophoroides//
Wang Huapeng, Hao Chunfeng, Zhang Zhengqing, Zhang Wei, Chang Yong, Li Menglou(Northwest A&F University, Yangling 712100, P.R.China)//
Journal of Northeast Forestry University,2016,44(7):102-107.
The experiment was conducted to clone and identify the Mth-like receptor gene in Dastarcus helophoroides, and study its expression profiles.mth-like2 was cloned using the method of rapid amplification of cDNA ends.The structure of Mth-like2 receptor was analyzed by bioinformatic methods.The expression profiles were analyzed by real-time qPCR.The full length cDNA sequence (2 117 bp) was obtained from D.Helophoroides and named as mth-like2.By sequence analysis, the open reading frame of mth-like2 was 1 458 bp in length, encoding 485 amino acid residues with an estimated molecular weight of 56.77 kDa and PI 8.83, with 7 transmembrane domains.By phylogenetic analysis, the amino acid sequences of the protein showed high identity to the corresponding protein from Tribolium castaneum.Real time quantitative PCR analysis showed variation in expression patterns of mth-like2 in different tissues (highly expressed in reproductive systems) and at different developmental stages (highly expressed in the 6-year instar larva), indicating that mth-likes were likely to involved in reproduction and development.mth-like2 expression was also significantly altered or remained stable in aging adults and under oxidation, high temperature and starvation stress, indicating that mth-like2 was to involved in aging and the resistance of oxidation, high temperature and starvation.
KeywordsDastarcus helophoroides; Mth-like receptor; Gene cloning; Real-time qPCR
1)国家自然科学基金项目(31170608)。
责任编辑:程红。

